Для цитирования:
Диаб Х.М., Пащинина О.А., Кондратчиков Д.С., Панина О.С. Хирургическое лечение пациентов с холестеатомой пирамиды височной кости (супралабиринтная и супралабиринтная апикальная форма). Голова и шея. Российский журнал=Head and neck. Russian Journal. 2020;8(4):60–66
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
For citation:
Diab Kh.M., Paschinina O.A., Kondratchikov D.S., Panina O.S. Surgical treatment of the patients with petrous pyramid cholesteatoma (supralabyrinthine and supralabyrinthine-apical forms). Head and neck. Russian Journal. 2020;8(4):60–66 (In Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients.
В статье представлена тактика хирургического лечения 13 пациентов с супралабиринтной и супралабиринтной апикальной холестеатомой пирамиды височной кости. Петрозэктомию выполняли трансмастоидальным доступом или в комбинации с доступом через среднюю черепную ямку (СЧЯ) для пластики дефектов передней поверхности пирамиды височной кости более 10 мм. В ходе хирургического вмешательства применялась эндоскопическая ассистенция. В случаях интраоперационной ликвореи после удаления холестеатом, распространяющихся до внутреннего слухового прохода (ВСП), трепанационную полость тампонировали абдоминальным жиром и ушивали наружный слуховой проход по технике «cul-de-sac». В остальных случаях выполняли тимпанопластику с формированием малой тимпанальной полости, что позволяло обеспечивать визуальный контроль трепанационной полости в послеоперационном периоде. В двух случаях выполнена пластика лицевого нерва (ЛН) по технике «конец-в-конец». Минимальный период послеоперационного наблюдения составил 1 год. Функцию ЛН оценивали при выписке (на 10е сутки) и через 3, 6, 12 месяцев после операции. Контроль состоятельности пластики дефекта СЧЯ проводился по данным компьютерной томографии на 3-и сутки и через 6 месяцев после операции. Для исключения рецидива холестеатомы пациентам выполняли магнитно-резонансную томографию в диффузно-взвешенном режиме через год после операции. Предлагаемый алгоритм хирургического лечения позволил добиться относительно низкого процента рецидива холестеатомы (15,4%) и отсутствия осложнений в виде ухудшения слуха и функции мимической мускулатуры.
Ключевые слова: холестеатома пирамиды височной кости, хронический гнойный средний отит, хирургическое лечение, средняя черепная ямка
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена без спонсорской поддержки.
In this article, the surgical tactics in 13 patients with supralabyrinthine and supralabyrinthine-apical petrous bone cholesteatoma are presented. Petrosectomy was performed by transmastoid approach or in combination with middle fossa approach for the large size — more than 10 mm — tegmental defects repairment. Endoscopic assistance was used during the surgery. In cases of intraoperative cerebrospinal fluid leakage after the removal of cholesteatoma, which spread to internal auditory meatus, trepanation cavity was obliterated with abdominal fat and external auditory channel was closed by ‘’cul-de-sac ‘’technique. In other cases, we performed tympanoplasty with a small tympanic cavity formation. In two cases, we performed the end-to-end plasty of the facial nerve. The minimal period of postoperative follow-up was 1 year. Function of facial nerveе was evaluated at discharge (for 10 days) and 3, 6, 12 months after surgery. The estimation of the reliability of the middle fossa defect repair was carried out according to the CT scan on the 3rd-10th day and 6 months after the surgery. To evaluate the recurrence of cholesteatoma, magnetic resonance imaging in diffuse-weighted mode was done year after the operation. The proposed surgical treatment algorithm allows to achieve a good result with a low rate of cholesteatoma recurrences (15.4%); also, there are no complications revealed related to the auditory and facial nerve function impairment.
Key words: petrous bone cholesteatoma, suppurative otitis media, surgical treatment, middle fossa
Conflicts of interest. The authors have no conflicts of interest to declare.
Funding. There was no funding for this study.
Введение
Холестеатома пирамиды височной кости представляет собой эпидермальную кисту, которая является результатом бесконтрольного роста ороговевающего плоскоклеточного эпителия и занимает каменистую часть височной кости [1–4]. Частота встречаемости среди всех патологических процессов, поражающих пирамиду височной кости, составляет 4–9% [1, 2, 5].
Супаралабиринтная форма холестеатомы встречается наиболее часто среди различных вариантов холестеатом пирамиды височной кости и составляет 70% случаев [6]. Холестеатома пирамиды является локально агрессивным образованием, разрушающим костную ткань и окружающие ее структуры, и может распространяться в подвисочную ямку, в среднюю и/или заднюю черепную ямку [1, 7, 8]. Кроме того, близость патологического процесса к лабиринту и лицевому нерву (ЛН) ставит под угрозу как слух, так и функцию ЛН (34,6–100%) [2, 9, 10]. Существует несколько современных классификаций холестеатомы пирамиды височной кости в зависимости от расположения процесса и объемов поражения. В клинической практике наиболее широко используются классификации M. Sanna (1993 г. и модификация 2011 г.) и D. Moffat и W. Smith (2008), которые считают точкой отсчета отношение патологического очага к структурам внутреннего уха и формально делят височную кость на 2 этажа (верхний и нижний) [1, 2, 11].
Согласно классификации M. Sanna, существует 5 классов: I – супралабиринтная; II – инфралабиринтная; III – инфралабиринтная-апикальная; IV – массивная; V – апикальная и 3 подкласса, которые являются уточняющими и добавляются к номеру класса при наличии: холестеатома ската (C), холестеатома с распространением в клиновидную пазуху (S), холестеатома носоглотки (R). В классификации D. Moffat и W. Smith выделяют 7 классов: супралабиринтную, супралабиринтную апикальную, инфралабиринтную, инфралабиринтную-апикальную, апикальную, массивную лабиринтную и массивную лабиринтную холестеатому пирамиды височной кости с апикальным распространением [11]. Классификация D. Moffat и W. Smith в отличие от классификации M. Sanna разделяет супралабиринтные холестеатомы на супралабиринтную и супралабиринтную апикальную.
Хирургическое лечение данной патологии является одной из сложнейших задач в отохирургии, сопряженной с высоким риском повреждения жизненно важных структур, находящихся в этой зоне (улитка, ЛН, твердая мозговая оболочка и внутренняя сонная артерия). Основная цель хирургических подходов к лечению холестеатомы пирамиды височной кости сегодня состоит в том, чтобы обеспечить радикальное удаление патологического образования, наряду с полным контролем и безопасностью для окружающих важных сосудисто-нервных структур. Своевременное вмешательство, на раннем этапе дает лучшие результаты по сохранению функции слуха и ЛН.
Хирургическая операция с сохранением слуха может быть использована при ограниченных холестеатомах пирамиды: супралабиринтиной и инфралабиринтной (трансмастоидальный-ретрофациальный подход). Однако, по мнению некоторых авторов, в большинстве случаев сохранение лабиринта интактным не представляется возможным [10, 12–14].
Редкая встречаемость, медленный рост, длительное бессимптомное течение процесса (при отсутствии перфорации барабанной перепонки), труднодоступное расположение в основании черепа, близость к жизненно важным сосудисто-нервным структурам, склонность к рецидивам делают вопрос о лечении пациентов с супралабиринтной и супралабиринтной апикальной холестеатомой является одним из самых актуальных в отохирургии.
Цель: оценить эффективность хирургического лечения пациентов с супралабиринтной и супралабиринтной апикальной холестеатомой пирамиды височной кости.
Материал и методы
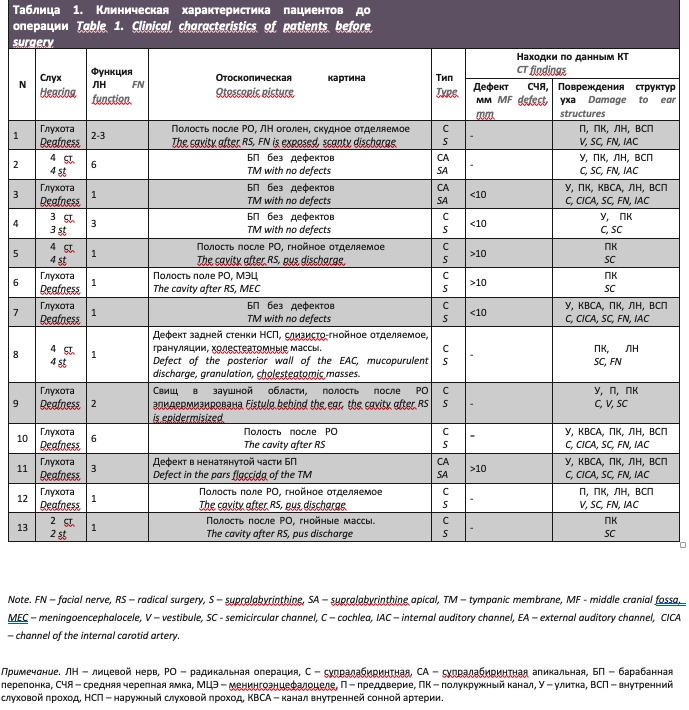
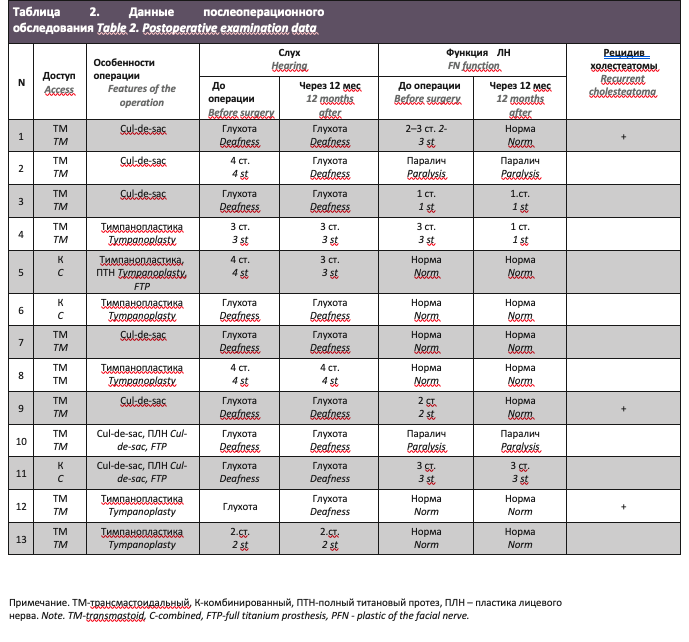
На базе НМИЦО с 2017 по 2020 г. были обследованы и прооперированы 13 пациентов, из них 10 с супралабиринтной (рис. 1) и 3 с супралабиринтной апикальной (рис. 2) холестеатомой пирамиды височной кости (по классификации D. Moffat). Средний возраст пациентов составил 37,8 года, 6 пациентов были женского пола, 7 мужского пола.
Всем пациентам было выполнено стандартное предоперационное обследование, включавшее в себя отомикроскопию, тональную пороговую аудиометрию (ТПА), компьютерную томографию (КТ) височных костей, магнитно-резонансную томографию (МРТ) головы в диффузно-взвешенном (DWI) режиме, оценка функции мимической мускулатуры оценивалась по шкале House-Brackmann’а до и после операции.
Данные предоперационных обследований представлены в табл. 1. Основными жалобами пациентов были снижение слуха разной степени, оторея, слабость мимической мускулатуры. Некоторые пациенты отмечали боль в ухе, головную боль, ушной шум и головокружение.
По данным МРТ головы в DWI режиме у всех пациентов были признаки холестеатомы.
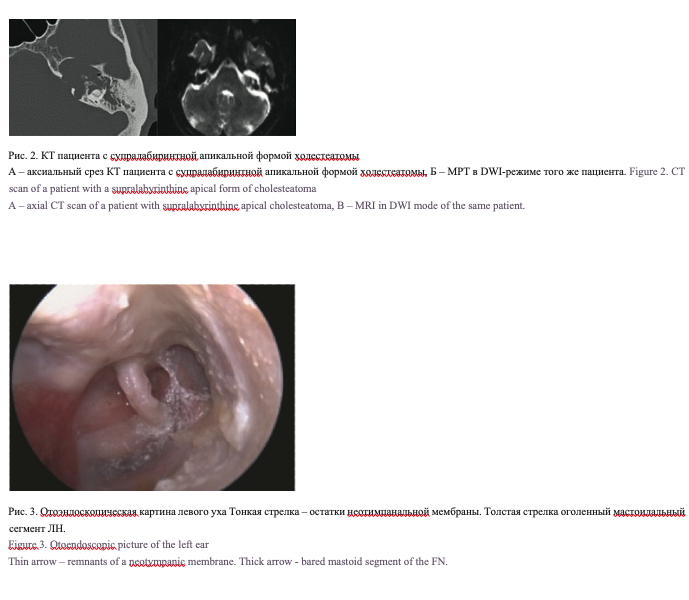
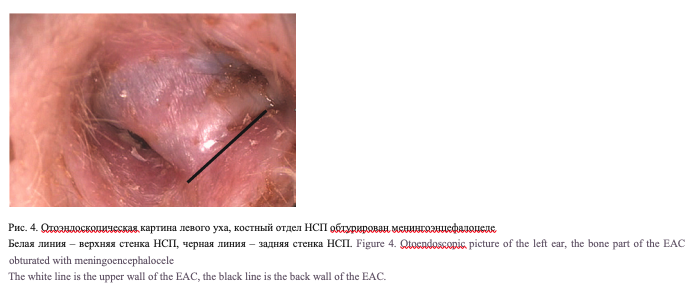
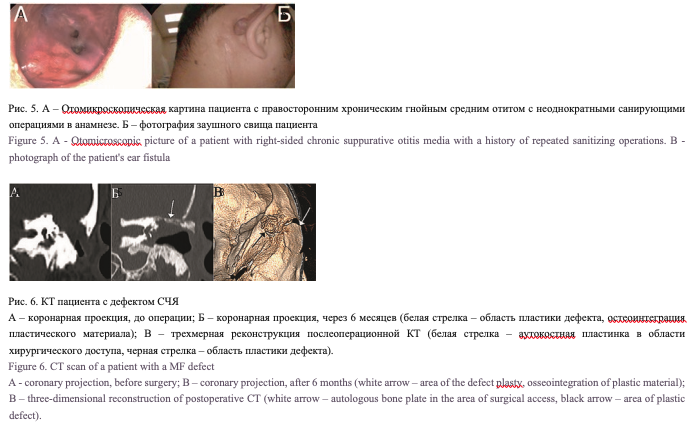
В 4 (30,8%) случаях холестеатома была врожденной, без эпизодов отореи в анамнезе. Девять (69,2%) пациентов страдали длительное время хроническим гнойным средним отитом, 6 (46%) из них имели в анамнезе неоднократные оперативные вмешательства по поводу хронического гнойного среднего отита. У оперированных ранее пациентов визуализировалась полость после радикальных операций, среди них в одном случае определялся оголенный лицевой нерв (ЛН, рис. 3), у одного пациента отмечалось менингоэнцефалоцеле (рис. 4). У другого пациента, ранее оперированного более 10 раз, определялась большая трепанационная полость и свищ в заушной области (рис. 5).
Оперативное лечение проводилось в условиях эндотрахеального наркоза, с использованием мониторинга ЛН, операционного микроскопа и видео-эндоскопической ассистенции. В 10 случаях санирующая операция выполнялась трансмастоидальным доступом. После выполнения расширенной аттикоан- тромастоидомии удаляли заднюю стенку наружного слухового прохода – НСП (при ее наличии) и выполняли субтотальную петрозэктомию.
В 3 случаях при дефектах костной стенки средней черепной ямки (СЧЯ) более 10 мм операции проводили комбинированным доступом (трансмастоидальным и через СЧЯ). Комбинированный подход заключался в выполнении подвисочной четырехугольной краниотомии размером 4×5 см. Производилась ревизия зоны дефекта с двух сторон, сначала со стороны мастоидальной полости, затем – через трепанационное отверстие после краниотомии. Пластика дефекта выполнялась с использованием «остеоматрикса», аутохряща и аутофасции. При дефектах менее 10 мм пластика дефекта проводилась аутотканями (фасция, фрагмент хряща из ушной раковины, наковальней или молоточком) со стороны трепанационной полости. Далее проводили санацию полостей среднего уха. При распространении холестеатомного матрикса на тимпанальный сегмент ЛН проводили частичную скелетизацию ЛН и очистку эпиневрия от холестеатомы. При распространении холестеатомы в структуры внутреннего уха холестеатому удаляли с выполнением лабиринтэктомии или вскрытия завитков улитки по ходу патологического процесса с возможной мобилизацией ЛН для идентификации остатков патологического процесса. В случаях распространения холестеатомного матрикса по ЛН до его внутриканальной части и соответственно ВСП выполняли транслабиринтный доступ к последнему со вскрытием твердой мозговой оболочки. В случаях обнаружения повреждения ЛН выполняли его пластику по технике «конец-в-конец» после мобилизации его центрального и периферического концов (наложением 3–4 эпипериневральных швов).
При распространении холестеатомы во ВСП (в 7 случаях), в случаях интраоперационной ликвореи, нервы ВСП, лабиринтный и тимпанальный сегменты ЛН отграничивали от полости уха аутофасцией, полость тампонировали аутожиром, НСП ушивали по технике «cul-de-sac». В случаях повреждения структур внутреннего уха медиальную стенку барабанной полости и/или область полукружных каналов тампонировали аутомышцей и отграничавали барабанную полость и антрум аутофасцией.
Результаты
Результаты оперативного вмешательства оценивали в раннем и позднем послеоперационных периодах (через год после оперативного вмешательства). Наличие рецидива холестеатомы оценивали визуально при осмотре трепанационной полости и по данным МРТ в DWI-режиме. Состоятельность пластики костного дефекта СЧЯ оценивали по результатам КТ черепа на 3-и сутки после операции и через 6 месяцев. Функцию ЛН оценивали при выписке (на 10-и сутки) и через 3, 6, 12 месяцев после операции.
В семи случаях у пациентов с разрушенной капсулой ВСП и возникшей интраоперационной ликворей особое внимание в послеоперационном периоде обращали на наличие признаков продолжавшейся ликвореи (скопление жидкости в области послеоперационной раны и истечение прозрачной жидкости в носоглоку).
У 5 пациентов, которым была выполнена тимпанопластика, в отдаленном послеоперационном периоде оценивали состояние трепанационной полости и степень тугоухости по данным ТПА.
Отдаленные результаты хирургического лечения представлены в табл. 2.
В группе пациентов, которым выполняли облитерацию полостей уха аутожиром, у двух отмечалось скопление ликвора в послеоперационной полости, которое купировалось самостоятельно на 14-е сутки. У этих пациентов был установлен дренаж в ране для выпуска ликвора.
Удаление холестеатомных масс с оголенных участков ЛН (мастоидального, тимпанального, лабиринтного) или интраканальной его части (при разрушении капсулы ВСП) у 6 пациентов привело к нарастанию/возникновению пареза ЛН в раннем послеоперационном периоде, что было связано с его отеком. Улучшение функции нерва до полного восстановления у этих пациентов отмечалось в срок от 3 месяцев до одного года.
Функция ЛН после операции у 7 пациентов оставалась неизменной. В одном случае после удаления холестеатомных масс из области ВСП функция мимической мускулатуры за год наблюдения улучшилась с 3-й до 1-й степени.
При осмотре пациентов, которым была выполнена тимпанопластика, в период от 3 до 6 месяцев определялась эпидермизация трепанационной полости у всех 6 пациентов, эпизодов отореи не отмечали.
По результатам МРТ в DWI режиме было выявлено 2 (15,4%) рецидива холестеатомы. Пациенты были прооперированы повторно, при ревизии были выявлено распространение холестеатомы по ходу оголенного канала ЛН в основном в области двубрюшного гребня ЛН с распространением в область шилососцевидного отверстия.
Слуховая функция улучшилась у одной пациентки, которой в ходе операции была выполнена оссикулопластика полным титановым протезом.
По результатам КТ черепа на 3–10-е сутки после операции мы не отметили смещения ауто- или алло-пластинок, используемых для закрытия дефектов СЧЯ у пациентов, которым была выполнена пластика дефекта СЧЯ стеоматриксом и другими материалами. При контрольном исследовании через 6 месяцев у всех пациентов пластика дефекта СЧЯ была состоятельной (рис. 6).
Обсуждение
Ряд авторов считают, что возможности освещения и увеличения, которые дает микроскоп, имеют определенные ограничения, особенно в случаях супралабиринтно апикального распространения патологического процесса, а неполное удаление матрикса при первом хирургическом вмешательстве при помощи микроскопа в дальнейшем может привести к рециди — ву [1–3, 5, 10, 15, 16].
Рецидив холестеатомы пирамиды, по данным различных авторов, встречается в 17–70% случаях с большим процентом послеоперационных осложнений в виде глухоты и пареза или паралича ЛН [17].
Благодаря более частому использованию эндоскопической техники в хирургии среднего уха и сосцевидного отростка в последние годы значительно усовершенствовались эндоскопическая техника, хирургическая тактика и инструментальное оснащение [18–20].
При cупралабиринтном распространении холестеатомы и сохраненном слухе М. Sanna рекомендует использовать доступ через СЧЯ [2]. В нашей работе мы использовали комбининрованный доступ (через СЧЯ и трансмастоидальный) только при обширных дефектах передней поверхности пирамиды височной кости для обеспечения их надежной пластики. В остальных случаях был осуществлен трансмастоидальный доступ с эндоскопической ассистенцией при санации труднодоступных мест (каменистая часть височной кости, твердая мозговая оболочка в области колена ЛН и ВСП, ревизия непосредственно апекса пирамиды). Использование эндоскопической ассистенции было особенно важно у пациентов, не имеющих повреждений лабиринта, т.к. она обеспечивает широкий обзор, не требуя расширения доступа, что может привести к травме улитки и развитию сенсоневральной тугоухости после операции.
При повреждении структур внутреннего уха, при отсутствии ликвореи ушивание НСП и облитерацию полостей уха аутожиром не выполняли для сохранения возможности наблюдения за трепанационной полостью в послеоперационном периоде и предотвращения ятрогенного повреждения ЛН при ревизионной операции в случаях резидуальной холестеатомы. В этих же целях оголенный ЛН был отграничен от фасциального лоскута аутохрящевыми пластинками, которые укалывались кзади от него для уменьшения его компрессии в раннем послеоперационном периоде, а также для возвышения уровня заживления неотимпанальной мембраны над ЛН, что уменьшало возможность их сращения.
Такой подход позволил нам добиться относительно низкого процента развития пареза мимческой мускулатуры в после- операционном периоде.
Выводы
Выбор адекватного доступа на основании тщательного изучения данных предоперационного обследования с учетом особенностей локализации и распространенности процесса позволят успешно элиминировать патологический процесс с возможностью минимизации травм жизненно важных структур. Сохранение структур лабиринта (сохранение слуховой функции) при полном удалении холестеатомы у пациентов с супралабиринтной формой представляется возможным, при использовании эндоскопической ассистенции, обеспечивающей хорошую визуализацию при менее травматичном доступе к зоне поражения.
В большинстве случаев супралабиринтной и супралабиринтной апикальной форм холестеатомы имеются тегментальные дефекты височной кости. Использование комбинированного доступа в случаях больших (более 10 мм) дефектов способствовало надежному их закрытию у всех пациентов.
Использование комбинированного доступа обеспечивает хорошую ревизию области твердой мозговой оболочки для тщательной ее санации от холестеатомы, что позволяет снизить процент рецидива в послеоперационном периоде.
ЛИТЕРАТУРА/REFERENCES
- Sanna M., Zini C., Gamoletti R. et al. Petrous bone cholesteatoma. Skull Base Surg. 1993;3(4):201–213. doi: 10.1055/s-2008-1060585.
- Sanna M., Pandya Y., Mancini F., Sequino G., Piccirillo E. Petrous bone cholesteatoma: classification, management and review of the literature. Audiol Neurootol. 2011;16(2):124–36. doi: 10.1159/000315900.3. Sabir B.I., Rahmat K., Bux S.I., Rajagopal N.S. et al. A giant mastoid cholesteatoma with posterior cranial extension causing mass effect and obstructive hydrocephalus. Neurol. Neurosurg. 2013;115(10):2192–2196. doi: 10.1016/j.clineuro.2013.05.023
- Omran A., De Denato G., Piccirillo E., Leone O., Sanna M. Petrous bone cholesteatoma: management and outcomes. 2006;116(4):619– 626. doi: 10.1097/01.mlg.0000208367.03963.ca.
- Kanzara T., Virk J.S., Chawda S., Owa A.O. Wholly endoscopic permeatal removal of a petrous apex cholesteatoma. Case Rep Otolaryngol. 2014;2014:184230. doi: 10.1155/2014/184230
- Danesi G., Cooper T., Panciera D.T., Manni V., Côté D.W. Sanna Classification and Prognosis of Cholesteatoma of the Petrous Part of the Temporal Bone:
A Retrospective Series of 81 Patients. Otol Neurotol. 2016;37(6):787-792. doi: 10.1097/MAO.0000000000000953.
- Lin Y., Chen Y., Lu L.J., Qiao L., Qiu J.H. Primary cholesteatoma of petrous bone presenting as cervical fistula. Nasus Larynx. 2009;36(4):466–9. doi: 1 0.1016/j.anl.2008.09.006.
- Pandya Y., Piccirillo E., Mancini F., Sanna M. Management of complex cases of petrous bone cholesteatoma. Otol Rhinol. Laryngol. 2010;119(8):51425. doi: 10.1177/000348941011900803 .
- Yanagihara N., Nakamura K., Hatakeyama T. Surgical management of petrous apex cholesteatoma: a therapeutic scheme. Skull Base Surg. 1992;2(1):22–7. doi: 10.1055/s-2008-1057109.
- Magliulo G. Petrous bone cholesteatoma: clinical longitudinal study. Eur Arch Otorhinolaryngol. 2007;264(2):11–120. doi: 10.1007/s00405-006-0168-x.
- Moffat D., Jones S., Smith W. Petrous temporal bone cholesteatoma: a new classification and long-term surgical outcomes. Skull Base. 2008;18(2):10–15. doi: 10.1055/s-2007-991112.
- Aubry K., Kovac L., Sauvaget E., Tran Ba Huy P., Herman P. Our experience in the management of petrous bone cholesteatoma. Skull Base. 2010;20(3):163–7. doi: 10.1055/s-0029-1246228.
- Alvarez F.L., Gómez J.R., Bernardo M.J., Suárez C. Management of petrous bone cholesteatoma: open versus obliterative techniques. Arch. Otorhinolaryngol. 2011;268(1):67–72. doi: 10.1007/s00405-010-1349-1.
- Pareschi R., Destito D., Righini S., et al. I colesteatomi della rocca: strategia chirurgica [Petrous bone cholesteatoma: surgical strategy]. Acta Otorhinolaryngol. Ital. 2001;21(4):220–5.
- Magliulo G., Terranova G., Sepe C., et al. Petrous bone cholesteatoma and facial paralysis. Otolaryngol. Allied. Sci. 1998;23(3):253–8. doi: 10.1046/j.13652273.1998.00144.x.
- Geven L.I., Mulder J.J., Graamans K. Giant Cholesteatoma: Recommendations for Follow-up. Skull Base. 2008; 18(5):353–9. doi: 10.1055/s-0028-1086054.
- Tomlin J., Chang D., McCutcheon B., Harris J. Surgical technique and re- currence in cholesteatoma: a meta-analysis. Neurootol .2013;18:135–42.
doi: 10.1159/000346140.
- Marchioni D., Villari D., Alicandri-Ciufelli M., Piccinini A., Presutti L. Endoscopic open technique in patients with middle ear cholesteatoma. Arch. Otorhinolaryngol. 2011;268(11):1557–63. doi: 10.1007/s00405-011-1533-y.
- Kumral T.L., Uyar Y., Yıldırım G., et al. Does endoscopic surgery reduce recurrence of the petrous apex cholesteatoma?. Indian J. Otolaryngol. Head Neck Surg. 2013;65(4):327–32. doi: 10.1007/s12070-013-0637-7.
- Presutti L., Nogueira J.F., Alicandri-Ciufelli M., Marchioni D. Beyond the middle ear: endoscopic surgical anatomy and approaches to inner ear and lateral skull base. Clin. North Am. 2013;46(2):189–200. doi: 10.1016/j. otc.2012.12.001.
Поступила 08.06.20
Принята в печать 02.11.20
Received 08.06.20
Accepted 02.11.20
Вклад авторов: Х.М. Диаб – разработка протокола исследования, проведение исследования, выполнение хирургических вмешательств, редактирование и написание статьи. О.А. Пащинина – сбор и анализ данных, проведение исследования, написание статьи. Д.С. Кондратчиков – проведение исследования, написание статьи и редактирование статьи. О.С. Панина – сбор и анализ данных, проведение исследования, написание статьи.
Authors’ contributions: H.M. Diab – development of the research protocol, conducting research, performing surgical interventions, editing and writing the article. O.A. Pashchinina – collecting and analyzing data, conducting research, writing the article. D.S. Kondratchikov – conducting research, writing and editing the article. O.S. Panina – collecting and analyzing data, conducting research, writing the article.
Информация об авторах:
Х.М. Диаб – д.м.н., заместитель директора научно-клинического отдела заболеваний уха ФГБУ НКЦО ФМБА России, Москва, Россия; e-mail: hasandiab@mail.ru. https://orcid.org/0000-0001-5337-3239
О.А. Пащинина – к.м.н., руководитель научно-клинического отдела заболеваний уха ФГБУ НКЦО ФМБА России, Москва, Россия; e-mail: olgap83@mail.ru. https://orcid.org/0000-0002-7188-3280
Д.С. Кондратчиков – младший научный сотрудник научно-клинического отдела заболеваний уха ФГБУ НКЦО ФМБА России, Москва, Россия; e-mail: kondratchikov@gmail.com. https://orcid.org/0000-0002-1629-3157 О.С. Панина – врач-оториноларинголог научно-клинического отдела заболеваний уха ФГБУ НКЦО ФМБА России. Россия, Москва, Россия; e-mail: dr.panina@gmail.com. https://orcid.org/0000-0002-5177-4255
Information about the authors:
H.M. Diab – Doctor of Medical Sciences, Deputy Director of the FSBI National Medical Research Center for Otorhinolaryngology of the Federal Medico-Biological Agency of Russia, Russia, Moscow; e-mail: hasandiab@mail.ru. https://orcid. org/0000-0001-5337-3239
- A. Pashchinina – Ph.D., Head of the Scientific and Clinical Department of Ear Diseases of the FSBI National Medical Research Center for Otorhinolaryngology of the Federal Medico-Biological Agency of Russia, Russia, Moscow; e-mail: olgap83@mail.ru. https://orcid.org/0000-0002-7188-3280
D.S. Kondratchikov – Junior Researcher, Scientific and Clinical Department of Ear Diseases, FSBI National Medical Research Center for Otorhinolaryngology of the Federal Medico-Biological Agency of Russia, Russia, Moscow, Russia; e-mail: kondratchikov@gmail.com. https://orcid.org/0000-0002-1629-3157 O.S. Panina – MD, Otorhinolaryngologist of the Scientific and Clinical Department of Ear Diseases of the FSBI National Medical Research Center for Otorhinolaryngology of the Federal Medico-Biological Agency of Russia, Russia, Moscow; e-mail: dr.panina@gmail.com. https://orcid.org/0000-0002- 5177-4255