Для цитирования:
Кугушев А.Ю., Лопатин А.В., Грачев Н.С., Рогожин Д.В., Гарбузов Р.В. Сосудистые мальформации нижней челюсти у детей, трудности диагностики и лечения. Голова и шея. Российский журнал=Head and neck. Russian Journal. 2020;8(4):67–76
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
For citation:
Kugushev A.Yu., Lopatin A.V., Grachev N.S., Rogozhin D.V., Garbuzov R.V. Vascular malformations of the lower jaw in children, problems in diagnosis and treatment. Head and neck. Russian Journal. 2020;8(4):67–76 (In Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients.
Введение. Артериовенозная мальформация (АВМ) – аномалия развития сосудов, представляющая собой клубок переплетенных артерий и вен, капилляры при этом отсутствуют. Поражение костей – редкая патология, при этом в 50% случаев поражаются кости черепа, в т.ч. нижняя челюсть. Лечение сосудистых мальформаций сложное и длительное, а диагностика часто затруднительна.
Материал и методы. В отделении челюстно-лицевой хирургии проведен анализ диагностических этапов постановки правильного диагноза и вариантов лечения у трех детей, находившихся на лечении в 2015–2019 гг. Результаты. Диагноз АВМ выставлен только после дообследования, что позволило выбрать индивидуальный метод лечения для каждого пациента, от местной терапии до резекции очага с аутокостной пластикой.
Заключение. Сосудистые мальформации костей – сложные в диагностике и потенциально опасные состояния, лечение которых должно проводиться мультидисциплинарной командой. Каждый случай уникален, поэтому нет единого подхода к лечению, однако во всех случаях требуется длительное наблюдение в связи с риском рецидива.
Ключевые слова: артериовенозная, мальформация, фистула, фиброзная дисплазия, амелобластома, одонтогенная киста, хронический остеомиелит, гигантоклеточная репаративная гранулема, нижняя челюсть
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена без спонсорской поддержки
Introduction. Arteriovenous malformation (AVM) is an anomaly of vascular development, which is a tangle of intertwined arteries and veins, with absence of capillaries. Bone damage is a rare pathology, while the bones of the skull are affected in 50% of cases, including lower jaw. Treatment of vascular malformations is complex and time-consuming, and diagnosis is often difficult.
Material and methods. The authors analyzed the stages for correct diagnosis and the treatment options in three children who were treated in 2015–2019 in the Department of Oral and Maxillofacial Surgery.
Results. The diagnosis of AVM was made only after additional examination, which made it possible to choose an individual method of treatment for each patient, from local therapy to resection of the lesion with autobone plasty. Conclusion. Vascular malformations of bones are difficult to diagnose and potentially dangerous conditions, t he treatment of which should be carried out by a multidisciplinary team. Each case is unique, so there is no single approach to treatment, but in all cases, long-term follow-up is required due to the risk of relapse.
Key words: arteriovenous, malformation, fistula, fibrous dysplasia, ameloblastoma, odontogenic cyst, chronic osteomyelitis, giant cell reparative granuloma, lower jaw
Conflicts of interest. The authors have no conflicts of interest to declare.
Funding. There was no funding for this study.
Введение
До 1980-х гг. сосудистые поражения назывались гемангиомами [1]. В 1982 г. J.B. Mulliken и J. Glowacki предложили бинарную систему классификации сосудистых аномалий, основанную на патологических особенностях [2]. Эта система, которая была принята Международным обществом по изучению сосудистых аномалий (ISSVA), с тех пор была расширена и в настоящее время широко используется [3]. Система классификации ISSVA разделяет сосудистые аномалии на две основные биологические категории: вазопролиферативные, или сосудистые новообразования (например, инфантильная гемангиома, врожденная гемангиома и т.д.) и пороки развития сосудов (артериовенозная мальформация – АВМ, артерио-венозные свищ и др.) [2]. Эти два класса сосудистых поражений имеют различную этиологию и клинические проявления. Клинически гемангиомы обычно появляются в раннем младенчестве, быстро растут в течение 1-го месяца жизни, затем постепенно инволютируют в течение 5 или 6 лет [3,4]. Сосудистые мальформации – это структурные аномалии кровеносных сосудов в результате ошибок морфогенеза, которые выявляются при рождении и сохраняются на протяжении всей жизни, сопровождаясь прогрессирующим расширением аномальных сосудов, выстланных плоским эндотелием [4, 5]. Эти пороки могут развиваться из капилляров, вен, лимфатических сосудов, артерий или их комбинации, что определяется скорость кровотока в них: «медленный кровоток» (порок капилляров, венозная мальформация или лимфатическая мальформация), «быстрый кровоток» (артериальная мальформация, АВМ или артериовенозные фистулы) и комбинированные сосудистые мальформации. [6].
Сосудистые мальформации часто видны на коже, но редко поражают внутренние органы или кости. Область головы и шеи поражается в 51% случаев, при этом чаще заболевание регистрируется у девочек (1:1,5–2,0) с пиком заболеваемости на втором десятилетии [7]. Однако описан широкий диапазон дебюта заболевания – от 3 месяцев до 74 лет [8]. Распространенность АВМ точно не установлена, по оценке различных авторов варьируется от 5 до 613 на 100 тыс. человек [9].
Несмотря на редкость, 50% всех внутрикостных сосудистых мальформаций встречаются в челюстно-лицевой области [10–12]. Поражение костей черепа является наиболее агрессивной формой, т.к. представлена АВМ, которая может приводить к деформации и функциональным расстройствам. Поражения челюстей являются редкими и потенциально опасными для жизни, что может проявляться как безобидными эпизодами кровоточивости десен, так и массивным кровотечением. Нижняя челюсть поражается в два раза чаще верхней [13]. АВМ представлены гипертрофированными артериями, шунтирующимися через очаг поражения в расширенные артериализированные вены в обход капиллярному кровотоку. Низкое кровяное сопротивление в мальформации приводит к увеличению кровотока и оттоку насыщенной кислородом крови в вены. Внутрикостные АВМ представляют собой группу наиболее тяжелых поражений, поведение которых часто непредсказуемо и связано с кровотечениями и смертью [10, 14, 15]. По этим причинам биопсия или даже обычное удаление зуба, когда стоматолог не знал о наличии АВМ, может привести к катастрофическому кровотечению [10, 11, 16–20].
Клинические проявления сосудистых мальформаций зависят от тяжести порока развития и могут оставаться нераспознанными в течение многих лет [21]. Однако у пациентов с АВМ часто отмечается отек мягких тканей, парестезия, боль переменной интенсивности, асимметрия лица, подвижность и смещение зубов, изменение цвета вышележащего слоя кожи и слизистой оболочки, местная пульсация, резорбция кости с «хрустом», а также резорбция корней в пораженном участке без явной патологии, связанной с зубами. Кровоточивость десен описана во всех описанных случаях [22], при этом стоматологи связывали ее с гингивитом. Кроме местных описаны системные проявления, такие как помутнение зрения, парестезия, носовое кровотечение и нарушения сердечного ритма [23].
При подозрении на сосудистую мальформацию диагностика проводится с помощью компьютерной (КТ) и магнито-резонансной томографии. «Золотым стандартом» для постановки диагноза является ангиография [5]. Использование ортопантомограммы не позволяет провести дифференциальную диагностику с АВМ [24]. На рентгенограмме АВМ часто выглядит как многоячеистое рентгенопрозрачное образование по типу отдельных ячеек или мыльных пузырей. Такая лучевая картина может быть интерпретирована как амелобластная фиброма, амелобластома, одонтогенные кератоцисты, гигантоклеточная репаративная гранулема или злокачественные первичные, или метастатические опухоли. По этим причинам необходимо проведение КТ с ангиографией, которое помогает уточнить степень поражения, эрозии костей и поражения крупных сосудов [8]. Суперселективная артериография остается важным инструментом для выявления АВМ и сосудов, способствующих ее развитию, т.к. после введение контраста мальформация увеличивает свою плотность до плотности окружающих сосудов [25]. Кроме того, ангиография может дать важную информацию о питающих артериях, дренирующих вену, скорости кровотока и характере патологического кровотока в АВМ.
Существует множество вариантов лечения АВМ в различных комбинациях и степени успеха. К ним относятся перевязка [23], эмболизация [26], радикальная резекция, использование склерозирующих растворов [27], кюретаж [28], наполнение полости воском [29] с последующим проведением кюретажа и криохирургии. Основными методами являются хирургическое – резекция (с или без предшествующей эмболизации) и изолированное использование эндоваскулярных методов [30, 31]. Резекция может приводить к эстетическим дефектам, особенно у детей раннего возраста, т.к. восстановление контура лица может представлять проблему из-за роста костей, а эндоваскулярные методики связаны с риском рецидива.
Клинические наблюдения
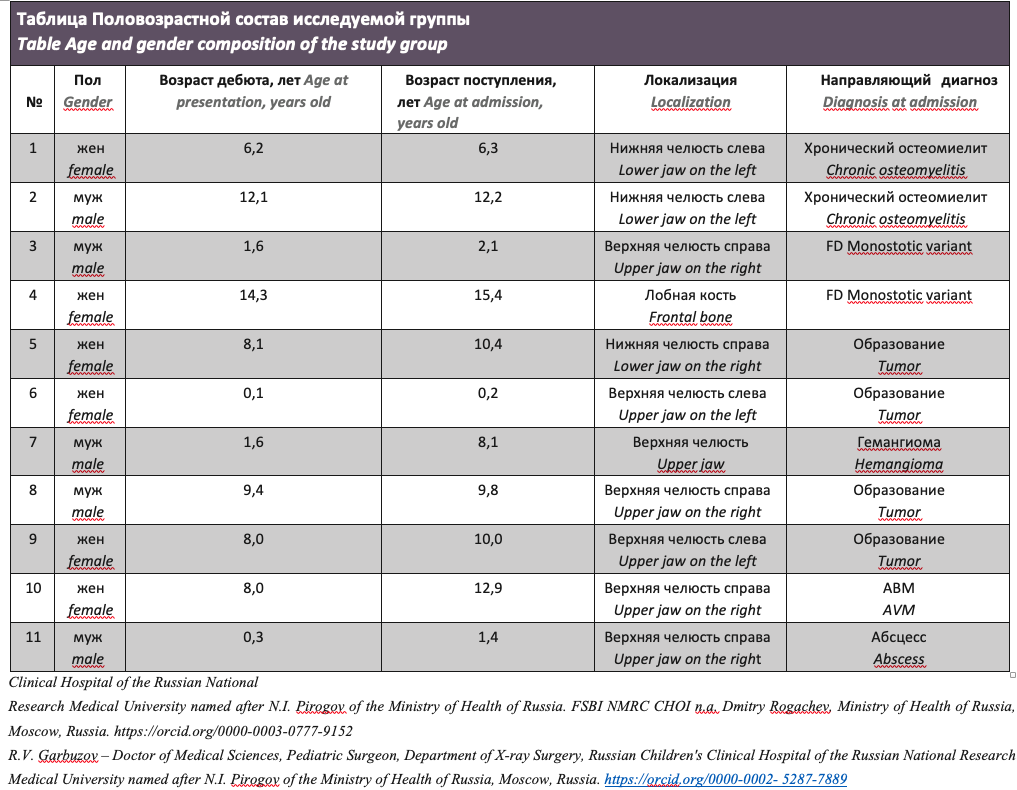
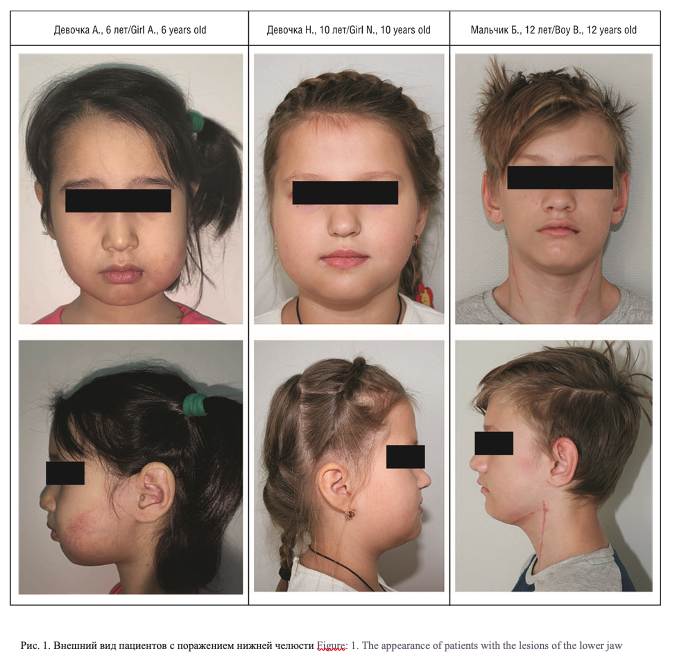
В отделении челюстно-лицевой хирургии РДКБ период 2011–2019 гг. наблюдались и получали лечение 11 детей с сосудистыми внутрикостными мальформациями (см. таблицу). Преимущественной зоной поражения являлась верхняя челюсть с жалобами на объемное образование с умеренным повторяющимся кровотечением. В двух случаях при поражении лобной кости и нижней челюсти единственной жалобой было появление медленно нарастающей костной деформации. Мягкотканное поражение в виде сосудистого пятна, телеангиоэк — тазий или увеличения в объеме было только у 3 детей, один из кото — рых имел очаг в нижней челюсти. Во всех остальных случаях имелась костная деформация с неизмененными покровными тканями. Поражение нижней челюсти было только в 3 случаях (рис. 1). В двух случаях направляющим диагнозом был хронический остеомиелит, по данным биопсии с места жительства, связанный с наличием мягкотканного дефектав полости рта после эпизода массивного кровотечения. В случае мальчика 12 лет периодические кровотечения у ребенка отмечались в течение двух лет, а у девочки 6 лет данный эпизод был первый после попытки удаления зуба. Жалоб на парестезию, нарушение чувствительности ни у кого не было. Кроме того, внешние проявления мальформации сосудов были только у девочки А., 6 лет.
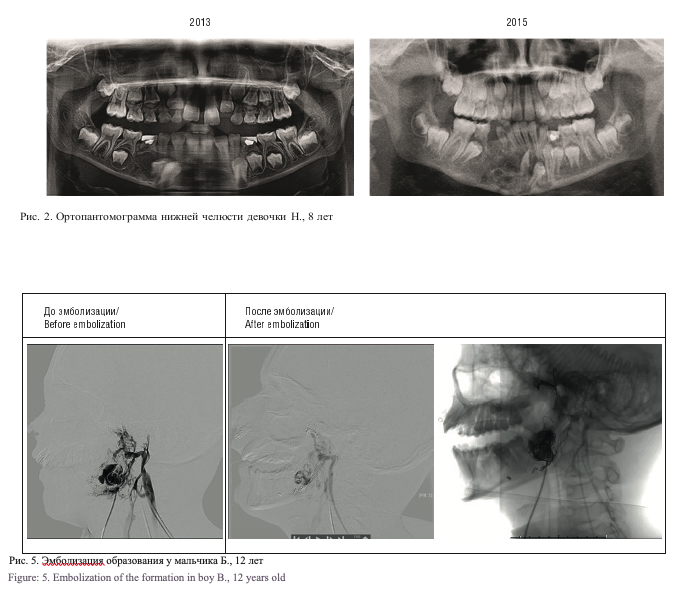
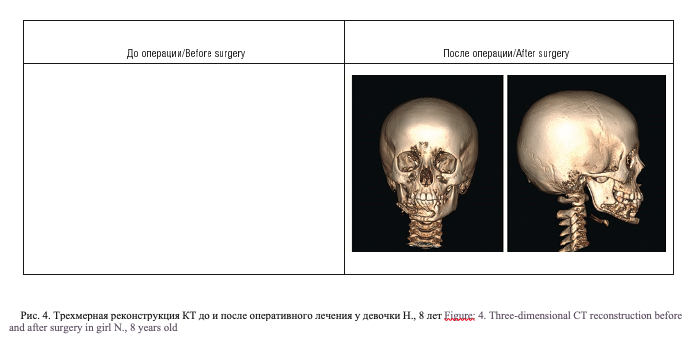
Трудности диагностики у девочки Н. 8 лет были связаны с тем, что ребенок наблюдался по поводу кистозного образования нижней челюсти в течение двух лет, выявленного при ортопантомографии (рис. 2). Эпизодов кровоточивости и парастезии не было. В связи с нарастанием объема поражения ребенку выполнено КТ, заподозрено одонтогенное образование. Из-за неровного края сосудистого образования перед операцией основным диагнозом было подозрение на гигантоклеточную репаративную гранулему. Ребенку попытались удалить образование, в ходе чего отмечалась умеренная кровоточивость из мягких тканей и нижней челюсти при интакном сосудисто-нервном пучке. При декортикации над образованием развилось выраженное артериальное кровотечение из костной полости, которое было остановлено с помощью пласцирования воском и компрессии. Удален подвижный 84 и ретенированный 41. Оперативное лечение было ограничено открытой биопсией. При гистологическом исследовании удаленного материала между трабекулами фрагментов костной ткани выявлено большое количество сосудов капиллярного и синусового типов, уплощенный эндотелий (CD34+) без признаков атипии и митотической активности. Подобные изменения расценены как гемангиома.
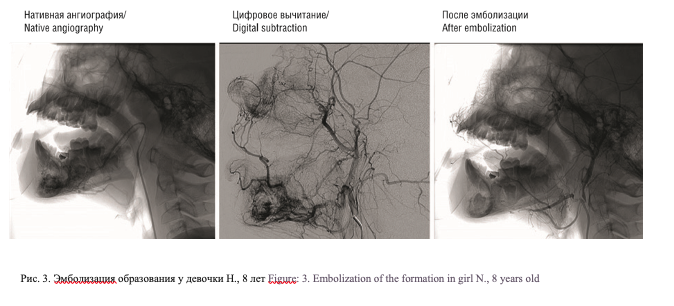
В связи с выявленным гиперваскулярным образованием выполнена эмболизация питающих сосудов. При ангиографии образование питалось из системы лицевой и нижнечелюстной артерий с двух сторон. Проведена эмболизация питающих сосудов цилиндрами гидрогеля (рис. 3). После эмболизации через 24 часа была проведена операция, которая сопровождалась менее выраженным кровотечением. Проведена декортикация костной полости с удалением сосудистого образования, окутывающего зачатки зубов (рис. 4). К сожалению, ребенок на контрольное обследование не явился.
В двух остальных случаях, мальчик Б., 12 лет и девочка А., 6 лет поступили в отделение в связи с хроническим остеомиелитом нижней челюсти. В обоих случаях были эпизоды массивного кровотечения (более 1 л) из лунки зуба. У мальчика Б., 12 лет кровотечение было остановлено после перевязки наружной сонной артерии с двух сторон, а у девочки достигнуто местной тампонадой гемостатической губкой.
В связи с подозрением на злокачественный процесс оба ребенка были обследованы в онкологических стационарах с проведением биопсии участков нижней челюсти, по результатам которой выставлен диагноз хронического воспалительного процесса в нижней челюсти, с чем дети и поступили в отделение. В обоих случаях начата местная терапия дефекта слизистой оболочки, на дне которой располагалась кость. У девочки А., 6 лет достигнута эпителизация дефекта в течение 10 дней. Учитывая отсутствие данных по КТ-ангиографии о наличии остаточного сосудистого образования, ребенок выписан под наблюдение. При наблюдении в течение 11 месяцев данных за рецидив внутрикостного образования не получено.
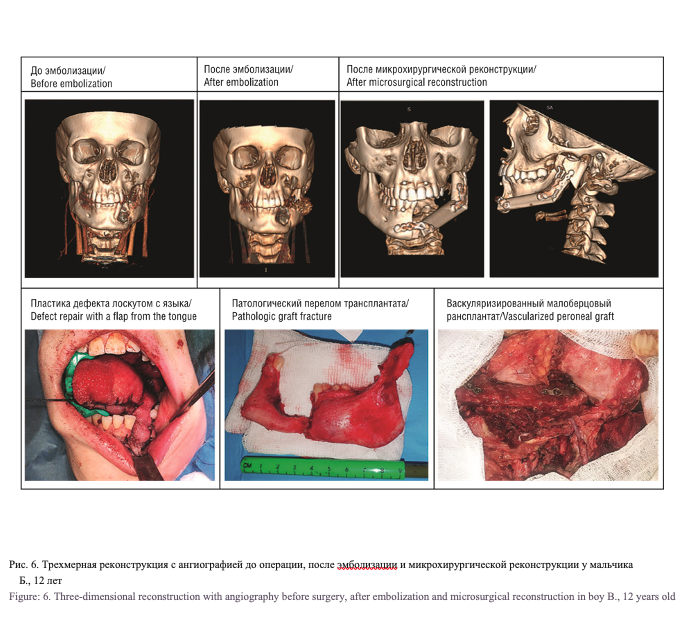
У мальчика Б., 12 лет местная терапия была безуспешна. При проведении КТ с ангиографией в задних отделах, на границе тела и ветви нижней челюсти выявлено внутрикостное неоднородное контраст-позитивное образование размером 30х18х36 мм с высокоплотными перегородками и смещением зубов. Подобные изменения соответствуют течению хронического остеомиелита с амелобластомой или кератокистой. Кроме того, в мягких тканях выявлена ангиодисплазия: наружная яремная вена слева расширена до 8,5 мм (контралатеральная 4,5 мм), многочисленные разнокалиберные (до 6 мм) патологически извитые вены вокруг тела и ветви нижней челюсти слева, в мягких тканях крыло-небной ямки, дна полости рта, подбородочной и подчелюстной областей слева. По передней поверхности шеи слева патологически расширенный (до 11 мм) аномальный венозный сосуд образуется на уровне подъязычной кости слева, проходит кпереди от левой доли щитовидной железы, следует к правой яремной вырезке за границу поля сканирования. Учитывая выявленные изменения, выполнена попытка эмболизации питающих сосудов спиралями AZURO и пункционное заполнение полости клеевой композицией сульфакрилат 2 мл (рис. 5).
Ребенку выполнена ревизия зоны воспаления с закрытием его лоскутом с боковой стенки языка. Однако данный подход не позволил купировать воспалительный процесс, несмотря на приживление мягких тканей, сформировался свищ с серозным отделяемым. В связи с сохранением воспаления и риском рецидива образования ребенку проведена резекция зоны поражения. При оперативном лечении выявлен патологический перелом в зоне остеомиелита. Выполнена резекция пораженного участка нижней челюсти с одномоментной пластикой дефекта васкуляризированным малоберцовым лоскутом (рис. 6).
Обсуждение
Пороки развития сосудов встречаются примерно у 1% новорожденных [32]. Большинство врожденных пороков развития часто неправильно диагностируется и не лечится [33]. Синонимами, которые используют для этих состояний, являются гемангиома, ангиома, артериовенозный шунт, артериовенозный свищ, артериовенозная аневризма, сосудистая мальформация и АВМ [34, 35]. На основании скорости кровотока АВМ были разделены на «медленный поток» (капиллярные, венозные, лимфатические или смешанные) и «высокий поток» (артериальные, артериовенозные свищи или шунтирующие подтипы [14]. АВМ, особенно с высокой скоростью кровотока крайне редки и потенциально опасны из-за высоких рисков огромной кровопотери во время удаления зуба или биопсии, а также высоких рисков рецидива [36]. Хотя голова и шея составляют менее 14% от площади поверхности тела, примерно 50% всех сосудистых мальформаций приходится на эту зону, но крайне редко они встречаются в нижней челюсти [37–39]. Внутрикостные сосудистые мальформации челюстей относительно редки, в литературе описано менее 200 случаев [40]. АВМ обычно выявляются в подростковом возрасте с преобладанием у девочек (2:1). Однако есть работы, указывающие на равную распространенность среди мужчин и женщин [1]. В исследовании J.L. Monteiro 78% всех случаев АВМ были у подростков, что связано с гормональными изменениями, запускающими развитие АВМ в кости [6, 41]. Тем не менее существует несколько теорий патогенеза АВМ, связанных с дефектом передачи сигналов TGF-β и аномалиями рецепторов прогестерона [42].
Диагностика и лечение сосудистых аномалий представляют собой проблему [43]. Клинические проявлением АВМ неспецифичны и включают отечность, расшатывание зубов, изменение цвета кожи и слизистой оболочки и нарушение чувствительности нижней губы или подбородка, что затрудняет проведение точной ранней диагностики [14]. Кроме того, часто отмечается незначительная кровоточивость десен, припухлость, деформация лица, неправильный прикус, резорбция костей. В некоторых случаях заболевание не имеет клинических симптомов и остается недиагностированным в течение длительного периода, как в случае одного ребенка, у которого заболевание было выявлено случайно при лечении зубов [44]. Ряд авторов указывают на наличие системных нарушений, таких как нарушение зрения, слезотечение, парестезия и нарушения сердечной деятельности (шум, гипертрофия и недостаточность), но в наших случаях не было обнаружено системным нарушений [39, 45, 46].
Рентгенография и КТ играют ограниченную роль в качестве диагностических инструментов при сосудистых мальформациях с высокой скоростью кровотока. При рентгенографии сосудистые мальформации челюстей могут выглядеть как любые поражения, начиная от кисты и заканчивая злокачественным новообразованием, за что были названы «великими рентгенологическими подражателями» [47]. В нижней челюсти АВМ часто выглядит как рентгенопрозрачное образование с размытыми краями по типу сот или мыльных пузырей, с небольшими округлыми и неровными лакунами, резорбцией корней зубов [48, 49]. При ортопантомографии выглядит как многоячеистая рентгенопрозрачная полость с расширением нижнего альвеолярного канала и внутрикостной полости [50]. В случае девочки Н., 10 лет первоначально полость имела четкие границы и больше была похожа на одонтогенную кисту и только спустя время приобрела стушеванные границы, что могло отражать рост образования на фоне изменения гормонального фона. Магнитно-резонансная томография является методом выбора, позволяя выявлять расширение сосудов в зоне поражения, а ангиография полезна особенно в случаях планируемой эмболизации перед операцией, позволяя определить тип кровотока, питающую артерию и возможные анастомозы [44].
В связи с высокой степенью мимикрии необходимо проводить широкий круг дифференциальной диагностики как с доброкачественными, так и со злокачественными образованиями. Из доброкачественных поражений наиболее часто приходится исключать одонтогенные кисты, которые могут окутывать зачатки зубов. Менее распространенные поражения включают неэпителиальные кисты (геморрагические или травматические), амелобластому, фиброзную дисплазию, гигантоклеточную репаративную гранулему, фиброму, миксому, нейрофиброму, эозинофильную гранулему и аневризмальные костные кисты, как в наблюдаемых нами случаях [51].
Лечение АВМ сложное и требует участия мультидисциплинарной команды. Наблюдение может использоваться в качестве временной меры в исключительных случаях, таких как беременность или отказ от терапии. Спонтанных регрессий не описано, а с течением времени поражение может постепенно увеличиваться [17, 50]. Ранее описанное использование лигирования приносящей артерии как симптоматическое лечение или подготовка к операции может приводить к быстрому появлению коллатерального кровообращения и невозможности последующей эндоваскулярной эмболизации [17, 18, 53, 54]. Кроме того, экстренная перевязка наружной сонной артерии недостаточна для остановки кровотечения из-за большой и уже развитой сети анастомозных кровеносных сосудов [14]. Возможность проведения эмболизации у ребенка Б. после перевязки наружной сонной артерии была возможна в связи с дефектами лигирования и сохранением кровотока по ней.
В настоящее время сверхселективная ангиографическая эмболизация рассматривается как лечение первой линии отдельно или в сочетании с хирургическим методом для уменьшения интраоперационного кровотечения. Окклюзия достигается с помощью подвижного баллона, спиралей или жидкого клея, что приводит к обеднению кровотока [55]. Успешный долговременный эффект эндоваскулярной терапии как окончательного лечения АВМ нижней челюсти составляет 70%. Это позволяет избежать калечащих операций и связанных с ними осложнений, особенно если АВМ возникают до подросткового возраста [16–18, 50, 53, 57, 58].
Однако следует учитывать возможные серьезные осложнения после эмболизации (например, окклюзия легочных или церебральных сосудов) и риски рецидива АВМ. Ряд склерозирующих агентов, таких как морруат натрия, азотистый иприт, кипящая вода и др. показали свою неэффективность при поражениях с высоким кровотоком, т.к. они мигрировали из зоны из-за скорости кровотока [12, 55, 59]. В некоторых случ.аях процедура эмболизации проводится в несколько сеансов из-за предшествующей перевязки артерий, высокой скорости кровотока или наличия микрошунтов, которые невидимы во время гиперселективной катетеризации и, следовательно, недоступны для лечения [17, 19, 53]. Таким образом, во многих случаях требовалось последующее проведение внутрикостной инъекции склерозирующих агентов для достижения дальнейшей облитерации АВМ [58].
Хирургическое лечение не является методом выбора для АВМ нижней челюсти. Используется блок-резекция пораженного участка, с временной реконструкцией аллопластическими материалами или аутокостным трансплантатом с последующей реконструкцией васкуляризированными аутокостными трансплантатами, чтобы избежать деформации лица и сделать возможной имплантацию зубов. [11, 16, 18, 19, 60, 61]. Однако мы придерживаемся тактики одновременной реконструкции васкуляризированными трансплантатами после удаления доброкачественных образований, т.к. сохраненная надкостница стимулирует репаративные процессы трансплантата.
Однако проведение обширных резекций может приводить к эстетическим и функциональным нарушениям, что потенциально приводит к психологическим проблемам у пациентов. Кроме того, рецидивы могут возникать даже после радикального лечения и в этом случае их лечение становится еще более сложной задачей [16]. По этим причинам ряд авторов выступают за эмболизацию как основного метода лечения, оправдывая данный подход постулатом «во-первых, не навреди» [6, 41]. Однако в описываемых случаях у нас имелся дефект слизистой оболочки полости рта с хроническим остеомиелитом как проявлением ишемизации окружающих тканей, а также лигирование ветвей наружной сонной артерии, выполненной по месту жительства с целью остановки кровотечения. Безусловно, наложение лигатуры на наружную сонную артерию может помочь остановить экстренное кровотечение. Тем не менее данный подход не лечит АВМ и не предотвращает рецидивы кровотечений, а увеличивает сложность будущего лечения [62]. В этой ситуации было невозможно провести эндоваскулярное лечение с тугим тампонированием костной полости, как предлагают ряд авторов, имеющих хороший долгосрочный эффект [6]. Однако комбинация эндоваскулярной и внутриочаговой окклюзии дает реоссификацию только в 50% случаев, что может быть связано с малым сроком наблюдения [6]. Кроме того, возможна реканализация АВМ после травмы под влиянием эстрогена во время полового созревания или беременности, или в результате неправильного ведения, например в случае частичной резекции или перевязки питающей артерии [63] Также реканализация может возникнуть в результате ангиогенеза или рекрутирования новых каналов, которые не были эмболизированы [64]. По этим причинам комбинированный подход имеет ряд преимуществ, т.к. операцию после эмболизации можно проводить даже у пациентов с экструдированным эмболизирующим материалом, ассоциированной грануляционной тканью или абсцессом [6, 12, 55, 65]. Кроме того, операция должна проводиться в случае невосприимчивости к эндоваскулярной терапии, обширном поражении и/или развитии осложнений, которые не могут быть излечены иначе (переломы костей и/или некроз), как в случае мальчика Б. [14].
S.B. Raymond описал случай регресса АВМ нижней челюсти после попытки биопсии [66]. В этом случае хирург вырезал часть кортикального слоя нижней челюсти и попытался сделать биопсию иглой. Однако процедура была прервана из-за значительного кровотечения, которое было остановлено с помощью гемостатической губки и прямого давления. Ангиография показала внутрикостную АВМ, и пациенту была запланирована эндоваскулярная артериальная эмболизация, однако через 2 месяца при ангиографии была выявлена небольшая остаточная АВМ и эмболизация не проводилась. При наблюдении полость заполнилась трабекулярной костью. Учитывая возможность регресса, отсутствие данных за остаточную опухоль в нижней челюсти, у девочки А. 6 лет было принято решение о возможности наблюдения в динамике с этапным склерозированием сосудов в мягких тканях.
Однако АВМ могут рецидивировать даже через много лет, пациенты должны находиться под наблюдением в течение более длительного времени, о чем не сообщается во многих исследованиях. Кроме того, уделяется мало внимания реоссификации полости, если она была достигнута.
Заключение
Лечение АВМ сложное, требует участия междисциплинарной команды. В настоящее время, благодаря развитию методов визуализации и эндоваскулярной хирургии, малоинвазивные методы доказали свою эффективность в сочетании с хирургическим подходом. Однако использование данных методик может приводить к осложнениям, а изолированное использование эндоваскулярных методов – к рецидиву, в связи с чем необходим долгосрочный мониторинг. Для исключения ятрогенного неконтролируемого кровотечения после экстракции зубов важно с осторожностью относиться к кровоточивости десен при отсутствии корреляции с другими клиническими данными.
ЛИТЕРАТУРА/REFERENCES
- Noreau G., Landry P.P., Morais D. Arteriovenous malformation of the mandible: Review of literature and case history. Can. Dent. Assoc. 2001;67:646–51.
- Mulliken J.B., Glowacki J. Classification of pediatric vascular lesions. Reconstr. Surg. 1982;70:120–1.
- Mulliken J.B., Glowacki J. Hemangiomas and vascular malformations in infants and children: A classification based on endothelial characteristics. Reconstr. Surg. 1982;69:412–22.
- Waner M., Suen J.Y. Management of congenital vascular lesions of the head and neck. (Williston Park) 1995;9:989–94, 997.
- Menon S., Roy Chowdhury S.K., Mohan C. Arteriovenous malformation in mandible. J. Armed. Forces India. 2005;61:295–6.
- Monteiro J.L.G.C., de Arruda J.A.A., Figueiredo Leal J.L., et al. Embolization as the Primary Treatment for Mandibular Arteriovenous Malformations: An Analysis of 50 Literature Reports and of an Illustrative Case. J. Oral Maxillofac. 2018;76(8):1695–707.
- Shah K., Srinivasan B., Ethunandan M., Pratt C. Arteriovenous malformation of the jaws: a black hole for the GDP – a case report. Dental Update, 2017;44(5):444–6. doi: 10.12968/denu.2017.44.5.444.
- Johnson L.M., Cook H., Friedlander A. Central arteriovenous malformations of the maxillofacial skeleton: case report. Oral Maxillofac. Surg. 1991;49:759−63.
- Stapf C., Mohr J.P., Pile-Spellman J., Solomon R.A., et al. Epidemiology and natural history of arteriovenous malformations. Neurosurg. Focus. 2001;11:e1.
- Giaoui L., Princ G., Chiras J., Guilbert F., Bertrand J.C. Treatment of vascular malformations of the mandible: a description of 12 cases. J. Oral Maxillofac. Surg. 2003;32:132.
- Shum J.W., Clayman L. Resection and immediate reconstruction of a pediatric vascular malformations in the mandible: case report. Oral Surg. Oral Med. Oral Pathol. Radiol. Endod. 2010;109:517–4З.
- Seehra J., Horner K., Coulthard P. Arteriovenous malformation of the mandible − a case report. Dent. J. 2006;201:25−7.
- Lamberg M.A., Tasanen A., Jääskeläinen J. Fatality from central hemangioma of the mandible. Oral Surg. 1979;37:578−84.
- Spreafico R., Sordo L., Bellotto R., et al. Arterio-venous malformation of the mandible. Case report and review of literature. Acta Otorhinolaryngol. Italica. 2016;36:333–6.
- Su L., Wang D., Han Y., et al. Salvage treatment of hemorrhagic arteriovenous malformations in jaws. J. Craniomaxillofac. Surg. 2015;43:1082.
- Yoshiga K., Tanimoto K., Okui T. High-flow arteriovenous malformation of the mandible: treatment and 7-year follow-up. J. Oral Maxillofac. Surg. 2003;41:348–50.
- Giauoi l., Princ G., Chiras J. Treatment of vascular malformations of the mandible: a description of 12 cases. J. Oral Maxillofac. Surg. 2003;32:132– 6.
- Sakkas N., Schramm A., Metzeger M.C. Arteriovenous malformation of the mandible: a life-threatening situation. Hematol. 2007;86:409–13.
- Hohlweg-Majert B., Metzeger M.C., Schramm A. Complication of intraoral procedures in patients with vascular tumors. Craniofac. Surg. 2008;19:816–9.
- Qu X., Su L, Wang M., Fan X. Two-year follow-up of osseointegration and rehabilitation in a patient with oral and maxillofacial arteriovenous malformations. J. Oral Maxillofac. Surg. 2013;42:1079.
- Hall E.H. What you don’t see can hurt you. N. Y. State Dent. J. 1993;59:45−7.
- Anderson J.H., Grisius R.J., McKeun T.W. Arteriovenous malformation of the mandible. Oral Surg. Oral Med. Oral Pathol. 1981;52:118−25.
- Coleman C.C., Jr. Diagnosis and treatment of congenital arteriovenous fistulas of the head and neck. Am. J. Surg. 1973;126:557−65.
- Fan X., Zhang Z., Zhang C., et al. Direct-puncture embolization of intraosseous arteriovenous malformation of jaws. J. Oral Maxillofac. Surg. 2002;60:890−6.
- Van Den Akker H.P., Kuiperl, Peeters F.L. Embolization of an arteriovenous malformation of the mandible. Oral Maxillofac. Surg. 1987;45:255−60.
- Selfe R.W., Sherman M., Miller T.F. Arteriovenous malformation of the mandible. 1978;86:659−66.
- Gamez-Araujo J.J., Toth B.B., Luna M.A. Central hemangioma of the mandible and maxilla: review of a vascular lesion. Oral Surg. Oral Med. Oral Pathol. 1974;37:230−8.
- Lund B.A., Dahlin D.C. Hemangiomas of the mandible and maxilla. J. Oral Surg. Anesth. Hosp. Serv. 1964;22:234−42.
- Gallagher D.M., Hilley D., Epker B.N. Surgical treatment of an arteriovenous malformation of the mandible in a child. A case report. J. Maxillofac. Surg. 1983;11:279−83.
- Fan X., Zhu L., Zhang C. Treatment of mandibular arteriovenous malformation by transvenous embolization through the mental foramen. Oral Maxillofac. Surg. 2008;66:139.
- Behnia H., Ghodoosi I., Motamedi M.H., et al. Embolization of an arteriovenous malformation of the mandible. J. Oral Maxillofac. Surg. 1987;45:255−60.
- Behnia H., Ghodoosi I., Motamedi M.H.K. Treatment of arteriovenous malformations: assessment of 2 techniques-transmandibular curettage versus resection and immediate replantation. Oral Maxillofac. Surg. 2008;66(12):2557–65.
- Martins F., Immordino V. Arterio-venous malformation of the base of tongue in pregnancy: Case report. Acta Otorhinolaryngol. Italica. 2009;29(5):274–8.
- Muqtadir F., Hiremath S., Agarwal S., Gufran K. Vascular malformation of cheek: A case report. Evolut. Med. Dental Sci. 2015;4(15):2617–20.
- Duncan I.C., Fourie P.A. Vascular malformations. Part 2. Current classification of vascular-malformations. South African J. Radiol. 2004;8(1):23–30.
- Kula K., Blakey G., Wright J.T., Terry B.C. High-flow vascular malformations: Literature re-view and case report. Dent. 1996;18(4):322–7.
- Colletti G., Frigerio A., Giovanditto F., et al. Surgical treatment of vascular malformations of the facial bones. J. Oral Maxillofac. Surg. 2014; 72:1326.e1.
- Cappabianca S., Del Vecchio W., Giudice A., Colella G. Vascular malformations of the tongue: MRI findings on three cases. Radiol. 2006;35:205–8.
- Dwivedi A.N.D., Pandey A., Kumar I., Agarwal A. Mandibular arteriovenous malforma-tion: A rare life- threatening condition depicted on multidetector CT angiography. 2014;(18):111–3.
- Richter G.T., Friedman A.B. Hemangiomas and vascular malformations: Current theory and management. J. Pediatr. 2012;2012(Article ID 645678):10.
- Fan X., Qiu W., Zhang Z., Mao Q. Comparative study of clinical manifestation, plain-film radiography, and computed tomographic scan in arteriovenous malformations of the jaws. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 2002;94:503–9.
- Rosen R.J., Contractor S. The use of cyanoacrylate adhesives in the management of congenital vascular malformations. Interv. Radiol. 2004;21:59.
- Ethunandan M., Mellor T.K. Haemangiomas and vascular malformations of the maxil-lofacial region-A review. J. Oral Maxillofac. Surg. 2006;44:263–72.
- Morgan P, Keller R. Patel K. Evidence-Based Management of Vascular Malformations. Plast. Surg. 2016;32:162.
- Bhuyan S.K., Birmiwal K.G., Kar I.B., et al. Malformation (A-V Shunt) of Mandible: A Rare Life Threatening Entity. J. Clin. Diagn. Res. 2016;10(11):ZD16–8. doi: 10.7860/JCDR/2016/22221.8862.
- Manjunath S.M., Shetty S., Moon N.J., et al. Arteriovenous malformation of the oral cavity. Case Rep. Dentistry. 2014;2014(Article ID 353580):5.
- Singh V., Bhardwaj P.K. Arteriovenous malformation of mandible: Extracorporeal curettage with immediate replantation technique. J. Maxillofac. Surg. 2010;1(1):45–9.
- Wood N., Goaz P. Differential Diagnosis of Oral and Maxillofacial Lesions. 5th ed. St Louis, MO: Mosby; 1997.
- Stafne E.C. Oral Roentgenographic diagnosis. 3rd ed. 1969.
- White S.C., Pharoah M J. Philadeplia: W.B. Saun-ders Company. Pp. 198. Oral Radiol. Principal Interpret. 5th ed 2004, Mosby Inc. pp. 449–52.
- Benndorf G., Kim D.M., Menneking H., Klein M. Endovascular management of a mandibular arteriovenous malformation in a patient with severe hemophilia a. AJNR. Am. J. Neuroradiol. 2004;25:614–7.
- Banna M. Intra-osseous vascular malformation of the mandible. J. Radiol. 1978;51:738–41.
- Sakkas N., Schramm A., Metzeger M.C., et al. Arteriovenous malformation of the mandible: a life-threatening situation. Ann. Hematol. 2007;86:409–13.
- Persky M.S., Yoo H.J., Berenstein A. Management of vascular malformations of the mandible and maxilla. 2003;113:1885–92.
- Giaoui L., Princ G., Chiras J., et al. Treatment of vascular malformations of the mandible: A description of 12 cases. Int. J. Surg. 2003;32:132–6.
- Lemound J.J., Brachvogel P., Götz F., et al. Treatment of mandibular highflow vascular malformations: Report of 2 cases. J. Oral Maxillofac. Surg. 2011;69:1956–66.
- Fan X.D., Su L.X., Zheng J.W., et al. Ethanol embolization of arteriovenous malformation of the mandible. Am. J. Neuroradiol. 2009;30:1178–83.
- Chen W., Ye T., Xu L., et al. A multidisciplinary approach to treating maxillofacial arteriovenous malformations in children. Oral Surg. Oral Med. Oral Pathol. Radiol. Endod. 2009;108;41–7.
- Churojana A., Khumtong R., Songsaeng D Chongkolwatana C Suthipongchai S. Life-threatening arterio-venous malformation of the maxillamandibular region and treatment outcomes. Neuroradiol. 2012; 18:49–59.
- Kar I.B., Mishra N., Sethi A.K., Mahavoi B.R. Unusual case of postextraction bleeding. J. Maxillofac. Surg. 2011;2(2):204–6.
- Behnia H., Motamedi M.H.K. Treatment of central arteriov-enous malformation of the mandible via resection and im-mediate replantation of the segment: a case report. Oral Maxillofac. Surg. 1997;55:79–84.
- Jackson I.T., Jack C.R., Aycock B., et al. The management of intraosseous arteriovenous malformations in the head and neck area. Reconstr. Surg. 1989;84:47.
- Zheng L.Z., Fan X.D., Zheng J.W., Su L.X: Ethanol embolization of auricular arteriovenous malformations: preliminary results of 17 cases. Am. J. Neuroradiol. 2009;30:1679.
- Bauer A.M., Bain M.D., Rasmussen P.A: Onyx resorbtion with AVM recanalization after complete AVM obliteration. Neuroradiol. 2015;21:351.
- Kumaravelu C., Vasudevan R., Uma Maheswari G.et al. High-flow vascular malformation of the mandible. Indian J. Dent. Research. 2007;18(2):90.
- Raymond S.B., Kaban L.B., Rabinov J.D: Spontaneous regression of a mandibular arteriovenous malformation. Oral Maxillofac. Surg .Cases. 2015;1:15.
- Amat E.F., Armengol J.P., Isabe Solivellas I.M., et al. Gingival bleeding of a high-flow mandibular arterio-venous malformation in a child with 8-year follow-up. Case Rep. Pediatr. 2015;2015(Article ID 745718):5.
Поступила 06.07.20
Принята в печать 02.11.20
Received 06.07.20
Accepted 02.11.20
Вклад авторов: Кугушев А.Ю. – написание текста рукописи, анализ данных, обзор публикаций по теме статьи, анализ полученных данных. Лопатин А.В. – разработка дизайна исследования. Грачев Н.С. – дифференциальная диагностика со злокачественными процессами, микрохирургический этап лечения. Рогожин Д.В. – морфологическая диагностика. Гарбузов Р.В. – ангиографическая диагностика и эмболизация сосудистых образований.
Authors’ contribution: Kugushev A.Yu. – writing the text of the manuscript, analyzing data, reviewing publications on the topic of the article, analyzing the data obtained. Lopatin A.V. – research design development. Grachev N.S. – differential diagnosis with malignant processes, microsurgical stage of treatment. Rogozhin D.V. – morphological diagnostics. R.V. Garbuzov – angiographic diagnosis and embolization of vascular formations.
Информация об авторах:
А.Ю. Кугушев – к.м.н., врач детский онколог отделения челюстно-лицевой хирургии РДКБ ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, доцент кафедры хирургии с курсом онкологии и реконструктивнопластической хирургии детского возраста ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава РФ, Москва, Россия; e-mail: drkugushev@ gmail.com. https://orcid.org/0000-0002-6881-7709. РИНЦ: 3045-0722 А.В. Лопатин – д.м.н., профессор, заведующий отделением челюстнолицевой хирургии РДКБ ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава РФ, ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава РФ, Москва, Россия. https://orcid.org/0000-0003-0043-9059
Н.С. Грачев – д.м.н., заведующий отделением онкологии и хирургии РДКБ ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава РФ, ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава РФ, Москва, Россия. https://orcid.
org/0000-0002-4451-3233
Д.В. Рогожин – д.м.н., заведующий патологоанатомическим отделением РДКБ ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава РФ, ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава РФ, Москва, Россия. https://orcid.org/0000-0003-0777-9152
Р.В. Гарбузов – д.м.н., врач детский хирург отделения рентгенхирургии РДКБ ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава РФ, Москва, Россия. https://orcid.org/0000-0002-5287-7889
Information about the authors:
A.Yu. Kugushev – PhD, pediatric oncologist of the Department of Maxillofacial Surgery of the Russian Children’s Clinical Hospital of the Russian National Research Medical University named after N.I. Pirogov of the Ministry of Health of Russia, Associate Professor of the Department of Surgery with the Course of Oncology and Pediatric Reconstructive Plastic Surgery, FSBI NMRC CHOI n.a. Dmitry Rogachev, Ministry of Health of Russia, Moscow, Russia; e-mail: drkugushev@gmail.com. https://orcid.org/0000-0002-6881-7709. RSCI: 3045-0722
A.V. Lopatin — Doctor of Medical Sciences, Professor, Head of the Department of Oral and Maxillofacial Surgery of the Russian Children’s Clinical Hospital of the Russian National Research Medical University named after N.I. Pirogov of the Ministry of Health of Russia. FSBI NMRC CHOI n.a. Dmitry Rogachev,
Ministry of Health of Russia, Moscow, Russia. https://orcid.org/0000-0003-0043-9059