Для цитирования: Усачев Д.Ю., Азизян Р.И., Лукшин В.А., Соснин А.Д., Саприна О.А. Шмигельский А.В. Удаление метастатического конгломерата лимфатических узлов шеи с одномоментной каротидной эндартерэктомией. Голова и шея Head and neck Russian Journal. 2018;6(2):50–54
For citations: Usachev D.Yu., Azizyan R.I., Lukshin V.A., Sosnin A.D., Saprina O.A., Shmigelsky A.V. Metastatic lymph node conglomerate removal with immediate carotid endarterectomy. Golova I Sheya Head and neck Russian Journal. 2018;6(2):50–54 (in Russian).
Doi: 10.25792/HN.2018.6.2.50–54
В статье рассматривается случай успешного одномоментного удаления метастатического конгломерата лимфатических узлов шеи и каротидной эндартерэктомии по поводу радиоиндуцированного стеноза. Операция проводилась с использованием методов мониторинга мозгового кровообращения. Обсуждаются показания к выбору подобной тактики лечения и технические аспекты выполненного вмешательства.
Ключевые слова: опухоли шеи, радиоиндуцированные стенозы, каротидная эндартерэктомия. Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Усачев Д.Ю., Азизян Р.И., Лукшин В.А., Соснин А.Д., Саприна О.А. Шмигельский А.В. Удаление метастатического конгломерата лимфатических узлов шеи с одномоментной каротидной эндартерэктомией. Голова и шея Head and neck Russian Journal. 2018;6(2):50–54
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
The article deals with the case of successful immediate removal of the metastatic neck lymph node conglomerate and carotid endarterectomy for radioinduced stenosis. The operation was performed using methods of cerebral circulation monitoring. Indications for such treatment tactics selection and technical aspects of surgery are discussed.
Key words: neck tumors, radioinduced stenoses, carotid endarterectomy.
Authors declare no conflict of interests for this article. Source of financing. Unspecified.
For citations: Usachev D.Yu., Azizyan R.I., Lukshin V.A., Sosnin A.D., Saprina O.A., Shmigelsky A.V. Metastatic lymph node conglomerate removal with immediate carotid endarterectomy. Golova I Sheya Head and neck Russian Journal. 2018;6(2):50–54 (in Russian).
The authors are responsible for the originality of the presented data and the possibility of publishing illustrative material – tables, drawings, photographs of patients.
Введение
Злокачественные опухоли органов головы и шеи являются широко распространенным заболеванием, составляющим, по данным онкологических регистров, до 10% всех выявленных злокачественных новообразований. Современные протоколы лечения больных данной патологией наряду с хирургическими и химиотерапевтическими методами включают проведение лучевой терапии. Одним из осложнений облучения области шеи является развитие васкулита брахиоцефальных артерий, приводящего к формированию радиационно-индуцированных стенозов сонных артерий [1–5]. Так, по данным S. Cheng и соавт., частота выявления гемодинамически значимых стенозов у больных раком ротоглотки в 6 раз выше, чем в среднем в популяции [1]. Этим можно объяснить более высокую частоту эпизодов нарушения мозгового кровообращения у пациентов данной группы, развивающихся как в ходе лечения, так и на протяжении последующего катамнестического наблюдения [6–8]. Поэтому тактика лечения данной патологии должна учитывать в т.ч. возможность профилактики ишемического инсульта. Одним из редко встречающихся в литературе вариантов применения данного подхода является одномоментное удаление опухоли в сочетании с каротидной эндартерэктомией [9, 10], что представлено в следующем клиническом наблюдении.
Клиническое наблюдение
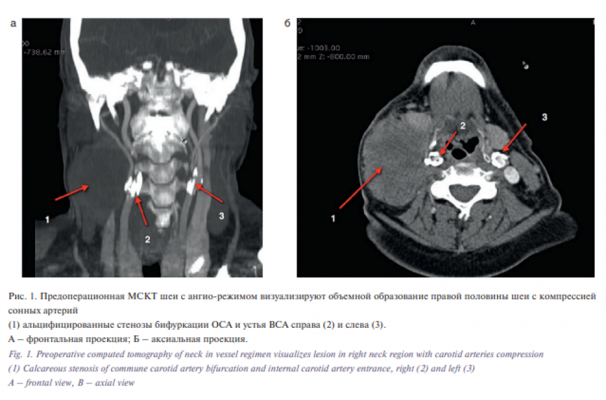
Пациент Д. 51 года наблюдался в РОНЦ им. Блохина с жалобами на плотное, безболезненное, объемное образование в правой половине шее. При сборе анамнеза отмечено наличие двух эпизодов острого нарушения мозгового кровообращения (ОНМК) в виде головокружений, обратимой слабости в правых конечностях. Под наблюдением онкологов пациент находился с 2015 г., когда отметил появление опухоли шеи справа. При динамическом наблюдении отмечена прогрессия процесса, и пациент направлен на консультацию в РОНЦ им Блохина, где диагностирован рак ротоглотки Т2Н3М0. Проведено 3 курса химиотерапии с выраженным эффектом в виде уменьшения размера патологического очага, далее начат курс конкурентной химиолучевой терапии на ротоглотку РОД 2Гр, СОД 70Гр, на шею и шейно-надключичные зоны РОД 2Гр СОД 50 Гр, шею справа до 60Гр. При контрольном осмотре выявлены метастатические узлы на шее справа. В плане комплексного обследования пациенту выполнена ультразвуковая допплерография (УЗДГ) сосудов шеи и спиральная компьютерная томография в ангиографическом режиме – выявлен стеноз сонных артерий до 70% с двух сторон (рис. 1).
С учетом прогрессии опухоли правой половины шеи в сочетании с симптоматическим стенозом бифуркации общей сонной артерии (ОСА) и внутренней сонной артерии (ВСА) справа больному предложено хирургическое лечение – радикальная шейная диссекция с одномоментной каротидной эндартерэктомией справа.
В марте 2017 г. первым этапом выполнена радикальная шейная диссекция с одномоментной каротидной эндартерэктомией. Операция проводилась под эндотрахеальным наркозом с поворотом головы влево и уложенным под правое плечо валиком. Для проведения интраоперационного нейромониторинга кровоснабжения и метаболизма головного мозга на период временного пережатия сонных артерий использовались допплеровский УЗ-сканнер с локацией правой средней мозговой артерии (Sonosite, RIMED, Израиль) и церебральный оксиметр (Invos Somanetics, США). Дополнительно в лучевую артерию слева установлена система для непрерывного прямого измерения артериального давления. Хирургическое вмешательство выполнялось с использованием бинокулярной лупы.
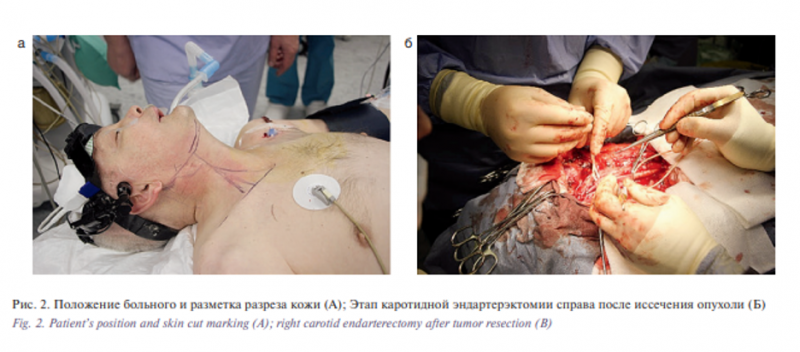
Для доступа к опухоли выполнен Т-образный разрез кожи справа от сосцевидного отростка по переднему краю грудиноключично-сосцевидной мышцы до середины ключицы (рис. 2А).
После выделения кожных лоскутов визуализирован опухолевый конгломерат размером до 6 см с нечетким контуром, ограниченно смещаемый, расположенный в верхней трети шеи. Выявлено поражение грудино-ключично-сосцевидной мышцы и сосудисто-нервного пучка справа с прорастанием опухоли в правую яремную вену. Последняя тромбирована на протяжении. На первом этапе в надключичной области с минимальными рубцовым и опухолевым поражением мягких тканей выполнен доступ к проксимальным отделам ОСА с целью последующего контроля возможного кровотечения, выделения структур сосудисто-нервного пучка и определения медиальной плоскости диссекции опухоли. ОСА взята на держалки, острым путем выполнена диссекция опухоли с выделением и мобилизацией блуждающего, подъязычного нервов. Грудино-ключичнососцевидная мышца и яремная вена перевязаны в верхней и нижней третях и иссечены вместе с прорастающей в них опухолью. По ходу диссекции медиального края опухоли выделены из грубых спаечных сращений ОСА в области ее бифуркации, ВСА и наружная сонная артерия (НСА) на протяжении 5 и 4 см соответственно. Стенки артерий интактны, пальпаторно определяется атеросклеротическая бляшка в бифуркации ОСА, распространяющаяся на ВСА и НСА. После мобилизации острым путем клетчатки надключичной и подчелюстной областей, области бокового треугольника шеи и вдоль сосудисто-нервного пучка опухоль удалена единым блоком.
На следующем этапе была выполнена комбинированная каротидная эндартерэктомия справа по стандартной методике. Выполнено пробное пережатие ОСА, при котором отмечено отсутствие снижения линейной скорости кровотока в средней мозговой артерии (сохранялась на уровне 45–50 см/сек) при стабильном значении церебральной оксиметрии. Это указывает на хорошую компенсацию мозгового кровотока в бассейне правой ВСА и позволяет выполнять основной этап реконструкции без использования временного внутрипросветного шунта.
После системной гепаринезации (2500 Ед гепарина внутривенно) наложены сосудистые клипсы на ВСА и НСА, сосудистый зажим на ОСА. ВСА отсечена от бифуркации ОСА, в ее просвете выявлена гетерогенная плотная кальцифицированная атеросклеротическая бляшка с участками атероматоза, вызывающая стеноз внутренней сонной артерии до 75%. После дополнительного продольного рассечения ВСА на 0,5 см в дистальном направлении выполнена эверсионная эндартерэктомия на протяжении 1,5 см. Атеросклеротическая бляшка в ОСА продольно рассечена в проксимальном направлении на 1,5 см с последующей прямой эндартерэктомией из ОСА и НСА на протяжении 2,5 и 1 см соответственно. После удаления атеросклеротической бляшки был получен хороший ретроградный кровоток из ВСА и НСА, свидетельствующий о компенсации мозгового кровотока в бассейне пережатой ВСА. После удаления мелких фрагментов атеросклеротической бляшки и измененной интимы наложен анастомоз между ВСА и бифуркацией ОСА по типу «конец-вбок» нитью Prolene 6,0. Область шва дополнительно укутана гемостатической марлей.
На следующем этапе была выкроена лестничная мышца, которая была перемещена и сшита с двубрюшной мышцей с целью прикрытия сонных артерий. Гемостаз с последующим послойным ушиванием раны. В ложе удаленной опухоли на сутки установлен активный дренаж по Редону.
Результаты гистологического исследования: метастаз низкодифферецированного неороговевающего плоскоклеточного рака ротоглотки.
Послеоперационный период протекал без осложнений. Пациент в первые сутки был активизирован, нарастания пирамидной, бульбарной симптоматики не отмечалось.
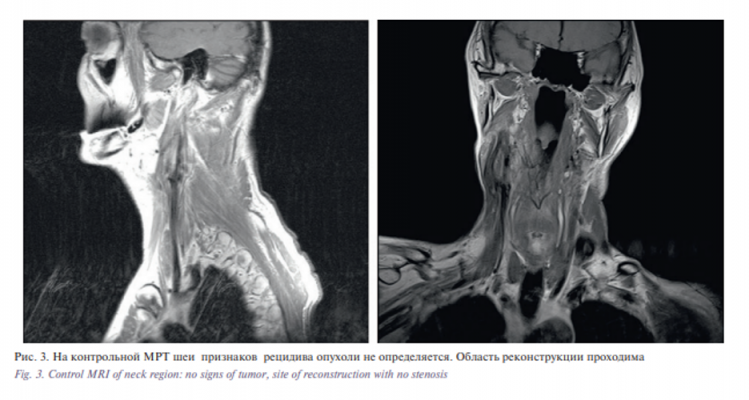
При выполнении контрольных МРТ и УЗ-исследований в раннем послеоперационном периоде – область реконструкции проходима, без гемодинамически значимых сужений, опухоль не определяется, сохраняется субкритический стеноз левой ВСА до 75% (рис. 3).
В связи с наличием симптоматического стеноза левой ВСА в августе 2017 г. вторым этапом выполнена каротидная эндартерэктомия слева. Послеоперационный период также протекал без осложнений, пациент был выписан из стационара в удовлетворительном состоянии.
В ходе катамнестического наблюдения в течение 10 месяцев отмечено стабильное клиническое течение заболевания без нарастания неврологической симптоматики. При контрольных УЗИ зоны реконструкции проходимы, хорошо визуализируются. Данных за рецидив опухоли не выявлено. Повторных нарушений мозгового кровообращения не наблюдалось. Пациент социально адаптирован, работает (по модифицированной шкале Рэнкина 1 балл). Обсуждение Определение тактики хирургического лечения сочетанных гемодинамически значимых стенозов сонных артерий у больных злокачественными опухолями шеи представляет собой сложную междисциплинарную проблему, которая требует дополнительного изучения. Ее актуальность обусловлена частым развитием радиоционно-индуцированных стенозов брахиоцефальных артерий у больных данной группы на фоне проведения лучевой терапии при отсутствии единых стандартов лечения данной сопутствующей патологии [1–4, 11, 12].
Результаты крупных международных многоцентровых кооперативных исследований убедительно доказали эффективность каротидной эндартерэктомии в профилактике ишемического инсульта как при симптоматических [13], так и асимптомных стенозах более 70% [14]. Однако у пациентов, страдающих злокачественными новообразованиями шеи, данные вмешательства связаны с повышенными рисками развития раневых и ишемических осложнений [5, 9, 10, 15]. Причиной тому является наличие выраженных рубцово-атрофических изменений мягких тканей после радиотерапии и опухолевых масс, компримирующих структуры сосудисто-нервного пучка. Это существенно затрудняет диссекцию сонных артерий, повышая вероятность повреждения черепно-мозговых нервов бульбарной группы и развития церебральной эмболии из нестабильной атеросклеротической бляшки. Этим объясняется более активное использование в данной группе больных превентивной эндоваскулярной ангиопластики и стентирования сонных артерий, особенно при планировании лучевой терапии и химиотерапии без открытой хирургической резекции опухоли. Так, по данным международного триала SAPPHIRE, использование эндоваскулярного метода реконструкции ВСА у пациентов с радиотерапией в анамнезе сопровождалось меньшей частотой осложнений по сравнению с каротидной эндартерэктомией [16].
В рассматриваемом клиническом наблюдении у пациента была выявлена опухоль больших размеров, поражающая сосудисто-нервный пучок и компримирующая сонные артерии, что диктовало необходимость ее открытого хирургического удаления. В подобных случаях в процессе удаления новообразования проводится тщательная диссекция опухоли с выделением сонных артерий и черепно-мозговых нервов. Таким образом, после удаления опухолевого конгломерата открывается возможность широкого доступа к сонным артериям, что позволяет одномоментно выполнить каротидную реконструкцию, что и было выполнено в приведенном клиническом случае. Применение эндоваскулярных методов в данном случае было нецелесообразно из-за ряда относительных противопоказаний. В первую очередь – это необходимость назначить пациенту дизагрегантную терапию (клопидогрел) в течение первого года с момента операции, что соответствует протоколу ангиопластики и стентирования и направлено на профилактику рестенозов и возможных тромботических осложнений в отдаленном послеоперационном периоде, которые привели бы к грубым нарушениям гемостаза, что негативно отразилось бы на этапе хирургического удаления опухоли, повысив риски раневых геморрагических осложнений [17]. Другим противопоказанием к стентированию сонных артерий являлось обильное включение плотных солей кальция в структуру атеросклеротической бляшки, что снижает эффективность эндоваскулярного метода при восстановлении просвета артерии и повышает частоту развития рестенозов в отдаленном послеоперационном периоде [17, 18]. По этой причине в рассматриваемом случае на втором этапе также выполнялась эверсионная каротидная эндартерэктомия.
Заключение Одномоментное выполнение каротидной эндартерэктомии и удаления злокачественного новообразований является редким наблюдением, представленным в литературе лишь в двух сериях (в общей сложности 14 наблюдений), при этом во всех описанных случаях были получены хорошие результаты лечения [9, 10]. Показаниями к выбору данной тактики хирургического лечения являются крупные опухоли шеи с компрессией сосудисто-нервного пучка в сочетании с гемодинамически значимыми стенозами сонных артерий. В подобных случаях целесообразно планировать одномоментные вмешательства, включая соответствующую комплектацию хирургической бригады, анестезиологическую подготовку, проведение интраоперационного нейромониторинга.
ЛИТЕРАТУРА/REFERENC
1.Cheng S.W., et al. Irradiation-induced extracranial carotid stenosis in patients with head and neck malignancies. Am. J. Surg. 1999;178(4):323–328.
- Dorth J.A., et al, Incidence and risk factors of significant carotid artery stenosis in asymptomatic survivors of head and neck cancer after radiotherapy. Head Neck. 2014;36(2):215–219.
- McGuirt W.F., et al. Irradiation-induced atherosclerosis: a factor in therapeutic planning. Ann. Otol. Rhinol. Laryngol. 1992;101(3):222–228.
- Seto K., et al. Radiation-induced carotid artery stenosis in a patient with carcinoma of the oral floor. Case Rep. Oncol. Med. 2013.2013: 379039.
- Xu J., Cao Y. Radiation-induced carotid artery stenosis: a comprehensive review of the literature. Interv. Neurol. 2014;2(4):183–192.
- Chu C.N., et al. Increase in stroke risk in patients with head and neck cancer: a retrospective cohort study. Br. J. Cancer. 2011;105(9):1419–1423.
- Smith G.L., et al. Cerebrovascular disease risk in older head and neck cancer patients after radiotherapy. J. Clin. Oncol. 2008;26(31):5119–5125.
- Thompson S.K., McKinnon J.G., Ghali W.A. Perioperative stroke occurring in patients who undergo neck dissection for head and neck cancer: unanswered questions. Can. J. Surg. 2003;46(5):332–334.
- Kroeker T.R., O’Brien J.C. Outcomes of combined oncologic resection and carotid endarterectomy in patients with head and neck cancer. Head Neck. 2013;35(5):E167–170.
- Rechtweg J., et al. Neck dissection with simultaneous carotid endarterectomy. Laryngoscope. 1998;108(8 Pt. 1):1150–1153.
- Atik M.A., et al. Preoperative Doppler sonography for prevention of perioperative stroke in head and neck cancer patients undergoing neck dissection: is it beneficial? J. Clin. Ultrasound. 2007;35(1):38–39.
- Thalhammer C. et al. Carotid artery disease after head and neck radiotherapy. Vasa. 2015;44(1):23–30.
- Barnett H.J., et al. Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis. North American Symptomatic Carotid Endarterectomy Trial Collaborators. N. Engl. J. Med. 1998;339(20):1415–1425.
- den Hartog A.G., et al. Asymptomatic carotid artery stenosis and the risk of ischemic stroke according to subtype in patients with clinical manifest arterial disease. Stroke. 2013;44(4):1002–1007.
- Sundt T.M., Sandok B.A., Whisnant J.P. Carotid endarterectomy. Complications and preoperative assessment of risk. Mayo Clin. Proc. 1975;50(6):301–306.
- Yadav J.S., et al. Protected carotid-artery stenting versus endarterectomy in high-risk patients. N. Engl. J. Med. 2004;351(15):1493–1501.
- Brott T.G., Howard G., Roubin G.S. Long-Term Results of Stenting Versus Endarterectomy for Carotid-Artery Stenosis. J. Vasc. Surg. 2016; 64(2):535–536.
- De Haro J., et al. Carotid Stenting in Patients With High Risk Versus Standard Risk for Open Carotid Endarterectomy (REAL-1 Trial). Am. J. Cardiol. 2017;120(2):322–326.
Поступила 02.02.18
Принята в печать 20.03.18
Received 02.02.18
Accepted 20.03.18
Сведения об авторах:
Д.Ю. Усачев – член-корр. РАН, д.м.н., профессор, заместитель директора по научной работе ФГАУ «Национальный медицинский исследовательский центр нейрохирургии имени академика Н. Н. Бурденко» МЗ РФ, Москва, Россия; e-mail: dousachev@nsi.ru
Р.И. Азизян – д.м.н., профессор, заведующий хирургическим отделением опухолей головы и шеи РОНЦ им. Н.Н. Блохина Минздрава России, Москва, Россия
В.А. Лукшин – д.м.н., руководитель группы «реконструктивной хирургии брахицефальных артерий» ФГАУ «Национальный медицинский исследовательский центр нейрохирургии имени академика Н. Н. Бурденко» МЗ РФ, Москва, Россия; e-mail: vlukshin@nsi.ru
А.Д. Соснин – младший научный сотрудник ФГАУ «Национальный медицинский исследовательский центр нейрохирургии имени академика Н.Н. Бурденко» МЗ РФ, Москва, Россия; e-mail: asosnin@nsi.ru
О.А. Саприна – врач хирург отделения опухолей головы и шеи РОНЦ им. Н.Н. Блохина Минздрава России, Москва, Россия
А.В. Шмигельский – д.м.н., ведущий научный сотрудник ФГАУ «Национальный медицинский исследовательский центр нейрохирургии имени академика Н. Н. Бурденко» МЗ РФ, Москва, Россия; e-mail: ashmigel@nsi.ru
About the authors:
D.Yu. Usachev – corresponding member of RAS, MD, professor, deputy scientific director, FSAI National medical research center of neurosurgery named after acad. N.N.Burdenko, MH RF, Moscow, Russia
R.I. Azizyan – MD, professor, head of surgical department for head and neck tumors, ROSC named after N.N. Blokhin, MH RF, Moscow, Russia
V.A. Lukshin — MD, head of the group for reconstructive surgery of brachycephalic arteries, FSAI “Nation=enko” MH RF, Moscow, Russia; e-mail: vlukshin@nsi.ru
A.D. Sosnin — Junior Researcher of the FSAI “National Medical Research Center of Neurosurgery named after Academician N. N. Burdenko”, Ministry of Health of the Russian Federation, Moscow, Russia; e-mail: asosnin@nsi.ru
O.A. Саприна – MD, surgeon, department of head and neck tumors, ROSC named after N.N. Blokhin, Ministry of Health of Russia, Moscow, Russia
A.V. Shmigelsky – MD, Ph.D., leading researcher, FSAI National Medical Research Center of Neurosurgery named after Academician N. N. Burdenko, Ministry of Health of the Russian Federation, Moscow, Russia; e-mail: ashmigel@ nsi.ru