Для цитирования: Шайхалиев А.И., Петрук П.С., Аразашвили Л.Д., Поляков К.А., Черкесов И.В., Колобовникова А.И. Новые подходы в лечении базалиомы. Клинический случай. Голова и шея Head and neck Russian Journal. 2018;6(2):45–49
Doi: 10.25792/HN.2018.6.2.45–49
Базальноклеточный рак кожи является самой частой неоплазией. Исход заболевания во многом зависит от характера клинического течения и морфологического типа опухоли. Применение тканевых расширителей (эспандеров) является достаточно простым и малоинвазивным методом, обеспечивающим постепенное растяжение кожного лоскута с целью закрытия дефекта, который образуется в результате удаления опухоли. В данной статье приведено описание реконструктивно-восстановительных этапов лечения у пациента с базалиомой в лобно-височной области.
Ключевые слова: базальноклеточный рак кожи, челюстно-лицевая хирургия, реконструктивная хирургия, эспандер.
Авторы заявляют об отсутствии конфликта интересов. И
Источник финансирования. Не указан.
Для цитирования: Шайхалиев А.И., Петрук П.С., Аразашвили Л.Д., Поляков К.А., Черкесов И.В., Колобовникова А.И. Новые подходы в лечении базалиомы. Клинический случай. Голова и шея Head and neck Russian Journal. 2018;6(2):45–49
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов
Введение
Согласно данным специализированной литературы, базальноклеточный рак кожи (БКРК) является самой частой неоплазией кожных покровов головы и шеи [1–6]. Чаще всего злокачественная опухоль кожи встречается у лиц мужского пола [7–9]. Одной из возможных причин является то, что именно они чаще заняты на производстве с вредными условиями труда [10–12]. Наиболее характерная локализация базалиомы – кожные покровы в области внутреннего угла глаза, лба, крыльев носа, носогубной складки, наружного уха [13, 14]. БКРК чаще представлен одиночным узлом, однако примерно в 10% случаев выявляются мультицентрические зачатки опухоли.
Для полноценного удаления опухолевых клеток в Германии разработаны и более 30 лет используются Тюбингенские методы микроскопически контролируемой хирургии (МКХ). Частота возникновения рецидивов при использовании вышеуказанных методов МКХ – самая низкая в мире, и по итогам лечения более 20 000 пациентов составляют 0,5% после 10 лет для первичных базалиом, для больших рецидивирующих базалиом – 5,3% после 10 лет [15].
В связи с активным изучением механизмов канцерогенеза и внедрением новых подходов к лечению в течение последних нескольких лет отмечается значительное возрастание интереса к проблеме БКРК, что определяет актуальность онкологической настороженности и информированности о клинической картине БКРК всех специалистов при первичном осмотре пациента.
Клинический случай
Пациент А., 1961 г.р. Диагноз: «базалиома височно-лобной области слева». Из анамнеза известно, что ранее больной был неоднократно оперирован по поводу удаления новообразования. На момент обращения отмечается рецидив базалиомы. В 2015 г. пациент поступил в клинику челюстно-лицевой хирургии Первого МГМУ им. И.М. Сеченова.
Локальный статус: зона поражения кожных покровов лобной области и волосистой части головы составляла до 12 см2 .
Этапы реконструктивно-восстановительного лечения:
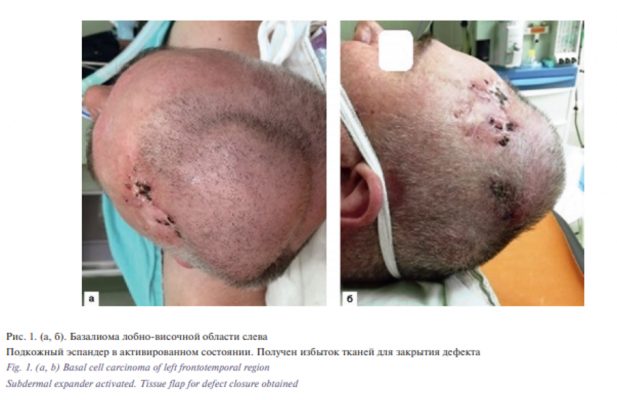
Этап I. Создание избытка кожного лоскута для последующего закрытия дефекта путем имплантации эспандера. В условиях общей анестезии после создания асептических условий стерильным маркером в теменной области слева была выполнена разметка границ размещения эспандера, которые располагались на расстоянии 1–2 см от пораженной кожи. Произведен разрез до 5 см по линии разметки. Проведена имплантация эспандера «Eurosilicone» полулунной формы диаметром 31 мм и объемом 100 мл. Порт для подачи жидкости выведен в затылочной области, после чего операционная рана послойно ушита узловыми швами. После снятия швов и полного заживления раны в течение последующих 3 месяцев с периодичностью 15 дней через камерный клапан подавали физиологический раствор с целью увеличения объема эспандера, тем самым выполняли постепенное растяжение окружающих тканей.
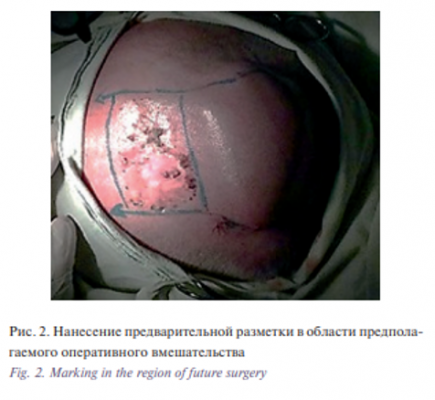
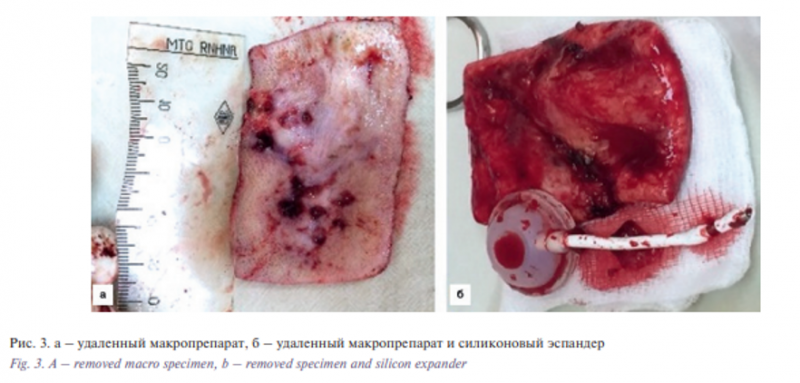
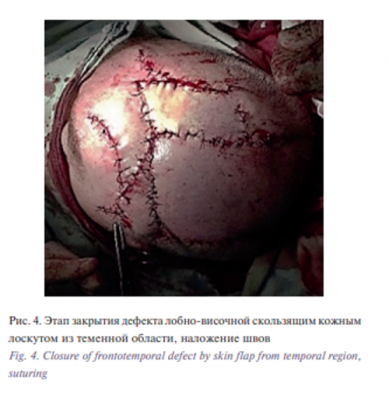
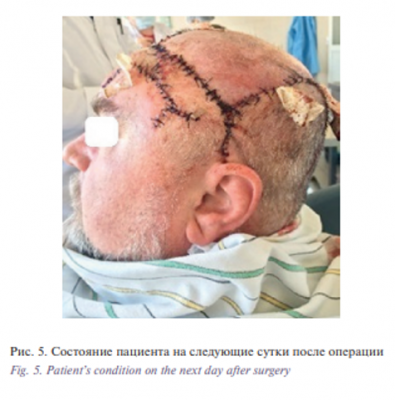
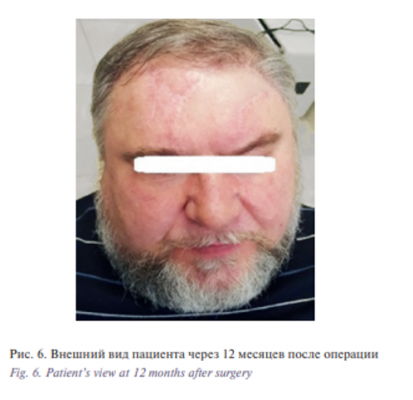
Этап II. Удаление базалиомы лобно-височной области слева. Извлечение эспандера. Закрытие дефекта скользящим кожным лоскутом из теменной области слева. В условиях эндотрахеального наркоза после создания асептических условий и нанесения предварительной разметки произведена резекция опухоли. Далее выполнены мобилизация и перемещение кожного лоскута из теменной области слева в область дефекта с одномоментной пластикой местными тканями. Гемостаз. Операционная рана ушита узловыми швами (рис. 1–6).
Обсуждение
В настоящее время различные варианты хирургического и консервативного лечения являются высокоэффективными при небольших размерах БКРК. Однако при обширных поражениях и необходимости резекции тканей более 5 см2 наиболее оптимальной является техника получения избытка тканей с помощью эспандера. Данное устройство для временной имплантации под кожу постепенно заполняют жидкостью и таким образом растягивают находящиеся над ним ткани. После получения достаточного количества тканей для закрытия дефекта эспандер удаляют, а полученный запас тканей используют для пластики.
Как правило, форма эспандера определяется типом и конфигурацией планируемого лоскута. Так, ткани для моделирования скользящего лоскута в области волосистой части головы лучше всего формировать баллоном полулунной формы. Кроме того, эспандер нужно выбирать таким образом, чтобы во время растяжения не оказывалось отрицательного воздействия на прилежащие анатомические структуры (например, веко, ушная раковина и т.д.). Выбор эспандера следует проводить с учетом размера дефекта, доступности и расположения кожи донорского участка. В работе G.H. Sasaki (1998) по растяжению тканей были сформулированы общие принципы выбора и наполнения эспандера: наполнять эспандер до ширины в 2,0–2,5 раза больше ширины дефекта в плоских областях и в 2,5–3,0 раза больше ширины дефекта в изогнутых областях. Для некоторых дефектов это означает, что требуемый эспандер должен быть больше, чем доступные окружающие ткани. В этом случае может потребоваться установка двух или более эспандеров вокруг дефекта и растяжение нескольких лоскутов, перемещаемых в зону дефекта [16].
Заключение
Таким образом, хирургические методики остаются ведущими и наиболее эффективными в лечении пациентов с базалиомами челюстно-лицевой области. Выбор тактики лечения должен быть основан на характере клинического течения заболевания, площади поражения кожи, а также с учетом морфологического подтипа опухоли. Предложенные в данной работе модификации реконструктивно-восстановительного этапа хирургического лечения с применением подкожного эспандера, учитывающие характеристики тканевых дефектов, позволяют достигать хороших косметических и функциональных результатов.
ЛИТЕРАТУРА
- Организационная технология взаимодействия кожно-венерологической и онкологической служб по оказанию специализированной помощи больным с предопухолевой и злокачественной патологией кожи. МЗ РФ, метод. указ. №2003/60. М., 2003.
- Романко Ю.С., Каплан М.А., Попучиев В.В. и др. Базально-клеточный рак кожи: проблемы лечения и современные аспекты фотодинамической терапии. Рос. журнал кожных и венерических заболеваний. 2004;6:6–10.
- Дубенский В.В., Гармонов А.А. Современные аспекты эпидемиологии, патогенеза, клиники и лечения базально-клеточного рака кожи. Вестн. дерматологии и венерологии. 2004;6:7–12.
- Чиссов В.И., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2003 году (заболеваемость и смертность). М., 2005.
- Kunte C., Konz B. Current recommendations in the treatment of basal cell carcinoma and squamous cell carcinoma of the skin. Hautarzt. 2007;58(5):419–426.
- Iorio M.L., Ter Louw R.P., Kauffman C.L., Davison S.P. Evidence-based medicine: facial skin malignancy. Plast. Reconstr. Surg. 2013;132:1631–1643.
- Bower C.P., Lear J.T., de Berker D.A. Basal cell carcinoma follow-up practices by dermatologists: a national survey. Br. J. Dermatol. 2001;145(6):949–956.
- Lai S.Y., Weber R.S. High-risk non-melanoma skin cancer of the head andneck. Curr. Oncol. Rep. USA. 2005;7(2):154–158.
- Буйко А.С., Сафроненкова И.А., Питерова О.В. Эпителиальные злокачественные опухоли кожи век стадии Т3–4: комбинированное лечение или скальпель? Офтальмологический журнал. 2002;1:30–34.
- Смулевич В.Б., Соленова Л.Г., Белякова С.В. Профессия родителей как фактор онкологического риска у детей. Рос. онкологический журнал. 2001;4:45–47.
- Давыдов М.И., Аксель Е.М. (ред.). Статистика злокачественных новообразований в России и странах СНГ в 2009 г. Вестник РОНЦ им. Н.Н. Блохина РАМН. 2011;22(3(85), прил. 1.
- Pasca di Magliano M., Hebrok M. Hedgehog signaling in cancer formation and maintenance. Nat. Rev. Cancer. 2003;3:903–911.
- Волгин В.Н., Соколова Т.В. Особенности течения базально-клеточного рака кожи в современных условиях. Врач. 2009;2:6–9.
- Nakai N., Takenaka H., Katoh N., et al. Basal cell carcinoma with a skip lesion on the nose after repeated cryotherapy. J. Dermatology. 2010;37(4):390–392.
- Мedical Tribune Kongressbericht. Mit “Tubinger Torte” und Flunder-Technik Basaliome garantiert entfernen. MTD 2001;51/52:36.
- Sasaki G.H. Tissue expanders and general guidelines for tissue expansion technique. In: Sasaki G.H, editor. Tissue expansion in reconstructive and aesthetic surgery. St. Louis: Mosby; 1998.
Поступила 15.01.18
Принята в печать 20.03.18
REFERENCES
- Organizatsionnaya tekhnologiya vzaimodeystviya kozhno-venerologicheskoy i onkologicheskoy sluzhb po okazaniyu spetsializirovannoy pomoshchi bol’nyms predopukholevoy i zlokachestvennoy patologiey kozhi. Min. zdrav. RF, metod. ukaz. №2003/60. M., 2003. (In Russ.)
- Romanko Yu.S., Kaplan M.A., Popuchiev V.V., et al. Basal cell carcinoma of the skin: the problems of treatment and the current aspects of photodynamic therapy. Rossijskij zhurnal kozhnykh i venericheskikh zabolevanij. 2004;6:6– 10 (In Russ.)
- Dubenskij V.V., Garmonov A.A. Sovremennye aspekty jepidemiologii, patogeneza, kliniki i lechenija bazal’no-kletochnogo raka kozhi. Vestnik dermatologii i venerologii. 2004;6:7–12 (In Russ.)
- Chissov V.I., Starinskiy V.V., Petrova G.V. Zlokachestvennye novoobrazovaniya v Rossii v 2003 godu (zabolevaemost’ i smertnost’). M., 2005. (In Russ.)
- Kunte C., Konz B. Current recommendations in the treatment of basal cell carcinoma and squamous cell carcinoma of the skin. Hautarzt. 2007;58(5):419–426.
- Iorio ML, Ter Louw RP, Kauffman CL, Davison SP. Evidence-based medicine: facial skin malignancy. Plast. Reconstr. Surg. 2013;132:1631–1643.
- Bower C.P., Lear J.T., de Berker D.A. Basal cell carcinoma follow-up practices by dermatologists: a national survey. Br. J. Dermatol. 2001;145(6): 949–956.
- Lai S.Y., Weber R.S. High-risk non-melanoma skin cancer of the head andneck. Curr. Oncol. Rep. USA. 2005;7(2):154–158.
- Bujko A.S., Safronenkova I.A., Piterova O.V. Jepitelial’nye zlokachestvennye opuholi kozhi vek stadii T3–4: kombinirovannoe lechenie ili skal’pel’? Oftal’mologicheskij zhurnal. 2002;1:30–34. (In Russ.)
- Smulevich V.B., Solenova L.G., Beljakova S.V. Professija roditelej kak faktor onkologicheskogo riska u detej. Rossijskij onkologicheskij zhurnal. 2001;4:45– 47 (In Russ.)
- Davydov M.I., Aksel’ E.M. (red.) Statistika zlokachestvennyh novoobrazovanij v Rossii i stranah SNG v 2009 g. Vestnik RONC im. N.N. Blohina RAMN. 2011;22 (3(85): prilozhenie 1 (In Russ.)
- Pasca di Magliano M., Hebrok M. Hedgehog signaling in cancer formation and maintenance. Nat. Rev. Cancer. 2003;3:903–911.
- Volgin V., Sokolova T. Basal-cell carcinoma of the skin under the present-day conditions. Vrach. 2009;2:6–9 (In Russ.)
- Nakai N., Takenaka H., Katoh N., et al. Basal cell carcinoma with a skip lesion on the nose after repeated cryotherapy. J. Dermatology. 2010;37(4):390–392.
- Мedical Tribune Kongressbericht. Mit “Tubinger Torte” und Flunder-Technik Basaliome garantiert entfernen. MTD. 2001;51/52:36.
- Sasaki GH. Tissue expanders and general guidelines for tissue expansion technique. In: Sasaki GH, editor. Tissue expansion in reconstructive and aesthetic surgery. St. Louis: Mosby; 1998.
Received 15.01.18
Accepted 20.03.18
Сведения об авторах:
А.И. Шайхалиев – к.м.н., доцент кафедры челюстно-лицевой хирургии стоматологического факультета ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), Москва, Россия; e-mail: astemirsh@yandex.ru
П.С. Петрук – ассистент кафедры челюстно-лицевой хирургии стоматологического факультета ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), Москва, Россия; e-mail: petruk_pavel@yahoo.com
Л.Д. Аразашвили – к.м.н., доцент кафедры челюстно-лицевой хирургии стоматологического факультета ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), Москва, Россия; e-mail: arazashvili@mai.ru
К.А. Поляков – к.м.н., доцент кафедры челюстно-лицевой хирургии стоматологического факультета ФГАОУ ВО Первый МГМУ |им. И.М. Сеченова Минздрава России (Сеченовский Университет), Москва, Россия; e-mail: 79067170999@yandex.ru
И.В. Черкесов – к.м.н., доцент кафедры челюстно-лицевой хирургии стоматологического факультета ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), Москва, Россия; e-mail: cherkesovi@gmail.com
А.И. Колобовникова – студентка 4 курса 14 группы стоматологического факультета ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), Москва, Россия; e-mail: kolobovnmm@ yandex.ru
About the authors:
A.I. Shaikhaliev – MD, associate professor, Department of Maxillofacial Surgery of the Stomatological Faculty of the FSAEI First Moscow State Medical University named after I.M. Sechenov, Ministry of Health of Russia (Sechenovsky University), Moscow, Russia; e-mail: astemirsh@yandex.ru
P.S. Petruk – medical assistant, Department of Maxillofacial Surgery of the Stomatological Faculty, FSAEI First Moscow State Medical University named after I.M. Sechenov of the Ministry of Health of Russia (Sechenovsky University), Moscow, Russia; e-mail: petruk_pavel@yahoo.com
L.D.Arazashvili – MD, assistant professor, Department of Maxillofacial Surgery of the Stomatological Faculty, FSAEI First Moscow State Medical University named after I.M. Sechenov of the Ministry of Health of Russia (Sechenovsky University), Moscow, Russia, e-mail: arazashvili@mai.ru
K.A.Polyakov – MD, assistant professor, Department of Maxillofacial Surgery of the Stomatological Faculty, FSAEI First Moscow State Medical University named after I.M. Sechenov of the Ministry of Health of Russia (Sechenovsky University), Moscow, Russia, e-mail: cherkesovi@gmail.com
I.V.Cherkesov – MD, assistant professor, Department of Maxillofacial Surgery of the Stomatological Faculty, FSAEI First Moscow State Medical University named after I.M. Sechenov of the Ministry of Health of Russia (Sechenovsky University), Moscow, Russia, e-mail: cherkesovi@gmail.com
A.I.Kolobovnikova – medical student of the 4th year, Department of Maxillofacial Surgery of the Stomatological Faculty, FSAEI First Moscow State Medical University named after I.M. Sechenov of the Ministry of Health of Russia (Sechenovsky University), Moscow, Russia, e-mail: kolobovnmm@yandex.ru
Введение
Соматостатин был впервые выделен и описан P. Brazeau et al. в 1973 году как вещество, способное тормозить высвобождение гормона роста [1], в этом же году он был впервые синтезирован в лабораторных условиях.
Изначально соматостатин был выделен из гипоталамуса, однако впоследствии оказалось, что он синтезируется во многих клетках, расположенных вне его, в том числе в желудке, кишечнике, поджелудочной железе, в области периферических нервных окончаний, в надпочечниках и сетчатке глаза. Как и другие пептидные гормоны, сома тостатин взаимодействует с рецепторами плазматиче- ской мембраны, при этом различают 5 типов рецепторов, которые экспрессируются в гипофизе, органах пищева- рительной системы и других, а также присутствуют во многих опухолевых клетках [2–4].
Соматостатин и его синтетические аналоги применяются не только при акромегалии и опухолях гипоталамуса, но и при панкреатитах и панкреонекрозах, а также при хирургических вмешательствах на ЖКТ и при лечении свищей пищеварительного тракта в связи с ингибирующим действием на секрецию соляной кислоты, пепсина и гастрина в желудке, угнетающим действием на эндо- и экзокринную функции поджелудочной железы, а также угнетением моторной активности желудочно-кишечного тракта, секреторной активности печени, желудка и тон- кого кишечника [5, 6]. Препарат Октреотид (Octreotide) представляет собой аналог гормона соматостатина и относится к фармакологической группе «Гормоны гипо- таламуса, гипофиза, гонадотропины и их антагонисты». В отличие от соматостатина, период полувыведения кото- рого составляет около 2–3 минут, период полувыведения препарата Октреотид составляет 100 минут, что делает возможным и целесообразным его применение для про- филактики осложнений при хирургических вмешательствах [7]. Эффективность и возможность применения в хирургической практике соматостатина и его производных была подробно рассмотрена и изучена в России и за рубежом [8–11], исследовалось использование препаратов в том числе при консервативной терапии послеоперационного хилоторакса, хилезного асцита [12–14]. Ряд исследователей получили положительный результат, применяя данные препараты в педиатрической практике [15–17]. В настоящее время Октреотид входит в список средств, рекомендованных в том числе в хирургической практике, код по МКБ-10 Z.100.
Наиболее распространенными заболеваниями слюнной железы являются сиаладенит, сиалолитиаз и паротит. После воспалительного процесса или травмы в результате закрытия общего протока или протока, отходящего от дольки железы, образуются ретенционные кисты, чаще в малых слюнных железах (нижней губы, щеки), реже – больших слюнных желез. Опухоли слюнных желез составляют по отношению к новообразованиям других органов 1–2%. Наиболее часто поражаются околоушные слюнные железы, реже – подчелюстные, подъязычная и малые слюнные железы [18–20]. При лечении доброкачественных новообразований слюнных желез опухолевый узел осторожно удаляется вместе с капсулой с последующим гистологическим исследованием удаленных тканей [21, 22].
В ряде научных работ рассматривалось положительное влияние препарата Октреотид при хирургическом лече- нии, затрагивавшем слюнные железы, – в частности, предотвращение развития и более быстрое закрытие слюнных свищей [23], а также лучший прогноз при пал- лиативных операциях на экскреторных железах [24], положительный эффект при добавлении Октреотида к консервативной терапии ксеростомии, вызванной луче- вым воздействием на большие слюнные железы [25], также исследовалось влияние препарата Октреотид на саливацию и концентрацию амилазы в секрете слюнных желез [26].
Материалы и методы
Настоящее исследование с результатами в формате экспертной оценки проводилось на базе отделения плас- тической хирургии Университетской клинической боль- ницы No1 Первого МГМУ им. И.М.Сеченова во временном интервале май-ноябрь 2015 года. Целью исследования была оценка влияния препарата Октреотид, применяемо- го в пред- и послеоперационном периоде, на количество осложнений при хирургическом лечении, включавшем удаление или резекцию одной или более слюнных желез. Также оценивалась безопасность препарата Октреотид при использовании в послеоперационном периоде после операций на больших слюнных железах.
Исследование проводилось с очным участием и под руководством проф., руководителя отделения пласти- ческой хирургии, д.м.н. Решетова И.В. В исследовании приняли участие пациенты мужского и женского пола в возрасте от 18 лет, которым было выполнено хирургиче- ское вмешательство на одной или более больших слюнных железах в объеме резекции или удаления. Исключались из исследования пациенты с непереносимостью ком- понентов исследуемого препарата и общесоматической патологией в стадии декомпенсации. Препарат Октреотид вводился подкожно в дозировках, рекомендованных при профилактике осложнений при хирургических операциях на поджелудочной слюнной железе: 100 мкг за 1 час до хирургического вмешательства, затем по 100 мкг 3 раза в сутки на протяжении 7 дней подряд.
Контрольное обследование проводилось через 2 недели после хирургического лечения, результат оценивался по наличию или отсутствию послеоперационных осложнений – инфицирования раны, гематомы, серомы или лимфореи, такие осложнения, как синдром Фрея и парез лицевого нерва, не рассматривались в связи со значительной зависимостью частоты их развития от объема и тактики хирургического лечения.
Были предусмотрены критерии выхода пациента из исследования при невозможности проведения контроль- ного осмотра через 2 недели после хирургического лечения, при развитии аллергических реакций на компоненты препарата, полиорганной недостаточности или летальном исходе в период наблюдения.
В исследовании приняли участие 56 пациентов, про- ходивших хирургическое лечение в отделении пластической хирургии Университетской клинической боль- ницы No1 Первого МГМУ им. И.М.Сеченова. Пациенты в возрасте 21–77 лет; среди них мужчин – 71,4% (40), женщин – 28,6% (16) были прооперированы; по поводу злокачественного новообразования, включая первичные операции, шейные и подчелюстные лимфаденэктомии, операции по поводу рецидивов и продолженного роста опухоли, реконструктивно-пластические операции после предшествующего лечения – 92,8% (52 пациента), также среди них – получавшие лучевую или химиотерапию в прошлом; по поводу доброкачественных новообразований слюнных желез – 7,2% (4 пациента); при этом была выполнена резекция или удаление околоушной слюнной железы в 71,4% (40 пациентов), одной подчелюстной слюнной железы или обеих – в 48,2% (24 пациента), одной подъязычной слюнной железы или обеих – в 14,2% (8 пациентов).
Результаты
За время наблюдения в послеоперационном периоде (в течение 2 недель) у пациентов на фоне стандартной терапии в сочетании с подкожными инъекциями Октреотида в указанной выше дозировке не было выявлено случаев развития инфицирования раны, гематомы или лимфореи; в 1,8% (1 случай) была выявлена серома околоушной области, потребовавшая дренирования послеоперационной раны на 5-е сутки после операции, дренаж был удален на 8-е сутки после операции с наложением отсроченных швов, после чего рана зажила первичным натяжением.
Также в 3,6% (2 случая) были отмечены участки диастаза швов послеоперационной раны, однако данных за связь данного осложнения с наличием кровотечения, лимфореи или развитием слюнного свища получено не было. В обоих случаях раны зажили вторичным натяжением, не потребовав дополнительного хирургического лечения.
Ни один из принявших участие в эксперименте пациентов не вышел из исследования, также у наблюдаемых пациентов не наблюдалось побочных или нежелательных явлений на введение препарата Октреотид.
Обсуждение
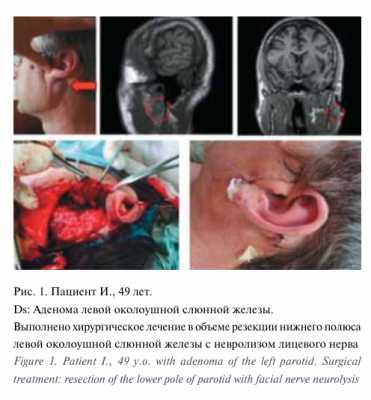
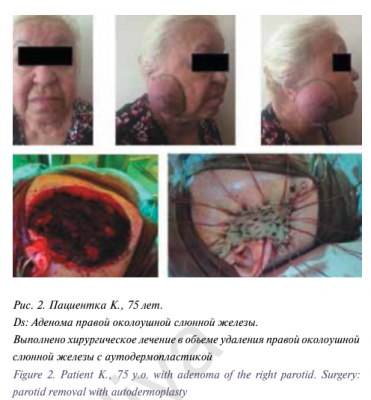
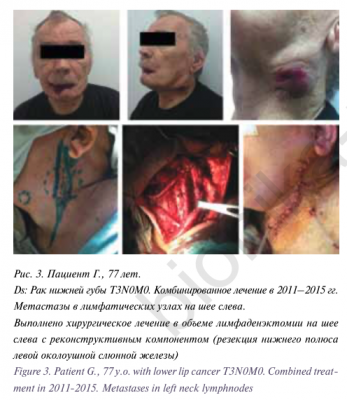
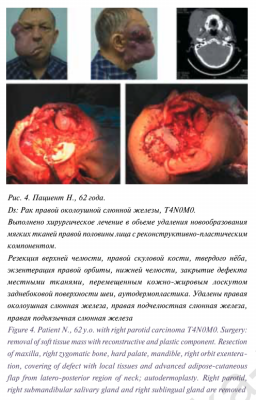
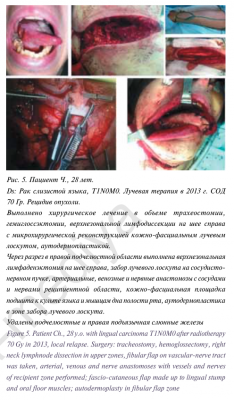
Одними из наиболее частых осложнений при хирургическом лечении больших слюнных желез являются инфициро- вание раны (2,3–3,8%), гематома (3,4–3,8%), серома/лимфорея (1,1–6,5%), синдром Фрея (1,7–4,8%) и парез лицевого нерва [27–29]. Как уже было указано, такие осложнения, как синдром Фрея и парез лицевого нерва, не рассматривались в связи со значительной зависимостью частоты их развития от объема и тактики хирургического лечения. Единственный случай развития учитываемого осложнения – серомы послеоперационной раны, составившей 1,8% всех случаев, можно считать хорошим показателем с учетом данных предше- ствующего опыта хирургического лечения, включающего резекцию или удаление одной или нескольких слюнных желез, кафедры пластической хирургии Университетской клинической больницы No1 Первого МГМУ им. И.М.Сеченова, а также данные мировой литературы. Особо следует отме- тить разнообразие выполненных операций, включающих резекцию одной слюнной железы при доброкачественном новообразовании (рис. 1), полное удаление одной слюнной железы по поводу доброкачественных или злокачественных новообразований (рис. 2), шейные лимфаденэктомии в связи с метастатическим поражением лимфатических узлов шеи или в профилактическом порядке (рис. 3), обширные резекции по поводу местно-распространенных опухолей (рис. 4), операции с одномоментным реконструктивным компонентом, включая реконструкцию свободным лоскутом с использованием микрохирургической техники (рис. 5). Особо следует отметить гладкий послеоперационный период пациентов, прошедших ранее лучевую терапию, так как в связи с пост лучевыми изменениями слюнных желез и прилежащих к ним мягких тканей у таких пациентов гораздо чаще встречаются не только послеоперационные осложнения, но и фоновые жалобы на ксеростомию и дискомфорт в полости рта.
В настоящее время проводится проспективное рандо- мизированное двойное слепое плацебо-контролируемое клиническое исследование в параллельных группах 2-й фазы по изучении эффективности Октреотида в профилактике развития слюнных свищей после хирургических операций по жизненным показаниям у пациентов, прошедших лучевую терапию. В ходе исследования также будут оцениваться секреторная активность слюнных желез и выраженность болевого синдрома. Режим дозирования соответствует дозам при профилактике хирургических осложнений на поджелу- дочной железе, 100 мкг перед операций и аналогичная доза трижды в день на протяжении двух недель после операции. Результаты исследования ожидаются в 2018 г. [30].
Помимо влияния препарата Октреотид непосредственно на рецепторы слюнных желез, следует рассмотреть возможный положительный эффект при резекции и удалении больших слюнных желез с точки зрения профилактики осложнений после хирургического вмешательства на органах лимфатической системы – учитывая соседствующее положение слюнных желез с лимфатическими узлами (подчелюстная и околоушная группы), возможность расположения лимфатических узлов, протоков и скопления лимфатической ткани внутри желез, а также выполнение резекции нижнего полюса околоушной слюнной железы или подчелюстной слюнной железы при шейной лимфаденэктомии [31]. Ранее исследована эффективность препарата Октреотид по этим показаниям, отмечено положи- тельное воздействие при лечении и профилактике лимфореи при хирургическом удалении подмышечных [32, 33], тазовых [34], шейных и подчелюстных [35] лимфатических узлов, лим- фодиссекциях при хирургических операциях по поводу рака желудка [36], а также в терапии массивных лимфорей после иссечения лимфатических мальформаций [37].
Выводы
Учитывая положительный опыт применения препарата Октреотид при хирургических операциях на больших слюнных железах, мы считаем целесообразным проведение дальней- ших клинических исследований с большим уровнем доказа- тельности. Помимо обоснованности применения Октреотида для профилактики осложнений, связанных с резекцией или удалением больших слюнных желез, особое внимание следует уделить положительному эффекту при терапии пациентов, прошедших лучевую терапию, затрагивавшую большие слюнные железы. В связи с положительным эффектом препарата Октреотид в профилактике и терапии осложнений, связанных с лимфатической системой, в том числе развития лимфорей и сером, перспективным видится его применение при проведении шейных лимфаденэктомий, при проведении которых могут быть резецированы или удалены подчелюстная или нижний полюс околоушной слюнной железы.
ЛИТЕРАТУРА/REFERENCES
- Brazeau P., Vale W., Burgus R., et al. Hypothalamic polypep tide that inhibits the secretion of immuno-reactive pituitary growth hormone Science. 1973;179:77–9.
- Csaba Z., Peineat S., Dournaud P. Molecular mechanisms of somatostatin receptor trafficking. J Mol Endocrinol. February 1, 2012;48:R1–R12.
- Csaba Z., Dournaud P. Cellular biology of somatostatin receptors. 2001;35(1):1–23.
- Unger N., Ueberberg B., Schulz S., Saeger W., Mann K., Petersenn S. Differential expression of somatostatin receptor subtype 1-5 proteins in numerous human normal tissues. Exp Clin Endocrinol Diabetes. 2012;120(08):482–489.
- Гельфанд Б.Р., Бруневич С.З., Гройзик К.Л. Препараты соматостатина в неотложной панкреатологии: состояние и перспективы. Вестникинтенсивной терапии. 1998;3:19–24. Gelfand B.R., Brunevich S.Z., Groizik K.L. Somatostatin in urgent pancreatology: status and prospects. Intensive therapy bulletin. 1998;3:19–24.
- Гринберг А.А., Затевахин И.И., Щеголев А.А. Хирургическая тактика при язвенных гастродуоденальных кровотечениях. М.: Принтэкспресс. 149 с. Grinberg A.A., Zatevakhin I.I., Schyogolev A.A. Syrgical tactics in ulcerous gastroduodenal bleedings. : Printexpress, 149 p.
- Моисеенко С.В. Октреотид – перспективы клинического применения. Клиническая фармакология и терапия. 1998; 8:73–77. Moiseenko S.V. Octreotide: clinical use prospects. Clinical pharmacology and therapy. 1998;8:73–77.
- Аль Сибунчи О.А., Павлычев А.В., Товмасян Р.С. Применение октреотида в хирургической гастроэнтерологии. М.: ГБОУ ВПО «РНИМУ имени Н И. Пирогова», 2013. 26 с. Al Sibunchi O.A., Pavlychev A.V., Tovmasyan R.S. Octreotide usage in surgical gastroenterology. M.: SBEI Pirogov Russian scientific research medical university. 2013. 26 p.
- Hwang S.J., Lin H.C., Chang C.F., Lee F.Y., Lu C.W., Hsia H.C., et al. A randomized controlled trial comparing octreotide and vasopressin in the control of acute oesophageal bleeding. J Hepatol. 1992;16:320–5.
- Christiansen J., Ottenjann R., Von Arx F. Placebo-controlled trial with the somatostatin analogue SMS 201-995 in peptic ulcer bleeding. 1989;97:568–74.
- Binder M., Uhl W., Friess H., Malfertheiner P., Bachler M.W. Octreotide in the treatment of acute pancreatitis: results of a unicentric prospective trial with three different octreotide dosages. 1994;55(Suppl 1):20–3.
- Rosti L., Bini R.M., Chessa M., Butera G., Drago M., Carminati M. The effectiveness of octreotide in the treatment of post-operative chylothorax. Eur J Pediatr. 2002;161:149–50.
- Cheung Y., Leung M.P., Yip M. Octreotide for treatment of post-operative chylothorax. J Pediatr. 2001;139:157–9.
- Bhatia C., Pratap U., Slavik Z. Octreotide therapy: a new horizon in treatment of iatrogenic chyloperitoneum. Arch Dis Child. 2001;85:234–5.
- Al-Hussaini A., Butzner D. Therapeutic Applications of Octreotide in Pediatric Patients. Saudi J Gastroenterol. 2012 Mar-Apr;18(2):87–94.
- Tissieres P., Bugmann P., Rimensberger P.C., Mentha G., Lencoultre C., Belli D.C. Somatostatin in the treatment of pancreatic pseudocyst complicating acute pancreatitis in a child with liver transplantation. J Pediatr Gastroenterol Nutr. 2000;31:445–7.
- Lam J.C., Aters S., Tobias J.D. Initial experience with octreotide in the pediatric population. Am J Ther. 2001;8:409–15.
- Eskander A., Irish J., Freeman J., Gullane P., Gilbert R., Groome P.A., Hall S.F., Urbach D.R., Goldsteinco D.P. Overview of major salivary gland cancer surgery in Ontario (2003–2010). J Otolaryngol Head Neck Surg. 2014;43(1):50.Toronto, On: Canadian Cancer Society; 2013. [updated May, 2013; cited March 15, 2014]. Available from: http://www.cancer.ca/en/en/cancer- information/cancer-type/salivary-gland/statistics/?region=ns.
- Speight P.M., Barrett A.W. Salivary gland tumours. Oral Dis. 2002;8(5):229–240.
- Ellis G.L., Auclair P.L. Tumors of the salivary glands. Washington, DC: Armed Forces Institute of Pathology; 1996. Benign epithelial neoplasms: 57–68. Rosai J. (Series Editor) Atlas of tumor pathology: series 3, fascicle 17.
- Papadogeorgakis N., Skouteris C.A., Mylonas A.I., Angelopoulos A.P. Superficial parotidectomy: technical modifications based on tumour characteristics. Journal of Cranio-Maxillofacial Surgery. December 2004; 32(6): 350–353.
- Spinell C., Ricci E., Berti P., Miccoli P. Postoperative salivary fistula: Therapeutic action of octreotide. Surgery (Impact Factor: 3.38). 02/1995;117(1):117–8.
- Harvey M., Dunlop R. Octreotide and the secretory effects of advanced cancer. Palliative medicine 1996;10:346–7.
- Belzile M., St-Amant M., Mathieu D., Doueik A.A., Fortier P.H., Dorion D. Radiation-induced xerostomia: is octreotide the solution? Otolaryngol Head Neck Surg. 2009;38(5):545–51.
- Loguercio C., de Sio I., Romano M., del Vecchio Blanco C., Coltorti M. Effect of somatostatin on salivary secretion in man. Digestion. 1987;36(2):91–5.
- Bova R., Saylor A., Coman W.B. Parotidectomy: review of treatment and outcomes. ANZ J Surg 2004;74:563–568.
- Papaspyrou G., Werner J.A., Sesterhenn A.M. Transcervical extirpation of the submandibular gland: the University of Marburg experience. European Archives of Oto-Rhino-Laryngology. 2014;271(7):2009–2012.
- Upton D.C., McNamar J.P., Connor N.P., Harari P.M., Hartig G.K. Parotidectomy: ten-year review of 237 cases at a single institution. Otolaryngol Head Neck Surg. 2007;136(5):788–92.
- Weinberger J. Octreotide VS Placebo in Prevention of Salivary Fistulae After Post Radiation Salvage Surgery. ClinicalTrials.gov Identifier: NCT02437825.
- Nageris B., Feinmesser R. Complications of parotidectomy: Surgical techniques of repair. Operative Techniques in Otolaryngology-Head and Neck Surgery. 1996;7(4):374–376.
- Carcoforo P., Soliani G., Maestroni U., Donini A., Inderbitzin D., Hui T.T., Lefor A., Avital I., Navarra G. Octreotide in the treatment of lymphorrhea after axillary node dissection: a prospective randomized controlled trial. J Am Coll Surg. 2003;196(3):365–9.
- Mahmoud S.A., Abdel-Elah K., Eldesoky A.H., El-Awady S.I. Octreotide can control lymphorrhea after axillary node dissection in mastectomy operations. Breast J. 2007;13(1):108–09.
- Kim W.T., Ham W.S., Koo K.C., Choi Y.D. Efficacy of octreotide for management of lymphorrhea after pelvic lymph node dissection in radical prostatectomy. Urology. 2010 Aug;76(2):398–401. doi: 10.1016/j. urology.2009.04.104. Epub 2010 Mar 25.
- Campisi C.C., Boccardo F., Piazza C., Campisi C. Evolution of chylous fistula management after neck dissection. Curr Opin Otolaryngol Head Neck Surg. 2013;21(2):150–6.
- Sheng-Zhang L., Hong-Fei T., Zhong-Lin N., Yao-Jun Y., Tao Y., Wei Z. Treatment and prevention of lymphorrhea after radical gastrectomy of gastric cancer. J Cancer Res Clin Oncol. 2009;135(4):613–6.
- Suver D.W., Perkins J.A., Manning S.C. Somatostatin treatment of massive lymphorrhea following excision of a lymphatic malformation. Int J Pediatr Otorhinolaryngol. 2004;68(6):845–50.