Для цитирования: Романчишен А.Ф., Гостимский А.В., Акинчев А.Л., Карпатский И.В., Матвеева З.С., Вабалайте К.В. Онкологическая опасность рецидивного зоба. Голова и шея Head and neck Russian Journal. 2019;7(2):12–17
For citation: Romanchishen A.F., Gostimsky A.V., Akinchev A.L., Karpatsky I.V., Matveeva Z.S., Vabalayte K.V. Oncological risk of recurrent goiter. Head and neck Russian Journal. 2019;7(1):12–17 (in Russian).
Doi: 10.25792/HN.2019.7.2.12–17
Цель исследования. Оценка риска злокачественного поражения тиреоидного остатка у больных рецидивным зобом, обоснование хирургической тактики в этой группе больных.
Материал и методы. В Санкт-Петербургском Центре эндокринной хирургии и онкологии за период с 1973 по 2016 г. оперированы 28 138 пациентов с различными заболеваниями щитовидной железы (ЩЖ).
Результаты. При ретроспективном анализе группы, состоявшей из 1106 больных рецидивным зобом, новое заболевание тиреоидного остатка выявлено в 156 (14,1%) случаях. Рак ЩЖ в тиреоидном остатке выявлен в 57 (36,5%) случаях или у 5,2% от всех больных рецидивным зобом. В работе выполнена оценка риска злокачественного поражения тиреоидного остатка у больных рецидивным зобом, обоснована хирургическая тактика в этой группе больных. Выявлено, что в условиях многоузловой трансформации тиреоидного остатка изменения топографо-анатомических соотношений и рубцовой ткани в зоне предыдущей операции возможности тонкоигольной аспирационной биопсии резко снижаются.
Выводы. Активная хирургическая тактика при выявлении многоузловой трансформации тиреоидного остатка является оправданной. Операцией выбора следует считать ререзекцию ЩЖ до объема тиреоидэктомии.
Ключевые слова: рецидивный зоб, рак щитовидной железы А
вторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Романчишен А.Ф., Гостимский А.В., Акинчев А.Л., Карпатский И.В., Матвеева З.С., Вабалайте К.В. Онкологическая опасность рецидивного зоба. Голова и шея Head and neck Russian Journal. 2019;7(2):12–17
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Purpose: to assess the risk of thyroid residue malignant change in patients with recurrent goi-ter, to substantiate the surgical tactics in this group of patients.
Material and methods: from 1973 to 2016, 28,138 patients with various thyroid diseases were operated in St. Petersburg Center for Endocrine Surgery and Oncology.
Results: in a retrospective analysis of a group consisting of 1106 patients with recurrent goi-ter, a new thyroid residue disease was registered in 156 (14.1%) cases. Thyroid cancer in the thyroid residue was detected in 57 (36.5%) patients or 5.2% of all patients with recurrent goi-ter. In this paper, we assessed the risk of thyroid residue malignant change in patients with recurrent goiter, and justified the surgical tactics in this group of patients. It was found that multinodular transformation of the thyroid residue and cicatrical changes in the area of the previous operation significantly decreased the opportunities of fine-needle aspiration biopsy. Findings. Active surgical tactics in case of detection of a multinodular transformation of the thyroid residue is justified. The operation of choice is thyroidectomy.
Key words: recurrent goiter, thyroid cancer
The authors declare no conflict of interest. Source of financing: not specified.
For citation: Romanchishen A.F., Gostimsky A.V., Akinchev A.L., Karpatsky I.V., Matveeva Z.S., Vabalayte K.V. Oncological risk of recurrent goiter. Head and neck Russian Journal. 2019;7(1):12–17 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of pub-lishing illustrative material – tables, figures, photographs of patients.
Введение
Рецидивы доброкачественных заболеваний щитовидной железы (ЩЖ) до сих пор остаются одной из актуальных проблем эндокринной хирургии и онкологии. По данным литературы, факторами риска рецидива являются неадекватный объем первичной операции, отсутствие или недостаточность заместительной терапии, стимуляция роста тиреоидной ткани [5, 10, 11, 13].
Все рецидивы, в соответствии с предложенной ранее [1] нами классификацией, можно разделить на «ложные» и «истинные». Под «ложными» рецидивами следует понимать возврат того же заболевания в относительно небольшие сроки (1–2 года) после первичного вмешательства. «Истинные» рецидивы обычно появляются гораздо в более поздние сроки и могут быть представлены либо возвратом основного, либо появлением нового заболевания тиреоидного остатка [1].
Подозрение на злокачественный рост у больных рецидивным зобом является одной из основных причин выполнения повторных операций. Фокусы карциномы можно обнаружить у больных, оперированных по поводу многоузлового зоба с компрессией органов шеи, рецидивов диффузного токсического зоба. F. Menegaux и соавт. (1999) выявили рак ЩЖ железы у 11,4% больных, оперированных по поводу рецидивного зоба [8]. Дооперационная диагностика рака ЩЖ в рецидивном зобе на ранних стадиях до сих пор остается проблематичной, несмотря на совершенствование методик ультразвукового исследования (УЗИ) и тонкоигольной аспирационной биопсии [2, 12].
Цель исследования – оценка риска злокачественного поражения тиреоидного остатка у больных рецидивным зобом, обоснование хирургической тактики в этой группе больных.
Материал и методы
В Санкт-Петербургском Центре эндокринной хирургии и онкологии, функционирующем на базе кафедр госпитальной хирургии и общей медицинской практики СПбГПМУ, за период с 1973 по 2016 г. оперированы 28 138 пациентов с различными заболеваниями ЩЖ. Хирургические вмешательства в связи с рецидивом зоба были осуществлены у 1398 (5,05%) больных. Среди них абсолютное большинство (96,3%) составили женщины. Мужчин было 53 (3,7%). Соотношение мужчин и женщин было 1:25,4. Средний возраст пациентов составил 50,2±4,6 года.
Статья построена на анализе 1106 (79,1%) наблюдений рецидивного зоба. Остальные наблюдения, главным образом, относящиеся к ранним этапам работы Центра, были исключены из подробного анализа в связи с неполными анамнестическими данными либо дефектами первичной документации.
Результаты
Особое место среди больных рецидивным зобом занимают пациенты новым заболеванием тиреоидного остатка. Такой диагноз может быть установлен в тех случаях, когда причиной повторной операции является патология тиреоидного остатка, качественно отличающаяся от той, которая привела к выполнению первичного вмешательства. Большей частью новые заболевания тиреоидного остатка возникают спустя значительный промежуток времени (13,9±3,15 года). При этом необходимо учитывать, что в некоторых случаях за новое заболевание может быть принят рецидив фоновой патологии ЩЖ, присутствовавший еще на момент первой операции.
Таким образом, при изучении данной проблемы необходимо в первую очередь ориентироваться на данные гистологических заключений, а в идеальном варианте производить сравнительный анализ макро- и микропрепаратов, что, к сожалению, не всегда доступно из-за больших временны`х промежутков между операциями. Кроме того, часть больных в наших наблюдениях первично оперировались в других регионах Российской Федерации, а в некоторых случаях медицинские учреждения, где они проходили лечение, были расформированы или реорганизованы к настоящему времени. Это затруднило поиск первичного гистологического материала для сравнения.
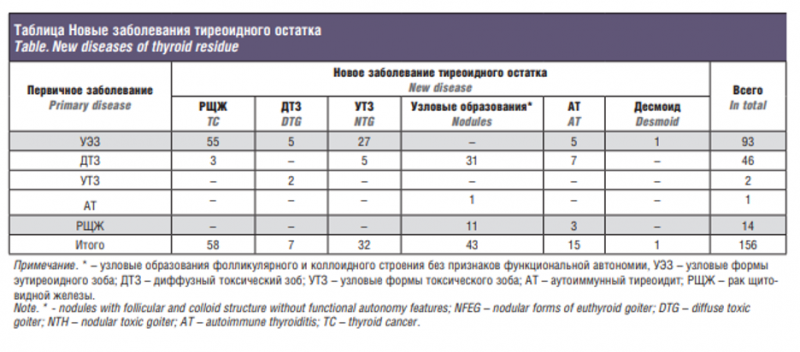
При ретроспективном анализе группы, состоявшей из 1106 больных рецидивным зобом, новое заболевание тиреоидного остатка выявлено в 156 (14,1%) случаев (см. таблицу).
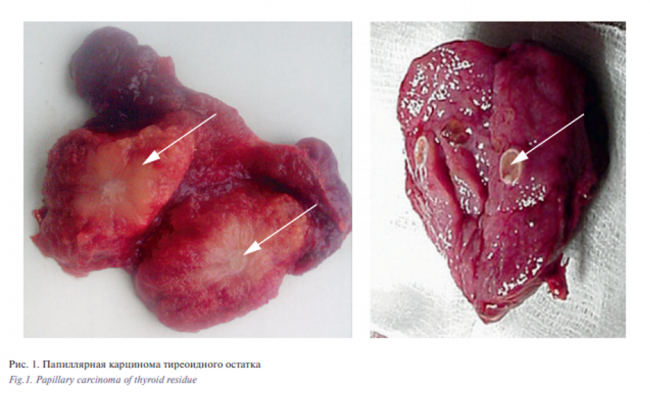
В большинстве наблюдений (62,8%) это были доброкачественные заболевания. Рак ЩЖ в тиреоидном остатке выявлен в 57 (36,5%) случаях или 5,2% от всех больных рецидивным зобом (рис. 1).
Эта цифра сопоставима с частотой случайно выявленного рака в многоузловом зобе (5–10%) по литературным данным [6, 9, 10, 12, 14]. Еще в 1 наблюдении в остатке ЩЖ была выявлена лимфома. Средний возраст больных раком ЩЖ в рецидивном зобе составил 55,5±12,4 года (от 24 до 84 лет). Мужчин было 7 (13,2%), женщин – 51 (1:7,3), т.е. доля мужчин в выборке оказалась в 3,5 раза больше, чем в основной группе (р<0,05). Срок возникновения рецидива варьировался от 5 до 48 лет и составил в среднем 17,6±8,2 года, что также значимо больше (р<0,05), чем в основной группе. Из расчетов были исключены 3 наблюдения, где дифференцированный рак ЩЖ в тиреоидном остатке обнаружен в пределах 2 лет после первичной операции. Здесь, наверное, правильнее говорить не о новом заболевании тиреоидного остатка, а о неадекватном предыдущем хирургическом вмешательстве. Так, например, у 1 больной, перенесшей правостороннюю гемитиреоидэктомию по поводу узлового зоба (фолликулярная аденома), в пределах 1 года диагностирован папиллярный рак в контралатеральной доле, где на момент первичного вмешательства имелся мелкий узел диаметром около 5 мм, оставленный хирургом. Аргументом послужило заключение тонкоигольной аспирационной биопсии из этого узла: коллоидный зоб. К сожалению, подобные случаи встречаются после хирургических вмешательств в неспециализированных стационарах. В таких ситуациях хорошим выходом для поиска новообразований в оставляемой ткани ЩЖ может послужить интраоперационное УЗИ.
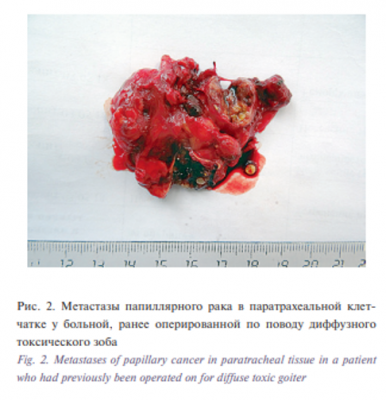
Еще одной иллюстрацией может послужить следующее клиническое наблюдение. Женщине 18 лет в одной из ЦРБ выполнена субтотальная резекция ЩЖ по поводу диффузного токсического зоба. Гистологическое заключение соответствовало клиническому диагнозу. Через 5 лет после операции выявлен рецидив в виде узловой трансформации тиреоидного остатка (тонкоигольная биопсия – коллоидный зоб). Больная наблюдалась еще 5 лет и только после появления шейной лимфаденопатии была выполнена пункция лимфоузла и диагностирована папиллярная карцинома. На повторной операции оказалось, что вместо узловой трансформации остатка в ложе железы имелись двусторонние метастазы в пара- и претрахеальные, паравазальные лимфоузлы (рис. 2).
При этом в тиреоидном остатке опухолевого роста выявлено не было. Единственным логичным объяснением этой ситуации можно считать только то, что папиллярная карцинома имелась еще до первой операции и была удалена вместе с резецированной железой, но по каким-то причинам не обнаружена в препарате. Таким образом, здесь правильнее говорить не о рецидиве, а о продолженном росте папиллярного рака ЩЖ.
Наибольшее число злокачественных новообразований ЩЖ в тиреоидном остатке (55 из 58 наблюдений) встретилось у больных, ранее оперированных по поводу узловых форм зоба. В 3 случаях карциномы выявлены у пациентов, перенесших вмешательства по поводу диффузного токсического зоба, показанием к операции был рецидивирующий тиреотоксикоз.
Сложности в диагностике рака возникли в группе больных, ранее оперированных по поводу узловых форм зоба с многоузловой деформацией тиреоидного остатка. Очевидным злокачественный рост на дооперационном этапе был лишь у 6 (10,3%) из 58 больных – при «запущенных» опухолях Т3-Т4. Еще у 9 больных папиллярный рак обнаружен после тонкоигольной аспирационной биопсии.
В 12 наблюдениях у больных многоузловым рецидивным зобом показанием к операции явилась невозможность исключить злокачественный рост. У этих больных по результатам тонкоигольной аспирационной биопсии диагностирована фолликулярная опухоль. У каждого из них гистологически был выявлен папиллярный рак ЩЖ на фоне полиаденоматозного зоба.
У 14 больных поводом для операции послужил рецидивный зоб шейнозагрудинной локализации с компрессией и девиацией органов шеи, еще у 3 – большие узловые образования, деформирующие контуры шеи. В большинстве случаев у таких пациентов тиреоидные остатки замещены множественными разнокалиберными узлами коллоидного строения, фолликулярными аденомами. Фокусы карцином оказались случайными интраоперационными либо гистологическими находками и не превышали в размерах 1–2 см. Все эти больные ранее были оперированы по поводу многоузловых форм эутиреоидного зоба. Узловая трансформация остатка у них являлась продолжением основного заболевания. И, как оказалось, размеры зоба и степень компрессии напрямую коррелировали с временным промежутком, прошедшим с момента первой операции.
Таким образом, рак ЩЖ в тиреоидном остатке до операции выявлен у 14 (24,2%) больных. В 14 (24,2%) случаях диагноз установлен интраоперационно. В 29 (50,0%) наблюдениях рак на фоне полиаденоматозной трансформации остатков верифицирован лишь при гистологическом исследовании. Следует отметить, что большинство этих наблюдений относилось к периоду до 2000 г. Еще в 1 (0,6%) случае при клинически явных признаках злокачественного роста в остатке гистологически верифицирована лимфома.
Объем повторных хирургических вмешательств у больных раком ЩЖ на фоне рецидивного зоба зависел от нескольких факторов: распространенности опухоли, числа фокусов карциномы, наличия макроскопически определяемых регионарных метастазов и гистологической структуры образований. По результатам интраоперационной оценки и гистологического исследования у большинства больных (38/65,5%) фокусы рака не превышали в диаметре 1–2 см и соответствовали стадии Т1. Карциномы Т2 и Т3 были выявлены у 9 (15,5%) и 7 (12,1%) пациентов. В 4 (6,9%) случаях степень распространения опухоли соответствовала Т4 у 3 больных анапластическим раком и 1 – лимфомой тиреоидного остатка. Регионарные метастазы обнаружены лишь в 5 случаях, что потребовало боковой шейной лимфаденэктомии.
Наиболее распространенной гистологической формой рака в рецидивном зобе оказалась папиллярная карцинома, обнаруженная у 36 (62,1%) больных. На втором месте – фолликулярный рак – 18 (31,0%) наблюдений. У 3 пациентов выявлен анапластический рак и у 1 больного – лимфома. Распределение раков по гистологическим формам полностью соответствовало таковому в общей группе больных, оперированных в Центре за последние 45 лет.
Обсуждение
Предпочтительным объемом операции, особенно в последние 1,5 десятилетия, являлась ререзекция до объема тиреоидэктомии, выполненная в 33 (56,9%) случаях. В случае дооперационной или интраоперационной диагностики рака вмешательство в обязательном порядке дополнялось центральной лимфаденэктомией. При выявлении метастазов в шейных лимфоузлах 2–7 групп (5 наблюдений), выполнялась боковая шейная лимфаденэктомия. Вмешательство в 2 случаях было одномоментным с основным, в остальных – вторым этапом, спустя 2–3 месяца. Одному больному потребовалось выполнение комбинированной операции – ререзекции ЩЖ до тиреоидэктомии с паратрахеальной лимфаденэктомией, дополненной боковой резекцией стенки пищевода, т.к. карцинома на небольшом участке врастала до подслизистого слоя.
До 1991 г. коллектив нашего Центра придерживался органосохраняющего подхода, в т.ч. и у больных рецидивным зобом и раком ЩЖ. Это послужило основанием выполнения различных вариантов органосохраняющих вмешательств у 22 (33,7%) больных. Чаще всего выполнялись резекции с оставлением 2–6 г визуально неизмененной ткани в области одного из верхних полюсов ЩЖ. К сожалению, в силу органосохраняющего подхода и сложности выявления фокусов карциномы на фоне больших многоузловых зобов у 13 больных операции носили онкологически неадекватный характер, т.к. ткань оставалась на стороне, выявленной при последующем гистологическом исследовании карциномы. Ререзекция ЩЖ до объема тиреоидэктомии выполнена позже у 2 больных – фокусов опухолевого роста в остатке и паратрахеальной клетчатке не выявлено. В последующие годы работы Центра подобных случаев не отмечалось.
Паллиативный характер носили вмешательства у 3 больных недифференцированным раком ЩЖ на фоне рецидивного зоба. Им выполнены паллиативные резекции опухоли, дополненные трахеостомией. В последние годы подобные вмешательства в нашем Центре дополняются интраоперационной фотодинамической терапией [3].
Зная гистологический диагноз у повторно оперированных больных, имеет смысл оценить диагностическую значимость тонкоигольной аспирационной биопсии для выявления рака в тиреоидном остатке. Исследование выполнено у 24 больных раком ЩЖ в рецидивном зобе. Папиллярный рак, по результатам тонкоигольной биопсии с гистологическим исследованием, подтвержден у 9 (37,5%) пациентов. В 13 случаях выявлена фолликулярная опухоль, оказавшаяся фолликулярным раком только в 1 случае. У остальных больных диагностированы фокусы папиллярного рака на фоне полиаденоматозного зоба. В 2 наблюдениях цитологически обнаружен коллоидный зоб, оказавшийся папиллярной карциномой. Следует также дополнительно отметить еще 4 случая, когда цитологически на дооперационном этапе предполагался рак в тиреоидном остатке (в 3 случаях папиллярный, в 1 – С-клеточная опухоль), однако при детальном гистологическом исследовании препарата обнаружена лишь доброкачественная патология.
Таким образом, чувствительность тонкоигольной аспирационной биопсии для выявления рака на фоне рецидивного зоба, рассчитанная с помощью четырехпольной таблицы, по нашим данным, не превышала 42,8%. Следует отметить, что в последние 5–10 лет число ошибок несколько снизилось, но разница из-за малого количества наблюдений статистически незначима. Помимо пункционной биопсии при определении показаний к повторным операциям при рецидивном зобе, несомненно, необходимо учитывать шейнозагрудинную локализацию узлов, признаки компрессии, ультразвуковые и клинические признаки злокачественного роста, наличие шейной лимфаде нопатии. Комплексная оценка факторов риска, динамики роста узлов позволяет сделать обоснованный выбор лечебной тактики в каждом конкретном случае. В любых сомнительных ситуациях предпочтительна активная хирургическая тактика.
Оптимальным объемом операции при рецидивном зобе, опираясь на полученные данные, по нашему мнению, является ререзекция до объема тиреоидэктомии. При обоснованном подозрении на злокачественный рост вмешательство должно быть дополнено центральной лимфаденэктомией на стороне поражения под обязательным контролем возвратного нерва. Также возможно одномоментное выполнение боковой шейной лимфаденэктомии в случае выявления регионарных метастазов.
Несмотря на многочисленные публикации о высоком риске повторных хирургических вмешательств [7, 8, 14], уровень послеоперационных осложнений в изученной группе больных оказался невысок. В группе из 58 больных односторонний парез гортани отмечен лишь в 1 случае, у 1 одной больной возникло послеоперационное кровотечение. Учитывая небольшой объем выборки, уровень осложнений дополнительно изучен в общей группе больных рецидивным зобом. Односторонняя травма возвратного нерва выявлена в 3,21%, двусторонняя – в 0,83%, кровотечение – в 1,04%. Аналогичные показатели в общей группе больных, оперированных в Центре за данный период, составили 0,83%, 0,08 и 0,36% соответственно. При этом за последние 10–15 лет отмечается тенденция к снижению уровня осложнений благодаря совершенствованию хирургической техники вмешательств на ЩЖ и применения интраоперационного мониторинга нервов шеи [4].
Выводы
- Рак ЩЖ как новое заболевание тиреоидного остатка у больных, ранее оперированных по поводу доброкачественной тиреоидной патологии, встречается в 5,2% наблюдений.
- В условиях многоузловой трансформации тиреоидного остатка изменения топографо-анатомических соотношений и рубцовой ткани в зоне предыдущей операции, возможности тонкоигольной аспирационной биопсии резко снижаются.
- Активная хирургическая тактика, основанная на комплексной оценке клинических, ультразвуковых и цитологических данных, при выявлении многоузловой трансформации тиреоидного остатка является оправданной. Операцией выбора следует считать ререзекцию ЩЖ до объема тиреоидэктомии.
- Хирургические вмешательства по поводу многузлового зоба, особенно в случаях рецидивов, рекомендуется выполнять в специализированных центрах, где с накоплением хирургами и морфологами опыта вероятность диагностических, тактических и технических ошибок снижается.
ЛИТЕРАТУРА
- Акинчев А.Л., Романчишен А.Ф. Послеоперационный рецидивный зоб. Вестник хирургии им. И.И. Грекова. 2005;164(5):43.
- Воробьев С.Л., Зайцева И.В., Матвеева З.С. Информативность критериев цитологической диагностики новообразований щитовидной железы. Вестник хирургии им. И.И. Грекова. 2007;166(2):62–4.
- Гостимский А.В., Романчишен А.Ф., Гавщук М.В. Фотодинамическая терапия в комбинированном лечении больных недифференцированным раком щитовидной железы. Онкохирургия. 2013;5(S1):31–2.
- Романчишен А.Ф., Вабалайте К.В., Романчишен Ф.А., Накатис Я.А., Готовяхина Т.В., Ким И.Ю., Яковлев П.Н., Карпатский И.В., Зенкова А.В., Матвеева З.С. Неотложные состояния в тиреоидной и паратиреоидной хирургии. Санкт-Петербург, 2014. 168 с.
- Cappellani A., Di Vita M., Zanghì A., Lo Menzo E., Cavallaro A., Alfano G., Giuffrida D. The recurrent goiter: prevention and management. Ann. Ital. Chir. 2008;79(4):247–53.
- Cerci C., Cerci S.S., Eroglu E., Dede M., Kapucuoglu N., Yildiz M. Thyroid cancer in toxic and non-toxic multinodular goiter. J. Postgrad. Med. 2007;53:157–60.
- Lefevre J.H., Trsallet C., Leenhardt L., Jublanc C., Chigot J.P., Menegaux F. Re-operative surgery for thyroid disease. Surgery.2007;392:685–91.
- Menegaux F., Turpin G., Dahman M., Leenhardt L., Chadarevian R., Aurengo A., du Pasquier L., Chigot J.P. Secondary thyroidectomy in patients with prior thyroid surgery for benign disease: a study of 203 cases. Surgery. 1999;126:479–83.
- Miccoli P., Minuto M.N., Galleri D., D’Agostino J., Basolo F., Antonangeli L. Inci-dental thyroid carcinoma in a large series of consecutive patients operated on for benign thy-roid disease. ANZ J. Surg. 2006;76:123–6. doi: 10.1111/j.1445- 2197.2006.03667.x.
- Müller P.E., Kabus S., Robens E., Spelsberg F. Indications, risks, and acceptance of total thyroidectomy for multinodular benign goiter. Surg. Today. 2001;3:958–62.
- Rudnicki J., Agrawal A.K., Jelen M., Sebastian M., Sroczynski M., Zysko D. His-topathological evaluation of recurrent goiter. Folia Histochem. Cytobiol. 2010;48(3):430–3.
- Tollin S.R., Mery G.M., Jelveh N., Fallon E.F., Mikhail M., Blumenfeld W. The use of fine-needle aspiration biopsy under ultrasound guidance to assess the risk of malignan-cy in patients with a multinodular goiter. Thyroid. 2000;10:235–41. doi: 10.1089/thy.2000.10.235.
- Torre G., Barreca A., Borgonovo G., Minuto M., Ansaldo G.L., Varaldo E. Goiter recurrence in patients submitted to thyroid stimulating hormone suppression: possible role of insulin-like growth factors and insulin-like growth factor-binding proteins. Surgery. 2000;127:99–103.
- Yavuz H.C., Mete T., Irak L., Aydin Y., Demirci H., Güler S. Malignancy and Complication Rate in Reoperation of Recurrent Goiter. Gazi Med. J. 2016;27:15–8.
Поступила 01.12.18
Принята в печать 01.04.19
REFERENCES
- A.L., Romanchishen A.F. Postoperative recurrent goiter. Bulletin of Surgery named after I.I. Grekov. 2005; 164 (5): 43. (In Russ.).
- Vorobiev S.L., Zaitseva I.V., Matveeva Z.S. Informational content of criteria for cytological diagnosis of thyroid neoplasms. Bulletin of Surgery named after I.I. Grekov. 2007; 166 (2): 62–4. (In Russ.).
- Gostimsky A.V., Romanchishen A.F., Gavshchuk M.V. Photodynamic therapy in the combined treatment of patients with undifferentiated thyroid cancer. Oncosurgery 2013; 5 (S1): 31–2. (In Russ.).
- Romanchishen A.F., Vabalayte K.V., Romanchishen F.A., Nakatis Ya.A., Gotovyakhina T.V., Kim I.Yu., Yakovlev P.N., Karpatsky I.V., Zenkova A. .V., Matveeva Z.S. Emergency conditions in thyroid and parathyroid surgery. St. Petersburg, 2014. 168 p. (In Russ.).
- Cappellani A., Di Vita M., Zanghì A., Lo Menzo E., Cavallaro A., Alfano G., Giuffrida D. The recurrent goiter: prevention and management. Ann. Ital. Chir. 2008;79(4):247–53.
- Cerci C., Cerci S.S., Eroglu E., Dede M., Kapucuoglu N., Yildiz M. Thyroid cancer in toxic and non-toxic multinodular goiter. J. Postgrad. Med. 2007;53:157–60.
- Lefevre J.H., Trsallet C., Leenhardt L., Jublanc C., Chigot J.P., Menegaux F. Re-operative surgery for thyroid disease. Surgery.2007;392:685–691.
8.Menegaux F., Turpin G., Dahman M., Leenhardt L., Chadarevian R., Aurengo A., du Pasquier L., Chigot J.P. Secondary thyroidectomy in patients with prior thyroid surgery for benign disease: a study of 203 cases. Surgery. 1999; 126:479–83.
- Miccoli P., Minuto M.N., Galleri D., D’Agostino J., Basolo F., Antonangeli L. Inci-dental thyroid carcinoma in a large series of consecutive patients operated on for benign thy-roid disease. ANZ J. Surg. 2006;76:123–6. doi: 10.1111/j.1445- 2197.2006.03667.x.
- Müller P.E., Kabus S., Robens E., Spelsberg F. Indications, risks, and acceptance of total thyroidectomy for multinodular benign goiter. Surg. Today. 2001;3:958– 62.
- Rudnicki J., Agrawal A.K., Jelen M., Sebastian M., Sroczynski M., Zysko D. His-topathological evaluation of recurrent goiter. Folia Histochem. Cytobiol. 2010;48(3):430–3.
- Tollin S.R., Mery G.M., Jelveh N., Fallon E.F., Mikhail M., Blumenfeld W. The use of fine-needle aspiration biopsy under ultrasound guidance to assess the risk of malignan-cy in patients with a multinodular goiter. Thyroid. 2000;10:235– 41. doi: 10.1089/thy.2000.10.235.
- Torre G., Barreca A., Borgonovo G., Minuto M., Ansaldo G.L., Varaldo E. Goiter recurrence in patients submitted to thyroid stimulating hormone suppression: possible role of insulin-like growth factors and insulin-like growth factor-binding proteins. Surgery. 2000;127:99–103.
- Yavuz H.C., Mete T., Irak L., Aydin Y., Demirci H., Güler S. Malignancy and Complication Rate in Reoperation of Recurrent Goiter. Gazi Med. J. 2016; 27:15–8.
Received 01.12.18
Accepted 01.04.18
Информация об авторах
: А.Ф. Романчишен – д.м.н. профессор, заведующий кафедрой госпитальной хирургии c курсами травматологии и ВПХ СПбГПМУ, Санкт-Петербург; e-mail: afromanchish-en@mail.ru.
А.В. Гостимский – д.м.н. профессор, заведующий кафедрой общей медицинской практики СПбГПМУ, Санкт-Петербург; e-mail: gostimsky@ mail.ru.
А.Л. Акинчев – к.м.н. доцент кафедры госпитальной хирургии c курсами травматологии и ВПХ СПбГПМУ, Санкт-Петербург; e-mail: alakichev@ mail.ru.
И.В. Карпатский – к.м.н., доцент кафедры общей медицинской практики СПбГПМУ, Санкт-Петербург, Россия; e-mail: ivspb@mail333.com.
З.С. Матвеева – к.м.н. ассистент кафедры госпитальной хирургии c курсами травматологии и ВПХ СПбГПМУ, Санкт-Петербург; e-mail: ikar122@post.ru and military field surgery, SPbSPMU, St. Petersburg; e-mail: ikar122@post.ru.
К.В. Вабалайте – к.м.н. доцент кафедры госпитальной хирургии c курсами травматологии и ВПХ СПбГПМУ, Санкт-Петербург; e-mail: vabalayte@ bk.ru. About the authors:
A.F. Romanchishen – MD, Professor, Head of the Department of Hospital Surgery with courses of traumatology and military field surgery, SPbSPMU, St. Petersburg; e-mail: af-romanchishen@mail.ru.
A.V. Gostimsky – MD, Professor, Head of the Department of General Medical Practice, SPbSPMU, St. Petersburg; e-mail: gostimsky@mail.ru.
A.L. Akinchev – Ph.D. Associate Professor at the Department of Hospital Surgery with courses in traumatology and military field surgery, SPbSPMU, St. Petersburg; e-mail: ala-kichev@mail.ru.
I.V. Karpatsky – MD, PhD, Associate Professor, Department of General Medical Practice, SPbSPMU, St. Petersburg, Russia; e-mail: ivspb@mail333.com.
Z.S. Matveyev – MD, Ph.D. Assistant of the Department of Hospital Surgery c courses traumatology and military field surgery, SPbSPMU, St. Petersburg; e-mail: ikar122@post.ru.
K.V. Vabalayte – MD, Ph.D. Associate Professor at the Department of Hospital Surgery with courses of traumatology and military field surgery, SPbSPMU, St. Petersburg; e-mail: vaba-layte@bk.ru.