Для цитирования: Уханов М.М., Иващенко А.В., Федяев И.М., Яблоков А.Е., Колганов И.Н., Тлустенко В.П. Применение робот-ассистированных систем для операций в области головы и шеи. Голова и шея Head and neck Russian Journal. 2019;7(2):52–63
For citation: Ukhanov M.M., Ivaschenko A.V., Fedyaev I.M., Yablokov A.E., Kolganov I.N., Tlustenko V.P. Application of robot-associated systems for head and neck surgery. Head and neck Head and neck Russian Journal. 2019;7(2):52–63 (in Russian).
Doi: 10.25792/HN.2019.7.2.52–63
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Уханов М.М., Иващенко А.В., Федяев И.М., Яблоков А.Е., Колганов И.Н., Тлустенко В.П. Применение робот-ассистированных систем для операций в области головы и шеи. Голова и шея Head and neck Russian Journal. 2019;7(2):52–63
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
The authors declare no conflict of interest.
Source of financing: not specified.
For citation: Ukhanov M.M., Ivaschenko A.V., Fedyaev I.M., Yablokov A.E., Kolganov I.N., Tlustenko V.P. Application of robot-associated systems for head and neck surgery. Head and neck Head and neck Russian Journal. 2019;7(2):52–63 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients.
Введение
В настоящее время в медицине используются робот-ассистированные системы, не оснащенные искусственным интеллектом, при этом они находятся или под непосредственным управлением человека или выполняют задание, созданное и спланированное врачом. В челюстно-лицевой хирургии и хирургической стоматологии робот-ассистированные системы применяются при операциях в области головы и шеи, а также при установке дентальных имплантатов.
K.T. Kavanagh в 1994 г. выполнил преклиническое исследование по применению робот-ассистированной хирургии в отоларингологии [1]. Было выполнено 5 антростомий на височных костях черепа человека с использованием робота и передачи изображения оперативного поля, измерена точность выполнения отверстий, представлены возможности применения роботизированной хирургии в будущем.
T.C. Lueth и соавт. в 1998 предложили первый действующий робот под названием OTTO для операций в челюстно-лицевой области [2]. Однако он представлял собой не отдельное устройство, а комплекс оснащения операционной, специально разработаные манипуляторы с инструментами и программное обеспечение. Для эксперимента была использована операционная в клинике Charite при университете Humboldt-University в Берлине. Операционная была оснащена мобильным компьютерным томографом (Philips/Analogic TomoScan M), мощным компьютером с программами для просмотра томограмм и планирования операций (AMIRA-ANAPLAST), системой оптической локализации (ImageGuided PixSys 3000), двумя роботами: PUMA 500 (для размещения датчиков и контроля) и MSS SurgiScope (для выполнения операций), оснащенных специальными манипуляторами для фиксации датчиков, жесткого катетера и стоматологического наконечника с электромотором. Несколько экспериментальных операций было выполнено на фантомах и головах свиней.
Подобное исследование на фантомах, но с другим роботом и другим программным обеспечением было выполнено также в 1998 г. C.R. Burghart и соавт. [3–5].
Внедрение в клиническую практику робот-ассистированных операций для удаления новообразований в области головы и шеи, для установки дентальных имплантатов и удаления зубов состоялось уже в ХХI веке. В обзоре J. De Ceulaer и соавт. (2012) отмечено увеличение числа публикаций о применении роботассистированных операций в области головы и шеи с 2009 г. [6].
Однако в России до сих пор такие операции не получили широкого распространения. Заболеваемость злокачественными новообразованиями в области головы и шеи в России остается высокой и составляет в среднем 33 тыс. больных с первично установленным диагнозом ежегодно – это 20% от общего количества, и занимает 6-е место в общей структуре онкологических заболеваний с приростом в 23,6% за 10 лет [7]. В структуре смертности от рака злокачественные опухоли головы и шеи занимают 8-е место [8].
В настоящее время в России, США и Европе наблюдается значительный рост числа случаев заболевания орофарингеальной плоскоклеточной карциномой, что связывают с эпидемией вируса папилломы [9]. В течение 10 лет (с 2003 по 2013 г.) в России отмечено увеличение числа заболевших раком гортани с 6,5 до 8 тыс. человек. Из-за изменения основных канцерогенных факторов: вместо табакокурения и алкоголя – вирусы папилломы и Эпштейна–Барр, и особенностей передачи вируса: основной путь – орогенитальный, изменилась структура заболеваемости. В основном заболевают мужчины европеоиды в возрасте от 40 до 59 лет, а вместо поражения передних отделов ротовой полости (губы и дно полости рта) чаще возникает рак ротоглотки [8, 9]. V. Mehta и соавт. сравнивали заболеваемость орофарингеальной плоскоклеточной карциномой в различных возрастных группах в период с 1973 по 2006 г. [10]. Было установлено, что доля больных 40–59 лет увеличилась с 35 до 45%, а доля больных 60–79 лет уменьшилась с 52 до 40%. Прогнозируется, что заболеваемость раком ротоглотки, связанной с вирусом папилломавируса, к 2020 г. превысит заболеваемость раком шейки матки, а к 2030 г., как предполагается, половина случаев рака головы и шеи будет связана с вирусом папилломавируса [11].
Цель статьи – провести анализ возможностей применения робот-ассистированных систем при операциях в области головы и шеи.
Применение роботов для операций в области головы и шеи (TORS)
TORS (TransOral Robotic Surgery) – это методика минимальноинвазивной робот-ассистированной операции, которая позволяет удалять доброкачественные и злокачественные опухоли из полости рта и горла.
История TORS начинается с 2003 г., когда B.M. Haus и соавт. выполнили серию операций на шее четырех животных с применением робота Da Vinci [12]. Было тщательно задокументировано операционное время, потраченное на выполнение различных процедур, клиническое состояние животных, величина кровопотери, оценены риски осложнений (воздушной эмболии и случайной травмы кровеносных сосудов).
В 2005 г. I.K. McLeod и P.C. Melder впервые выполнили операцию в области головы и шеи (удаление валлекулярной кисты) при помощи робота с доступом через рот без выполнения наружных разрезов [13].
Разработчиками методики TORS признаны американские хирурги B.W. O’Malley и G.S. Weinstein из университета Пенсильвании (США). В 2006 г. они опубликовали в журнале Laryngoscope свое исследование, в котором описали, как вначале отработали методику TORS в 10 операциях на трупах, а затем выполнили операцию удаления опухоли основания языка с помощью робота через ротовую полость у трех пациентов [14]. В 2011 г. B.W. O’Malley и G.S. Weinstein выпустили книгу «Transoral Robotic Surgery (TORS)» с подробным описанием методики операции [15]. На базе кафедры отоларингологии университета Пенсильвании с 2006 г. действует учебный центр по обучению хирургов операции TORS (https: oto.med.upenn. edu/education/62-2/). Программа обучения TORS включает в себя операции на трупах, виртуальное обучение и наблюдение за реальными операциями.
Устройство операционной для выполнения TORS
Операция TORS была разработана и в настоящее время наиболее часто выполняется с использованием робота da Vinci (Intuitive Surgical Inc). Операционная с роботом da Vinci состоит из трех основных частей: хирургическая часть, стойка визуализации и хирургическая консаль [16, 17].
Хирургическая часть, или собственно оперирующий робот, состоит из четырех «рук-манипуляторов»: одна «рука» удерживает стереоскопическую камеру (0–30 градусов, 12 мм, с двумя оптическими каналами – каждый 5 мм), другие три манипулятора удерживают инструменты EndoWrist (Intuitive Surgical Inc.) размером 5 мм (педиатрический размер) или 8 мм (стандартный размер), которые легко заменяются хирургическим персоналом по требованию.
Стойка визуализации оснащается двумя источниками света, инсуффлятором, компьютером с программным обеспечением, которое позволяет просматривать трехмерное изображение (КТ и т.д.). Обычно на стойке установлен второй монитор компьютера для ассистента хирурга.
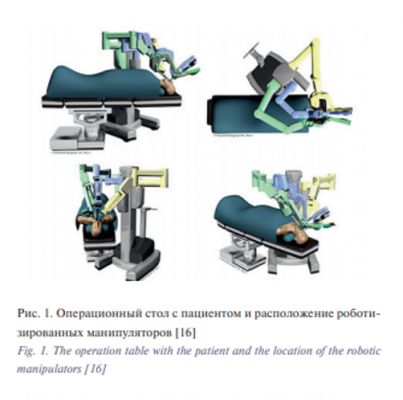
Хирургическая консоль воспроизводит два изображения, по одному на каждый глаз. Это создает трехмерное изображение, которое значительно улучшает восприятие глубины в пределах хирургического поля. Кроме того, консоль является интерфейсом для хирурга по управлению хирургическими инструментами и «руками-манипуляторами». Консоль оснащена педалями для контроля камеры и захвата инструмента манипулятором, настройки фокуса и электрокоагуляции. Возможна персональная настройка управления. Инструменты EndoWrist контролируются хирургом на главной консоли и обеспечивают множество степеней свободы, включая бросок, угловой поворот вокруг вертикальной оси и вращение вокруг продольной оси, плюс две дополнительных степени свободы в запястье и две других для приведения инструмента в действие – всего 7 степеней свободы (у эндоскопических инструментов только 4 степени свободы) [18]. Консоль с хирургом должна располагаться в конце операционной, чтобы минимизировать препятствия и максимизировать коммуникацию между хирургом и его ассистентом во время операции TORS, позволяя освободить пространство для маневра тележки с хирургическим роботом, которая располагается с правой стороны от пациента, напротив хирурга. Медсестра и стойки с инструментами располагаются на другой стороне от пациента, также напротив хирурга. Аппарат анастезии и анастезиолог находятся в области ног пациента. Введение в анастезию обычно проводится без перемещения пациента; эта методика подробно описана J.J. Chi и соавт. (2010) [19]. Такая методика немного усложняет введение, но значительно упрощает настройку процедуры, экономя 15–20 минут на клинический случай. Выполнение индукции через анастезиологический аппарат не требует отключения/ повторного подключения четырех проводов, контролирующих устройств или контура анестезии, что позволяет избежать запутывания проводов с оборудованием робота. Кроме того, в лежачем положении пациента дыхательный путь обеспечивается благодаря стандартной эндотрахеальной интубации и трубка фиксируется надлежащим образом. Для защиты пациента используются защитные очки и мягкие назубные каппы. После введения в анестезию стойка с роботом устанавливается справа от пациента, а столик с эндоскопами и столик медсестры располагаются слева. Затем хирург устанавливает ретрактор в полости рта пациента, чтобы достичь хирургического раскрытия, и три стерильно задрапированных, роботизированных «руки» располагаются в хирургической позиции (рис. 1).
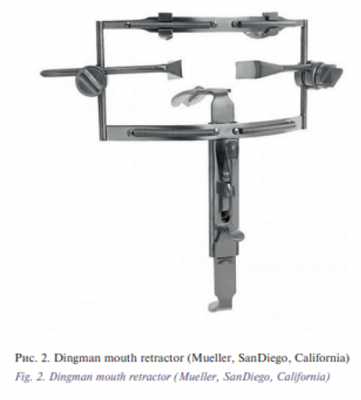
Роторасширители для операции TORS Dingman mouth retractor (Mueller, SanDiego, California) – имеет регулируемые лезвия для отвода щеки, создает удовлетворительное раскрытие, не препятствует движению инструмента, предоставляет возможность выполнять эндоларингеальные ушивания поражений полости рта и ротоглотки (рис. 2) [20].
Согласно руководству G.S. Weinstein и B.W. O’Malley от 2008 г., при выполнении операции TORS с использованием робота da Vinci для обнажения гортани и гортаноглотки лучше использовать роторасширитель FK retractor (Feyh-Kastenbauer system) (Gyrus ACMI, Southborough, Massachusetts), а для операций в области миндалин и основания языка – роторасширитель Crow-Davis (Storz, Tuttlingen, Germany) (рис. 3) [16].
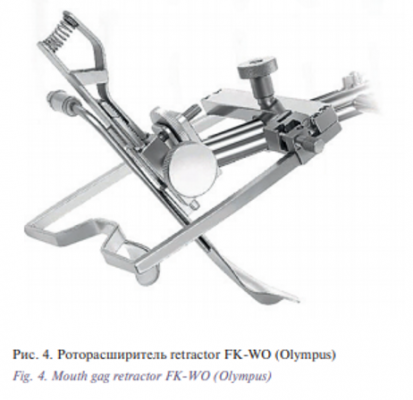
G.S. Weinstein и B.W. O’Malley внесли изменения в оригинальную ретракторную систему FK, чтобы оптимизировать ретрактор для использования совместно с роботом da Vinci. Новая модель ретрактора теперь называется FK-WO (Feyh-Kastenbauer Weinstein-O’Malley) (Olympus) (рис. 4). Модификации заключались в расширении апертуры рамки, чтобы обеспечить больше места для инструментов и камеры, а также новые лезвия для экспонирования надглотки.
- Remacle и соавт. (2011) предложили свою конструкцию ретракторной системы для выполнения операции TORS – Laryngeal Advanced Retractor System (LARS) (Fentex, Tuttlingen, Germany) (рис. 5) [20].
По мнению авторов, он обладает следующими преимуществами:
- изогнутый каркас позволяет легче адаптировать ретрактор к форме лица пациента;
- каркас расширен горизонтально, чтобы облегчить движение манипуляторов робота;
- адаптируемые и съемные вертикальные балки для крепления дополнительных инструментов;
- две системы, позволяющие движение лезвий во многих направлениях.
Для выполнения операции TORS с роботом Flex Robotic System предлагается использовать роторасширитель Medrobotics Flex Retractor [21].
Роботы для операции TORS
Для выполнения операции TORS могут использоваться различные роботы. В 2009 г. после ряда публикаций об успешном лечении онкологических заболеваний по методу TORS, FDA (Food and Drug Administration) выдало разрешение на применение TORS при ранних стадиях заболевания (T1-T2) [22]. В настоящее время фирмой Intuitive Surgical Inc (США) разработано уже несколько поколений роботов (рис. 6), в 2014 г. был выпущен на рынок робот da Vinci Xi (https: www.intuitive. com/en/products-and-services/da-vinci/systems). В исследовании M. Alessandrini и соавт. (2018) отмечено, что современная модель робота da Vinci Xi предоставляет клинические преимущества при выполнении операции TORS по удалению карциномы основания языка: более короткое операционное время и меньшая потеря крови во время операции по сравнению с предыдущей моделью робота – da Vinci Si [23].
Компания Medrobotics (США) разработала робот-ассистированную систему для выполнения операции TORS – Flex Robotic System (рис. 7) (https: medrobotics.com.). В 2012 г. C.M. Rivera-Serrano и соавт. выполнили успешную визуализацию гортани на трупе человека трансорально с использованием Flex Robotic System [24]. Удобство применения этого гибкого робота для визуализации гортани было подтверждено в последующих исследованиях [25, 26].
В 2014 CE и в 2015 г. FDA одобрили применение Flex Robotic System для операции TORS, в настоящее время проводятся клинические исследования этой системы [21, 27–35].
На сегодняшний день для выполнения операций TORS в США и Европейском Союзе используются две системы роботов: da Vinci и Flex Robotic System [36, 37].
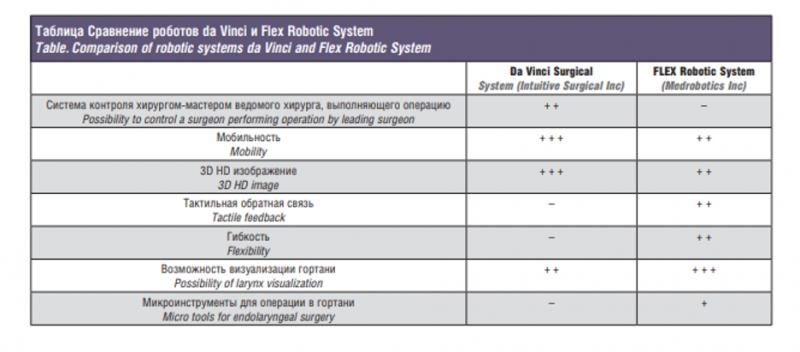
- Poon и соавт. (2018) суммировали преимущества и недостатки робот-ассистированных систем da Vinci и Flex Robotic System (см. таблицу) [36].
В 2016 г. F.C. Holsinger опубликовал результаты преклинического исследования на трупах прототипа робота от компании Intuitive Surgical Inc (США) – da Vinci SP (рис. 8) для применения в операции TORS. Эта робот-ассистированная система имеет один гибкий манипулятор с инструментами и камерой, что делает его более эргономичным и упрощает выполнение операции [38].
В 2018 г. R.K. Tsang и соавт. опубликовали первое клиническое исследования применения робота da Vinci SP для выполнения операции TORS [39]. Была выполнена радикальная тонзиллэктомия и иссечение ретрофарингеального лимфатического узла у пациента 63 лет с плоскоклеточной карциномой левой миндалины T1N1M0. Автор отметил эргономичность и удобство этого робота, который однако не обеспечивал обратной тактильной чувствительности, что могло привести к чрезмерному давлению на ткани во время операции.
Компания Endomaster Pte Ltd из Сингапура разрабатывает робот-ассистированную систему EndoMaster. G. Tay и соавт. (2018) выполнили 4 операции TORS (радикальная тонзиллэктомия) на трупах с применением прототипа системы Endomaster [40]. Они отметили хорошую визуализацию операционного поля и компактность робота. Предполагается, что стоимость Endomaster будет значительно ниже существующих аналогов для выполнения операции TORS.
Существует еще несколько перспективных робот-ассистированных систем, которые в будущем, возможно, будут применяться для операции TORS: Auris Robotic Endoscopy System (Auris Health, Inc, США), Versius Robotic Surgery System (CMR Surgical Ltd, Великобритания), Single Port Orifice Robotic Technology (Titan Medical Inc., Канада), Senhance Surgical System (TransEnterix, Inc., США), K-FLEX endoscopic surgical robot (KAIST, Южная Корея) .
Преимущества TORS
Клинические преимущества операции TORS для пациентов:
- проведение операции без обезображивающего удаления нижней челюсти [41];
- проведение операции без трахеостомии [14];
- более быстрый возврат к нормальной речи и глотанию [42];
- значительное сокращение времени операции;
- более короткое время госпитализации [14];
- сокращение времени восстановления после операции [14];
- минимизация или устранение необходимости химиолучевой терапии [14, 42];
- сниженный риск долговременных проблем с глотанием (чаще всего наблюдается при химиолучевом облучении или традиционной открытой хирургии);
- меньше осложнений по сравнению с традиционной открытой хирургией;
- значительно меньше боли [14];
- меньше рубцов по сравнению с традиционной открытой хирургией [14];
- меньший риск инфицирования раны [14];
- меньше потеря крови [14];
- меньший риск переливания крови по сравнению с открытой операцией. Преимущества для хирурга при выполнении TORS операции:
- Улучшенная 3D HD визуализация, позволяющая выполнять точное рассечение тканей. Трехмерная визуализация и десятикратное увеличение изображения операционного поля усиливают глубину поля и четкость плоскостей тканей во время рассечения [43]. Это особенно полезно во время операции в области головы и шеи и операции у детей из-за малого размера операционного поля и невозможности маневра инструментов и камеры в нем. Это также помогает различать типы тканей при онкологической диссекции [44].
- Устранение физиологического дрожания и дыхательного движения. Хирургическая система устраняет тремор хирурга через аппаратные и программные фильтры. Кроме того, движения могут быть масштабированы, в результате чего большие перемещения могут быть переведены в микродвижения внутри операционного поля, что позволяет хирургу выполнять операцию с большей точностью [45].
- Исключены проблемы прямой видимости, необходимой для стандартной микроскопной трансоральной лазерной хирургии, за счет угловых телескопов и крутящихся инструментов [16].
- Мультиподвижные инструменты. Инструменты EndoWrist имеют 7 степеней свободы, что повышает ловкость, обеспечивает маневренность, приближающуюся к открытой хирургии [16].
- Максимальное сохранение функции и точное определение безопасного запаса для полного удаления опухоли [16].
- Применение лазерного зонда без дрожания в качестве альтернативы электрокоагуляции по показаниям [16].
- Снижение усталости. Во время роботизированной части операциия хирург сидит, удобно положив предплечья на подушку, а его голова в это время упирается в консоль, следовательно, улучшается эргономика. Это приводит к снижению усталости тела. Для хирурга, сидящего на удаленном рабочем месте, нет необходимости физического скручивания и занятия неловких позиций для перемещения инструментов в пределах операционного поля при одновременной визуализации монитора. К тому же усталость мышц кисти уменьшается, что вместе с улучшенной визуализацией делает такие задачи, как наложение швов, существенно проще. Исследования показывают, что роботизированная хирургия менее стрессовая для хирурга [46].
- Восстанавливает правильную координацию рук и глаз. Роботизированная система устраняет «эффект центра вращения» [47] эндоскопической хирургии и делает манипуляции с инструментом и камерой более интуитивно понятными, имитирующими открытую хирургию.
- Телехирургия. С момента внедрения роботизированной хирургии желание преодолеть географические ограничения и обеспечить доступность специалистов было важной целью. J. Marescaux и соавт. (2002) описали возможность и безопасность выполнения робот-ассистированной лапароскопической холецистэктомии на расстоянии с использованием высокоскоростной связи между хирургическим отделением в Страсбурге (Франция) и хирургической консолью в Нью-Йорке (США) [48]. Телехирургия позволяет преодолеть эти барьеры, а также предлагает новые возможности для обучения и репетиторства.
- Обучение. Роботизированная система предоставляет некоторые интересные инструменты и возможности для обучения. Опытный хирург может использовать другую консоль рядом со стажером, которая может быть активирована для управления главными или вспомогательными «руками-манипуляторами». Vinci Skills Simulator (Intuitive Surgical Inc.) может быть подключен к консоли, что позволяет создать виртуальную среду обучения, сохраняя тот же роботизированный интерфейс [49].
Основные анатомические области, в которых может выполняться операция TORS [16]
Ротоглотка и основание черепа:
- миндалина;
- основание языка;
- небо;
- стенка глотки;
- парафарингеальное пространство. Гортань и гортаноглотка:
- преддверие полости гортани;
- гортанная щель;
- грушевидная пазуха;
- стенка глотки. Противопоказания к выполнению TORS с применением робота da Vinci [16] • детский возраст;
- плохое открытие полости рта (менее 1,5 см);
- инвазия нижней челюсти;
- вовлечение основания языка, требующее резекции более 50% основания языка;
- поражение стенки глотки, требующее резекции более 50% стенки глотки;
- рентгенологическое подтверждение поражения сонной артерии;
- фиксация опухоли к превертебральной фасции.
Удаление злокачественных новообразований в области головы и шеи
Первые операции TORS в качестве лечения рака были выполнены для удаления злокачественной опухоли основания языка [14]. В 2007 г. группа Weinstein опубликовала данные о лечении 27 пациентов: в 93% после радикальной тонзиллэктомии методом TORS были достигнуты чистые края резекции, хорошее глотание и отсутствие гастростомы у большинства пациентов – 96% [42]. В 2007 г. G.S. Weinstein и соавт. представили результаты использования TORS для частичной надглоточной ларингэктомии [50]. В 2009 г. B.A. Boudreaux и соавт. продемонстрировали успешное удаление опухолей методом TORS в ротовой полости, ротоглотке, гортаноглотке и гортани [51].
Трансоральная роботизированная хирургия (TORS) все чаще используется в последние годы в отоларингологии для удаления злокачественных опухолей ротоглотки. Впервые операции TORS по удалению злокачественных опухолей в окологлоточном пространстве выполнили B.W. O’Malley и соавт. в 2010 г. [52]. Показания к TORS расширились до лечения опухолей парафариенгеального пространства, опухолей щитовидной и паращитовидной желез, новообразований слюнных желез [6, 53–55]. M.G. Maglione и соавт. (2018) представили серию клинических случаев по удалению доброкачественных опухолей окологлоточного простанства методом TORS [56]. В последние годы описано использование TORS для операций в области ретрофарингеального пространства (преимущества – предотвращение трансцервикального разреза и уменьшение риска повреждения основных сосудов шеи и нижних черепных нервов): удаление метастатического папиллярного рака щитовидной железы, удаление первичного плоскоклеточного рака задней стенки глотки и удаление доброкачественных опухолей ретрофарингеального пространства [55, 57, 58].
S.E. Ford и соавт. (2014) выполнили ретроспективное когортное сравнительное исследование среди 130 пациентов в период с октября 2004 по март 2012 г. с окологлоточной плоскоклеточной карциномой [59]. Половине пациентов была выполнена операция TORS, а другой половине – традиционная открытая операция и дополнительная терапия. В целом пациенты после операции TORS выживали чаще (94%, 91 и 89% через 1, 2 и 3 года соответственно), чем после открытой операции (85%, 75 и 73% через 1, 2 и 3 года) (р=0,35). В подгруппе пациентов с ВПЧ (вирус папилломы человека)-отрицательным статусом выживаемость после открытой хирургии была еще меньше (58%, 25 и 25% через 1, 2 и 3 года). Был сделан вывод, что онкологические результаты не приносятся в жертву, когда пациенты с окологлоточной плоскоклеточной карциномой лечатся TORS вместо открытой хирургии, независимо от ВПЧ-статуса пациента.
- Dabas и соавт. (2017) представили проспективное исследование отдаленных онкологических результатов у пациентов с T1-T2 NO злокачественными ВПЧ-отрицательными опухолями ротоглотки, где единственным методом лечения была операция TORS [60]. Всего в исследовании участвовали 57 пациентов (48 мужчин и 9 женщин), 31 (54,8%) пациент с раком основания языка, 24 (42,1%) пациента – со степенью T1 и 33 (57,9%) пациента – с Т2. За время наблюдения у 2 (4,2%) пациентов был региональный рецидив и у 1 (2,1%) был отдаленный метастаз, двое пациентов умерли по причинам, не связанным с онкологией. Были свободны от онкологии спустя 29 месяцев наблюдения 43 (89,6%) пациента, общая выживаемость за 29 месяцев составила 93,8%. Были сделаны выводы, что TORS операция в качестве единственного метода лечения является хорошим вариантом для лечения ВПЧ-отрицательных ранних резектируемых злокачественных новообразований ротоглотки, которые относительно невосприимчивы к облучению. TORS может использоваться для снижения интенсивности лечения рака ротоглотки на ранней стадии и, таким образом, для предотвращения ранней и поздней токсичности, связанной с лучевой/ химиолучевой терапией.
- Mahmoud и соавт. (2018) выполнили большое ретроспективное исследование 1873 пациентов с окологлоточной плоскоклеточной карциномой, из которых 73% были ВПЧ-позитивны и 30% лечились с использованием TORS [61]. Среди ВПЧ-позитивных пациентов не было разницы в 3-летней выживаемости среди тех, кому вначале сделали TORS (без или с последующей терапией) и среди тех, кто получил только радио и химиотерапию: 95 и 91% (р=0,116). Однако в ВПЧ-отрицательной группе 3-летняя выживаемость пациентов, подвергшихся TORS операции, была значительно выше (84%), чем пациентов, получивших радио и химиотерапию – 66% (р=0,01).
Удаление ларингоцеле
Ларингоцеле – это доброкачественная, кистообразная опухоль, развивающаяся из морганиевых желудочков гортани. Она бывает внутренней, наружной и комбинированной [62]. Обычно наружное и комбинированное ларингоцеле удаляется наружным способом, а внутреннее – эндоларингеальным методом при прямой ларингоскопии. Первые публикации об успешном применении TORS для удаления ларингоцеле относятся к 2013 г. [63]. В отличие от операций с наружным доступом TORS позволяет избежать появления послеоперационного рубца на шее, сохраняет в целости каркас гортани и мускулатуру [64–67]. Кроме того, у пациентов с TORS короче время операции, нет необходимости создания трахеостомы или гастростомы, меньше время пребывания в стационаре и раньше начинается прием пищи [63, 64, 68]. По сравнению с эндоскопической микроларингоскопией TORS обеспечивает превосходную трехмерную визуализацию с помощью дополнительной роботической руки для смещения и манипулирования тканями [64, 66, 69]. Тонкие движения руки при микроларингоскопии заменяются на точные движения робота при TORS [69].
Лечение тонзиллита язычной миндалины
- Montevecchi и соавт. (2017) представили свой опыт (10 пациентов с февраля 2012 по апрель 2014 г.) удаления язычной миндалины у пациентов с тонзиллитом при помощи операции TORS [70]. В тех случаях, когда тонзиллит язычной миндалины не поддается лечению стандартной лекарственной терапией, показано удаление язычной миндалины. В прошлом операция по удалению язычной миндалины считалась опасной из-за возможности обильного кровотечения при использовании холодных режущих инструментов. С появлением электрокоагуляции и СО2 — лазера операция стала менее сложной, хотя риск кровотечения остается еще достаточно высоким. По мнению авторов, удаление язычной миндалины при помощи TORS с роботом da Vinci легче и и надежнее благодаря трехмерному обзору и возможности маневрировать инструментами во всех направлениях.
Лечение ночного апноэ
Синдром обструктивного ночного апноэ – недооцененная, но серьезная проблема для здоровья, которая трудно поддается лечению. Этот синдром снижает качество жизни и вызывает сердечно-сосудистые и цереброваскулярные заболевания. C. Vicini и соавт. (2010) представили положительный опыт применения операции TORS (резекция основания языка) для лечения обстуктивного ночного апноэ: у 10 пациентов после операции значительно уменьшился индекс AHI (38,3±23,5 до операции и 20,6±17,3 после операции) [71]. F.T. Kayhan и соавт. (2016) успешно выполнили лечение обструктивного ночного апноэ у 25 пациентов методом TORS операции (резекция основания языка и пластика верхнего отдела гортани) [72]. A. Arora и соавт. (2016) представили положительный опыт лечения ночного обструктивного апноэ, неподдающегося обычному лечению, методом операции TORS [73]. S.C. Miller и соавт. (2017) представили систематический обзор исследований лечения обструктивного ночного апноэ методом операции TORS, включающий 6 статей и результаты лечения 353 пациентов [74]. Был сделан вывод, что метод TORS был успешен в большинстве случаев.
TORS в России
В России первая операция с использованием робота daVinci была выполнена в 2007 г. На начало июля 2018 г. в России в различных клиниках функционирует 25 роботов da Vinci. Планируется создать учебный центр по роботической хирургии на базе РАН, ведется разработка российского хирургического робота [75]. В России операции TORS выполняются в клинике пластической хирургии Первого МГМУ им. И.М. Сеченова (Москва) с использованием робота da Vinci под руководством акад. РАН, д.м.н. Игоря Владимировича Решетова. C мая 2016 по октябрь 2017 г. было выполнено 9 робот-ассистированных операций с трансоральным доступом (7 в ротоглотке и 2 в полости носа) для удаления злокачественных опухолей различной локализации. Отмечены преимущества TORS операции для хирурга (малоинвазивность, точность хирургических действий, улучшенная система визуализации и возможность применения усовершенствованного хирургического инструментария) и пациента (отсутствие видимых шрамов и рубцов на лице, полное восстановление утраченных функций, сокращение сроков госпитализации и быстрое возвращение к привычному образу жизни) [76–78].
Эффективность применения роботассистированных операций в различных областях медицины
Необходимо отметить, что в иностранной научной литературе опубликовано несколько исследований, в которых сравниваются клинические результаты и стоимость лечения при выполнении операций в урологии, гинекологии и общей хирургии методом робот-ассистированной хирургии, лапароскопией и традиционным способом.
Например, J.W. Yaxley и соавт. в 2016 г. в рандомизированном исследовании сравнивал ранние результаты операции роботассистированной и открытой радикальной ретропубической простатэктомии у 326 пациентов с клинически локализованным раком простаты [79]. Было установлено, что оценки функции мочеиспускания у пациентов спустя 12 недель после операции значительно не различались между двумя группами: 83,8 после открытой операции и 82,5 после робот-ассистированной; оценки сексуальной функции у пациентов спустя 12 недель после операции также были близки: 35,0 после открытой операции и 38,9 после робот-ассистированной операции. Послеоперационные осложнения были у 14 (9%) пациентов после открытой операции и у 6 (4%) пациентов после робот-ассистированной операции.
В 2018 г. эта же группа ученых опубликовала отдаленные результаты этого рандомизированного исследования [80]. Спустя 24 месяца после операции оценки функции мочеиспускания у пациентов после открытой операции были 90,86 и после робот-ассистированной – 91,33; оценки сексуальной функции (индекс EPIK) спустя 24 месяца после операции у пациентов после открытой операции были 46,9 и 45,7 после робот-ассистированной операции. Авторы сделали вывод, что единственное преимущество робот-ассистированной операции – это малая инвазивность, но функция мочеиспускания и сексуальные возможности пациента одинаковы после открытой и робот-ассистированной операции.
- Sridharan и G.Sivaramakrishnan в 2018 г. опубликовали сравнительный анализ 45 исследований, сравнивающих результаты простатэктомии при локализованном раке простаты, выполненной тремя различными методами: открытым, с применением лапароскопа и с использованием робота [81]. Выявлено, что наблюдаются сходные функциональные, онкологические и постоперационные результаты для всех трех методов. Обнаружено, что после лапароскопической операции необходимо самое короткое время катетеризации.
I.G. Jeong и соавт. (2017) выполнили ретроспективное когортное исследование результатов радикальной нефрэктомии, выполненной лапароскопическим методом и с применением робота у 23 753 пациентов с 2003 по 2015 г. [82]. Было установлено, что нет различий в послеоперационных и отдаленных осложнениях после выполнения радикальной нефрэктомии с применением робота или лапораскопически, но операции с использованием робота отличались более длительным временем операции и более высокой стоимостью лечения.
J.D. Wright и соавт. (2012) выполнили сравнительное исследование результатов гистерэктомии для лечения эндометриального рака у 2464 женщин (1027 женщин в группе с лапароскопической гистерэктомией и 1437 с роботической гистерэктомией) с 2008 по 2010 г. [83]. Было установлено, что нет значительных различий между двумя группами по различным видам осложнений. Общее число осложнений составило 9,8% в группе с лапароскопической гистерэктомией и 8,1% в группе с роботической гистерэктомией. В то же время стоимость операции с применением робота была значительно выше – 10,618$, чем операция с лапароскопом – 8,996$.
J.D. Wright и соавт. (2016), отслеживая результаты лечения 6304 женщин с раком матки 1–2 ст. с 2006 по 2011 г., установили, что общее число осложнений после робот-ассистированной гистерэктомии (23,7% ) было выше, чем после лапароскопической гистерэктомии (19,5%) [84]. В то же время отдаленные результаты лечения, в т.ч. онкологические, были одинаковы независимо от вида операции (абдоминальная, лапароскопическая или роботическая).
L.A. Cantrell и соавт. (2010 ) выполнили ретроспективный анализ выживаемости женщин после роботической радикальной гистерэктомии для лечения рака шейки матки [85]. Было установлено, что параметры выживаемости, спустя три года после роботической операции, не отличаются от результатов после традиционной операции с лапаротомией.
C.C. Chiu и соавт. (2019) изучили стоимость и клинические результаты операций по удалению рака кишечника у 531 536 пациентов в период с 2008 по 2014 г., выполненных открытым способом (65,6%), лапароскопически (32,9%) и с применением робота (1,5%) [86]. Было достоверно установлено, что наиболее высокий уровень смертности, число общих осложнений, более длительное время госпитализации и наиболее высокая стоимость были при выполнении операций открытым способом. В то же время лапароскопические операции оказались дешевле робот-ассистированных (14641 и 16628$), но показатели смертности и общих осложнений – одинаковы.
S.J. Lee и соавт. (2019) выполнили у пациентов ретроспективный анализ результатов операции левосторонней гепатоэктомии, выполненной открытым способом, лапароскопически и с применением робота [87]. Установлено, что не было никаких существенных различий в оценочной кровопотере, применении маневра Прингла, пребывании в стационаре после операции, числе внутривенных анальгетических инъекций или послеоперационных осложнений между роботизированной и лапароскопической группами.
- Fruscione и соавт. (2019) установили, что при резекции печени лапароскопическим методом и с применением робота нет значительных различий в числе осложнений, кровопотери, времени операции и времени госпитализации [88].
S.H. Lee и соавт. (2019) в систематическом обзоре сравнивали исследования с результатами операций по межсфинктерной резекции рака прямой кишки, выполненных лапароскопическим методом и с применением робота [89]. Установлено, что при операциях с роботом меньше кровопотеря, несмотря на более длительное операционное время, но клинические и функциональные ближайшие и 3-летние результаты одинаковы.
В систематическом обзоре N. Hoshino и соавт. (2019) установлено, что во всех 17 обзорах, сравнивающих результаты операций рака прямой кишки с использованием лапароскопа и с применением робота, нет различий в клинических исходах [90]. Таким образом, большинство робот-ассистированных операций в области урологии, гинекологии и общей хирургии имеют или малоинвазивную альтернативу в виде лапароскопической операции, или открытую операцию с таким же клиническим исходом. В то же время TORS во многих случаях не имеет малоинвазивной альтернативы, и применение TORS значительно улучшает качество жизни и улучшает прогноз после операции [91]. Область головы и шеи наиболее насыщена сосудами и нервами и имеет самый трудный доступ для оперативных вмешательств по сравнению с областью грудной клетки, живота или малого таза. После операций по удалению злокачественных новообразований в области головы и шеи пациентам, как правило, необходимо или выполнение сложной пластики с подсадкой кожно-мышечных лоскутов, или изготовление сложных и дорогостоящих протезов. У пациентов нарушается эстетика, страдают функции речи, жевания и глотания. Им сложно найти работу и социально адаптироваться. Кроме того, при закупке оборудования операционный лапароскоп в среднем в 10 раз дешевле, чем хирургический робот da Vinci. С экономической точки зрения, в настоящее время рационально оснащать отделения урологии , гинекологии и общей хирургии лапароскопами, а закупку хирургических роботов выполнять для челюстнолицевых хирургов и отоларингологов.
Отсутствие широкого внедрения операций TORS в России, по нашему мнению, связано с тем, что хирурги-стоматологи (в отличие от хирургов других специальностей) не имеют опыта выполнения лапароскопических операций, когда хирург ориентируется на изображение в мониторе. Без обучения за рубежом и создания федерального российского учебного центра, на базе которого можно будет проходить виртуальное и реальное обучение, внедрение операций TORS невозможно.
На наш взгляд, необходимо принимать следующие меры для внедрения TORS в России:
- Создание федерального учебного центра по операциям TORS на базе какого-либо медуниверситета с привлечением стоматологов, челюстно-лицевых хирургов и хирургов отоларингологов.
- Обучить нескольких ведущих хирургов-стоматологов и отоларингологов в учебных центрах TORS за рубежом (в США и Европе) для работы в российском учебном центре.
- Оснастить учебный центр роботом da Vinci (США) c учебной консолью и Flex Robotic System (США).
- Постепенно оснастить хирургическими роботами ведущие клиники России, в которых выполняются операции в области головы и шеи, с обучением хирургов в российском центре TOR.
- Разработка, изучение и внедрение российского хирургического робота для выполнения операций TORS.
Заключение
Робот-ассистированные операции в области головы и шеи обладают значительными клиническими и экономическими преимуществами по сравнению с традиционными методами хирургического лечения в этой области. В связи с эпидемией папилломавируса и значительным ростом заболеваемости злокачественными новообразованиями ротоглотки среди мужчин работоспособного возраста, внедрение операций TORS приобретает большое значение.
Появление и внедрение операций TORS в России, на наш взгляд, не представляется возможным без инициативы и контроля со стороны Правительства РФ. Мы предлагаем комплекс мер, из которых основное – это создание федерального учебного центра по операциям TORS в области головы и шеи.
ЛИТЕРАТУРА/REFERENCES
- Kavanagh K.T. Applications of image-directed robotics in otolaryngologic surgery. Laryngoscope. 1994;104(3 Pt 1):283–93. https: doi. org/10.1288/00005537-199403000-00008.
- Lueth T.C., Hein A., Albrecht J., Demirtas M., Zachow S., et al. A Surgical Robot System for Maxillofacial Surgery. IEEE, Germany, Europe, 1998. pp. 2470-2475. Рublished in: IECON ’98. Proceedings of the 24th Annual Conference of the IEEE Industrial Electronics Society (Cat. No.98CH36200).
- Burghart C.J., Muenchenberg U. Rembold: A System for Robot Assisted Maxillofacial Surgery. In Westwood et al. (Ed.), Medicine Meets Virtual Reality, 10s Press, 1998. Р. 220–6.
- Raczkowsky J.P., Bohner C., Burghart H. Grabowski. Planning and Simulation of Medical Robot Tasks. In Westwood et al. (Ed.), Medicine Meets Virtual Reality, IOS Press, 1998. Р. 209–14.
- Burghart C.R., Muenchenberg J.E., Rembold U. A system for robot assisted maxillofacial surgery. Stud Health Technol. Inform. 1998;50:220–6.
- De Ceulaer J., De Clercq C., Swennen G.R. Robotic surgery in oral and maxillofacial, craniofacial and head and neck surgery: a systematic review of the literature. Int. J. Oral. Maxillofac. Surg. 2012;41(11):1311–24. doi: 10.1016/j.ijom.2012.05.035.
- Решетов И.В. Опухоли органов головы и шеи. Тверь: Тверской полиграфический комбинат; 2016:12–5. (InRuss.) [Reshetov I.V. Opukholi organov golovy i shei. Tver’: Tverskoi poligraficheskii kombinat. 2016;12–5].
- Стукань А.И., Чухрай О.Ю., Порханов В.А., Мурашко Р.А., Бодня В.Н., Макарова Ю.М. Орофарингеальная карцинома, ассоциированная с вирусом папилломы человека: тенденции эпидемиологии и методы выявления вируса в опухоли. Опухоли головы и шеи. 2018;8(3):77–83. doi:10.17650/2222 1468 2018 8 3 77 83 (In Russ.). [Stukan A.I., Chukhrai O.Yu., Porkhanov V.A., Murashko R.A., Bodnya V.N., Makarova Yu.M. Oropharyngeal carcinoma associated with the human papillomavirus: trends in epidemiology and methods for detecting the virus in a tumor. Head and neck tumors. 2018; 8 (3): 77–83. doi: 10.17650 / 2222 1468 2018 8 3 77 83].
- Kofler B., Laban S., Busch C.J., et al. New treatment strategies for HPV-positive head and neck cancer. Eur. Arch. Otorhinolaryngol. 2014;271(7):1861–7. doi: 10.1007/s00405 013 2603 0.
- Mehta V., Yu G.P., Schantz S.P. Population-based analysis of oral and oropharyngeal carcinoma: changing trends of histopathologic differentiation, survival and patient demographics. Laryngoscope. 2010;120(11):2203–12. doi: 10.1002/lary.21129.
- Chaturvedi A.K., Engels E.A., Pfeiffer R.M., et al. Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J. Clin. Oncol. 2011;29(32):4294–301.
- Haus B.M., Kambham N., Le D., Moll F.M., Gourin C., Terris D.J. Surgical robotic applications in otolaryngology. Laryngoscope. 2003;113(7):1139–44.
- McLeod I.K., Melder P.C. Da Vinci robot-assisted excision of a vallecular cyst: a case report. Ear. Nose Throat. J. 2005;84(3):170–2.
- O’Malley B.W., Weinstein G.S., Snyder W., Hockstein N.G. Transoral robotic surgery (TORS) for base of tongue neoplasms. Laryngoscope. 2006;116(8):1465–72.
- Weinstein G.S., O’Malley B.W. Transoral Robotic Surgery (TORS). Plural Publishing. 2011;253. ISBN13: 978-1-59756-074-0 http: www. pluralpublishing.com/publication_tors.htm.
- Weinstein G.S., O’Malley B.W. Da Vinci® Transoral Surgery Procedure Guide. Intuitive Surgical Training Publication. August 2008. 31 р.
- Oliveira C.M., Nguyen H.T., Ferraz A.R., Watters K., Rosman B., Rahbar R. Robotic surgery in otolaryngology and head and neck surgery: a review. Minim Invasive Surg. 2012;2012:286563. doi: 10.1155/2012/ 286563.
- Lanfranco A.R., Castellanos A.E., Desai J.P., Meyers W.C. Robotic surgery: a current perspective. Ann. Surg. 2004;239(1):14–21.
- Chi J.J., Mandel J.E., Weinstein G.S., O’Malley B.W. Anesthetic considerations for transoral robotic surgery. Anesthesiol. Clin. 2010;28(3):411–22. doi: 10.1016/j.anclin.2010.07.002.
- Remacle M., Matar N., Lawson G. Bachy V. Laryngeal advanced retractor system: a new retractor for transoral robotic surgery. Otolaryngol. Head Neck Surg. 2011;145(4):694–6. doi: 10.1177/0194599811415930
- Hasskamp P., Lang S, Holtmann L, Stuck BA, Mattheis S. First use of a new retractor in transoral robotic surgery (TORS). Eur. Arch. Otorhinolaryngol. 2016;273(7):1913–17. doi: 10.1007/s00405-015-3719-1.
- Cracchiolo J.R., Roman B.R., Kutler D.I., Kuhel W.I., Cohen M.A. Adoption of transoral robotic surgery compared with other surgical modalities for treatment of oropharyngeal squamous cell carcinoma. J. Surg. Oncol. 2016;114(4):405–11. doi: 10.1002/jso.24353.
- Alessandrini M., Pavone I., Micarelli A., Caporale C. Transoral robotic surgery for the base of tongue squamous cell carcinoma: a preliminary comparison between da Vinci Xi and Si. J. Robot. Surg. 2018;12(3):417–23. doi: 10.1007/s11701-017-0750-9.
- Rivera-Serrano C.M., Johnson P., Zubiate B., Kuenzler R., Choset H., Zenati M., et al. A transoral highly flexible robot: Novel technology and application. The Laryngoscope. 2012;122:1067–71.
- Johnson P.J., Rivera Serrano C.M., Castro M., Kuenzler R., Choset H., Tully S., et al. Demonstration of transoral surgery in cadaveric specimens with the medrobotics flex system. The Laryngoscope. 2013;123:1168–72.
- Mandapathil M., Greene B., Wilhelm T. Transoral surgery using a novel single-port flexible endoscope system. Eur. Arch. Otorhinolaryngol. 2015;272:2451–6.
- Remacle M., Prasad V.M.N., Lawson G., Plisson L., Bachy V., Van der Vorst S. Transoral robotic surgery (TORS) with the Medrobotics Flex System: first surgical application on humans. Eur Arch Oto-rhino-laryngology: Off J. Eur. Federation Oto-RhinoLaryngol. Societies (EUFOS): German Society for OtoRhino-Laryngology – Head and Neck Surgery. 2015;272:1451–5.
- Mandapathil M., Duvvuri U., Güldner C., Teymoortash A., Lawson G., Werner J.A. Transoral surgery for oropharyngeal tumors using the Medrobotics Flex® System – a case report. Int. J. Surg. Case Rep. 2015;10:173–5.
- Mattheis S., Lang S. A new flexible endoscopy-system for the transoral resection of head and neck tumors. Laryngo-rhino-otologie. 2015;94:25–8.
- Schuler P.J., Duvvuri U., Friedrich D.T., Rotter N., Scheithauer M.O., Hoffmann T.K. First use of a computer-assisted operator-controlled flexible endoscope for transoral surgery. The Laryngoscope. 2015;125:645–8.
- Lang S., Mattheis S., Hasskamp P., Lawson G., Güldner C., Mandapathil M., et al. A european multicenter study evaluating the flex robotic system in transoral robotic surgery. The Laryngoscope. 2017;127:391–5.
- Mattheis S., Hasskamp P., Holtmann L., Schäfer C., Geisthoff U., Dominas N., et al. Flex Robotic System in transoral robotic surgery: the first 40 patients. Head Neck. 2017;39:4717–5.
- Remacle M., Prasad V.M.N. Preliminary experience in transoral laryngeal surgery with a flexible robotic system for benign lesions of the vocal folds. Eur. Arch. Otorhinolaryngol. 2018;275(3):761–5. doi: 10.1007/s00405-018-4900-0.
- Tan Wen Sheng B., Wong P., Teo Ee Hoon C. Transoral robotic excision of laryngeal papillomas with Flex® Robotic System — A novel surgical approach. Am. J. Otolaryngol. 2018;39(3):355–358. doi: 10.1016/j.amjoto.2018.03.011.
- Persky M.J., Issa M., Bonfili J.R., Goyal N., Goldenberg D., Duvvuri U. Transoral surgery using the Flex Robotic System: Initial experience in the United States. Head Neck. 2018;40(11):2482–6. doi: 10.1002/hed.25375.
- Poon H., Li C., Gao W., Ren H., Lim C.M. Evolution of robotic systems for transoral head and neck surgery. Oral Oncol. 2018;87:82–8. doi: 10.1016/j. oraloncology.2018.10.020.
- Friedrich D.T., Scheithauer M.O., Greve J., Hoffmann T.K., Schuler P.J. Recent advances in robot-assisted head and neck surgery. Int. J. Med. Robot. 2017;13(2). doi: 10.1002/rcs.1744.
- Holsinger F.C. A flexible, single-arm robotic surgical system for transoral resection of the tonsil and lateral pharyngeal wall: Next-generation robotic head and neck surgery. Laryngoscope. 2016;126(4):864–9. doi: 10.1002/ lary.25724.
- Tsang R.K., Wong E.W.Y., Chan J.YK. Transoral radical tonsillectomy and retropharyngeal lymph node dissection with a flexible next generation robotic surgical system. Head Neck. 2018;40(6):1296–8. doi: 10.1002/hed.25118.
- Tay G., Tan H.K., Nguyen T.K., Phee S.J., Iyer N.G. Use of the EndoMaster robot-assisted surgical system in transoral robotic surgery: A cadaveric study. Int. J. Med. Robot. 2018;14(4):e1930. doi: 10.1002/rcs.1930.
- Borumandi F., Heliotis M., Kerawala C., Bisase B., Cascarini L. Role of robotic surgery in oral and maxillofacial, and head and neck surgery. Br. J. Oral Maxillofac. Surg. 2012;50(5):389–93. doi: 10.1016/j.bjoms.2011.06.008.
- Weinstein G.S., O’Malley B.W., Snyder W., Sherman E., Quon H. Transoral robotic surgery: radical tonsillectomy. Arch. Otolaryngol. Head Neck Surg. 2007;133(12):1220–6.
- Dion Y.M., Gaillard F. Visual integration of data and basic motor skills under laparoscopy. Influence of 2-D and 3-D video-camera systems. Surg. Endosc. 1997;11(10):995–1000.
- Lawson G., Matar N., Remacle M., Jamart J., Bachy V. Transoral robotic surgery for the management of head and neck tumors: learning curve. Eur. Arch. Otorhinolaryngol. 2011;268(12):1795–801. doi: 10.1007/s00405-011-1537-7.
- Kim V.B., Chapman W.H., Albrecht R.J., Bailey B.M., Young J.A., Nifong L.W., Chitwood W.R. Early experience with telemanipulative robot-assisted laparoscopic cholecystectomy using da Vinci. Surg. Laparosc Endosc. Percutan. Tech. 2002;12(1):33–40.
- Berguer R., Smith W. An ergonomic comparison of robotic and laparoscopic technique: the influence of surgeon experience and task complexity. J. Surg. Res. 2006;134(1):87–92.
- Prasad S.M., Ducko C.T., Stephenson E.R., Chambers C.E., Damiano R.J. Prospective clinical trial of robotically assisted endoscopic coronary grafting with 1-year follow-up. Ann. Surg. 2001;233(6):725–32.
- Marescaux J., Leroy J., Rubino F., Smith M., Vix M., Simone M., Mutter D. Transcontinental robot-assisted remote telesurgery: feasibility and potential applications. Ann. Surg. 2002;235(4):487–92.
- Feifer A., Al-Ammari A., Kovac E., Delisle J., Carrier S., Anidjar M. Randomized controlled trial of virtual reality and hybrid simulation for robotic surgical training. BJU. Int. 2011;108(10):1652–6; discussion 1657. doi: 10.1111/j.1464-410X.2010.10060.x.
- Weinstein G.S., O’Malley B.W., Snyder W., et al. Transoral robotic surgery: supraglottic partial laryngectomy. Ann. Otol. Rhinol. Laryngol. 2007;116:19Y23.
- Boudreaux B.A., Rosenthal E.L., Magnuson J.S., et al. Robot-assisted surgery for upper aerodigestive tract neoplasms. Arch. Otolaryngol. Head Neck Surg. 2009;135:397Y401.
- O’Malley B.W., Quon H., Leonhardt F.D., Chalian A.A., Weinstein G.S. Transoral robotic surgery for parapharyngeal space tumors. ORL. J. Otorhinolaryngol. Relat. Spec. 2010;72:332–6.
- Moore E.J., Ebrahimi A., Price D.L., Olsen K.D. Retropharyngeal lymph node dissection in oropharyngeal cancer treated with transoral robotic surgery. Laryngoscope. 2013;123(7):1676–81. doi: 10.1002/lary.24009.
- Goepfert R.P., Liu C., Ryan W.R. Trans-oral robotic surgery and surgeonperformed trans-oral ultrasound for intraoperative location and excision of an isolated retropharyngeal lymph node metastasis of papillary thyroid carcinoma. Am. J. Otolaryngol. 2015;36(5):710–4. doi: 10.1016/j.amjoto.2015.04.011.
- Givi B., Troob S.H., Stott W., Cordeiro .T, Andersen P.E., Gross N.D. Transoral robotic retropharyngeal node dissection. Head Neck. 2016;38(Suppl. 1): E981–86. doi: 10.1002/hed.24140.
- Maglione M.G., Guida A., Pavone E., Longo F., Aversa C., Villano S., Ionna F. Transoral robotic surgery of parapharyngeal space tumours: a series of four cases. Int. J. Oral. Maxillofac. Surg. 2018;47(8):971–5. doi: 10.1016/j. ijom.2018.01.008.
- Bearelly S., Prendes B.L., Wang S.J., Glastonbury C., Orloff L.A. Transoral robotic-assisted surgical excision of a retropharyngeal parathyroid adenoma: a case report. Head Neck. 2015;37(11):150–2. doi: 10.1002/hed.24010.
- Kane A.C., Walvekar R.R., Hotaling J.M. Transoral robotic resection of a retropharyngeal parathyroid adenoma: a case report. J. Robot. Surg. 2018 Jul 9. doi: 10.1007/s11701-018-0843-0.
- Ford S.E., Brandwein-Gensler M., Carroll W.R., Rosenthal E.L., Magnuson J.S. Transoral robotic versus open surgical approaches to oropharyngeal squamous cell carcinoma by human papillomavirus status. Otolaryngol. Head Neck Surg. 2014;151(4):606–11. doi: 10.1177/0194599814542939.
- Dabas S., Gupta K., Ranjan R.3. Sharma A.K., Shukla H., Dinesh A. Oncological outcome following de-intensification of treatment for stage I and II HPV negative oropharyngeal cancers with transoral robotic surgery (TORS): A prospective trial. Oral Oncol. 2017;69:80–3. doi: 10.1016/j. oraloncology.2017.04.010.
- Mahmoud O., Sung K., Civantos F.J., Thomas G.R., Samuels M.A. Transoral robotic surgery for oropharyngeal squamous cell carcinoma in the era of human papillomavirus. Head Neck. 2018;40(4):710–21. doi: 10.1002/hed.25036.
- DeSanto L.W. Laryngocele, laryngeal mucocele, large saccules, and laryngeal saccular cysts: a developmental spectrum. Laryngoscope. 1974;84:1291–6.
- Ciabatti P.G., Burali G., D’Ascanio L. Transoral robotic surgery for large mixed laryngocoele. J. Laryngol. Otol. 2013;127:435–7.
- Kayhan F.T., Gunes S., Koc A.K., Yigider A.P., Kaya K.H. Management of laryngoceles by transoral robotic approach. J. Craniofac. Surg. 2016;27:981–5.
- Villeneuve A., Vergez S., Bakhos D., Lescanne E., Pinlong E., Moriniere S. Management of laryngoceles by transoral robotic surgery. Eur. Arch. Otorhinolaryngol. 2016;273:3813–7.
- Lisan Q., Hoffmann C., Jouffroy T., Hans S. Combined laser and robotic approach for the management of a mixed laryngomucocele. J. Robotic. Surg. 2016;10:81–3
. 67. Patel K.B., Lin C., Kramer S., Fada C., Ozer E. Transoral robotic excision of laryngocele: Surgical considerations. Head Neck. 2019. doi: 10.1002/ hed.25612.
- Thome R., Thome D.C., De La Cortina R.A. Lateral thyrotomy approach on the paraglottic space for laryngocele resection. Laryngoscope. 2000;110:447– 50.
- Genden E.M., O’Malley B.W., Weinstein G.S., et al. Transoral robotic surgery: role in the management of upper aerodigestive tract tumors. Head Neck. 2012;34:886–93.
- Montevecchi F., Cammaroto G., Meccariello G., D’Agostino G., Hsu Y.S., Galletti B., Vicini C. Trans-oral robotic surgery (TORS) for the treatment of lingual tonsillitis. When conventional therapies fail. Int. J. Med. Robot. 2017;13(3). doi: 10.1002/rcs.1763.
- Vicini C., Dallan I., Canzi P., Frassineti S., La Pietra M.G., Montevecchi F. Transoral robotic tongue base resection in obstructive sleep apnoea-hypopnoea syndrome: a preliminary report. ORL. J. Otorhinolaryngol. Relat. Spec. 2010;72(1):22–7. doi: 10.1159/000284352.
- Kayhan F.T., Kaya K.H., Koç A.K., Yegin Y., Yazici Z.M., Türkeli S., Sayin I. Multilevel Combined Surgery With Transoral Robotic Surgery for Obstructive Sleep Apnea Syndrome. J. Craniofac. Surg. 2016;27(4):1044–8. doi: 10.1097/ SCS.0000000000002608.
- Arora A., Chaidas K., Garas G., Amlani A., Darzi A., Kotecha B., Tolley N.S. Outcome of TORS to tongue base and epiglottis in patients with OSA intolerant of conventional treatment. Sleep Breath. 2016;20(2):739–47. doi: 10.1007/ s11325-015-1293-9.
- Miller S.C., Nguyen S.A., Ong A.A., Gillespie M.B. Transoral robotic base of tongue reduction for obstructive sleep apnea: A systematic review and metaanalysis. Laryngoscope. 2017;127(1):258–65. doi: 10.1002/lary.26060.
- РАН планирует создать тренировочный центр роботической хирургии. Материалы портала «Научная Россия», 13 июля 2018 г., 15:50 https: scientificrussia.ru/articles/ran-planiruet-sozdattrenirovochnyj-tsentr-robotizirovannoj-meditsiny. (In Russ.) [RAS is planning to create a training center for robotic surgery. Materials of the portal “Scientific Russia”, July 13, 2018, 15:50 https: scientificrussia. ru/articles/ran-planiruet-sozdat-trenirovochnyj-tsentr-robotizirovannojmeditsiny].
- Решетов И.В., Сукорцева Н.С., Шевалгин А.А., Святославов Д.С., Насилевский П.А. Реконструктивно-пластические операции с использованием роботической техники. Анналы пластической, реконструктивной и эстетической хирургии. 2017;1:123–4 (In Russ.)/ [Reshetov I.V., Sukortseva N.S., Shevalgin A.A., Svyatoslavov D.S., Nasilevsky P.A. Reconstructive plastic surgery using robotic technology. Annals of plastic, reconstructive and aesthetic surgery. 2017; 1: 123–4].
- Решетов И.В., Сукорцева Н.С., Шевалгин А.А., Святославов Д.С., Кудрин К.Г., Насилевский П.А. Робот-ассистированные вмешательства в лечении злокачественных новообразований головы и шеи. Онкология. 2018;2:43–50. Doi: 10.17116/onkolog20187243-50 (In Russ.). [Reshetov I.V., Sukortseva N.S., Shevalgin A.A., Svyatoslavov D.S., Kudrin K.G., Nasilevsky P.A. Robot-assisted interventions in the treatment of malignant neoplasms of the head and neck. Oncology. 2018; 2: 43–50. doi: 10.17116 / onkolog20187243-50].
- Решетов И.В., Сукорцева Н.С., Шевалгин А.А., Святославов Д.С., Насилевский П.А. Роботассистированная резекция ротоглотки. Вестник отоларингологии. 2018;5:36–9. doi: 10.17116/ otorino20188305136 (In Russ.). [Reshetov I.V., Sukortseva N.S., Shevalgin A.A., Svyatoslavov D.S., Nasilevsky P.A. Robotic assisted oropharyngeal resection. Bulletin of otolaryngology. 2018; 5: 36–9. doi: 10.17116 / otorino20188305136].
- Yaxley J.W., Coughlin G.D., Chambers S.K., Occhipinti S., Samaratunga H., Zajdlewicz L., Dunglison N., Carter R., Williams S., Payton D.J., Perry-Keene J., Lavin M.F., Gardiner R.A. Robot-assisted laparoscopic prostatectomy versus open radical retropubic prostatectomy: early outcomes from a randomised controlled phase 3 study. Lancet. 2016;388(10049):1057– 66. doi: 10.1016/S0140-6736(16)30592-X.
- Coughlin G.D., Yaxley J.W., Chambers S.K., Occhipinti S., Samaratunga H., Zajdlewicz L., Teloken P., Dunglison N., Williams S., Lavin M.F., Gardiner R.A. Robot-assisted laparoscopic prostatectomy versus open radical retropubic prostatectomy: 24-month outcomes from a randomised controlled study. Lancet. Oncol. 2018;19(8):1051–60. doi: 10.1016/S1470-2045(18)30357-7.
- Sridharan K., Sivaramakrishnan G. Prostatectomies for localized prostate cancer: a mixed comparison network and cumulative meta-analysis. J. Robot. Surg. 2018;12(4):633–9. doi: 10.1007/s11701-018-0791-8.
- Jeong I.G, Khandwala Y.S., Kim J.H., Han D.H., Li S., Wang Y., Chang S.L., Chung B.I. Association of Robotic-Assisted vs Laparoscopic Radical Nephrectomy With Perioperative Outcomes and Health Care Costs, 2003 to 2015. JAMA. 2017;318(16):1561–1568. doi: 10.1001/jama.2017.14586.
- Wright J.D., Burke W.M., Wilde E.T., Lewin S.N., Charles A.S., Kim J.H., Goldman N., Neugut A.I., Herzog T.J., Hershman D.L. Comparative effectiveness of robotic versus laparoscopic hysterectomy for endometrial cancer. J. Clin. Oncol. 2012;30(8):783–91. doi: 10.1200/JCO.2011.36.7508.
- Wright J.D., Burke W.M., Tergas A.I., Hou J.Y., Huang Y., Hu J.C., Hillyer G.C., Ananth C.V., Neugut A.I., Hershman D.L. Comparative Effectiveness of Minimally Invasive Hysterectomy for Endometrial Cancer. J. Clin. Oncol. 2016;34(10):1087–96. doi: 10.1200/JCO.2015.65.3212.
- Cantrell L.A., Mendivil A., Gehrig P.A., Boggess J.F. Survival outcomes for women undergoing type III robotic radical hysterectomy for cervical cancer: a 3-year experience. Gynecol. Oncol. 2010;117(2):260–5. doi: 10.1016/j. ygyno.2010.01.012.
- Chiu C.C., Hsu W.T., Choi J.J., Galm B., Lee M.G., Chang C.N., Liu C.C., Lee C.C. Comparison of outcome and cost between the open, laparoscopic, and robotic surgical treatments for colon cancer: a propensity score-matched analysis using nationwide hospital record database. Surg. Endosc. 2019 Jan 23. doi: 10.1007/s00464-019-06672-7.
- Lee S.J., Lee J.H., Lee Y.J., Kim S.C., Hwang D.W., Song K.B., Shin S.H., Kwon J.W., Park G.S., Park Y.J., Park K.M. The feasibility of robotic left-side hepatectomy with comparison of laparoscopic and open approach: Consecutive series of single surgeon. Int. J. Med. Robot. 2019;12:e1982. doi: 10.1002/ rcs.1982.
- Fruscione M., Pickens R., Baker E.H., Cochran A., Khan A., Ocuin L., Iannitti D.A., Vrochides D., Martinie J.B. Robotic-assisted versus laparoscopic major liver resection: analysis of outcomes from a single center. HPB (Oxford). 2019 Jan 4. pii: S1365-182X(18)34562-3. doi: 10.1016/j.hpb.2018.11.011.
- Lee S.H., Kim D.H., Lim S.W. Robotic versus laparoscopic intersphincteric resection for low rectal cancer: a systematic review and meta-analysis. Int. J. Colorectal. Dis. 2018;33(12):1741–53. doi: 10.1007/s00384-018- 3145-0.
- Hoshino N., Sakamoto T., Hida K., Sakai Y. Robotic versus laparoscopic surgery for rectal cancer: an overview of systematic reviews with quality assessment of current evidence. Surg. Today. 2019 Jan 11. doi: 10.1007/ s00595-019-1763-y.
- Borumandi F., Cascarini L. Robotics in oral and maxillofacial surgery. Ann. R.Coll. Surg. Engl. 2018;100(Suppl. 6):16–8. doi: 10.1308/rcsann.supp1.16.
Поступила 01.02.19 Принята в печать 01.04.19
Received 01.02.19 Accepted 01.04.18
Информация об авторах:
М.М. Уханов – врач-стоматолог ортопед, клиника «ДДЦ», Москва; e-mail: uhanov1@yandex.ru.
А.В. Иващенко – д.м.н., директор ООО «Инновационный стоматологический центр», Самара; e-mail: ivachencoaveg@rambler.ru.
И.М. Федяев – д.м.н., профессор кафедры челюстно-лицевой хирургии и стоматологии ГБОУ ВО Самарский государственный медицинский университет Минздрава РФ, Самара; e-mail: fedyaev47@mail.ru.
А.Е. Яблоков – ординатор кафедры челюстно-лицевой хирургии и стоматологии ГБОУ ВО Самарский государственный медицинский университет Минздрава РФ, Самара; e-mail: s1131149@yandex.ru.
И.Н. Колганов – аспирант кафедры челюстно-лицевой хирургии и стоматологии ГБОУ ВО Самарский государственный медицинский университет Минздрава РФ, Самара; e-mail:igor.kolganov.91@mail.ru.
В.П. Тлустенко – д.м.н., заведующая кафедрой ортопедической стоматологии ГБОУ ВО Самарский государственный медицинский университет Минздрава РФ, Самара; e-mail: ivachencoaveg@rambler.ru.
About the authors:
M.M. Ukhanov – MD, orthopedist, dentist, clinic “DDC”, Moscow; e-mail: uhanov1@yandex.ru. A.V. Ivaschenko – MD, director of Innovative Dentistry Center LLC, Samara; e-mail: ivachencoaveg@rambler.ru.
I.M. Fedyaev – MD, Professor, Department of Maxillofacial Surgery and Dentistry, Samara State Medical University, Samara; e-mail: fedyaev47@mail.ru.
A.E. Yablokov – MD, Department of Oral and Maxillofacial Surgery and Dentistry of Samara State Medical University, Samara; e-mail: s1131149@yandex.ru.
I.N. Kolganov – MD, PhD Student, Department of Maxillofacial Surgery and Dentistry, Samara State Medical University, Samara; e-mail: igor.kolganov.91@ mail.ru.
V.P. Tlustenko – MD, Head of the Department of Orthopedic Dentistry of Samara State Medical University, Samara; e-mail: ivachencoaveg@rambler.ru.