Для цитирования: Исаев В.М., Наседкин А.Н., Егоров В.И., Залевская О.И., Исаев Э.В., Пустовит О.М., Фетисов И.С. Опыт 15-летнего клинического применения антимикробной фотодинамической терапии гнойного верхнечелюстного синусита. Голова и шея Head and neck Russian Journal. 2018;6(2):55–61
For citations: Isaev V.M., Nasedkin A.N., Egorov V.I., Zalevskaya O.I., Isaev E.V., Pustovit O.M., Fetisov I.S. Experience of 15-year clinical application of antimicrobic photodynamic therapy for purulent maxillary sinusitis treatment. Golova I Sheya. Head and neck. Russian Journal. 2018;6(2):55–61 (in Russian).
Doi: 10.25792/HN.2018.6.2.55–61
Проблема лечения гнойного верхнечелюстного синусита (ГВС) остается актуальной, несмотря на широкое применение современных антибактериальных средств, противогрибковых препаратов, современных способов хирургии, включающих малоинвазивные эндоскопические лазерные, ультразвуковые и иные методы хирургического вмешательства в отношении верхнечелюстных пазух.
Цель работы: повысить эффективность лечения острых и обострения хронических ГВС с помощью антимикробной фотодинамической терапии (АФДТ).
Результаты. В течение 15 лет в клинических условиях 320 пациентам было проведено малоинвазивное лечение острого или обострения хронического ГВС с помощью АФДТ. Описываемый в статье способ первоначально применяли только в тех случаях, когда проведенное ранее лечение, включая хирургическое, не давало стойкого эффекта, или в тех случаях, когда у пациента была выражена аллергическая реакция на применение многих антибактериальных препаратов. Сеансы АФДТ ГВС проводили как в стационаре, так и в амбулаторных условиях. Для проведения АФДТ использовали только отечественный фотосенсибилизатор Радахлорин, отечественный лазерный медицинский аппарат «Лахта-Милон» и отечественные кварц-полимерные волокна для трансляции лазерного излучения в полость верхнечелюстной пазухи. После отработки методики АФДТ и получения положительных результатов данный метод стали применять как основной способ лечения первично диагностированного ГВС. Результаты многолетнего применения АФДТ показали, что она является эффективным способом лечения ГВС, но имеет и противопоказания к применению, а именно: одонтогенный ГВС; полипозный ГВС и индивидуальная непереносимость Радахлорина и света. Применение АФДТ позволило добиться полного излечения, подтвержденного клиническими и микробиологическими результатами исследований у 288 (90%) из 320 пациентов с ГВС.
Ключевые слова: антимикробная фотодинамическая терапия, гнойный верхнечелюстной синусит, радахлорин, лазерное излучение.
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Исаев В.М., Наседкин А.Н., Егоров В.И., Залевская О.И., Исаев Э.В., Пустовит О.М., Фетисов И.С. Опыт 15-летнего клинического применения антимикробной фотодинамической терапии гнойного верхнечелюстного синусита. Голова и шея Head and neck Russian Journal. 2018;6(2):55–61
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Background. The problem of purulent maxillary sinusitis (PMS) treatment remains relevant, despite the widespread use of modern antibacterial agents and antifungal drugs, introduction of modern methods of surgery, including minimally invasive endoscopic laser, ultrasound and others.
Aim. To increase the efficiency of acute (catarrhal, purulent) and chronic (catarrhal, purulent, fungal) maxillary sinusitis treatment with the use of photodynamic therapy.
Materials and methods.
Within the last 15 years 320 patients with acute and chronic PMS underwent a minimally invasive treatment with APDT. The method described in the article was initially applied only in cases when the previous treatment, including surgical treatment, did not provide a stable effect, or in those cases when the patient had an allergic reaction to one of antibacterial drugs. The sessions of APDT were conducted both in hospital and in outpatient settings. Only Russian photosensitizer Radakhlorin, the domestic laser medical device “Lakhta-Milon” and domestic quartz-polymer fibers were used to produce laser irradiation of the maxillary sinus cavity. The APDT technique development and obtaining positive results allowed using it as the main method for primary PMS treatment.
Results. The long-term results of APDT use showed its effectiveness for the treatment of PMS, but it also has contraindications, namely: odontogenic PMS; polypous PMS and individual intolerance to Radachlorin and light. The use of APDT allowed to achieve a complete response, confirmed by clinical and microbiological data in 288 (90%) of 320 patients with PMS. Key words: photodynamic therapy, maxillary sinusitis, radachlorin.
Authors declare no conflict of interests for this article. Source of financing. Unspecified.
For citations: Isaev V.M., Nasedkin A.N., Egorov V.I., Zalevskaya O.I., Isaev E.V., Pustovit O.M., Fetisov I.S. Experience of 15-year clinical application of antimicrobic photodynamic therapy for purulent maxillary sinusitis treatment. Golova I Sheya. Head and neck. Russian Journal. 2018;6(2):55–61 (in Russian).
The authors are responsible for the originality of the presented data and the possibility of publishing illustrative material – tables, drawings, photographs of patients.
Введение
Несмотря на современные достижения в лечении воспалительных заболеваний околоносовых пазух (ОНП), эти заболевания, по данным некоторых авторов, продолжают составлять 29–30% от всех заболеваний ЛОР-органов среди стационарных больных [1–3].
Ранее было проведено много исследований по выявлению возбудителей острого и обострения хронического гнойного верхнечелюстного синусита (ГВС). Исследователи обнаруживали аэробную и анаэробную микрофлору, явно патогенную и непатогенную[4]. Нередко обнаруживали различного рода грибы [5]. В конечном итоге сложилось мнение, что при остром ГВС чаще обнаруживают Streptococcus pneumonie, Haemophilus influense, Streptococcus spp., Moraxella сatarrhalis и Staphylococcus аureus. При хроническом ГВС, как правило, обнаруживают те же микроорганизмы, но выявляется и анаэробная флора [6]. Однако основными бактериальными возбудителями ГВС считают S. pneumoniаe и H. influenzae, которые высевают из пазух больных примерно в 70–75% [7]. При этом S. аureus не относят к типичным возбудителям ГВС, т.к. он обычно заселяет преддверие полости носа, являясь сапрофитом [8]. Грибковая флора при хроническом ГВС чаще всего представлена Aspergillus, Fusariumsolani, Dematioceaous [9].
Знание спектра бактериальной или грибковой флоры при ГВС дает возможность выбора и проведения правильной антибактериальной терапии [10]. При этом вышеперечисленных представителей микромира следует рассматривать в качестве ориентира при эмпирическом подборе средств антибактериальной терапии ГВС. Однако, с этиологической точки зрения, причиной развития ГВС не может быть только один микробный патоген, как правило, их бывает несколько, и они усиливают патологическое воздействие друг друга [11].
Также многообразен и сложен патогенез этого заболевания. Несомненна роль аллергии, состояния местного и общего иммунитета в возникновении острого ГВС и формировании его хронических форм [12].
Наряду с общей антибактериальной терапией, включающей, как правило, одну или несколько повторных пункций верхнечелюстной пазухи (ВЧП) для ее освобождения от свободного гноя и для последующего введения антибиотика, предложено множество более объемных способов и методов хирургического лечения различных форм ГВС, включая FESS (Functional Endoscopic Sinus Surgery), которая в ряде стран является «золотым» стандартом лечения многих заболеваний ОНП [13]. При этом все известные хирургические способы лечения ГВС осуществляют с обязательным применением антибиотиков в послеоперационном периоде, что в свою очередь не гарантирует от возникновения рецидива ГВС [14]. К тому же следует добавить, что антибиотики всегда воздействуют на патогенные микробы не только строго локально в очаге воспаления и в послеоперационной полости, но и на уровне организма в целом, нередко приводя к развитию аллергических реакций [15]. Если же антибиотики применяют без учета чувствительности к ним патогенных микробов, то у последних развивается привыкание и повышается резистентность к проводимому лечению, что в свою очередь способствует переходу воспаления из острой стадии в хроническую.
Недостаточная эффективность известных способов хирургического и медикаментозного лечения ГВС диктовала и диктует необходимость поиска современной, безопасной, эффективной и высокотехнологичной терапии этого заболевания.
Достижения современной лазерной медицины позволяют считать, что перечисленным выше требованиям отвечает антимикробная фотодинамическая терапия (АФДТ). Прежде всего, этому способствовало появление новых, в т.ч. и отечественных фотосенсибилизаторов (ФС) и новых источников света (лазеры).
Имеются сведения об эффективном использовании АФДТ в комплексном лечении гнойных ран и трофических язв за счет ее бактерицидного действия и стимулирующего влияния на продукцию цитокинов и факторов роста клеток [16–22].
Эффективность АФДТ проявляется как следствие фотохимической реакции, возникающей в очаге воспаления с образованием синглетного кислорода и других высокоактивных свободных радикалов, оказывающих повреждающее действие на воспаленную ткань и патогенную флору, в результате чего воспаленные клетки и микробы погибают, т.е. осуществляется стерилизация очага воспаления [23, 24]. Подобная фотохимическая реакция становится возможной, когда на ФС, введенный в очаг и вступивший во взаимодействие с клетками микробов и воспаленной ткани, воздействуют лазерным излучением достаточной мощности и длиной волны, совпадающей с пиком поглощения ФС [25, 26]. Селективность разрушения воспаленной ткани и микробных клеток без повреждения окружающих ее здоровых тканей после лазерного воздействия обеспечивается избирательным накоплением ФС именно в этих тканях, в которых идет активная митотическая реакция и вокруг которых создается энергодефицитная зона [27, 28]. Высокая селективность лечебного действия АФДТ оказалась особенно ценным свойством для оториноларингологии, где патологические ткани тесно прилегают к здоровым тканям и жизненно важным органам [29].
Цель исследования: повысить эффективность лечения острых и хронических гнойных верхнечелюстных синуситов с помощью АФДТ.
Материал и методы
В ЛОР-клинике ГБУЗ МОНИКИ им. М.Ф. Владимирского с 2002 по 2017 г. методом АФДТ были пролечены 320 пациентов (основная группа) с острым или обострением хронического ГВС (196 мужчин и 124 женщины в возрасте от 20 до 60 лет). При этом у 302 больных ГВС был односторонним, у 18 больных –_ двухсторонним. Давность заболевания ГВС – от одного года до 12 лет. Однократно АФДТ была проведена 310 больным, а 10 больным – двукратно (табл. 1).
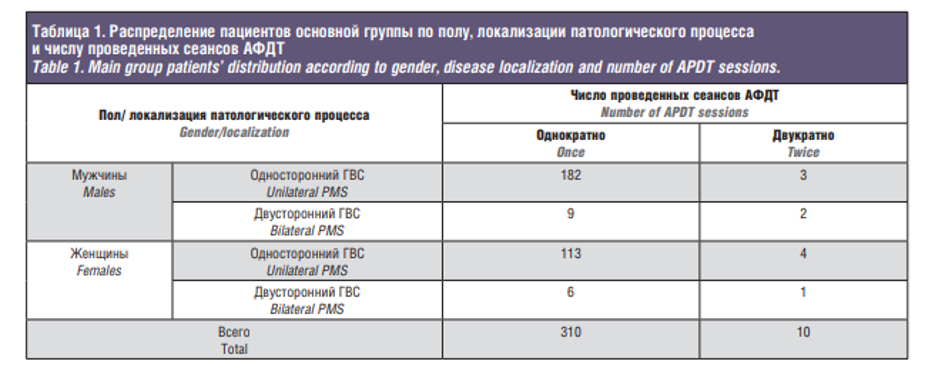
На первом этапе внедрения в клиническую и поликлиническую практику АФДТ (2002–2004), тогда еще нового метода лечения различных форм ГВС (патент на изобретение № 2228775 от 01.10.2002), эмпирическим путем нами были изучены и отработаны тактика проведения сеанса АФДТ, особенности ведения больных в первые 3–5 суток после сеанса АФДТ, показания и противопоказания к применению данного способа лечения. Результаты, полученные после АФДТ у больных ГВС (основная группа), сравнивали с таковыми результатами после лечения различных форм ГВС традиционным способ (контрольная группа).
В основную группу первого этапа исследования вошли 60 пациентов с ГВС в возрасте от 20 до 60 лет (39 мужчин и 21 женщина). Из них одностороннее поражение ВЧП имели 56 больных, двустороннее – 4 человека.
Контрольную группу составили 30 пациентов в возрасте от 18 до 63 лет (17 мужчин, 13 женщин) с ГВС. Из них у 27 больных ГВС был односторонним, а 3 пациента имели двустороннее поражение ВЧП. Длительность заболевания составила от года до 15 лет. В анамнезе 24 (80%) больных имели 3–4 обострения ГВС в год, 6 (20%) пациентов – 1–2 обострения в течение года. Пациентам контрольной группы проводили лечение традиционными комплексными методами, включающими в себя наряду с прочим обязательную антимикробную терапию и, как правило, неоднократно повторяемые пункции ВЧП.
Накопленный нами клинический опыт применения АФДТ уже на первом этапе нашего исследования позволил выработать показания и противопоказания к ее проведению. Прямым показанием к проведению АФДТ стала неэффективность других методов лечения ГВС, включая хирургические. Так, 12 пациентов основной группы (7 мужчин и 5 женщин), несмотря на ранее проведенную гайморотомию, имели рецидивное течение ГВС, а после курса АФДТ мы наблюдали у них стойкую ремиссию заболевания более 3 лет, что было подтверждено микробиологическим контролем и данными динамического клинического наблюдения. Противопоказаниями для проведения АФДТ являлись: возраст до 18 лет, индивидуальная непереносимость ФС или (и) лазерного излучения (рекомендация получена от разработчика Радахлорина), ГВС одонтогенной природы (до ликвидации первопричины заболевания); полипозная форма ГВС. Основанием для двух последних противопоказаний явились результаты собственного наблюдения за больными после АФДТ. Так, 11 пациентов основной группы первого этапа исследования менее чем через 3 месяца после сеанса АФДТ стали предъявлять жалобы на ощущение тяжести в проекции ВЧП, затруднение носового дыхания, слизисто-гнойные выделения из носа, подъем температуры тела до субфебрильных цифр. Позднее, по данным компьютерной томографии (КТ) ОНП и по клиническим данным, у всех этих больных был подтвержден диагноз ГВС, т.е. проведенное нами лечение (АФДТ) оказалось неэффективным. Анализ причин неэффективности АФДТ у этих больных указывал на то, что в 6 случаях (4 мужчины и 2 женщины в возрасте от 25 до 60 лет) клиническое развитие ГВС (до проведения АФДТ) сочеталось с полипозным поражением слизистой оболочки ВЧП, а у 5 больных (4 мужчины и 1 женщина в возрасте от 20 до 56 лет) причиной развития ГВС была одонтогенная патология, не диагностированная на момент проведения сеанса АФДТ. В конечном итоге, после первого этапа клинического применения АФДТ был разработан и усовершенствован способ лечения острых и хронических ГВС, а также показания и противопоказания к его применению.
Описание способа.
ВЧП сначала освобождают от гноя путем ее пункции по стандартной методике (содержимое и смыв из пораженной пазухи берут на микробиологическое исследование), а затем ее промывают физиологическим раствором (пункционная игла Куликовского, шприц 20 мл, раствор физиологический). После того, как промывная жидкость на взгляд становится чистой, пазуху с помощью шприца продувают воздухом, освобождая от оставшейся в ней жидкости. Затем в положении пациента сидя в пазуху вводят 10 мл 0,35% водного раствора Радахлорина, а пункционную иглу извлекают и ватно-мазевым тампоном туго тампонируют средний носовой ход в целях предотвращения вытекания раствора ФС. После этого больного укладывают на одноименный бок в кровать. Таким образом, находясь в горизонтальном положении, больной проводит не менее двух часов, меняя попеременно позу («на боку», «на спине»), не вставая и не поворачиваясь на противоположный бок. Через 2 часа, когда ФС максимально накапливается в поверхностных слоях воспаленной слизистой оболочки пазухи и вступает в адгезию с оставшимися в пазухе микробами, исследуемую пазуху вновь пунктируют, еще раз тщательно промывают физиологическим раствором и продувают. На завершающем этапе процедуры через иглу Куликовского в пазуху вводят кварц-полимерное волокно (световод) с шаровидной индикатрисой свечения на рабочем торце. Последний на 2–3 мм должен выступать из просвета иглы в просвет пазухи. После этого начинают облучать (точнее освечивать) слизистую оболочку пазухи красным лазерным светом, генерируемым медицинским аппаратом «Лахта-Милон» ML500-SP (разработан фирмами ЗАО «МИЛОН ЛАЗЕР» и ООО «СИГМ ПЛЮС», сертификат МЗ РФ – Протокол №4 от 13.06.1996, рег.№ 29/10-679-96). Аппарат генерирует лазерное излучение (видимый красный диапазон спектра, λ — 662±3 нм) с выходной мощностью до 2,5 Вт в непрерывном режиме. Эта длина волны лазерного излучения совпадает с пиком поглощения Радахлорина. Освечивание пазухи начинают с низкого уровня выходной мощности (100–300 мВт) до тех пор, пока у пациента не появляется ощущение легкого или умеренного «покалывания» внутри пазухи. В конечном итоге, манипулируя уровнем мощности (с тенденцией на ее увеличение до 350–400 мВт) и временем светового воздействия на слизистую оболочку, допуская появление у пациента умеренного ощущения жжения или даже болезненности, необходимо в общей сложности получить общую плотность дозы светового воздействия на уровне 2,25–10,0 Дж/см2 . Причем набор необходимого уровня плотности дозы может проходить поэтапно с небольшими перерывами (20–30 секунд), во время которых пазуху продувают, освобождая ее от скапливающейся слизи. В среднем для получения желаемого эффекта от АФДТ в отношении ГВС общее время сеанса составляет 30–60 минут. По окончании сеанса АФДТ световод вместе с иглой Куликовского извлекают, оставляя в пазухе специальную ирригационную дренажную трубку. В последующие 3–5 дней после сеанса АФДТ ежедневно через дренажную трубку осуществляют промывание пазухи стерильным физиологическим раствором, чтобы избежать возникновения асептического воспаления с выраженным гипертензионным синдромом (отек и боль в области пазухи). Как правило, в течение 5–7 дней после АФДТ следует принимать антигистаминные препараты в возрастной дозе в сочетании с сосудосуживающими средствами в виде капель в нос или спрея.
Если же в пазухе не оставляют дренажную трубку, то в последующие 3–5 дней после сеанса АФДТ обязательно ежедневно эту пазуху пунктируют и промывают физиологическим раствором через иглу Куликовского. При последнем промывании пазухи осуществляют бактериологический контроль смыва из промывной жидкости. Подобным образом микробиологическое исследование смывов осуществляют на 3-и, 7-е сутки и через месяц после АФДТ.
На втором этапе клинического исследования (2004–2017), следуя установленным нами правилам отбора больных для проведения АФДТ, мы кардинально повысили эффективность этого способа лечения ГВС, что позволило добиться существенного повышения результатов лечения еще у 260 пациентов (основная группа второго этапа клинического применения АФДТ для лечения ГВС).
Результаты и их обсуждение
Микробиологический анализ смывов из пораженных пазух до сеанса АФДТ показал рост патогенной микрофлоры у 256 (80%) пациентов. Основными возбудителями гнойных гайморитов являлась аэробная флора: H. influenza –18%, S. pneumonia – 13%, Streptococcus группы CFG – 11%, S. aureus – 8%, Klebsiella spp. – 6%, M. cataralis – 5%, и в меньшей степени анаэробная флора (19%). Все выявленные микроорганизмы встречались как в виде монофлоры, так и в ассоциациях. Аэробно-аэробная флора встречалась в большинстве случаев (68%), аэробно-анаэробная флора высевалась реже (26%) и лишь в 6% случаев выявлена анаэробно-анаэробная флора (у пациентов с одонтогенной природой ГВС).
У 64 (20%) больных, у которых смывы из пазух до сеанса АФДТ исходно оказались «стерильными», мы повторно исследовали их на внутриклеточные паразиты по методике полимерной цепной реакции (ПЦР). Так, были выявлены Chlamydia pneumonia, Chlamydia psittaci, Ureaplasma urealyticum и Mycoplasma pneumoniae.
Эффективность АФДТ оценивали через месяц после лечения в соответствии со стандартными критериями ВОЗ, учитывающими динамику патологического процесса и данные микробиологического контроля (табл. 2, 3).
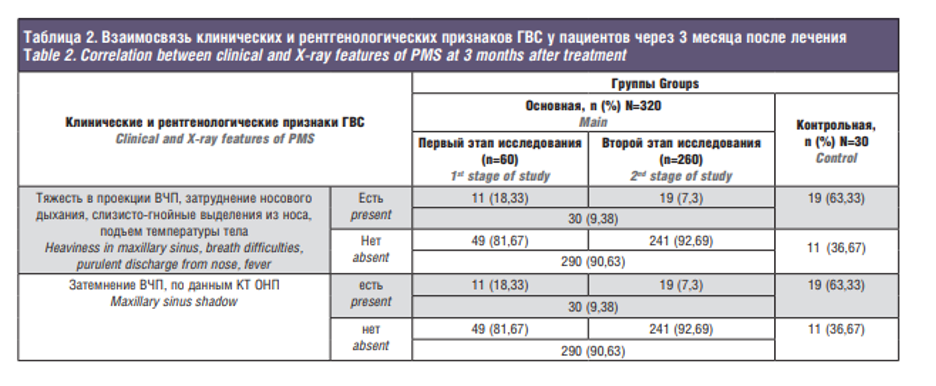
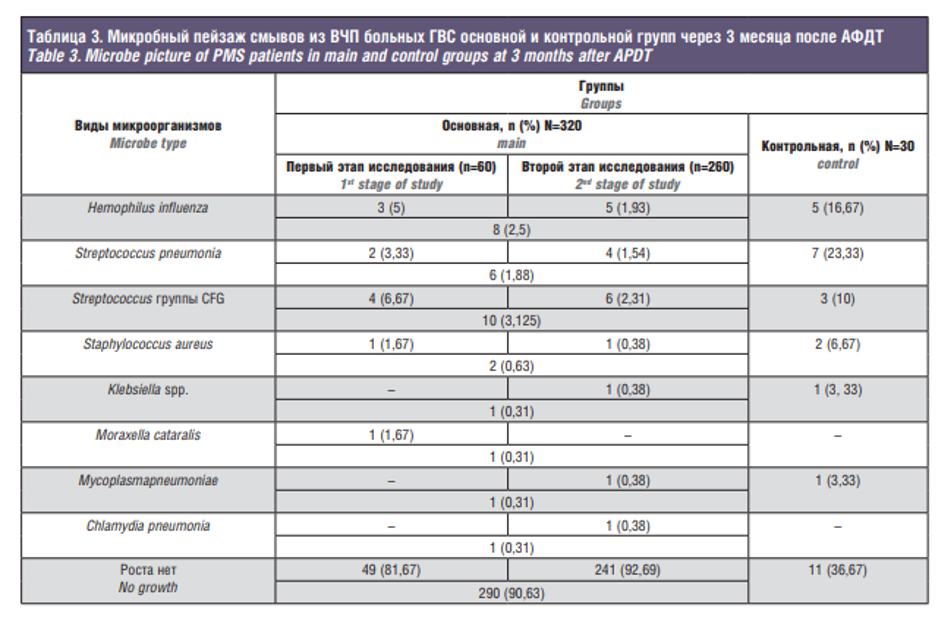
Как видно из табл. 2 и 3, у 49 (81,67%) пациентов основной группы первого этапа исследования и у 241 (92,69%) больного основной группы второго этапа исследования после АФДТ в течение 3 месяцев наблюдали положительные результаты: отсутствие жалоб и клинических признаков ГВС, а также отрицательное 3-кратное микробиологическое исследование смывов из ВЧП. В группе контроля аналогичные результаты лечения имели лишь 11 (36,67%) человек.
Неэффективной АФДТ оказалась у 19 (66,33%) из 30 больных контрольной группы и у 11 (18,33%) из 60 больных основной группы первого этапа клинического исследования. Однако после анализа причин неэффективности АФДТ у больных этой группы на втором этапе клинического применения АФДТ ГВС нам удалось снизить показатель неэффективности до 7,3% (19 из 260 пациентов). Этому способствовало тщательное соблюдение показаний и противопоказаний при отборе пациентов и четкое выполнение способа АФДТ ГВС.
Заключение
Таким образом, при соблюдении показаний и противопоказаний можно с уверенностью констатировать высокую эффективность (свыше 90%) АФДТ острого и обострения хронического воспаления ВЧП по сравнению с традиционными методами лечения. Была определена оптимальная доза лазерной энергии для проведения эффективной АФДТ, которая составляет 2,25–10 Дж/см2 . Микробиологические исследования смывов из ВЧП в динамике показали, что происходит инактивация как грамположительной, так и грамотрицательной бактериальной флоры, а также анаэробов и грибов, что выражается в значительном многократном снижении микробной обсемененности после однократного сеанса АФДТ. Было показано, что проведение повторных сеансов АФДТ не вызывает развития резистентности микробной флоры к лечению и не сказывается отрицательно на здоровье пациентов. Осложнений от АФДТ мы не отмечали.
ЛИТЕРАТУРА
- Аксенова А.В., Брико Н.И., Клейменов Д.А. Хронические фарингиты, назофарингиты, синуситы и риниты – эпидемиологические показатели распространенности и заболеваемости в Москве и Российской Федерации с 1996 по 2009 г. Российская оториноларингология. 2012;2:11–19.
- Попадюк В.И., Фомина А.В., Коршунова И.А., Бицаева А.В. Анализ результатов опроса пациентов с заболеваниями полости носа и околоносовых пазух об организации и качестве специализированной медицинской помощи. Вестник оториноларингологии. 2016;3:23–25.
- Меркулов O.A. Качество жизни больных с патологией ЛОР-органов. Вестник оториноларингологии. 2009;4:54–56.
- Brook I. Microbiology of sinusitis. Proc. Am. Thorac. Soc. 2011;8(1):90–100.
- Алешукина A.B. Медицинская микробиология. Ростов-на-Дону: Феникс. 2003.474 с.
- Изотова Г.Н., Кунельская Н.Л., Туровский А.Б. Острый гнойный синусит: современные представления. Справочник поликлинического врача. 2009;4:58–59.
- Eton V., Schroeter A., Kelly L., et al. Epidemiology of invasive pneumococcal and Haemophilusinfluenzae diseases in Northwestern Ontario, Canada, 2010– 2015. Int. J. Inf. Dis. 2017;65:27–33.
- Thunberg U., Söderquist B., Hugosson S. Bacterial findings in optimised sampling and characterisation of S. aureus in chronic rhinosinusitis. Eur. Arch. Oto-Rhino-Laryngol. 2017;274(1):311–319.
- Туровский А.Б. Значение бактериальной микрофлоры в этиологии и патогенезе хронического синусита. Вестник оториноларингологии. 2008;3:39–41.
- Santee C.A., Nagalingam N.A., Faruqi A.A., et al. Nasopharyngeal microbiota composition of children is related to the frequency of upper respiratory infection and acute sinusitis. Microbiome. 2016;1.4(1):34.
- Pynnonen M.A., Lynn S., Kern H.E., et al. Diagnosis and treatment of acute sinusitis in the primary care setting: A retrospective cohort. Laryngoscope. 2015;125(10):2266–2272.
- Солдатов И.Б. Руководство по оториноларингологии. М., 1997. 607 с.
- Jiam N.T.-L., Goldberg A.N., Murr A.H., et al. Surgical treatment of chronic rhinosinusitis after sinus lift. Am. J. Rhinol. Аallergy. 2017;31(4):271–275.
- Barshak M.B., Durand M.L. The role of infection and antibiotics in chronic rhinosinusitis. Laryngoscope Investigative Otolaryngology. 2017;2(1):36–42.
- Santos V.M. dos, Machado H.S. Antibiotic Allergy: A Clinical Review. J. Allergy Clin. Immunol. Pract. 2017;5(3):577–586.
- Волгин В.Н., Странадко Е.Ф., Кагоянц Р.В. Фотодинамическая терапия базальноклеточного рака ЛОР-органов. Biomedical Photonics. 2013;3:49.
- Странадко Е.Ф., Карабоев У.М., Толстых М.П.Фотодинамическая терапия при гнойных заболеваниях мягких тканей. Хирургия. 2000;9:67–70.
- Исаев В.М. Лазерные технологии в лечении неопухолевых заболеваний в ринологии: Автореф. дисс. д.м.н. М., 2004. 46 с.
- Карпищенко С.А., Рябова М.А., Улупов М.Ю. ФДТ в радикальном лечении начальных стадий рака гортани. Biomedical Photonics. 2012; 1:39–40.
- Лапченко А.С. Фотодинамическая терапия. Области применения и перспективы развития в оториноларингологии. Вестник оториноларингологии. 2015;6:4–9.
- Лапченко А.С., Гуров А.В., Кучеров А.Г. и др. Современные подходы к проведению антимикробной и противовоспалительной фотодинамической терапии в оториноларингологии. Вестник оториноларингологии. 2014;1:60–63.
- Лапченко А.С. Фотодинамическая терапия. Области применения и перспективы развития в оториноларингологии. Вестник оториноларингологии. 2015;6:4–9.
- Логунова Е.В., Егоров В.И., Наседкин А.Н., Русанова Е.В. Опыт и перспективы антимикробной фотодинамической терапии хронического тонзиллита. Российская оториноларингология. 2015;S1:77–80.
- Логунова Е.В.. Клинико-лабораторное обоснование применения фотосенсибилизаторов второго поколения для антимикробной фотодинамической терапии больных с гнойно-воспалительными заболеваниями верхних дыхательных путей. Рос. оториноларингология. 2014;1(68):144–148.
- Странадко Е.Ф., Кулешов И.Ю., Караханов Г.И. Фотодинамическое воздействие на патогенные микроорганизмы (современное состояние проблемы антимикробной фотодинамической терапии). Лазерная медицина. 2010;14:52–56.
- Решетников А.В. Фотосенсибилизаторы в современной клинической практике. Материалы научно-практической конф. оториноларинголого0в ЦФО РФ «Лазерные технологии в оториноларингологии». Тула. 2007. С. 153–166.
- Исаев В.М., Егоров В.М., Наседкин А.Н., Мустафаев Д.М., Исаев Э.В. Лечение хронического верхнечелюстного синусита с помощью фотодинамической терапии. Лазерная медицина. 2014;4:52–53.
- Наседкин А.Н. Лазеры в оториноларингологии. М., 2000. 140 c.
- Наседкин А.Н., Грачев Н.С., Логуова Е.В., Русанова Е.В. Антимикробная фотодинамическая терапия заболеваний уха, горла и носа. Biomedical Photonics. 2013;3:59–60.
Поступила 10.01.18
Принята в печать 20.03.18
REFERENCES
- Aksenova A.V., Brico N.I., Kleimenov D.A. Chronic pharyngitis, nasopharyngitis, sinusitis and rhinitis – epidemiological indicators of prevalence and incidence in Moscow and the Russian Federation from 1996 to 2009. Rossijskaja otorinolaringologija. 2012; 2:11–19 (In Russ.).
- Popadyuk V.I., Fomina A.V., Korshunova I.A., Bitsaeva A.V. Analysis of the results of a survey of patients with diseases of the nasal cavity and paranasal sinuses on the organization and quality of specialized medical care. Vestnik otorinolaringologii. 2016; 3: 23–25 (In Russ.).
- Merkulov O.A. Quality of life of patients with pathology of ENT organs. Vestnik otorinolaringologii. 2009;4:54–56 (In Russ.).
- Brook I. Microbiology of sinusitis. Proc Am Thorac Soc. 2011;8(1):90–100. 5. Aleshukina A.V. Medical microbiology. Rostov-on-Don: Phoenix. 2003.474 p. (In Russ.)
- Izotova G.N., Kunelskaya N.L., Turovsky A.B. Acute purulent sinusitis: current view. Spravochnik poliklinicheskogo vracha. 2009; 4: 58–59 (In Russ.).
- Eton V., Schroeter A., Kelly L., et al. Epidemiology of invasive pneumococcal and Haemophilusinfluenzae diseases in Northwestern Ontario, Canada, 2010– 2015. Int. J. Inf. Dis. 2017;65:27–33.
- Thunberg U., Söderquist B., Hugosson S. Bacterial findings in optimised sampling and characterisation of S. aureus in chronic rhinosinusitis. European Archives of Oto-Rhino-Laryngology. 2017;274(1):311–319.
- Turovsky A.B. The importance of bacterial microflora in the etiology and pathogenesis of chronic sinusitis. Vestnik otorinolaringologii. 2008; 3: 39–41 (In Russ.).
- Santee C.A., Nagalingam N.A., Faruqi A.A., et al. Nasopharyngeal microbiota composition of children is related to the frequency of upper respiratory infection and acute sinusitis. Microbiome. 2016;1.4(1):34.
- Pynnonen M.A., Lynn S., Kern H.E., et al. Diagnosis and treatment of acute sinusitis in the primary care setting: A retrospective cohort. Laryngoscope. 2015;125(10):2266–2272.
- Soldatov I.B. Manual on otorhinolaryngology. M .: Medicine. 1997. 607 p. (In Russ.)
- Jiam N.T.-L., Goldberg A.N., Murr A.H., et al. Surgical treatment of chronic rhinosinusitis after sinus lift. Am J Rhinol Аallergy. 2017;31(4):271–275.
- Barshak M.B., Durand M.L. The role of infection and antibiotics in chronic rhinosinusitis. Laryngoscope Investigative Otolaryngology. 2017; 2(1):36–42.
- Santos V.M. dos, Machado H.S. Antibiotic Allergy: A Clinical Review. J. Allergy Clin.Immunol. Pract. 2017;5(3):577–586.
- Volgin V.N., Stranadko E.F., Kagoyants R.V. Photodynamic therapy of basal cell carcinoma of the LOR organs. Biomedical Photonics. 2013; 3: 49 (In Russ.).
- Stranadko E.F., Karaboev U.M., Tolstykh M.P. Photodynamic therapy for purulent diseases of soft tissues. Surgery. 2000; 9: 67–70 (In Russ.).
- Isaev V.M. Laser technologies in the treatment of non-tumor diseases in rhinology: Abstract. diss. Doc. med. sciences. M., 2004. 46 pp. (In Russ.).
19.Karpishchenko S.A., Ryabova M.A., Ulupov M.Yu. PDT in the radical treatment of the initial stages of laryngeal cancer. Biomedical Photonics. 2012; 1: 39–40 (In Russ.).
- Lapchenko A.S. Photodynamic therapy. Areas of application and development prospects in otorhinolaryngology. Vestnik otorinolaringologii. 2015; 6: 4–9 (In Russ.).
- Lapchenko A.S., Gurov A.V., Kucherov A.G., et al. Modern approaches to the conduct of antimicrobial and anti-inflammatory photodynamic therapy in otorhinolaryngology. Vestnik otorinolaringologii. 2014;1: 60–63 (In Russ.).
- Lapchenko A.S. Photodynamic therapy. Areas of application and development prospects in otorhinolaryngology. Vestnik otorinolaringologii. 2015; 6:4–9 (In Russ.).
- Logunova E.V., Egorov V.I., Nasedkin A.N., Rusanova E.V. Experience and prospects of antimicrobial photodynamic therapy of chronic tonsillitis. Rossijskaja otorinolaringologija. 2015;S1:77–80 (In Russ.).
- Logunova E.V. Clinical and laboratory substantiation of second generation photosensitizers application for antimicrobial photodynamic therapy of patients with purulent-inflammatory diseases of the upper respiratory tract. Rossijskaja otorinolaringologija. 2014;1(68): 144–148 (In Russ.).
- Stranadko E.F., Kuleshov I.Yu., Karakhanov G.I. Photodynamic effect on pathogenic microorganisms (current state of the problem of antimicrobial photodynamic therapy). Lazernaja medicina. 2010;14:52–56 (In Russ.).
- Reshetnikov A.V. Photosensitizers in modern clinical practice. Materials of scientific and practical conf. otorhinolaryngologists of the Central Federal District of Russia “Laser technologies in otorhinolaryngology”. Tula. 2007. P. 153–166 (In Russ.).
- Isaev V.M., Egorov V.M., Nasedkin A.N., Mustafayev D.M., Isaev E.V. Treatment of chronic maxillary sinusitis with the help of photodynamic therapy. Lazernaja medicina. 2014;4:52–53 (In Russ.).
- Nasedkin A.N. Lasers in otorhinolaryngology. M.: Engineering. 2000. 140 c. (In Russ.). 29. Nasedkin A.N., Grachev N.S., Logunova E.V., Rusanova E.V. Antimicrobial photodynamic therapy of ear, throat and nose diseases. Biomedical Photonics. 2013;3:59–60 (In Russ.).
Received 10.01.18
Accepted 20.03.18
Сведения об авторах:
В.М. Исаев – д.м.н., проф. кафедры оториноларингологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, Москва, Россия; тел. 8 (495) 631-72-43
А.Н. Наседкин– д.м.н., проф. кафедры оториноларингологии ГБУЗ МО МО ИКИ им. М.Ф. Владимирского, Москва, зав. кафедрой оториноларингологии, Институт медико-социальных технологий МГУПП, Москва, Россия; тел.: 8 (495) 631-08-01
В.И. Егоров – д.м.н., проф., зав. кафедрой оториноларингологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, Москва, Россия; тел.: 8 (495) 631-33-45
О.И. Залевская – генеральный директор ООО «РАДА-ФАРМА», Москва, Москва Э.В. Исаев – врач-оториноларинголог ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, Москва, Россия; тел.: 8 (495) 631-08-01, e-mail: eldarlor@ gmail.com
О.М. Пустовит – очный аспирант кафедры оториноларингологии ФУВ ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, Москва, Россия; тел.: 8 (495) 631-08-01, e-mail: olga_pustovit@bk.ru
И.С. Фетисов – ассистент кафедры оториноларингологии МГУПП Институт медико-социальных технологий, Москва, Россия
About the authors:
V.M. Isaev – MD, Professor of Otorhinolaryngology department, SBIH Moscow regional research clinical institute n.a. M.F. Vladimirskiy. Moscow, Russia; tel. 8(495) 631-08-01
A.N. Nasedkin – MD, Professor of Otorhinolaryngology department, SBIH Moscow regional research clinical institute n.a. M.F. Vladimirskiy. Moscow, Russia; tel. 8(495) 631-08-01
V.I. Egorov – MD, Professor, head of Otorhinolaryngology department, SBIH Moscow regional research clinical institute n.a. M.F. Vladimirskiy. Moscow, Russia; tel. 8(495) 631-08-01
V.I. Zalevskaya– General Director LLB «Rada-Farma», Moscow
E.V. Isaev – MD, doctor of Otorhinolaryngology department, SBIH Moscow regional research clinical institute n.a. M.F. Vladimirskiy. Moscow, Russia; tel. 8(495) 631-08-01, e-mail: eldarlor@gmail.com
O.M. Pustovit – post-graduate student of Otorhinolaryngology department, SBIH Moscow regional research clinical institute n.a.
M.F. Vladimirskiy. Moscow, Russia; tel. 8(495) 631-08-01. e-mail: olga_pustovit@bk.ru I.S. Fetisov – assistent of Otorhinolaryngology department, The Institute of medical and social technologies of FGBOU VPO MGUPP, Moscow, Russia
