Для цитирования: Карпищенко С.А., Черебилло В.Ю., Шумилова Н.А., Пузаков Н.С., Станчева О.А., Данилова Д.М. Особенности диагностики и лечения низкодифференцированной синоназальной карциномы, клинический пример. Голова и шея Head and neck Russian Journal. 2019;7(2):42–51
For citation: Karpischenko S.A., Cherebillo V.Yu., Shumilova N.A., Puzakov N.S., Stancheva O.A., Danilova D.M. Features of low-grade synonasal carcinoma diagnosis and treatment: clinical case. Head and neck Russian Journal. 2019;7(2):42–51 (in Russian).
Doi: 10.25792/HN.2019.7.2.42–51
Введение.
Около 90% всех злокачественных опухолей переднего отдела основания черепа составляет рак полости носа и околоносовых пазух различного происхождения. Нередко первичными проявлениями опухолевого процесса могут служить затяжные бактериальные риносинуситы, характеризующиеся односторонним типом поражения полости носа. Важным диагностическим этапом постановки диагноза «новообразование синоназальной области» является мультиспиральное или конусно-лучевое компьютерное исследование околоносовых пазух в период купирования клинических симптомов. Окончательный диагноз устанавливается на основании биопсии обнаруженного мягкотканного образования с неровными контурами и контактным кровотечением. Однако лишь в 80% случаев устанавливается правильный гистологический диагноз, что связано с особенностями гистологической формы заболевания, локализацией процесса, степенью дифференцировки опухоли и качества забора материала. При локализации неопластического процесса в ольфакторной зоне, необходимо выполнять тщательную дифференциальную диагностику между нейроэктодермальными образованиями и низкодифференцированными синоназальными опухолями. Точность постановки гистологического диагноза сопряжена с различиями в тактике лечения больных с учетом типа новообразования и прогнозами пятилетней выживаемости.
Клинический случай: На примере пациентки с низкодифференцированной синоназальной карциномой, находившейся на лечении в отделении оториноларингологии с клиникой ПСПбГМУ им. акад. И.П. Павлова проанализированы трудности диагностики и особенности верификации типа опухолевого процесса на основании клинико-лабораторных данных. Впервые заподозрить наличие неопластического процесса в полости носа удалось с использованием конусно-лучевой компьютерной томографии в период между рецидивирующими риносинуситами. Наличие дефекта в области ситовидной пластинки левой половины полости носа, эндоскопическая картина, имитирующая полипозные разрастания слизистой оболочки, послужили показаниями для биопсии образования. Первичная гистологическая оценка подтвердила диагноз эстезионейробластомы. Совместно с нейрохирургической бригадой новообразование было полностью удалено, что не сопровождалось назальной ликвореей и не потребовало пластики дефекта ситовидной пластинки. Широкая интраоперационная биопсия выявила наличие в препарате низкодифференцированной синоназальной карциномы, что потребовало последующего химиолучевого лечения.
Выводы. Рецидивирующие односторонние воспалительные поражения полости носа и околоносовых пазух необходимо исследовать на предмет неопластических изменений. При постановке диагноза следует учитывать клинико-морфологическую картину заболевания. Первичная инцизионная биопсия новообразований полости носа должна подтверждаться повторным морфологическим исследованием в ходе радикального иссечения опухоли. Ключевые слова: эндоскопия, риносинусит, эстезионейробластома, низкодифференцированная синоназальная карцинома
Авторы заявляют об отсутствии конфликта интересов. Источник финансирования. Не указан.
Для цитирования: Карпищенко С.А., Черебилло В.Ю., Шумилова Н.А., Пузаков Н.С., Станчева О.А., Данилова Д.М. Особенности диагностики и лечения низкодифференцированной синоназальной карциномы, клинический пример. Голова и шея Head and neck Russian Journal. 2019;7(2):42–51
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Introduction: About 90% of all malignant tumors of the skull anterior base are presented by nasal cavity carcinomas or paranasal sinuses cancer. Frequently, prolonged bacterial rhinosinusitis with unilateral opacification can be the primary manifestation of a neoplastic process. An important diagnostic method for sinonasal malignancy identification is a computed tomography of the paranasal sinuses. The diagnosis can be confirmed by the biopsy taken from the nasal cavity tissue with uneven contours and contact bleeding. However, only 80% of the cases are correctly confirmed histologically due to the specifics of morphological types of the disease, the localization of lesions, the tumor differentiation grade, and the quality of the sampling material. If the neoplastic process is localized in the olfactory area, it is necessary to perform a thorough differential diagnosis between neuroectodermal lesions and undifferentiated sinonasal tumors since the histological diagnosis accuracy greatly influences the patients’ treatment strategy and the 5-year survival prognosis. Clinical case: female patient with an undifferentiated sinonasal carcinoma underwent treatment at the Department of Otorhinolaryngology of the First State Medical University, St. Petersburg. The main difficulties of diagnosis and verification were analyzed based on clinical and laboratory data. The neoplastic process in the nasal cavity was suspected for the first time only during the remission between relapsed acute rhinosinusitis with the use of cone-beam computed tomography. The main indications for biopsy were: the existence of a defect on the left cribriform plate of the nasal cavity and the endoscopic picture with an polyp-like lesions. Primary histology confirmed the diagnosis of esthesioneuroblastoma. Complete removal of the lesion was not complicated by nasal liquorrhea and did not require plastic repair of the cribriform plate. An intraoperative biopsy revealed low-grade sinonasal carcinoma, which required subsequent chemoradiation therapy.
Conclusion: Recurrent unilateral inflammation of the nasal cavity and paranasal sinuses should be differentiated with the neoplastic process that must be morphologically confirmed.
Key words: endoscopy, rhinosinusitis, esthesioneuroblastoma, undifferentiated sinonasal carcinoma The authors declare no conflict of interest. Source of financing: not specified.
For citation: Karpischenko S.A., Cherebillo V.Yu., Shumilova N.A., Puzakov N.S., Stancheva O.A., Danilova D.M. Features of low-grade synonasal carcinoma diagnosis and treatment: clinical case. Head and neck Russian Journal. 2019;7(2):42–51 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients.
Злокачественные новообразования полости носа и околоносовых пазух составляют 1–4% от числа всех злокачественных новообразований. Поражение обонятельной зоны полости носа наблюдается как при развитии нейроэктодермальных поражений, так и низкодифференцированных синоназальных карцином.
Впервые ольфакторная нейробластома была описана L. Berger, G. Luc, D. Richard в 1924 г., и с тех пор в мировой литературе приводится большое количество наблюдений опухоли, преимущественно у пациентов в возрасте 20–40 лет [1]. Опухоль берет начало из обонятельного нейроэпителия и имеет недифференцированные нейроэктодермальные структуры. Обонятельный эпителий уникален в нервной системе организма тем, что способен к регенерации. Гистологическое строение обонятельного органа отражает эту способность. В обонятельном эпителии присутствует несколько типов клеток: зрелые обонятельные нейроэпителиальные клетки, базальный слой стволовых клеток, которые населяют дифференцированный эпителий, сустентакулярные опорные клетки и плоские клетки, образующие протоки Боумана в собственной обонятельной пластинке [2]. Эти типы клеток тесно связаны и образуются из общей клетки-предшественника во время восстановления после повреждения эпителия [3]. Согласно морфологическому строению, выделяют три типа обонятельной нейробластомы: эстезионейробластому, эстезионейроцитому и эстезионейроэпителиому [4]. Наиболее часто опухоль берет свое начало в полости носа (65%), из клеток решетчатого лабиринта (29%), верхнечелюстной пазухи (3,8%), клиновидной пазухи (0,75%), носоглотки и интракраниально (по 0,75%) среди всех случаев развития ольфакторной нейробластомы [5].
Для клинического стадирования эстезионейробластомы использовался ряд классификаций: по S. Kadish [6], A. Morita и соавт. [7] [8] и по P. Dulguerov [9]. Согласно последней, T1 стадия устанавливается, когда опухоль вовлекает в процесс полость носа и/или околоносовые пазухи (исключая основную пазуху) и поражает самые верхние отделы клеток решетчатого лабиринта, T2-опухоль вовлекает полость носа и околоносовые пазухи (включая основную пазуху) с инвазией или эрозией ситовидной пластинки, T3-опухоль выступает в область орбиты либо в область передней черепной ямки без инвазии в оболочки головного мозга, T4-опухоль вовлекает головной мозг; N0 – нет метастазов в шейные лимфатические узлы, N1 – любой вид поражения шейных лимфатических узлов, M0 – без метастазов, M1 – отдаленные метастазы. Частота рецидивирования заболевания увеличивается в соответствии со степенью опухолевого поражения и варьируется от 8 до 36% [5].
Основным методом в лечении ольфакторной эстезионейробластомы является хирургическое лечение с или без лучевой терапии. Превентивное облучение регионарных лимфатических узлов снижает риск рецидива у пациентов с N0 стадией [5]. Поэтому операция, сопровождающаяся лучевой терапией, рассматривается в большинстве лечебных центров как «золотой стандарт» лечения ольфакторной эстезионейробластомы. Эффективность неоадъювантной или адъювантной химиотерапия остается неизвестной, а актуальность регионарной лимфодиссекции или лучевой терапии является спорной [3].
Дифференциальная диагностика ольфакторной эстезионейробластомы должна проводиться с синоназальной недифференцированной карциной, синоназальной нейроэндокринной карциномой, мелкоклеточной карциномой, аденомой гипофиза, меланомой, лимфомой и рабдомиосаркомой [3]. Существует ряд факторов, которые усложняют диагностику ольфакторной нейробластомы: во-первых, опухоль очень редкая, составляет примерно 2% всех злокачественных синоназальных опухолей; во-вторых, гистологически опухоль трудно отличить от ряда других новообразований; в-третьих, сама нейробластома может обладать переменной биологической активностью – от относительно индолентного до локально агрессивного и метастатического роста [3]. Единственная система гистологических градаций, применимая к ольфакторной нейробластоме, была предложена V.J. Hyams в 1988 г. на основе опыта Института патологии Вооруженных сил [10]. Эта система классифицирует каждый случай ольфакторной эстезионейробластомы в одну из четырех степеней, начиная от хорошо дифференцированных (I) до наименее дифференцированных (IV), и основана на структуре опухоли, клеточном плеоморфизме, наличии нейрофибриллярного матрикса и розеток, митотической активности и наличии некроза или кальцификации [3].
Клинический случай
Больная 1963 г. рождения поступила в отделение оториноларингологии в апреле 2017 г. с диагнозом: «острый гнойный полисинусит» и жалобами на гнойные выделения из носа, боль в проекции лобного синуса слева, заложенность носа, повышение температуры до 37,2 °С. Указанные жалобы возникли остро и беспокоили пациентку в течение 2 недель. Из анамнеза известно, что женщина страдала рецидивирующими синуситами в течение года, проходила курсы консервативного лечения (системная антибактериальная терапия, топические кортикостероиды) с временным эффектом. В анализе крови при поступлении в стационар отмечен лейкоцитоз 11,5×109 /л, нейтрофилия 74,3%, увеличение СОЭ до 19 мм/час. По данным представленных рентгенологических снимков выявлено затенение верхнечелюстных пазух с двух сторон с наличием признаков уровня содержимого, снижение пневматизации лобного синуса и клиновидной пазухи слева. Эндоскопически на фоне признаков гнойного воспалительного процесса в полости носа выявлен патологический процесс в верхнем носовом ходе слева, расцененный как полиповидные изменения. При пункции верхнечелюстных пазух с двух сторон получено гнойное отделяемое. В течение 6 дней получала консервативное лечение, включающее системную антибактериальную терапию (цефтриаксон), инфузионную противоотечную терапию с дексаметазоном, местное лечение (промывание верхнечелюстных пазух растворами антисептических средств).
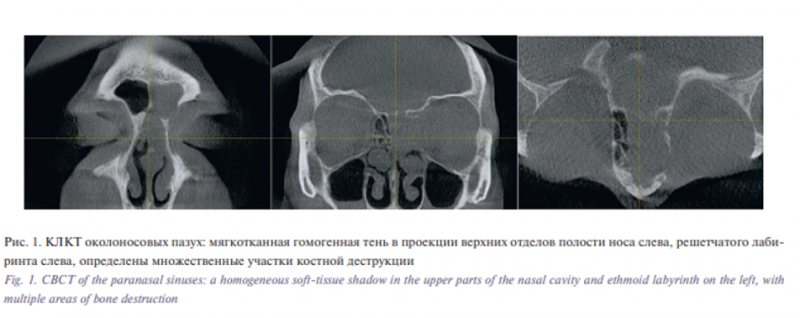
На фоне лечения отмечена положительная клиническая динамика, однако в связи с сохранением болевого синдрома в проекции лобной пазухи слева с иррадиацией в медиальный край глазницы выполнена конусно-лучевая компьютерная томография (КЛКТ) околоносовых пазух (рис. 1).
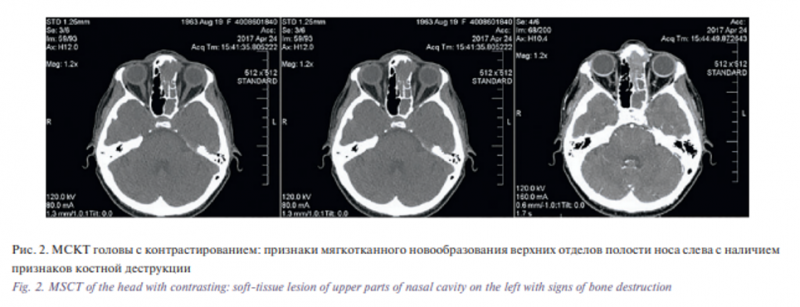
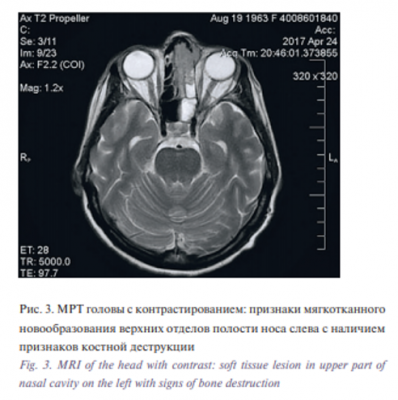
По результатам КЛКТ выявлена мягкотканная гомогенная тень в проекции верхних отделов полости носа слева, решетчатого лабиринта слева, определены множественные участки костной деструкции (ситовидной пластинки решетчатой кости в передних отделах, участков слезной кости и лобного отростка верхней челюсти слева), отмечено распространение в область левой лобной пазухи с тотальным ее заполнением и частичной деструкцией ее стенки в области глазничного края лобной кости, затемнение левой клиновидной пазухи. Проведена спиральная компьютерная томография (МСКТ) околоносовых пазух носа (рис. 2) и магнитно-резонансная томография (МРТ) головы (рис. 3) с внутривенным контрастированием, по результатам которых подтвердилось наличие признаков мягкотканного новообразования верхних отделов полости носа слева, левого решетчатого лабиринта, левой лобной и основной пазух с наличием признаков деструкции медиальной стенки левой орбиты, основания черепа слева и возможным поражением передних отделов левой лобной доли в области прямой извилины и обонятельной борозды. Выполнен рентген грудной клетки, больная осмотрена терапевтом, неврологом, офтальмологом: изменений со стороны легких, неврологической симптоматики и патологии со стороны органа зрения не выявлено.
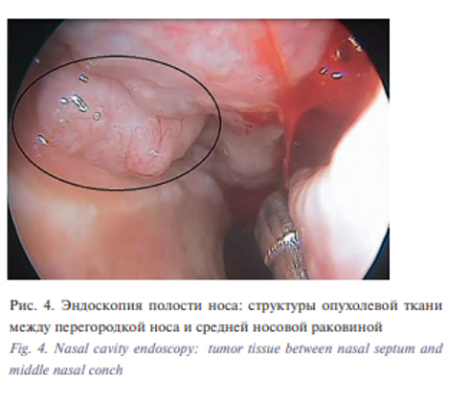
В ходе эндоскопии образования верхних отделов полости носа слева выявлено, что пространство под средней носовой раковиной слева свободно, при отведении средней носовой раковины латерально визуализировано белесоватое мелкобугристое новообразование, распространяющееся вдоль всей средней носовой раковины медиальнее ее (рис. 4).
Произведено вскрытие клеток решетчатого лабиринта щипцами Блэксли, получен гной, кусочки образования из передних и задних отделов верхнего носового хода отправлены на гистологическое исследование, по результатам которого верифицирована ольфакторная нейробластома.
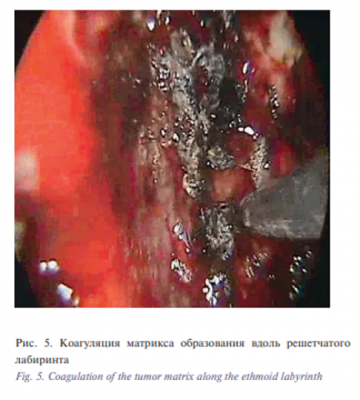
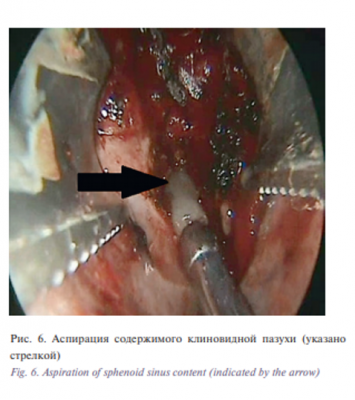
Злокачественное новообразование полости носа удалено в условиях общего эндотрахеального обезболивания с участием нейрохирурга под контролем электромагнитной навигационной станции. Интраоперационно установлено, что новообразование исходит из средних отделов решетчатого лабиринта слева, заполняет верхние отделы полости носа слева, прорастает среднюю носовую раковину, частично достигает передней стенки клиновидной пазухи. В ходе операции резецирована проросшая опухолью средняя носовая раковина, посредством шейвера и коагуляции удалены массы опухоли из полости носа и клеток решетчатого лабиринта, монополярным каутером коагулирован матрикс образования вдоль решетчатого лабиринта (рис. 5). Установлено, что опухоль блокировала отток из задних отделов решетчатого лабиринта, клетки которого санированы. Выполнена коагуляция слизистой оболочки над клиновидной пазухой, вскрыта полость пазухи, аспирировано застойное содержимое (рис. 6).
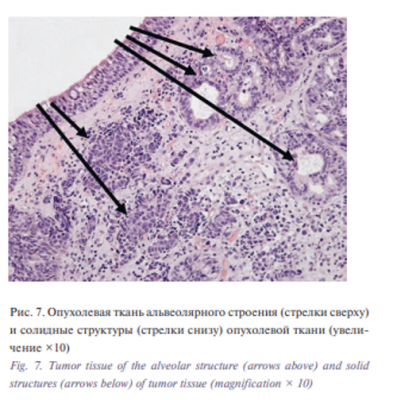
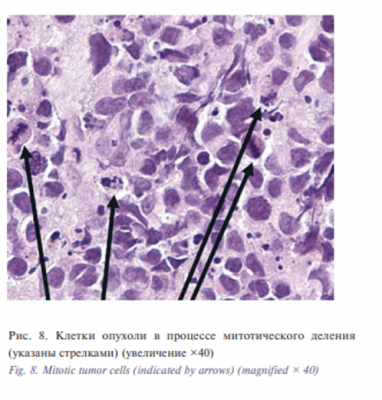
При гистологическом исследовании диагностирована низкодифференцированная карцинома (рис. 7, 8) с чертами нейроэндокринной дифференцировки с высокой пролиферативной активностью (по Ki-67 около 50% клеток опухоли) (рис. 9).
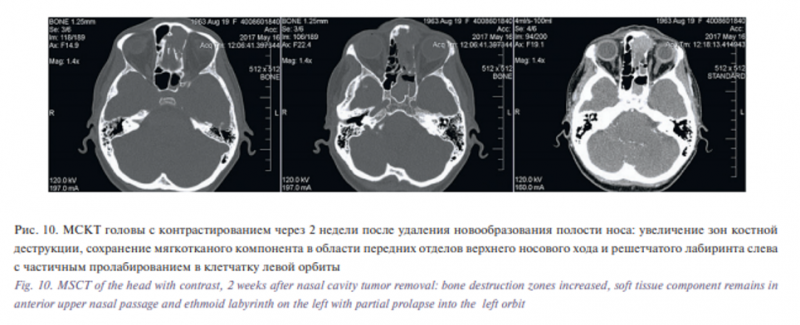
В связи с изменением гистологического диагноза проведена контрольная МСКТ околоносовых пазух носа и орбит в условиях внутривенного болюсного контрастного усиления, по результатам которого выявлено увеличение зон костной деструкции лобного отростка лобной кости, левой слезной кости, клеток решетчатого лабиринта слева, медиальной стенки левой орбиты, задней стенки левой лобной пазухи, сохранение мягкотканного компонента в области передней черепной ямки, передних отделов верхнего носового хода и решетчатого лабиринта слева, с тотальным заполнением левой лобной пазухи, частичным пролабированием в клетчатку левой орбиты (рис. 10).
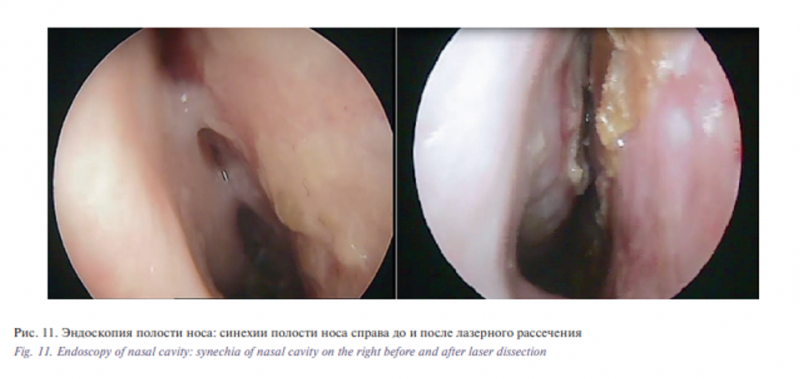
При дообследовании (ультразвуковое исследование шеи и брюшной полости, компьютерная томография брюшной полости) значимых изменений не выявлено. В течение месяца больная получала курс дистанционной лучевой терапии с суммарной дозой 60 Гр, в течение последующих 6 месяцев – 4 курса химиотерапевтического лечения цисплатином, на фоне чего отмечен регресс образования. В отдаленном периоде через 3 месяца после окончания лечения выявлены синехии полости носа справа, что потребовало лазерного рассечения в условиях местной анестезии (рис. 11).
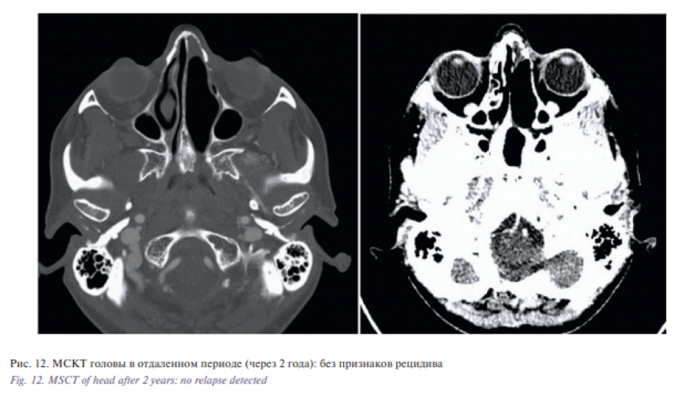
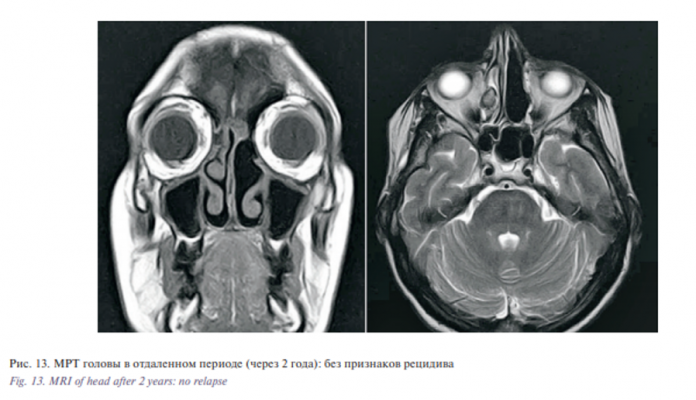
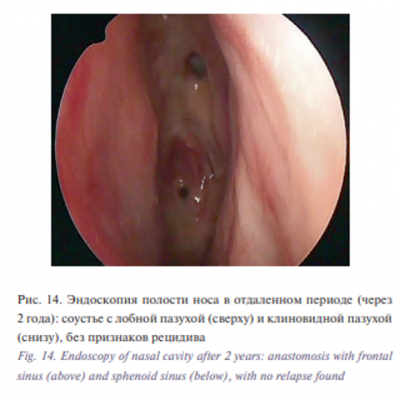
К настоящему моменту срок наблюдения за больной составил 2 года с момента установления диагноза. На контрольных МСКТ (рис. 12) и МРТ (рис. 13) околоносовых пазух и орбит, а также при эндоскопии полости носа (рис. 14) признаков рецидива образования не выявлено.
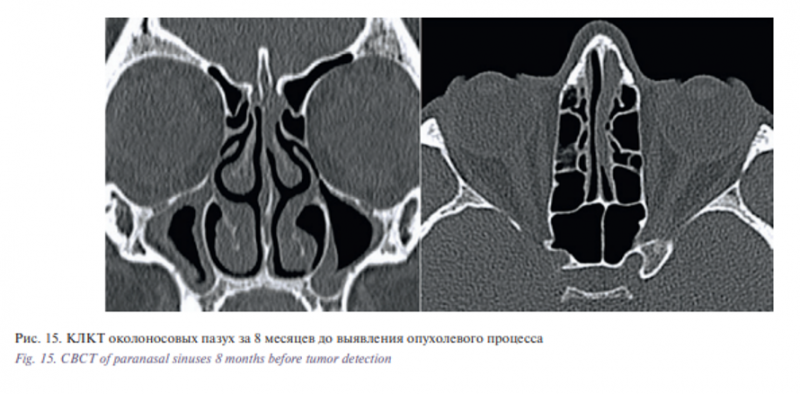
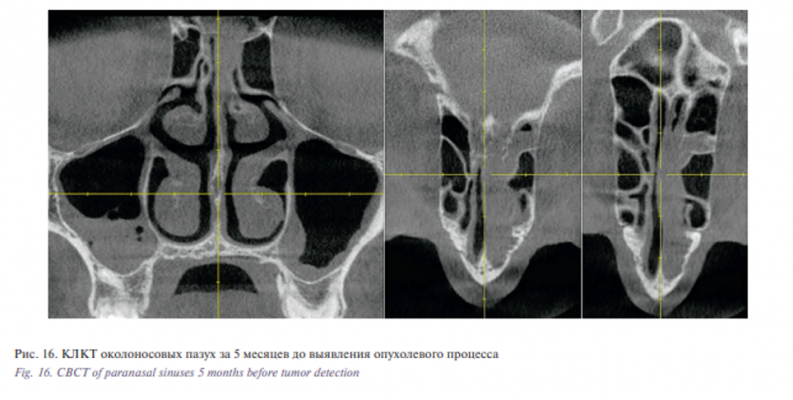
Проведен ретроспективный анализ компьютерных томограмм, выполненных трижды в течение года до установления онкологического заболевания (за 12, 8 и 5 месяцев). На фоне признаков двустороннего верхнечелюстного синусита за 8 месяцев до выявления опухолевого процесса впервые отмечено затенение верхнего носового хода слева с признаками деструкции ситовидной пластины (рис. 15), за 5 месяцев – расширение зоны деструкции и области затенения верхних отделов полости носа слева (рис. 16). Описания результатов рентгенологических исследований врачами-рентгенологами не проводилось.
Обсуждение
Как минимум 90% от всех злокачественных опухолей переднего отдела основания черепа составляют карциномы полости носа и околоносовых пазух. Единственным проявлением опухолевого процесса в верхних отделах полости носа может служить снижение обоняния, а при одностороннем процессе течение заболевания на ранних этапах развития может не иметь клинической симптоматики. В нашем клиническом случае признаки развития опухолевого процесса в виде затенения верхнего носового хода с деструкцией ситовидной пластинки рентгенологически наблюдались за 5 и 8 месяцев до установления диагноза. Оценка результатов томограмм проводилась врачами-оториноларингологами, которые не выявили признаков костной деструкции. Отсутствие описания томограмм врачомрентгенологом привело к неправильной интерпретации выявленных изменений в пользу хронического воспалительного процесса в околоносовых пазухах, что послужило причиной поздней диагностики опухолевого процесса.
Согласно гистологическому исследованию биопсийного материала диагностирована ольфакторная нейробластома. Однако по результатам исследования материала после удаления новообразования полости носа, патологический процесс верифицирован как плоскоклеточная карцинома, требующая другой лечебной тактики.
Ошибочная верификация опухолевого процесса как ольфакторной нейробластомы в нашем случае привела к тому, что хирургическое лечение оказалось неэффективным и стимулировало процессы костной деструкции, по данным контрольной МСКТ околоносовых пазух и орбит.
Удаленный массив опухоли гистологически соответствовал низкодифференцированной синоназальной карциноме (НСК), которая является редкой агрессивной злокачественной опухолью, поражающей полость носа и околоносовые пазухи. H.F. Frierson и соавт. впервые описали эту опухоль в 1986 г., предполагая ее происхождение из эпителия Шнайдера. Считается, что синоназальная карцинома является эпителиальным новообразованием с неопределенным гистогенезом с или без нейроэндокринной дифференциации, а также без признаков плоскоклеточной или железистой дифференцировки [11]. Синоназальные опухоли с нейроэндокринной дифференцировкой являются гетерогенными образованиями нейроэктодермального и эпителиального происхождения, включают в себя ольфакторные нейробластомы и нейроэндокринные карциномы. [12]. Ранее НСК относилась к группе ольфакторных нейробластом, ряд авторов относили ее к неклассифицированным опухолям ввиду отсутствия соответствия необходимым критериям [13]. Были выявлены некоторые доказательства нейроэндокринной дифференциации в НСК, однако к группе нейроэндокринных опухолей она так и не относится [14]. Микроскопически НСК состоит из гнездовидных, дольчатых, трабекулярных и листоподобных клеток среднего размера, не имеющих дифференцировки. Эти клетки без признаков железистой или плоскоклеточной дифференцировки обладают гиперхромными ядрами круглой или овальной формы, слабо развитой эозинофильной цитоплазмой, имеют много фигур митоза, зоны некроза, обладают четко очерченными границами, характеризуются экспрессией цитокератинов, эпителиального мембранного антигена, иногда нейрон-специфической энолазы. Сохранившийся поверхностный эпителий может иметь черты выраженной дисплазии или карциномы in situ [11].
Иммуногистохимические маркеры имеют решающее значение в диагностике НСК. У большинства пациентов с НСК определяется положительная реакция на эпителиальные маркеры, такие как панцитокератины (AE1/AE3) [15], низкомолекулярные цитокератины и простые кератины (СК 7, 8 и 19) [16]. Как правило, на цитокератины 5, 6 и 14 у данных пациентов реакция отрицательная, что очень важно при дифференциации НСК от плоскоклеточного рака, который экспрессируют цитокератины 5/6 и 13 [17] . Кроме того, обычно НСК положительна на предмет носительства Эпштейна–Барр вирусной инфекции [18]. Выявлена зависимость заболевания НСК от пола: соотношение мужчин и женщин по распределению патологии составило 2–3:1. Возрастная зависимость варьируется от 3-й до 9-й декады жизни. В свою очередь медиана заболеваемости составляет 50–60 лет [16]. НСК, как правило, выявляется на этапе экзофитного роста с вовлечением прилежащих структур основания черепа. P.Y. Musy и соавт. в своем исследовании определили, что у 50% пациентов с верифицированным диагнозом отмечалась инвазия в твердую мозговую оболочку, а у 30% опухоль распространялась в орбиту [19]. Клинические проявления заболевания варьируются от неспецифических симптомов, таких как заложенность носа, носовое кровотечение, лицевая и головная боль, до более выраженных (проптоз, диплопия и нарушение остроты зрения, паралич черепно-мозговых нервов). Время от начала заболевания до значимых клинических проявлений составляет в среднем от недели до нескольких месяцев [20]. В нашем клиническом случае НСК развивалась в полости носа в течение как минимум 8 месяцев до момента установления опухолевого процесса, а нерадикальное ее удаление на основании неправильной гистологической верификации биопсийного материала способствовало стремительному прогрессированию процесса с расширением зон костной деструкции. При этом главным методом лечения всех синоназальных карцином, в т.ч. низкодифференцированных, является полное и ради кальное хирургическое иссечение в пределах здоровых тканей (R0), что коррелирует с высокой пятилетней выживаемостью по сравнению с резекциями R1/2 [21]. В нашем клиническом случае только курс лучевой терапии с последующими курсами химиотерапии цисплатином позволили достичь полного регресса опухолевого процесса. Согласно рекомендациям Национальной всеобщей онкологической сети (National Comprehensive Cancer Network), адъювантная лучевая терапия всегда должна следовать за хирургическим вмешательством по поводу НСК, даже если выполнена резекция R0 [22].
Одномоментная химиолучевая терапия оказалась успешной только в нескольких клинических случаях, что объясняется тенденцией к быстрому метастазированию опухолевого процесса [23]. Наиболее оптимальными сроками для проведения тимодальной терапии (хирургическое лечение, лучевая и химиотерапия) считаются 30–60 дней после оперативного вмешательства [24].
Среди химиотерапевтических препаратов, использованных одновременно с лучевой терапией, наибольшее распространение получил только цисплатин [24].
Перспективным методом в лечении пациентов с НСК считается применение углерод-ионной радиотерапии (CIRT), которая имеет превосходное распределение дозы, более высокую линейную энергию передачи и более высокую относительную биологическую эффективность по сравнению с терапией обычным фотонным излучением. CIRT признается перспективным методом лечения НСК, однако его роль в качестве адъювантной лучевой терапии до сих пор неизвестна, а эффективность была продемонстрирована только при нерезецированных опухолях [25].
По последним данным, пятилетняя выживаемость пациентов с НСК составляет 62,5% среди 16 больных, из которых 40% (6 из 16) лечились без хирургического вмешательства [26, 27]. Сроки наблюдения за нашей пациенткой составили на данный момент 2 года с момента диагностики опухолевого процесса. И несмотря на позднюю верификацию опухолевого процесса, ошибочную гистологическую интерпретацию биопсийного материала, повлекшую за собой менее радикальный объем хирургического вмешательства и, вследствие этого прогрессирование опухолевого процесса и костной деструкции в послеоперационном периоде, на фоне курса лучевой и химиотерапии удалось достичь полного регресса опухолевого процесса.
Заключение
Интерес представленного клинического случая заключается в успешном лечении распространенной формы НСК, сопровождающейся множественными очагами костной деструкции при поздней диагностике опухолевого процесса и нерадикальном объеме оперативного вмешательства. Несвоевременная диагностика опухолевого процесса в результате проведения рентгенологического обследования без заключения рентгенологов, ставит под сомнение диагностическую ценность подобных исследований, поскольку не исключает ошибок в интерпретации полученных результатов непрофильными специалистами.
ЛИТЕРАТУРА
- Пачес А.И. Опухоли головы и шеи. Клиническое руководство. М., 2013. 170 с. (In Russ.). [Paches A. Tumors of the head and neck. Clinical guide. M., 2013. 170 p. (In Russ.)].
- Franssen E.H., de Bree F.M., Verhaagen J. Olfactory ensheathing glia: their contribution to primary olfactory nervous system regeneration and their regenerative potential following transplantation into the injured spinal cord. Brain Res. Rev. 2007;56:236–58.
- Bell D., et al. Prognostic utility of Hyams histological grading and Kadish-Morita staging systems for esthesioneuroblastoma outcomes. Head and neck pathology. 2015;9(1):51–9.
- Мустафаев Д.М. и др. Эстезионейробластома полости носа (ольфакторная нейробластома). Российская оториноларингология. 2009;5:85–91.
- Abdelmeguid A.S., et al. Long-Term Outcomes of Management of Olfactory Neuroblastoma: MD Anderson Experience. J. Neurol. Surg. Part B: Skull Base. 2018;79(01):184.
- Kadish S., Goodman M., Wang C.C. Olfactory neuroblastoma – A clinical analysis of 17 cases. Cancer. 1976;37(3):1571–6.
- Morita A., Ebersold M.J., Olsen K.D., Foote R.L., Lewis J.E., Quast L.M. Esthesioneuroblastoma: prognosis and management. Neurosurg.1993;32:706–14.
- Bachar G., Goldstein D.P., Shah M., et al. Esthesioneuroblastoma: the Princess Margaret Hospital experience. Head Neck. 2008;30:1607–14.
- Dulguerov P., Allal A.S., Calcaterra T.C. Esthesioneuroblastoma: a metaanalysis and review. Lancet. Oncol.. 2001;2(11):683–90.
- Hyams V.J. Olfactory neuroblastoma (case6). Special tumors of the head and neck. Checago: Am. Soc. Clin. Pathol. 1983;29.
- Frierson H.F., Mills S.E., Fechner R.E., Taxy J.B., Levine P.A. Sinonasal undifferentiated carcinoma: an aggressive neoplasm derived from Schneiderian epithelium and distinct from olfactory neuroblastoma. Am. J. Surg. Pathol. 1986;10(11):771–2.
- Thompson L.D.R., Bell D., Bishop J.A. Neuroendocrine carcinomas. In: El-Naggar A.K., Chan J.K.C., Grandis J.R., Takata T., Slootweg P., ed. Pathology and genetics of head and neck tumours. Lyon: IARC Press. 2017. Р. 21–3.
- López-Hernández A., et al. Genetic profiling of poorly differentiated sinonasal tumours. Sci. Report. 2018;8(1):3998.
- Cerilli L.A., et al. Sinonasal undifferentiated carcinoma: immunohistochemical profile and lack of EBV association. Am. J. Surg. Pathol. 2001;25(2):156–63.
- Soldatova L., et al. Sinonasal carcinomas with neuroendocrine features: histopathological differentiation and treatment outcomes. J. Neurol. Surg. Part B: Skull Base. 2016;77(06):456–65.
- Ejaz A., Wenig B.M. Sinonasal undifferentiated carcinoma: clinical and pathologic features and a discussion on classification, cellular differentiation, and differential diagnosis. Adv. Anat. Pathol. 2005;12(3):134–43.
- Franchi A., et al. Sinonasal carcinomas: recent advances in molecular and phenotypic characterization and their clinical implications. Critical Rev. Oncol. Hematol. 2011;79(3):265–77.
- Enepekides D.J. Sinonasal undifferentiated carcinoma: an update. Curr. Opin. Otolaryngol. Head Neck Surg. 2005;13(4):222–5.
- Musy P.Y., Reibel J.F., Levine P.A. Sinonasal undifferentiated carcinoma: the search for a better outcome. Laryngoscope. 2002;112(8):1450–5.
- Tanzler E.D., Morris C.G., Orlando C.A., Werning J.W., Mendenhall W.M. Management of sinonasal undifferentiated carcinoma. Head Neck. 2008;30(5):595–9.
- Perri F., et al. Locally advanced paranasal sinus carcinoma: A study of 30 patients. Oncology letters. 2017;13(3):1338–42.
- Lin E.M., et al. Sinonasal undifferentiated carcinoma: a 13-year experience at a single institution. Skull Base. 2010;20(02):61–7.
- Shen W., Sakamoto N., Yang L. Prognostic models and nomograms for predicting survival of patients with maxillary sinus carcinomas. Int. Forum Allergy Rhinol. 2017;7(7):741–74.
- Perri F., et al. Clinical management of localized undifferentiated sinonasal carcinoma: our experience and review of the literature. Anti-cancer drugs.2019;30(3):308–12.
- Mohamad O., et al. Carbon ion radiotherapy: a review of clinical experiences and preclinical research, with an emphasis on DNA damage/repair. Cancers. 2017;9(6):66.
- Rosenthal D.I., et al. Sinonasal malignancies with neuroendocrine differentiation: patterns of failure according to histologic phenotype. Cancer: Interdisciplinary Int. J. Am. Cancer Soc. 2004;101(11):2567–73.
- Карпищенко С.А. и др. Синоназальная инвертированная папиллома: литературный обзор. Folia Otorhinolaryngol. Pathol. Respir. 2017;23(3):4–16 (In Russ.). [Karpischenko S.A., et al. Synonasal inverted papilloma: a literature review. Folia Otorhinolaryngol. Pathol. Respir. 2017; 23 (3): 4–16 (In Russ.)].
Информация об авторах:
С.А. Карпищенко – кафедра оториноларингологии с клиникой ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург, Россия; e-mail: karpischenkos@mail.ru
В.Ю. Черебилло – кафедра нейрохирургии ГБОУ ВПО «Первый СанктПетербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург, Россия
Н.А. Шумилова – кафедра оториноларингологии с клиникой ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург, Россия
Н.С. Пузаков – кафедра нейрохирургии ГБОУ ВПО «Первый СанктПетербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург, Россия
О.А. Станчева – кафедра оториноларингологии с клиникой ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург, Россия
Д.М. Данилова – патологоанатомическое отделение ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург, Россия, Россия
About the authors:
S.A. Karpischenko – Department of Otorhinolaryngology with Clinic, SBEI “First St. Petersburg State Medical University named after Acad. I.P. Pavlov, St. Petersburg, Russia; e-mail: karpischenkos@mail.ru
V.Yu. Cherebillo – Department of Neurosurgery SBEI “First St. Petersburg State Medical University named after Acad. I.P. Pavlov, St. Petersburg, Russia
N.A. Shumilova – Department of Otorhinolaryngology with a clinic SBEI “First St. Petersburg State Medical University named after Acad. I.P. Pavlov, St. Petersburg, Russia
N.S. Puzakov – Department of Neurosurgery SBEI “First St. Petersburg State Medical University named after Acad. I.P. Pavlov, St. Petersburg, Russia
O.A. Stancheva – Department of Otorhinolaryngology with a clinic SBEI “First St. Petersburg State Medical University named after Acad. I.P. Pavlov, St. Petersburg, Russia
D.M. Danilova – pathological anatomy department, SBEI “First St. Petersburg State Medical University named after Acad. I.P. Pavlov, St. Petersburg, Russia