Для цитирования:
Гилева К.С., Миронова Е.А. Новый метод устранения вторичных ограниченных дефектов и рубцовых деформаций боковой поверхности языка и мягких тканей дна полости рта с использованием FAMM-лоскута и ксеномембаны Permacol. Голова и шея = Head and neck. Russian Journal. 2019;7(1):10–18
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Doi: 10.25792/HN.2019.7.1.10–18
Цель. Повышение эстетических и функциональных результатов хирургического лечения пациентов с вторичными ограниченными дефектами боковой поверхности языка и мягких тканей дна полости рта с помощью методики устранения дефекта FAMM-лоскутом в сочетании с ксеномембраной Permacol. Материал и методы. С сентября 2016 по июль 2018 г. было выполнено 5 оперативных вмешательств по устранению рубцовой деформации дна полости рта и языка с воссозданием анатомической структуры челюстно-язычного желобка (ЧЯЖ) с применением FAMM-лоскута и ксеномембраны Permacol. В качестве предоперационной подготовки выполнены МСКТ-ангиография сосудов лица, шеи с перфузией тканей щечной области и дна полости рта, волюметрическая оценка параметров ЧЯЖ до и после оперативного вмешательства, сравнение результатов, снятие альгинатных слепков исследуемой области. В послеоперационном периоде на 30-е сутки выполнено гистологическое исследование и изучение имплантированного материала Permacol с анализом процессов репарации.
Результаты. Была разработана оригинальная методика устранения вторичных ограниченных дефектов дна полости рта и боковой поверхности языка с использованием FAMM-лоскута и ксеномембаны Permacol. Для того чтобы избежать наличия тянущей ножки и ограничения открывания рта была разработана новая модификация FAMM-лоскута с поперечным направлением, с удобным углом ротации через ретромолярную область на дно полости рта. По результатам волюметрической оценки изменений параметров ЧЯЖ наблюдалось трехкратное увеличение ширины и пятикратное увеличение глубины ЧЯЖ. По данным морфологического исследования, на 30-е сутки происходило формирование специфичного для данной области многослойного плоского ороговевающего эпителия, прочного коллагенового каркаса, что подтверждено результатами морфологического исследования. В результате изучения данных МСКТ-ангиографии периферических ветвей наружной сонной артерии даже у пациентов, перенесших онкопластическое лечение, включающее микрохирургическую реконструкцию, в каждом отдельном случае был визуализирован надежный источник кровоснабжения щечного лоскута.
Выводы. За счет иссечения рубцовой контрактуры и воссоздания анатомической формы ЧЯЖ достигается функционально и эстетически выгодный результат. У пациентов улучшается функция звукопроизношения, эвакуации слюны, за счет восполнения дефицита прикрепленной десны устраняется препятствие к выполнению рационального зубочелюстного протезирования. Сочетание таких факторов, как сокращение времени оперативного вмешательства, относительно небольшой донорский ущерб, надежность кровоснабжения является аргументом в пользу приоритетности выбора этого метода в ряду альтернативных реконструктивных методик.
Ключевые слова: новообразования полости рта, дефекты боковой поверхности языка и мягких тканей дна полости рта, FAMM-лоскут, ксеномембрана Permacol.
Purpose: to improve the aesthetic and functional results of surgical treatment of patients with secondary localized defects of the tongue body and mouth floor soft tissues using the FAMM flap technique and Permacol xenomembrane. Material and methods. From September 2016 to July 2018, 5 surgical interventions were performed to eliminate cicatricial deformity of the mouth floor and tongue body with the mandibular-lingual groove (MLG) anatomical reconstruction using a FAMM-flap and Permacol xenomembrane. As preoperative preparation, MSCT-angiography of the face and neck vessels with the buccal area and the floor of the mouth tissues perfusion, volumetric assessment of MLG parameters before and after surgery, comparison of the results, and the alginate casts removal were performed. On the 30th day after operation a histological analysis and the examination of the implanted Permacol membrane with subsequent repair processes study were performed.
Results. An original technology for elimination of secondary localized defects on the floor of the mouth and the tongue body was developed using FAMM-flap and Permacol xenomembane. In order to avoid a “pulling leg” defect and mouth opening restriction, a new modification of the FAMM-flap was elaborated, using transverse direction and convenient rotation angle through the retromolar region to the bottom of the oral cavity. According to the results of a volumetric assessment of changes in the MLG parameters, a threefold increase in the width and a fivefold increase in the MLG depth were observed. Morphological analysis on the 30th day showed a multi-layered squamous epithelium (specific for this area) and a strong collagen basis formation. MSCT-angiography of the external carotid artery peripheral branches demonstrated that even in patients who underwent oncoplasty, including microsurgical reconstruction, blood supply of the buccal flap was sufficient.
Conclusions: Functional and aesthetical benefits were achieved due to the cicatricial contracture elimination and the MLG anatomical reconstruction. Pronunciation and saliva evacuation were also improved and obstacles for further dental prosthesis were removed. A combination of factors such as shortened operation time, relatively small donor damage, and blood supply reliability, is an argument in favor of this method choice among the other alternative reconstructive techniques.
Keywords: tumors of the oral cavity, defects of the tongue body and mouth floor soft tissues, FAMM-flap, Permacol xenomembrane
Введение
Остаточные ограниченные дефекты в области боковой поверхности языка и дна полости рта являются частым исходом хирургического лечения по поводу новообразований языка и дна полости рта. Согласно статистике Объединенного Американского комитета по раку/Международного противоракового союза (American Joint Committee on Cancer/International Union Against Cancer), в Западных странах, а также в странах Восточно Центральной Азии наиболее распространенным местом локализации новообразований в полости рта является язык и дно полости рта [1, 4].
Хирургическое иссечение в сочетании с лучевой терапией является наиболее оптимальной комплексной терапией. После хирургической резекции массива тканей языка и дна полости рта возникают обширные дефекты мягких тканей, требующие одномоментного реконструктивного вмешательства. «Золотым стандартом» первичной реконструкции является возмещение объема удаленных тканей реваскуляризированными мягкотканными лоскутами (кожно-фасциальным лоскутом с предплечья, лоскутом с переднебоковой поверхности бедра) [1–4].
Целью первичной реконструкции является восстановление дефицитных тканей дна полости рта и языка. Однако сложную анатомическую структуру данной области невозможно вос создать с помощью одноплоскостной структуры лоскута, и воссоздание челюстно-язычного желобка (ЧЯЖ) на первом этапе реконструктивного лечения является недостижимой задачей. Хирургическая резекция опухолей полости рта (в сочетании с реконструкцией свободными мягкоткаными лоскутами) может в значительной степени менять анатомичность внутриротовых структур, У таких больных за счет недостаточной глубины ЧЯЖ, рубцовых изменений ранее пересаженного лоскута затруднена подвижность языка и невозможно выполнить съемное протезирование и установить дентальные имплантаты.
Первичная реконструкция данной области позволяет эффективно закрывать первичный мягкотканный дефект, образующийся после обширных резекций. В отдаленном послеоперационном периоде с учетом послеоперационной лучевой терапии и процессов послеоперационного рубцевания ткани лоскута сокращаются, образуется рубцовая контрактура языка и дна полости рта.
Проблемы, с которыми сталкиваются пациенты при отсутствии ЧЯЖ после первичной реконструкции – это нарушение жевания, глотания и речи, что обусловливает потребность вторичного реконструктивно-восстановительного лечения с прецизионным воссозданием исходных анатомических структур, включающих дно полости рта, боковую поверхность языка и форму ЧЯЖ.
Тянущая рубцовая деформация языка и дна полости рта в подъязычном пространстве и ретромолярной зоне делают невозможным выполнение рационального протезирования.
Важной задачей вторичной реконструкции является создание условий для рационального протезирования за счет восполнения дефицита прикрепленной десны. На сегодняшний день в этом вопросе не существует стандартных подходов. В литературе встречаются различные методики устранения дефектов и деформаций структур полости рта, но отсутствует описание этой анатомической области как единой отдельной клинически значимой единицы со сложной трехмерной структурой, прецизионное восстановление которой является важным компонентом зубочелюстной реабилитации.
Описаны методики изолированного устранения дефектов дна полости рта и языка с помощью осевых пропеллерных лоскутов со слизистой оболочки щеки и языка [5–8] реваскуляризированными свободными кожными лоскутами [9, 10], восстановление языка и дна полости рта единым моноблоком тканей с помощью различных реваскуляризированных кожно-мышечных и кожножировых лоскутов [1–3, 19].
Наиболее распространенным методом является повторная микрохирурическая реконструкция. Но помимо прямых противопоказаний существует еще ряд таких обстоятельств, как психологическая неготовность большинства пациентов к повторной микрохирургической операции, дополнительный донорский ущерб. Эти факторы обусловливают поиск наименее травматичного и малоинвазивного метода реконструкции боковой поверхности языка и дна полости рта, устраняющего дефекты данных анатомических структур и форму ЧЯЖ.
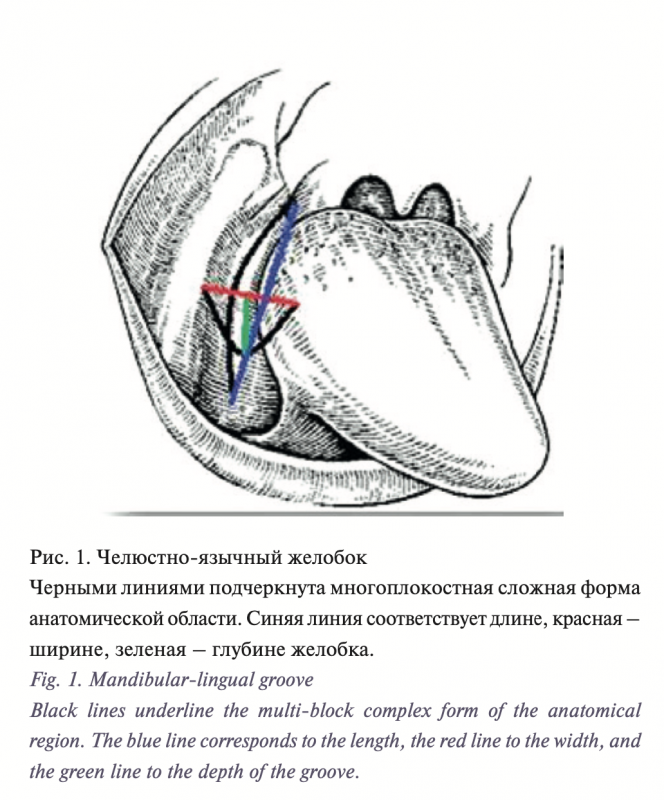
Согласно анатомическому понятию, ЧЯЖ ограничен сверху слизистой оболочкой дна полости рта, снизу – задним отделом челюстно-подъязычной мышцы (m. mylohyoideus), снаружи – внутренней поверхностью тела нижней челюсти, изнутри – боковой поверхностью языка, сзади – основанием передней небной дужки (arcus palatoglossus), спереди граница практически отсутствует, т.к. клетчатка ЧЯЖ непосредственно связана с клетчаткой подъязычного пространства [3]. Дефект, проходящий по ЧЯЖ, представляет собой 3D-дефект, а для устранения дефекта ЧЯЖ необходим химерный лоскут, воссоздающий сложную трехмерную структуру данной области. (рис. 1).
Материал и методы
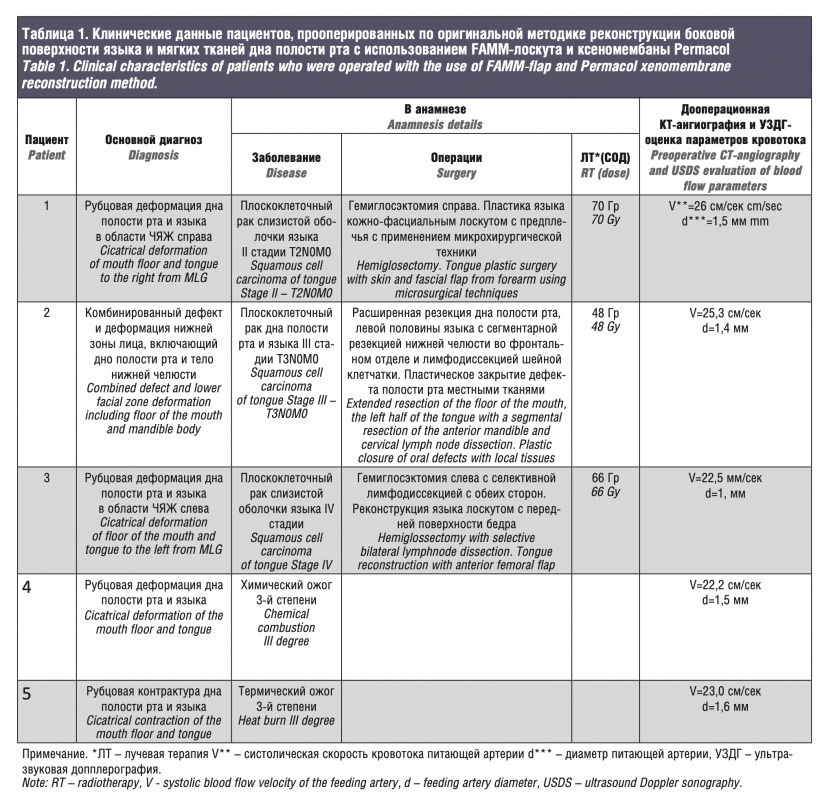
В период с сентября 2016 по июль 2018 г. было выполнено 5 оперативных вмешательства с целью устранения рубцовой деформации дна полости рта и языка с воссозданием анатомической структуры ЧЯЖ с применением FAMM-лоскута и ксеномембраны Permacol (табл. 1).
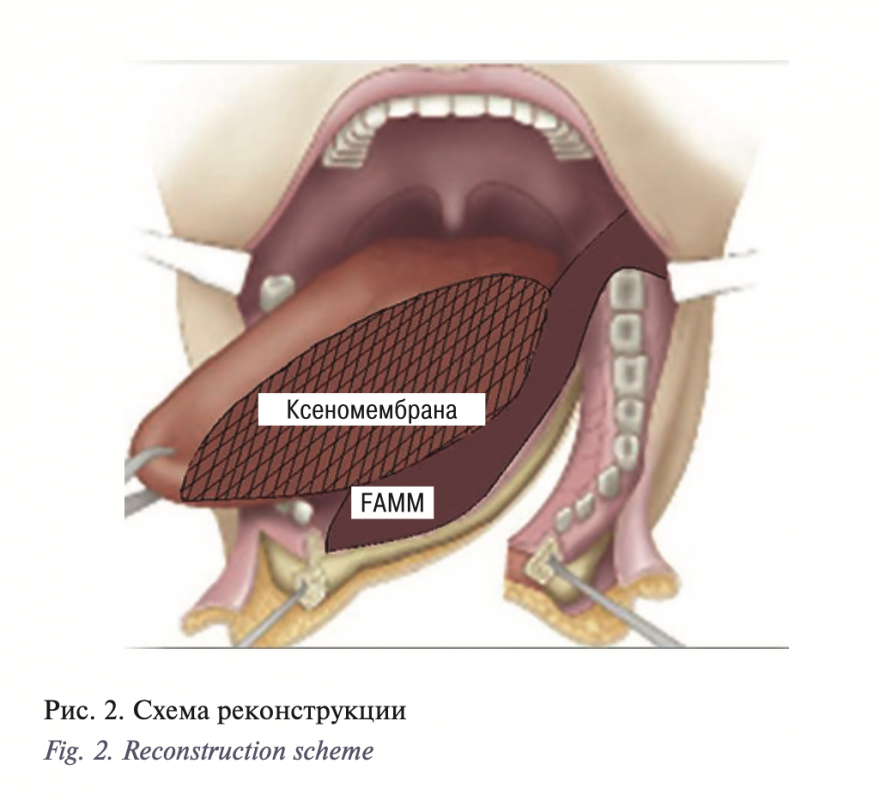
У пациентов наблюдалось снижение артикуляции, затруднение произношения и членораздельной речи, нарушение слюнооттока. Выполнение рационального протезирования было невозможным. После иссечения рубцовых тканей, производилось устранение вторичного ограниченного дефекта дна полости рта и языка с воссозданием трехмерной структуры ЧЯЖ с помощью FAMM-лоскута (слизисто-мышечного лоскута с осевым типом кровоснабжения на лицевой артерии) и ультратонкой ксеномембраны Permacol Surgical Implant (США) (рис. 2).
В контексте нашей работы понятие ЧЯЖ приобретает клиническую значимость и отличается от ранее описанного анатомического понятия ввиду того, что мы имеем дело с измененной анатомией. Для удобства понимания мы выделили новый термин «клинический челюстно-язычный желобок», который представляет собой ладьеобразное углубление от слизистой поверхности щеки до условно-боковой поверхности языка, дном является дно полости рта в ретромолярной зоне, подъязычном пространстве. Длина ЧЯЖ составляет 7–10 см, ширина – 1–1,5 см, глубина – 1–0,5 см.
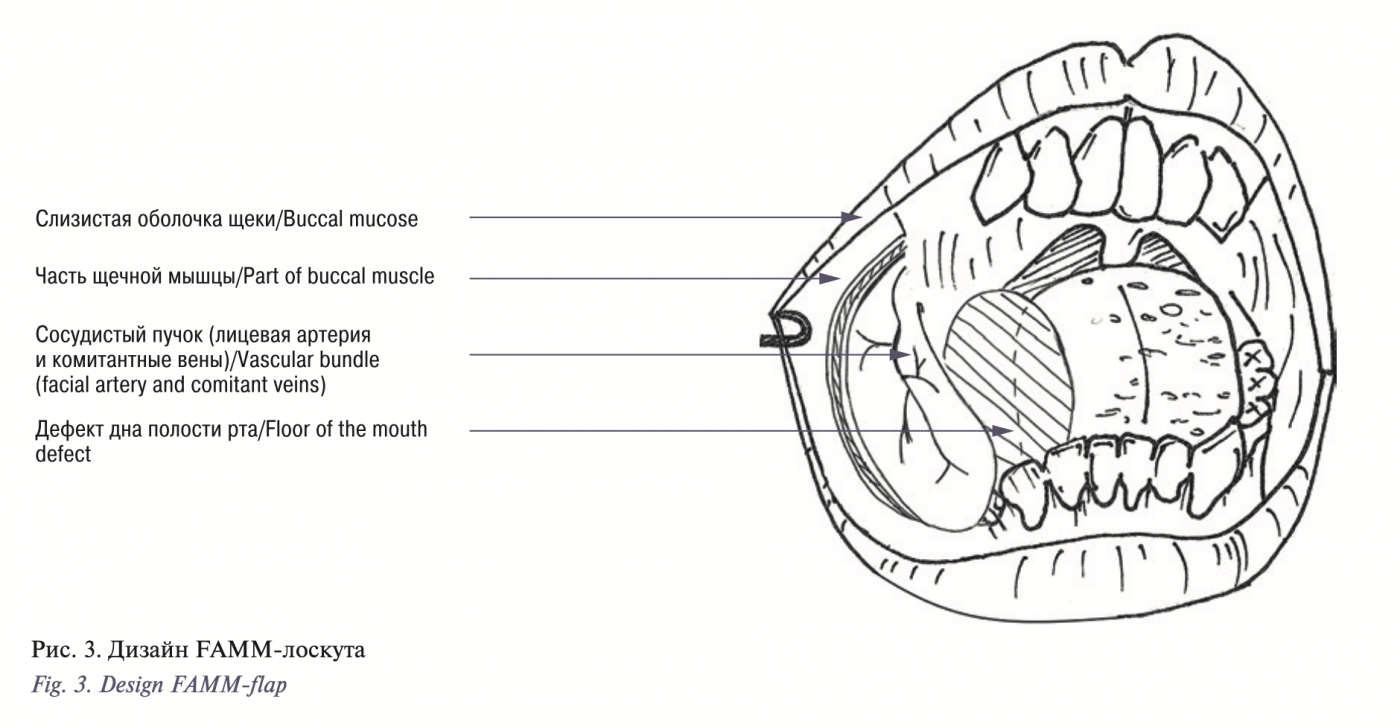
В состав FAMM-лоскута (осевого слизисто-мышечного лоскута), включаются (рис. 3) [11–15]:
-
слизистая оболочка полости рта и подслизистая основа, покрывающая щечную мышцу со стороны полости рта;
-
часть щечной мышцы;
-
сосудистая ножка, включающая лицевую артерию и комитантные вены.
Анатомия щечной мышцы отличается богатым и сложным кровоснабжением из трех основных источников [4]:
-
Щечная артерия кровоснабжает заднюю порцию щечной мышцы, это ветвь верхнечелюстной артерии.
-
Ветви лицевой артерии кровоснабжают переднюю часть щечной мышцы.
-
Задняя верхняя альвеолярная артерия, ветвь верхнечелюстной артерии.
Богатое перфорантное кровоснабжение позволяет выкраивать слизисто-мышечный лоскут в области щеки длиной до 8–9 см, шириной до 2,0 см, толщиной до 0,5 см в зависимости от размеров дефекта дна полости рта [11–15].
На этапе предоперационной подготовки мы изучали периферические ветви наружной сонной артерии по данным МСКТангиографии с целью определения возможности выкраивания FAMM-лоскута. Это особенно актуально у данных больных, поскольку при раке слизистой оболочки полости рта в подавляющем большинстве случаев при выполнении лимфодиссекции или микрохирургической реконструкции лицевая артерия перевязывается, в связи с чем кровоток в ней на уровне выкраивания лоскута осуществляется ретроградно либо через коллатерали.
Дефект боковой поверхности языка мы устраняли с помощью ультратонкой ксеномембраны из свиной дермы «Permacol Surgical Implant» размерами 5×5 см, толщиной 0,5 мм. Пермакол (Permacol) расшифровывается как перманентный коллаген. По структуре и свойствам представляет собой биологический имплантат из листовой свиной кожи, лишенной антигенной структуры и спаянной химически (crosslinking). Имплантат представляет собой чистый поперечно-связанный коллаген и эластин, лишенный клеточных структур, жировой ткани и пр. Данный материал не обладает антигенными свойствами и вызывает минимальную воспалительную реакцию, не отличающуюся от нормального репаративного процесса. Коллагеновые волокна являются каркасом для прорастания тканями реципиента и васкуляризации. Благодаря поперечному связыванию он устойчив к тканевым и бактериальным ферментам, вследствие чего не рассасывается со временем, не деформируется в тканях и обеспечивает постоянное укрепление мягких тканей. Минимальная реактивность Permacol не провоцирует развитие инфекционных процессов в мягких тканях и позволяет использовать его при наличии инфекции, а также не удалять его при персистировании хирургической инфекции [17–18].
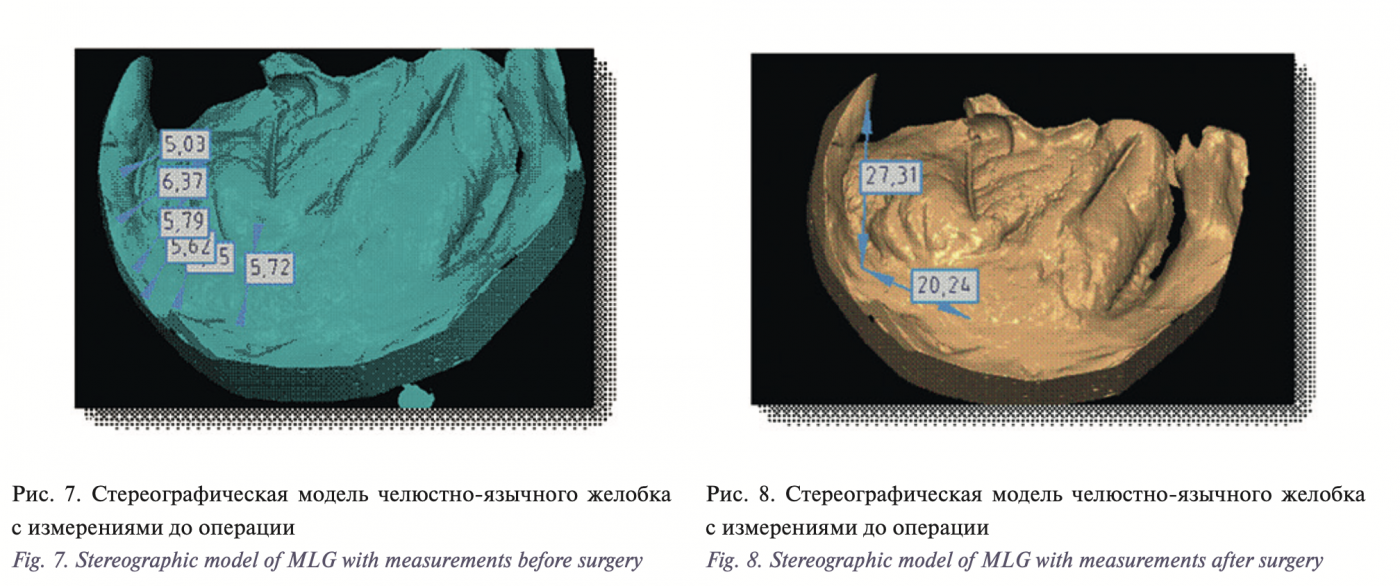
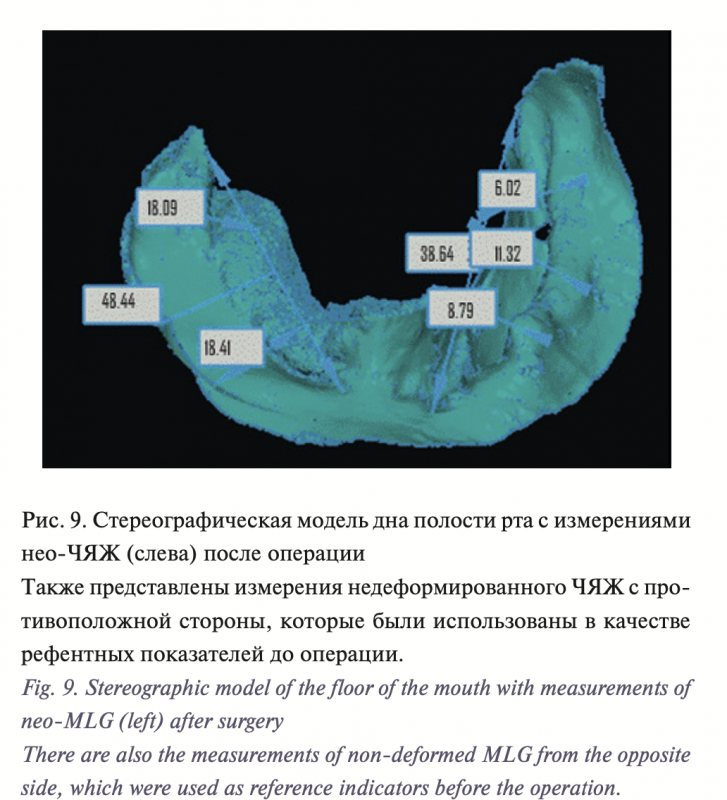
На 30-е сутки после реконструкции проводилась биопсия с последующим морфологическим исследованием для оценки процессов восстановления поверхности языка на матрице мембраны Permacol. Для предоперационной волюметрической оценки параметров ЧЯЖ и послеоперационной оценки результатов проводилось снятие альгинатных слепков исследуемой области с последующим сканированием и 3D-компьютерной визуализацией. Также измеряли противоположный (здоровый) ЧЯЖ для использования его в качестве эталона реконструкции.
Для того чтобы оценить степень изменения подвижности языка, улучшение артикуляции на пред- и послеоперационном этапах был использован метод ультразвуковой визуализации и аудиозаписи. Для объективной оценки звукопроизношения были использованы артикуляторно-акустические характеристики звуков, сформулированные Л.С. Волковой, исходя из ее классификации согласных звуков на переднеязычные, среднеязычные и заднеязычные [20]. Наибольшее затруднение пациенты испытывали при произнесении согласных переднеязычных звуков, таких как «с, з», что совпадает с данными, полученными при УЗ-диагностике, согласно которым в переднем отделе языка наблюдается наименьшая подвижность.
Результаты
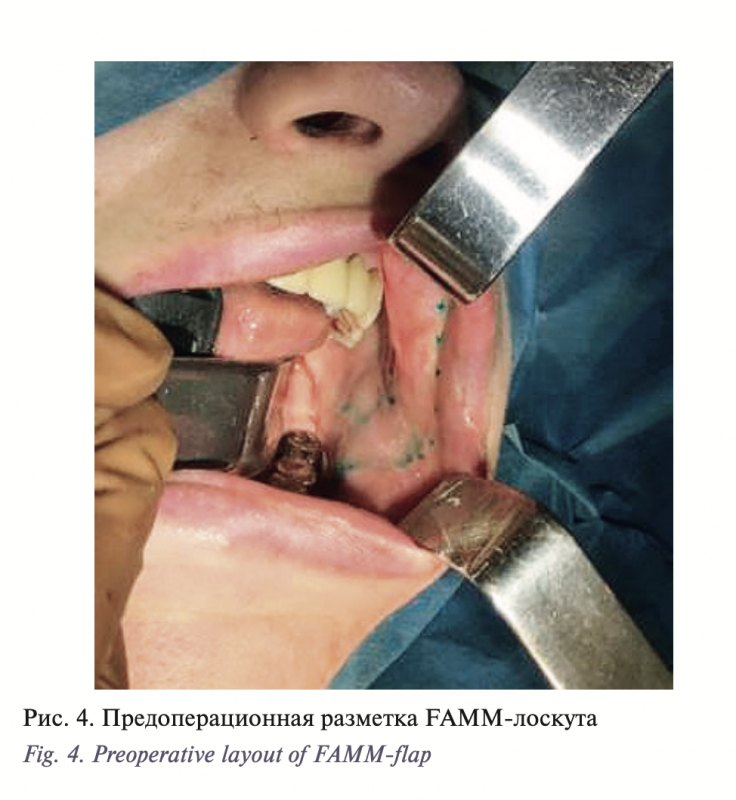
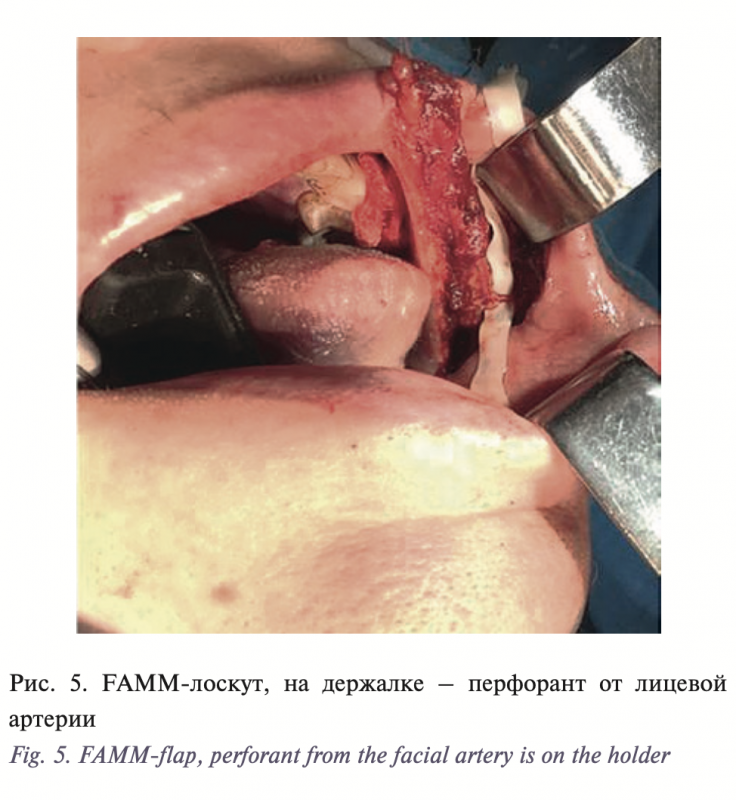
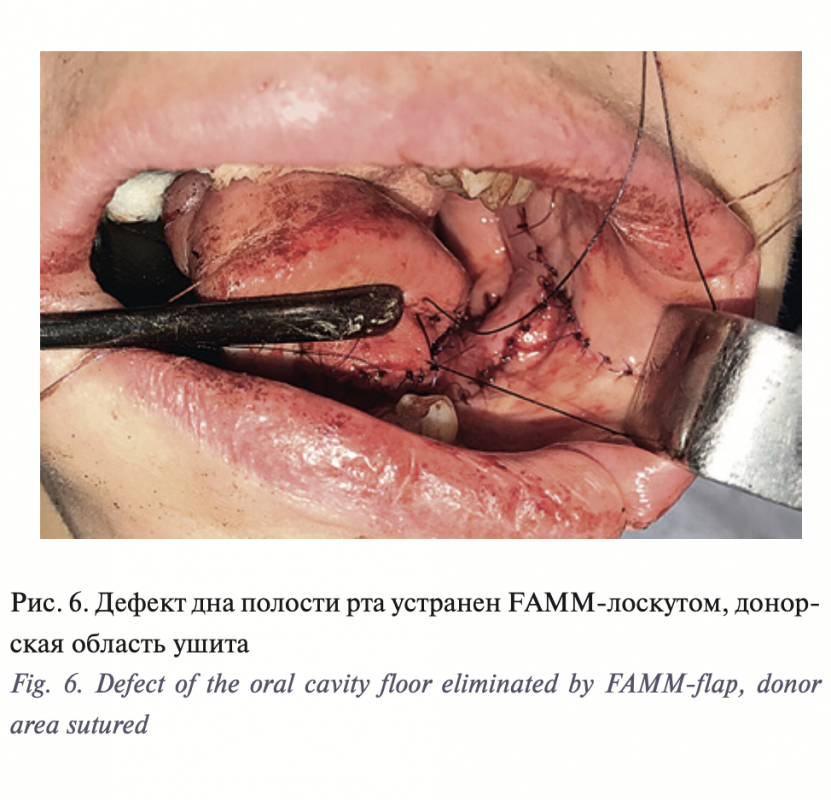
В результате нашей работы была разработана оригинальная методика устранения вторичных ограниченных дефектов дна полости рта и боковой поверхности языка с использованием FAMM-лоскута и ксеномембаны Permacol. Для того чтобы избежать наличия тянущей ножки, ограничивающей открывание рта, мы разработали новую модификацию FAMM-лоскута с поперечным направлением, с удобным углом ротации через ретромолярную область на дно полости рта. В ходе диссекции под волокнами щечной мышцы идентифицируется лицевая артерия, по ходу лицевой артерии по направлению к основанию ножки (0,5 см от устья Стенонова протока) визуализируется перфорант, прободающий щечную мышцу в средней ее трети, и формируется FAMM-лоскут без пересечения лицевой артерии по протяжению на данном перфоранте (рис. 4, 5). Лоскут ротируется через ретромолярную область на дно полости рта. Образовавшийся дефект щеки закрывается послойным ушиванием. Подобный дизайн FAMM-лоскута позволяет избежать наличия тянущей ножки и ограничения открывания рта (рис. 6). Поперечный островковый слизисто-мышечный лоскут на перфоранте от лицевой артерии (модификация FAMMлоскута) эффективно устраняет дефект дна полости рта, участвуя в формировании нео-ЧЯЖ. По результатам волюметрической оценки изменений параметров ЧЯЖ наблюдается трехкратное увеличение ширины и пятикратное увеличение глубины ЧЯЖ (табл. 2, рис. 7–9).
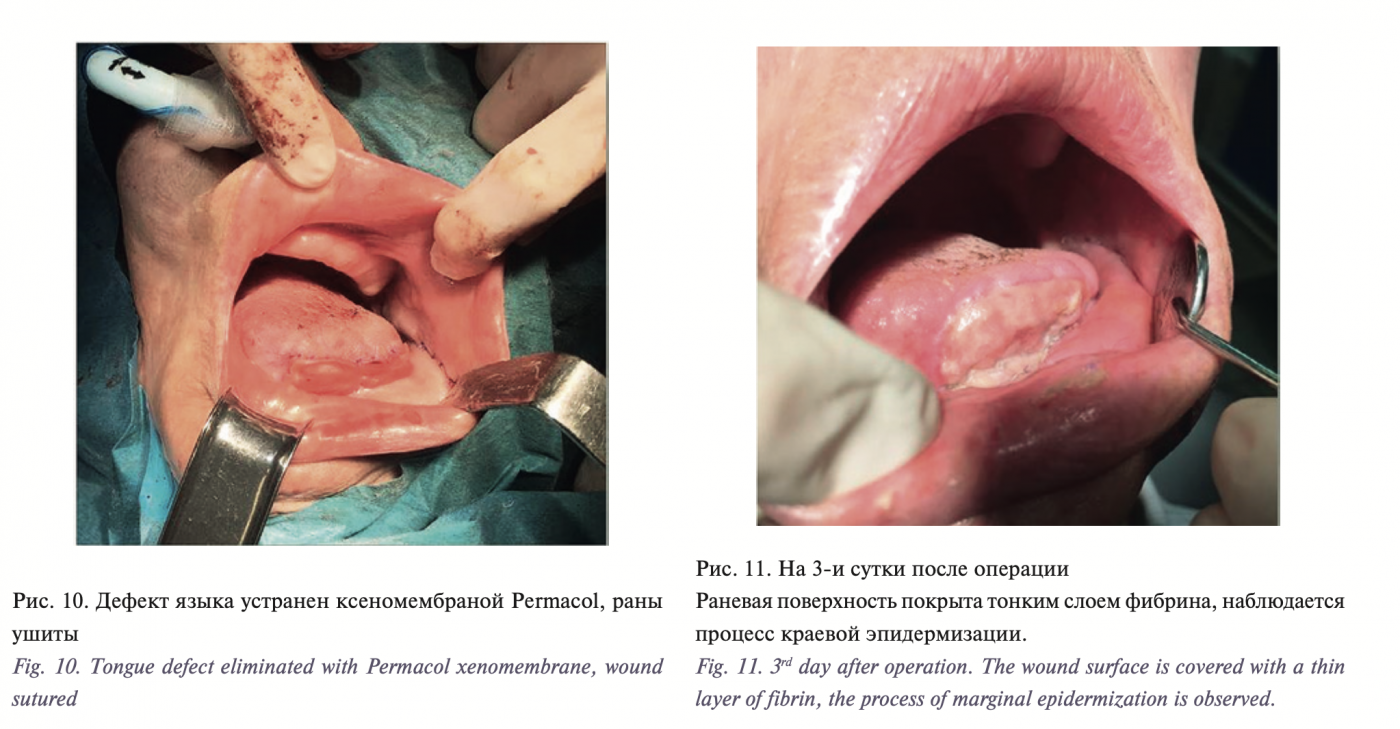
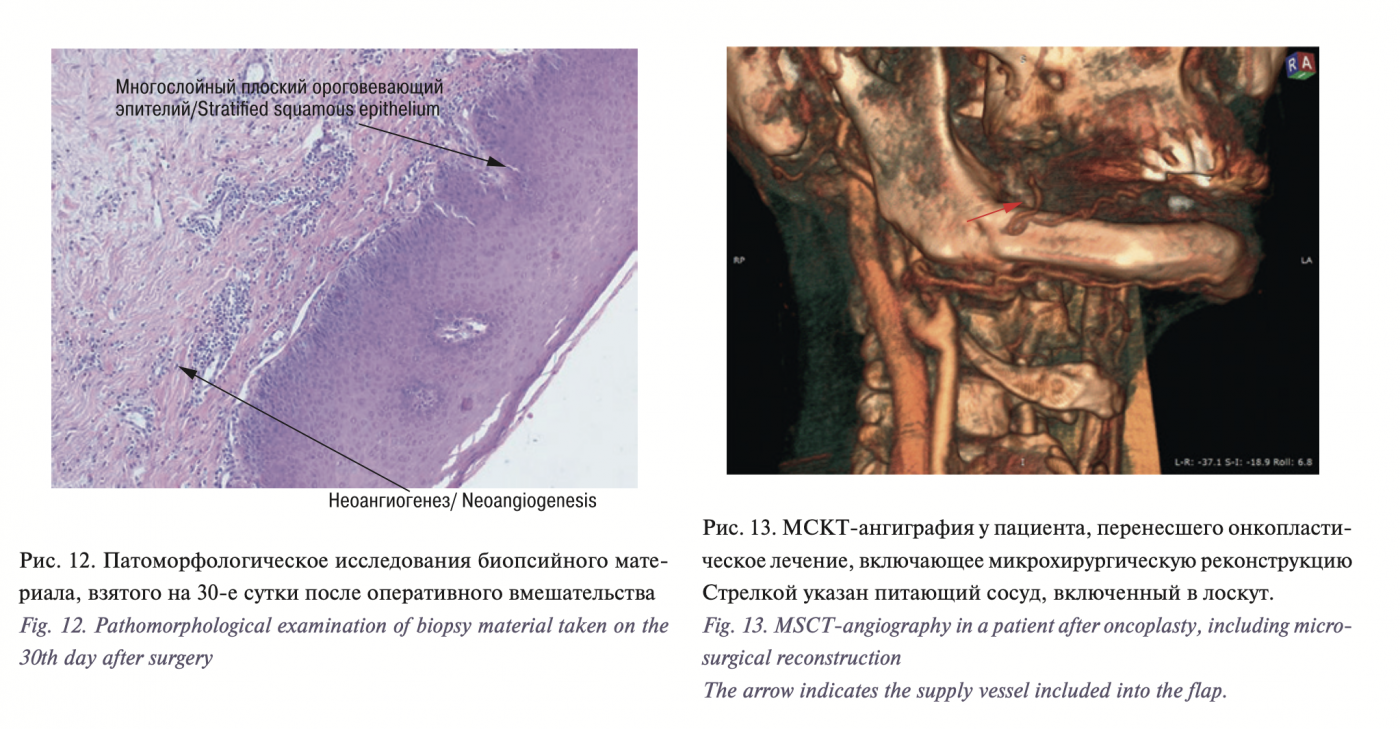
Дефект в области боковой поверхности языка устраняется с помощью ксеномембраны из свиной дермы «Permacol Surgical Implant» (рис. 10). Согласно нашим наблюдениям, на 3-и сутки за счет мукокондуктивного эффекта на коллагеновой матрице наблюдались процессы краевой эпидермизации – 0,5–1 мм от края раны (рис. 11), на 30-е сутки формировался специфичный для данной области многослойный плоский ороговевающий эпителий, а также прочный коллагеновый каркас, что подтверждено результатами морфологического исследования (рис. 12).
В случае имплантации ксеномембраны Permacol процесс полной эпителизации боковой поверхности языка занял 25–30 дней в отличие от реконструкции языка посредством кожного компонента, для которого характерен длительный процесс ослизнения лоскута (6 месяцев) [18].
В результате изучения данных МСКТ-ангиографии периферических ветвей наружной сонной артерии даже у пациентов, перенесших онкопластическое лечение, включающее микрохирургическую реконструкцию, в каждом отдельном случае был визуализирован надежный источник кровоснабжения щечного лоскута.
В отдаленном послеоперационном периоде через 6 месяцев после стабилизации процессов рубцевания проводилась оценка звукопроизношения и артикуляции, в результате которой удалось достичь улучшения мобильности переднего и среднего отделов языка амплитудой до 10 мм (по данным УЗ-исследования), что положительно сказывалось на функции звукопроизношения и субъективно оценивалось пациентами как улучшение функции речи.
Заключение
Слизистая оболочка щеки благодаря природному избытку тканей, растяжимости, богатой васкуляризации, редким вовлечением в патологические процессы в полости рта – идеальное донорское место. Также в отличие от другого пластического материала слизистая оболочка щеки не нуждается в функциональной адаптации (ослизнение).
Подобное сочетание модифицированного FAMM-лоскута на перфаранте от лицевой артерии для закрытия дефекта дна полости рта и ксеномембраны Permacol (5×5 см, 0,5 мм) для закрытия дефекта боковой поверхности языка дает возможность прецизионного воссоздания 3D-формы ЧЯЖ.
Анатомическая близость донорской зоны к реципиентной позволяет избежать дополнительного донорского ущерба, а поперечная конфигурация и дизайн лоскута с ротацией его через ретромолярную область позволяет избежать наличия тянущей ножки и ограничения открывания рта в послеоперационном периоде.
Из-за богатого перфорантного кровотока и развития коллатерального кровотока мы пришли к выводу, что слизистая оболочка щеки – надежный донорский источник, даже у пациентов, перенесших перевязку наружных сонных артерий.
Репаративные процессы в данной зоне протекают в кратчайшие сроки, даже у пациентов, получивших химиолучевую терапию.
За счет иссечения рубцовой контрактуры и воссоздания анатомической формы ЧЯЖ достигается функционально и эстетически выгодный результат. У пациентов улучшается функция звукопроизношения, эвакуация слюны, за счет восполнения дефицита прикрепленной десны устраняется препятствие к выполнению рационального зубочелюстного протезирования.
Сам процесс операции и послеоперационный период связаны с большим психологическим и физическим комфортом по сравнению с альтернативной микрохирургической операцией.
Сочетание таких факторов, как сокращение времени оперативного вмешательства, относительно небольшой донорский ущерб, надежность кровоснабжения являются аргументами в пользу приоритетности выбора этого метода в ряду альтернативных реконструктивных методик.
ЛИТЕРАТУРА
-
Jatin Shah’s Head and Neck Surgery and Oncology, 4th Edition, 2012. ISBN: 9780323248860.
-
Хубезов Д.А., Трушин С.Н., Огорельцев А.Ю., Мнихович М.В., Пучков Д.К. Опыт применения импланта PERMACOL в эксперименте и в клинике. Рос. медико-биологический вестник им. акад. И.П. Павлова. 2014;1:114–20.
-
Jatin P. Shah, Snehal G., Patel Bhuvanesh Singh. Хирургия и онкология головы и шеи: Русское издание под ред. И.В. Решетова. М., 2017. 480 с.
-
Тимофеев А.А. Руководство по челюстно-лицевой хирургии и хирургической стоматологии. Киев, 2002. 290 с.
-
Cordova А., Toia F., D’Arpa S., Giunta G., Moschella F. A New Mucosal Propeller Flap (Deep Lingual Artery Axial Propeller): The Renaissance of Lingual Flaps. Plastic and Reconstructive Surgery, March 2015.
-
Huang L., Guo F., Jian X.C., Ou X.R., Jiang C.H. Clinical application of submental artery perforator flap in oral and maxillofacial defect restoration after tumor resection. Zhonghua Kou Qiang Yi Xue Za Zhi. 2018; 53(1):3–7.
-
Naveen B.S., Mohan M.T., Joseph S.T. Contralateral Islanded Facial Artery Myomucosal Flap for the Reconstruction of Floor of the Mouth Defect. Send to Craniomaxillofac Trauma Reconstr. 2018;11(2):157–60.
-
İşlek A., Balcı M.K., Yüksel Ö., Önal K., Arslanoğlu S., Eren E. Infrahyoid Flap, a Convenient Alternative for Reconstruction of Tongue and Floor of Mouth Defects: Case Series. Arch. Otorhinolaryngol. 2018;56(2):85–8.
-
Agrawal G., Gupta A., Chaudhary V., Qureshi F., Choraria A., Dubey H. Medial Sural Artery Perforator Flap for Head and Neck Reconstruction. Maxillofac. Surg. 2018;8(1):61–5.
-
Wolff K.-D. New aspects in free flap surgery: Mini-perforator flaps and extracorporeal flap perfusion. Stomatol. Oral Maxillofac. Surg. 2017;118(4):238–41.
-
Montero P.H., Patel S.G. Cancer of the Oral Cavity. Article in press. Surg. Oncol. Clin. N. Am. 2015;24(3):491–508.
-
Pribaz J., Stephens W., Crespo L., Gifford G. A new intraoral flap: Facial artery musculomucosal (FAMM) flap. Reconstr. Surg. 1992;90:421–25.
-
Sumarroca А., Rodríguez-Bauzà E., Vega C., Fernández M. Reconstruction of Oral Cavity Defects With FAMM (Facial Artery Musculomucosal) Flaps. Experience Acta Otorrinolaringol. Esp. 2015;66(5):275–80.
-
Bozola A.R., Gasques J.A., Carriquiry C.E., Cardoso de Oliveira M. The buccinator musculomucosal flap: anatomic studyand clinical application. Reconstr. Surg. 1989;84:250–7.
-
Joshi A., Rajendraprasad J.S., Shetty K. Reconstruction of intrao-ral defects using facial artery musculomucosal flap. J. Plast. Surg. 2005; 58:1061–6.
-
Ayad T., Xie L. Facial artery musculomucosal flap in head andneck reconstruction: a systematic review. Head Neck. 2014.
-
Permacol™ Surgical Implant Crosslinking Review. May 2011. White Paper.
-
Хубезов Д.А., Трушин С.Н., Огорельцев А.Ю., Мнихович М.В., Пучков Д.К. Опыт применения импланта Permacol в эксперименте и в клинике. Рос.
медико-биологический вестник им. акад. И.П. Павлова. 2014;1:114–20.
-
Wei Mardini: Flaps and reconstructive surgery. 638 р.
-
Волкова Л.С., Лалаева Р.И., Мастюкова А.М. и др. Логопедия. М., 1989.
528 с.
REFERENCES
-
Jatin Shah’s Head and Neck Surgery and Oncology, 4th Edition, 2012. ISBN: 9780323248860.
-
Khubezov D.A., Trushin S.N., Ogoretsev A.Yu., Mnichovich M.V., Puchkov D.K. Experience of using the PERMACOL implant in the experiment and in the clinic. Russian Medical and Biological Bulletin named after academician I.P. Pavlov. 2014; 1: 114–20.
-
Jatin P. Shah. Хирургия и онкология головы и шеи: Русское издание под ред. акцией И.В. Решетова. М., 2017. 480 с.
-
Timofeev A.A. Guide to Maxillofacial Surgery and Surgical Dentistry. Kiev, 2002. 290 p.
-
Cordova А., Toia F., D’Arpa S., Giunta G., Moschella F. A New Mucosal Propeller Flap (Deep Lingual Artery Axial Propeller): The Renaissance of Lingual Flaps. Plastic and Reconstructive Surgery, March 2015.
-
Huang L., Guo F., Jian X.C., Ou X.R., Jiang C.H.Clinical application of submental artery perforator flap in oral and maxillofacial defect restoration after tumor resection. Zhonghua Kou Qiang Yi Xue Za Zhi. 2018;53(1):3–7.
-
Naveen B.S., Mohan M.T., Joseph S.T. Contralateral Islanded Facial Artery Myomucosal Flap for the Reconstruction of Floor of the Mouth Defect. Send to Craniomaxillofac Trauma Reconstr. 2018;11(2):157–60.
-
İşlek A., Balcı M.K., Yüksel Ö., Önal K., Arslanoğlu S., Eren E. Infrahyoid Flap, a Convenient Alternative for Reconstruction of Tongue and Floor of Mouth Defects: Case Series. Turk Arch Otorhinolaryngol. 2018;56(2):85–8.
-
Agrawal G., Gupta A., Chaudhary V., Qureshi F., Choraria A., Dubey H. Medial Sural Artery Perforator Flap for Head and Neck Reconstruction. Maxillofac. Surg. 2018;8(1):61–5.
-
Wolff K.-D. New aspects in free flap surgery: Mini-perforator flaps and extracorporeal flap perfusion. Stomatol. Oral Maxillofac. Surg. 2017;118(4):238–41.
-
Montero P.H., Patel S.G. Cancer of the Oral Cavity. Article in press. Surg. Oncol. Clin. N. Am. 2015;24(3):491–508.
-
Pribaz J., Stephens W., Crespo L., Gifford G. A new intraoral flap: Facial artery musculomucosal (FAMM) flap. Reconstr. Surg. 1992;90:421–25.
-
Sumarroca А., Rodríguez-Bauzà E., Vega C., Fernández M. Reconstruction of Oral Cavity Defects With FAMM (Facial Artery Musculomucosal) Flaps. Exp. Acta Otorrinolaringol Esp. 2015;66(5):275–280.
-
Bozola A.R., Gasques J.A., Carriquiry C.E., Cardoso de Oliveira M. The buccinator musculomucosal flap: anatomic studyand clinical application. Reconstr. Surg. 1989;84:250–7.
-
Joshi A., Rajendraprasad J.S., Shetty K. Reconstruction of intrao-ral defects using facial artery musculomucosal flap. J. Plast. Surg. 2005;58:1061–6.
-
Ayad T., Xie L. Facial artery musculomucosal flap in head andneck reconstruction: a systematic review. Head Neck. 2014.
-
Permacol™ Surgical Implant Crosslinking Review. May 2011. White Paper.
-
Khubezov D.A., Trushin S.N., Ogoretsev A.Yu., Mnichovich M.V., Puchkov D.K. Experience of using the Permacol implant in the experiment and in the clinic.
Russian Medical and Biological Bulletin named after academician I.P. Pavlov. 2014;1:114–20.
-
Wei Mardini: Flaps and reconstructive surgery. 638 р.
-
Volkova L.S., Lalayeva R.I., Mastyukova A.M. and others. M., 1989. 528 p.
Поступила 20.07.18
Принята в печать 20.11.18
Информация об авторах:
К.С. Гилева – к.м.н., пластический хирург, челюстно-лицевой хирург, микрохирург, научный сотрудник отдела разработок высокотехнологичных методов реконструкции лица и шеи ФГБУ «ЦНИИСиЧЛХ», Москва, Россия. Е.А. Миронова – пластический хирург, аспирант отделения реконструктивной челюстно-лицевой хирургии, микрохирургии и эктопротезирования ФГБУ «ЦНИИСиЧЛХ» Минздрава России,
Москва, Россия; e-mail: lena.arise@gmail.com. https://orcid.org/0000-0001- 5362-4114
В статье представлена проблема остаточных, ограниченных дефектов языка и дна полости рта, которые являются частым осложнением хирургического лечения рака слизистой оболочки полости рта. Известно, что первичная реконструкция данной области позволяет эффективно закрывать мягкотканный дефект, образующийся после обширных резекций. На сегодняшний день в этом вопросе не существует стандартных подходов. Предложенная в статье методика пластики для устранения дефекта челюстно-язычного желобка включает химерный лоскут, воссоздающий сложную трехмерную структуру данной области. Описаны в период с сентября 2016 по июль 2018 г. 5 клинических случаев устранения рубцовой деформации дна полости рта и языка с воссозданием анатомической структуры челюстно-язычного желобка с применением FAMM-лоскута и ксеномембраны Permacol. Данная методика позволяет сделать вывод о том, что метод оставляет минимальный донорский ущерб, в качестве пластического материала используется оптимальный донорский материал. Применение комбинированной методики позволяет воссоздать трехмерную модель анатомической зоны.