Для цитирования:
Торшин В.И., Кастыро И.В., Костяева М.Г., Еремина И.З., Ермакова Н.В., Хамидулин Г.В., Шевцова С.Н., Цатурова И.А., Скопич А.А., Попадюк В.И. Влияние экспериментального моделирования септопластики на цитоархитектонику гиппокампа у крыс. Голова и шея. Российский журнал = Head and neck. Russian Journal. 2019;7(4):33–41.
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Doi: 10.25792/HN.2019.7.4.33–41
Цель: оценить влияние моделирования септопластики на изменение цитоархитектоники гиппокампа у крыс.
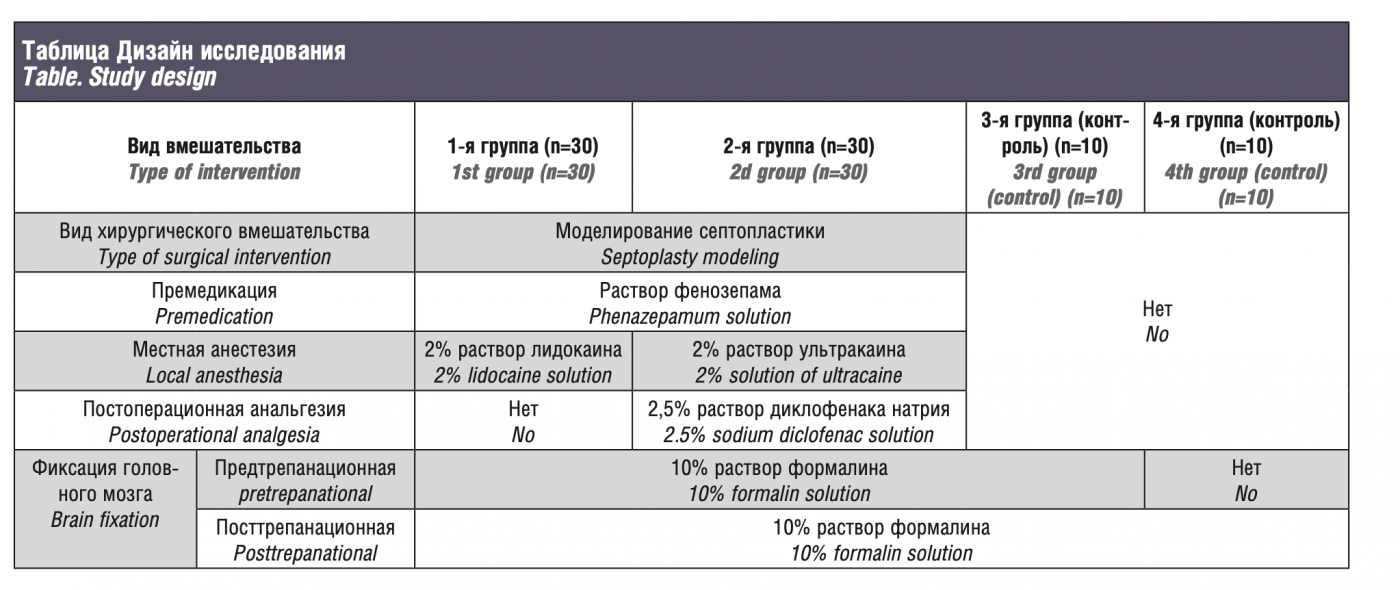
Материал и методы. Исследование проводилось на 80 половозрелых крысах самцах. В экспериментальных 1-й и 2-й группах проводилась премедикация раствором фенозепама. Первая группа: 30 крыс, местная инфильтрационная анестезия 2% раствором лидокаина; 2-я группа: 30 крыс, местная инфильтрационная анестезия 2% раствором ультракаина, послеоперационная анальгезия раствором диклофенака натрия (6 дней); 3-я и 4-я группы были контрольными (по 10 животных). В 1–3-й группах проводилась предтрепанационная фиксация головного мозга, в 4-й группе это не проводили, а подсчитывали артефактные темные нейроны (ТН). Изучали число ТН в гиппокампе на срезах головного мозга, окрашенных гематоксилин-эозином, на 2-й, 6 и 14-й дни после операции.
Результаты. Во 2-й группе в зонах СА1, СА2, СА3 и DG наблюдалось меньшее число ТН по сравнению с 1-й группой на 6-й день (p<0,05), а на 14-й день во 2-й группе число ТН было сопоставимо с 3-й группой в зонах СА1 и СА2 (p<0,05). В 4-й группе по сравнению с 3-й группой число ТН было достоверно выше во всех гиппокампальных зонах (p<0,05).
Выводы. Количественные изменения ТН могут свидетельствовать о влиянии хирургического стресса при моделировании септопластики и различном анестезилогическом пособии на изменения цитоархитектоники в различных отделах гиппокампа.
Ключевые слова: темные нейроны, септопластика, хирургический стресс, моделирование септопластики, гиппокамп
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Objective: to evaluate the effect of septoplasty modeling on changes in the hippocampal cytoarchitectonics in rats. Material and methods. The study was conducted on 80 sexually mature male rats. In the experimental 1st and 2nd groups, premedication with phenazepamum solution was performed. The first group: 30 rats, local infiltration anesthesia with 2% lidocaine solution; the second group: 30 rats, local infiltration anesthesia with 2% ultracaine solution, postoperative analgesia with sodium diclofenac solution (6 days); the 3rd and 4th groups were control (10 animals each). In groups 1–3, pre-trepanation fixation of the brain was performed, in group 4 this was not done, and artifact dark neurons (DN) were counted. We studied the number of DN in the hippocampus on brain sections stained with hematoxylin-eosin on the 2nd, 6th and 14th days after surgery.
Results. In the 2nd group, in the zones CA1, CA2, CA3 and DG, a smaller number of DN was observed compared with the 1st group on the 6th day (p <0.05), and on the 14th day in the 2nd group the number of DN was comparable with the 3rd group in zones CA1 and CA2 (p<0.05). In the 4th group, compared with the 3rd group, the number of DN was significantly higher in all hippocampal zones (p<0.05).
Conclusions. Quantitative changes in DN may indicate the effect of surgical stress in the modeling of septoplasty and various anesthesia on changes in cytoarchitectonics in various parts of the hippocampus. Keywords: dark neurons, septoplasty, surgical stress, septoplasty modeling, hippocampus
The authors declare no conflict of interest.
Source of financing: not specified.
Введение
Любое хирургическое вмешательство является стрессорным фактором для организма и проявляется изменениями в нейрогуморальной регуляции и появлением поведенческих расстройств [1, 2]. Особая роль в регуляции поведения в головном мозге отведена гиппокампу [3, 4].
Гиппокамп может иметь значение для определения чувствительности к депрессогенному воздействию окружающей среды [5]. Результаты многочисленных научных работ выявили, что он очень чувствителен к внешним воздействиям [5]. Экспериментально было показано, что стресс может влиять на объем и функцию гиппокампа [6], а длительное его воздействие может вызывать дендритную атрофию клеток гиппокампа и дефицит памяти [7]. Недавние исследования определили существование определенных нейронных цепей между гиппокампом и другими отделами головного мозга, которые имеют некоторое функциональное значение. В частности, эти цепи регулируют функцию новых нейронов в зубчатой извилине (DG). Морфофизиологические данные свидетельствуют о том, что аксоны из передней перегородки непосредственно активируют зрелые нейроны и образуют синапсы с новообразованными нейронами, увеличивая уровень афферентного возбуждающего входа, тем самым инициируя дифференцировку новых нейронов в гиппокампе [8].
Ранее нами было показано, что хирургические вмешательства в краниофасциальной области представляют особый интерес для оценки острой боли, прогнозирования ее уровня и борьбы с ней [9]. Постоперационный болевой синдром является одной из составляющих хирургического стресса при таком виде ринохирургии, как септопластика. В предыдущих наших исследованиях было показано значение оценки уровня боли в постоперационной анальгезии [10].
На сегодняшний день в доступной нам литературе не встречается исследований, посвященных оценке связи между хирургическим стрессом после вмешательств на перегородке носа и гиппокампальными цитоархитектоническими изменениями.
Цель исследования. Оценить влияние моделирования септопластики на изменение цитоархитектоники гиппокампа у крыс.
Материал и методы
Исследование было проведено на 80 беспородных половозрелых крысах-самцах в возрасте 12–18 месяцев. Все крысы были разделены на 4 группы. Крысам первых двух групп проводилось хирургическое вмешательство на перегородке носа (по 30 крыс в каждой группе). По 10 крыс использовались в двух группах контроля соответственно (см. таблицу).
Дизайн исследования и само исследование были одобрены этическим комитетом Медицинского института ФГАОУ ВО Российский университет дружбы народов. Исследования на животных проводились согласно требованиям Приказа Министерства высшего и среднего специального образования СССР №742 от 13.11.1984 «Правила проведения работ с использованием экспериментальных животных».
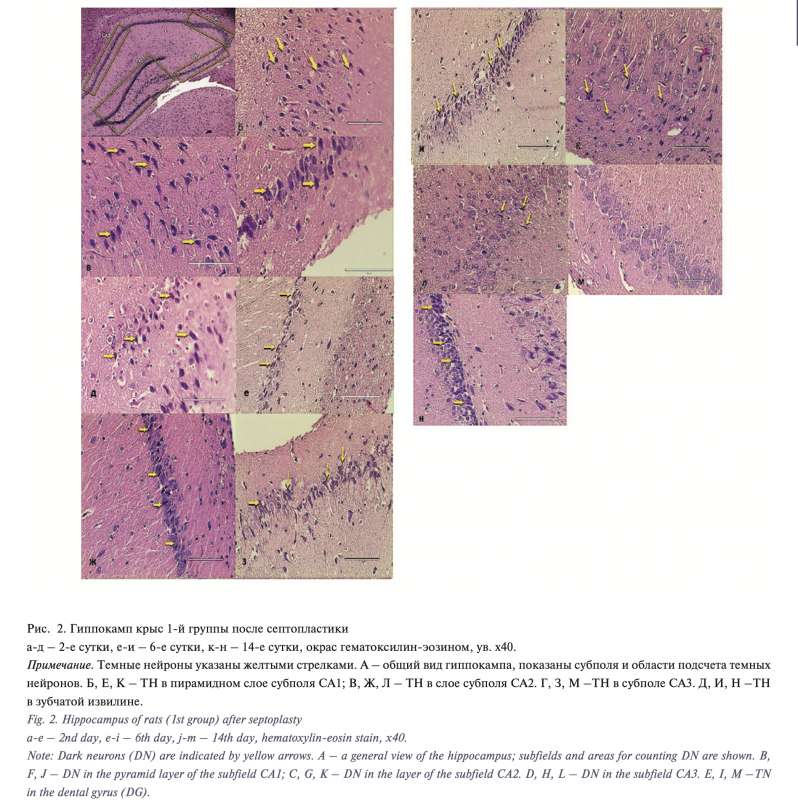
Перед операцией в хвостовую вену вводили раствор фенозепама (0,05 мг/кг). После местной инфильтрационной анестезии проводили зигзагообразную скарификацию слизистой оболочки перегородки носа острым зондом в каудокраниальном направлении. В 1-й группе использовали 0,5 мл раствора лидокаина (20 мг/мл), во 2-й – 0,5 мл раствора ультракаина (20 мг/мл). Во 2-й группе перед операцией и в течение 6 дней после нее внутрибрюшинно вводили раствор диклофенака натрия в дозировке 2 мг/кг. Животных забивали путем гильотинизации. В обеих экспериментальных группах крыс забивали на 2-е, 6 и 14-е сутки после операции по 10 шт. В первых трех группах фиксацию головного мозга проводили предтрепанационно путем введения через сердце физиологического раствора, а затем 10% раствора формалина в течение 5–10 минут. В 4-й группе (группе контроля) предтрепанационной фиксации не проводили. После трепанации черепа головной мозг фиксировали 10% раствором формалина и заключали в парафиновые блоки. Получали 4 среза головного мозга во фронтальной плоскости толщиной 4 мкм от каждой крысы и окрашивали гематоксилином и эозином. Изучали субполя гиппокампа СА1, СА2, СА3 и зубчатую извилину (DG). Подсчитывали абсолютное число темных нейронов (ТН) в пирамидном слое субполей на каждом срезе. Вычисляли средние значения и стандартные ошибки для срезов каждого животного и для группы в соответствующем субполе. Для оценки достоверности различий между группами использовали критерий Манна–Уитни при уровне значимости p <0,05.
Результаты исследования
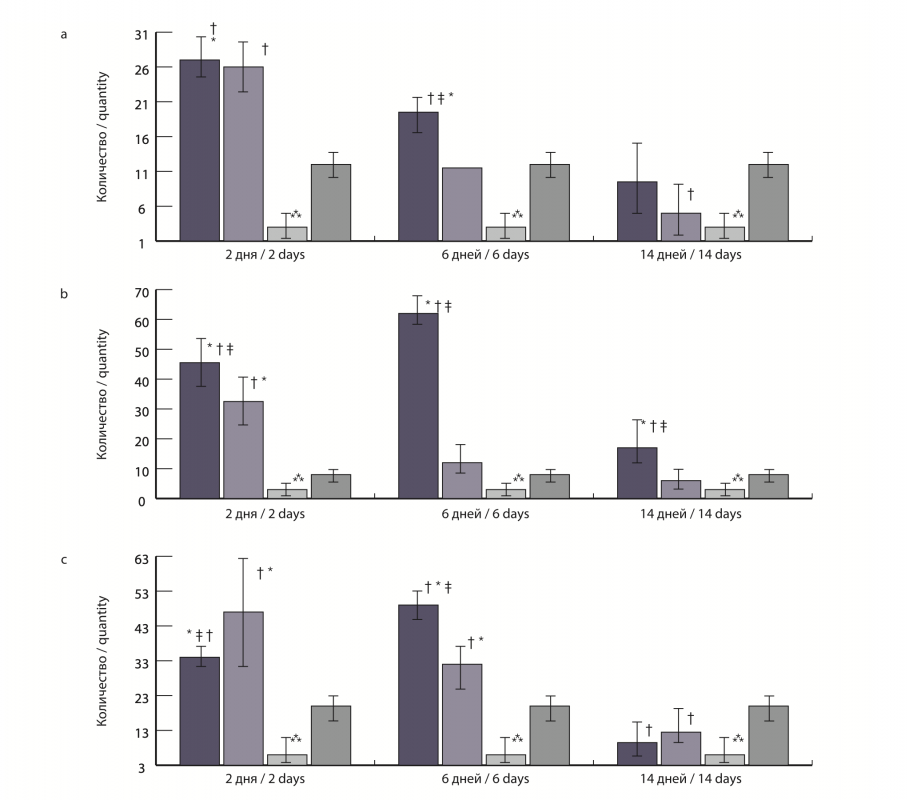
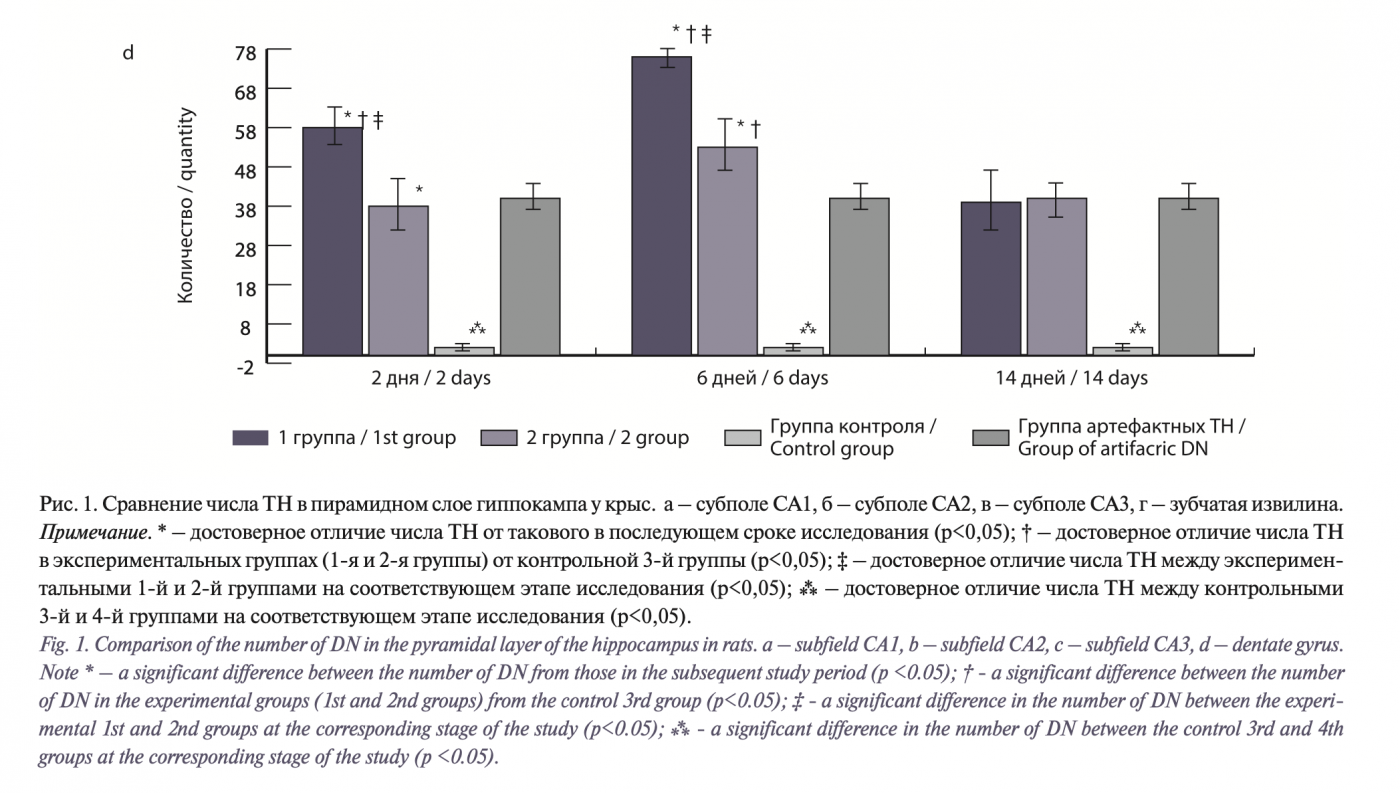
При сравнении результатов между экспериментальными группами, было очевидно, что на 2-е сутки после операции число ТН в СА2 было достоверно выше в 1-й группе (p<0,05) (рис. 1 б, 2 г), а в СА3 и DG – во 2-й группе число ТН было значимо больше (p<0,05) (рис. 1в, г, 3в, г), в СА1 между 1-й и 2-й группами никаких отличий не наблюдалось (p<0,05) (рис. 1б, 2а, 3а). Однако при анализе численности ТН в динамике по группам в обеих экспериментальных группах к 14-му дню отмечалось достоверное снижение числа ТН в СА1 (рис. 2к, 5а); во 2-й группе на 6-й и 14-й дни их было значительно меньше (p<0,05) (рис. 1а, 4а), по сравнению со вторыми сутками после хирургического вмешательства. В СА2 на 6-й и 14-йе дни после операции ТН преобладали в 1-й группе (p<0,05) (рис. 2ж, л), тогда как во 2-й группе их число достоверно уменьшалось по сравнению с предыдущим сроком и по сравнению с 1-й группой (p<0,05) (рис. 1б, 3б, 4б, 5б), а в 1-й группе на 6-й день произошло резкое увеличение их числа, но на 14-е сутки их стало меньше даже по сравнению со 2-м днем после операции (p<0,05). В СА3 у животных 1-й группы наблюдалась похожая картина, как и в СА2, а именно: рост числа ТН на 6-й день и резкое падение на 14-й день (p<0,05) (рис. 1в, 2 г–м). Во 2-й группе в СА3 число ТН с каждым сроком уменьшалось (p<0,05) по сравнению с предыдущими днями наблюдения (рис. 1в, 3в, 4в, 5в, 2м, 5в). В DG на 6-й послеоперационный день по количественному соотношению ТН наблюдалось увеличение их числа в 1-й группе по сравнению со 2-й группой и по сравнению со 2-м днем забоя (p<0,05) (рис. 1г, 2д, 3г. 5г). На 14-й день их численность в 1-й группе достоверно уменьшилась (рис. 2н) по сравнению с 6-м и 2-м днями (p<0,05). У животных 2-й группы в зубчатой извилине наблюдалась отрицательная динамика числа ТН на 14-й день (p<0,05) (рис. 5г).
Обсуждение
Анестезиологическое пособие. В клинической практике септопластика может проводиться как в хрящевом, так и в костном отделах [10]. Наиболее часто для местной анестезии используют прокаин и лидокаин. Однако учитывая, что в процессе септопластики у человека заинтересована и костная ткань (сошник, решетчатая кость, твердое небо), нам представилось интересным изучить влияние на стрессовый ответ артикаина. Для уменьшения носового кровотечения, вызванного травматизацией полости носа, было использовано сочетание артикаина с адреналином (0,5 мг/100 мл). Известно, что среди всех местных анестетиков именно артикаин обладает наилучшей проницаемостью в костную ткань [11, 12]. Для уменьшения послеоперационного воспаления во 2-й экспериментальной группе был применен диклофенак натрия.
Формирование ТН и артефактные ТН. Отличительной особенностью всех ТН является гипербазофилия, гипераргирофилия, гиперэлектронная плотность и резкое уплотнение ультраструктурных элементов [13]. Среди темных нейронов в настоящее время по обратимости процесса формирования ТН и причинам возникновения ТН выделяют следующие типы: необратимые эксайтотоксические, необратимые неостриатальные, обратимые и артефактные [14]. Однако для каждого из этих типов характерны общие морфологические характеристики, проявляющиеся в виде резкого уплотнения всех ультраструктурных элементов в области перикариона и дендритов. Согласно гипотезе F. Gallyas и соавт. [15], формирование «темных» нейронов состоит из инициирующего и исполнительного процессов. В то время как инициирующий фактор демонстрирует широкое разнообразие биохимических процессов (различные патобиохимические каскады или мгновенные физические повреждения, например, ишемия или травма головы), процесс исполнения является одним и тем же физическим событием – фазовый переход гель-гель [16]. Самая важная особенность дегенерации нейронов заключается в том, что она неоднородна по внешнему виду, тогда как артефактные темные нейроны всегда мономорфны [17]. В связи с существующим мнением, что ТН всегда представляют собой артефакт [18], в нашем исследовании мы ввели дополнительную группу контроля (4-я группа артефактных ТН) без предтрепанационной перфузии головного мозга для того, чтобы подтвердить или опровергнуть значимость влияния хирургического стресса в формировании ТН. Число ТН в 4-й группе контроля во всех субполях гиппокампа было достоверно выше, чем в 3-й группе контроля (p<0,05) (рис. 1). На 2-е послеоперационные сутки во всех группах и во всех зонах (исключение DG 2-й группы, где число ТН достоверно не отличалось от 4-й группы) (p<0,05) ТН было больше в экспериментальных группах по сравнению с группой артефактных нейронов (p<0,05) (рис. 6). В аммониевом роге (СА1, СА3) на 14-е сутки в 4-й группе число ТН было достоверно выше (рис. 1а, в, рис. 6д, ж) по сравнению со 2-й группой (p<0,05), и только в 1-й группе их число было больше в СА1 и СА2 по сравнению с группой артефактных ТН (p<0,05) (рис. 1а, б). По нашему мнению, полученные данные свидетельствуют о том, что в экспериментальных группах если и имело место возникновение артефактных ТН, то оно не повлияло значимо на общее количество темных нейронов. Об этом говорит и различие между обеими контрольными группами (рис. 6а–з).
Экспериментальные исследования свидетельствуют, что хирургическая травма вызывает нарушение поведения и провоцирует нейровоспалительные реакции в мозге крыс [19, 20]. У человека психологический стресс сопутствует основной операции и возникает до ее начала. Известно, что он воздействует на 60–80% пациентов хирургических отделений [21]. Провоспалительные цитокины ингибируют нейрональные функции гиппокампа, включая долговременную потенциацию и дендритное разветвление, которые участвуют в формировании и поддержании памяти [22]. В частности, интерлейкин-1β модулирует NMDA-AMPA-рецепторы в гиппокампе [23]. Каспазный каскад также может активировать глутаматные рецепторы, что приводит к формированию темных нейронов в головном мозге [24]. В нашем исследовании число ТН преобладало именно в 1-й группе, где проводилось минимальное анестезиологическое пособие. Аммониев рог. В исследовании D. Kim и соавт. в эксперименте на крысах по пересечению обоих подъязычных нервов, выполняющих двигательную иннервацию языка и вкусовую перцепцию, было выявлено, что моторные повреждения сопровождались уменьшением числа нейронов в областях CA1 и CA3. В пределах дорсального гиппокампа области CA1 и CA3 важны для сохранения памяти [25]. Например, атрофия апикальных дендритов или снижение плотности в телах нейронов CA1 и CA3 приводит к нарушениям памяти у крыс и мышей [26, 27], а уменьшение объема гиппокампа в зоне CA3 или DG у людей связаны с проблемами обучения и памяти [28]. Результаты настоящего исследования четко показывают, что имеются различия в СА1 и СА2 субполях на 6-й и 14-й дни между экспериментальными группами. Так, число ТН было значительно выше в группе с заведомо неадекватным обезболиванием (рис. 1а, б). В зоне СА3 большая численность ТН наблюдалась на 6-й день после хирургической травматизации перегородки носа именно в 1-й группе (рис. 1в). Данные настоящего исследования подтверждаются результатами предыдущих наших работ, в которых было показано, что само хирургическое вмешательство на перегородке носа ведет к изменениям в поведенческих реакциях у крыс – уменьшению двигательной активности и нарушению неассоциативной памяти [29]. DG. Известно, что новые нейроны в течение жизни продолжают возникать в субгранулярной зоне зубчатой извилины гиппокампа [30, 31]. Дифференцирующие нейроны созревают в новые клетки [31], одновременно мигрируя в различные части гиппокампа. Этот процесс связан с обучением и памятью, стрессом и физическими упражнениями и считается, что он может изменяться при неврологических заболеваниях. В одних исследованиях было показано, что у взрослых людей в зубчатой извилине ежедневно возникают сотни новых нейронов [32], в других исследованиях было выявлено гораздо меньшее число предполагаемых новых нейронов [33, 10, 34]. Несмотря на эти расхождения, обычно считается, что взрослый человеческий гиппокамп продолжает генерировать новые нейроны.
Показано, что нейрогенез в зубчатой извилине представляет собой многоступенчатый процесс, посредством которого стеблеподобные клетки-предшественники пролиферируют в пред- эволюционные предшественники, дифференцируются в незрелые нейроны и затем созревают в полностью функциональные нейроны клеток гранулярного слоя, которые интегрируются в систему гиппокампа [35].
Предполагается, что уменьшение нейрогенеза в зубчатой извилине может способствовать уменьшению числа клеток в областях CA1 и CA3 гиппокампа у крыс с моторными нарушениями, которые является частью нейронных механизмов, ответственных за когнитивные нарушения, индуцированные повреждениями [25].
В настоящем исследовании было выявлено большее число ТН в зубчатой извилине в 1-й группе (с минимальным анестезиологическим пособием: местный анестетик – лидокаин, нестероидные противовоспалительные средства не применялись) на 2-й и 6-й дни в СА1, СА2 и DG, на 6-й день в СА3 по сравнению со 2-й группой и группами контроля. В контрольной 3-й группе отмечалось небольшое число ТН по сравнению с группами с хирургическим вмешательством. Это можно объяснить отсутствием стресс-фактора – моделирования септопластики.
На основании данных, полученных нами в настоящем исследовании, а также результатов исследований других авторов, можно предположить, что, вероятно, существует баланс между погибающими нейронами и появлением новых дифференцированных клеток в норме, а возникновение ТН говорит, возможно, о нарушении этого баланса. Безусловно, что такие данные требуют дополнительных исследований в области ассоциативной памяти и расстройств обонятельного анализатора при моделировании септопластики в дальнейших экспериментальных работах.
Заключение
Изменение цитоархитектоники зон СА1, СА2 и DG гиппокампа может служить критерием выраженности послеоперационного стресса и качества периоперационного анестезиологического пособия в эксперименте при моделировании септопластики. Для того, чтобы предотвратить формирование артефактных ТН и получение ложноположительного результата, необходимо соблюдать такое важное методологическое условие, как предтрепанационная перфузионная фиксация головного мозга. Неполноценная противоболевая и противовоспалительная постоперационная терапия в эксперименте при моделировании септопластики у крыс провоцирует выраженный хирургический стресс-ответ и, вероятно, нарушение в функционировании нейронов гиппокампа, что проявляется в возникновении ТН во всех его отделах.
ЛИТЕРАТУРА
-
Santos M.M.B. dos, Martins J.C.A., Oliveira L.M.N. Anxiety, depression and stress in the preoperative surgical patient. Revista de Enfermagem Referência. 2014;IV(3):7–15.
-
Wetzel C.M., Kneebone R.L., Woloshynowych M., Nestel D., Moorthy K., Kidd J., Darzi A. The effects of stress on surgical performance. J. Surg. 2006;191(1):5–10.
-
Glickman S.E., Higgins T.J., Isaacson R.L. Some effects of hippocampal lesions on the behavior of Mongolian gerbils. Behav. 1970;5(8):931–8.
-
Moadab G., Bliss-Moreau E., Bauman M.D., Amaral D.G. Early amygdala or hippocampus damage influences adolescent female social behavior during group formation. Neurosci. 2017;131(1):68–82.
-
Whittle S., Yap M.B., Sheeber L., Dudgeon P., Yücel M., Pantelis C., Simmons J.G., Allen N.B. Hippocampal volume and sensitivity to maternal aggressive behavior: a prospective study of adolescent depressive symptoms. Psychopathol. 2011;23(1):115–29.
-
Bagot R.C., van Hasselt F.N., Champagne D.L., Meaney M.J., Krugers H.J., Joels M. Maternal care determines rapid effects of stress mediators on synaptic plasticity in adult rat hippocampal dentate gyrus. Learn. Memory. 2009;92:292–300.
-
Brunson K.L., Kramar E., Lin B., Chen Y.C., Colgin L.L., Yanagihara T.K., et al. Mechanisms of late-onset cognitive decline after early-life stress. J. Neurosci. 2005;25:9328–38.
-
Vivar C., Potter M.C., Choi J. Monosynaptic inputs to new neurons in the dentate gyrus. Commun. 2012;3:1107.
-
Попадюк В.И., Кастыро И.В., Ермакова Н.В., Торшин В.И. Септопластика и тонзиллэктомия: сравнение эффективности местных анестетиков с позиций острого стресс-ответа. Вест. оториноларин гологии. 2016;81(3):7–11. [Popadyuk V.I., Kastyro IV., Ermakova N.V., Torshin V.I. Septoplasty and tonsillectomy: acute stress response as a measure of effectiveness of local anesthetics. Vestn. Otorinolaringol. 2016;81(3):7–11.] (In Russ.). doi: 10.17116/otorino20168137-11.
-
Kastyro I.V., Torshin V.I., Drozdova G.A., Popadyuk V.I. Acute pain intensity in men and women after septoplasty. Open Med. J. 2017;6(3):305–10.
-
Kolli N.K., Nirmala S.V., Nuvvula S. The effectiveness of articaine and lidocaine single buccal infiltration versus conventional buccal and palatal injection using lidocaine during primary maxillary molar extraction: a randomized control trial. Essays Res. 2017;11(1):160–4.
-
Syed G.A., Mulay S. Articaine vs lidocaine: a review. IOSR J. Dent. Med. Sci. 2014;13(9):40–4.
-
Kövesdi E., Pál J., Gallyas F. The fate of “dark” neurons produced by transient focal cerebral ischemia in a non-necrotic and non-excitotoxic environment: neurobiological aspects. Brain Res. 2007;1147:272–83.
-
Graeber M.B., Blakemore W.F., Kreutzberg G.W. Cellular pathology of the central nervous system. In: Graham D.I., Lantos P.L. (eds) Greenfield’s neuropathology. Vol 1. Arnold, London. 126 p.
-
Gallyas F., Farkas O., Mázló M. Gel-to-gel phase transition may occur in mammalian cells: mechanism of formation of “dark” (compacted) neurons. Cell. 2004;96:313–24.
-
Gallyas F., Csordás A., Schwarcz A., Mázló M. “Dark” (compacted) neurons may not die through the necrotic pathway. Brain Res. 2005;160(4):473–86.
-
Garman R.H. Histology of the central nervous system. Pathol. 2011;39(1):22–35.
-
Jortner B.S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. 2006;27(4):628–34.
-
Cao X.Z., Ma H., Wang J.K., Liu F., Wu B.Y., Tian A.Y. Postoperative cognitive deficits and neuroinflammation in the hippocampus triggered by surgical trauma are exacerbated in aged rats. Neuropsychopharmacol. Biol. Psychiatry. 2010;34(8):1426–32.
-
Ma Y., Cheng Q., Wang E., Li L., Zhang X. Inhibiting tumor necrosis factoralpha signaling attenuates postoperative cognitive dysfunction in aged rats. Med. Rep. 2015;12(2):3095–100.
-
Shevde K., Panagopoulos G. A survey of 800 patients’ knowledge, attitudes, and concerns regarding anesthesia. Analg. 1991;73(2):190–8.
-
Vasconcelos A.R., Yshii L.M., Viel T.A., Buck H.S., Mattson M.P., Scavone C. Intermittent fasting attenuates lipopolysaccharide-induced neuroinflammation and memory impairment. Neuroinflammat. 2014;11:85.
-
Lai A.Y., Swayze R.D., El-Husseini A., Song’ C. Interleukin-1 beta modulates AMPA receptor expression and phosphorylation in hippocampal neurons. 2006;175(1–2):97–106.
-
Strahlendorf J., Box C., Attridge J., Diertien J., Finckbone V., Henne W.M., Medina M.S., Miles R., Oomman S, Schneider M, Singh H, Veliyaparambil M, Strahlendorf H. AMPA-induced dark cell degeneration of cerebellar Purkinje neurons involves activation of caspases and apparent mitochondrial dysfunction. Brain Res. 2003;1994(2):146–59.
-
Kim D., Chung S., Lee S.-H., Choi S.-Y., Kim S.-M., Koo J.H., Lee J.-H. Decreased hippocampal brain-derived neurotrophic factor and impaired cognitive function by hypoglossal nerve transection in rats. Cell. Mol. Med. 2017;21(12):3752–60.
-
McEwen B.S. Stress and hippocampal plasticity. Rev. Neurosci. 1999;22:105–22.
-
Onozuka M., Watanabe K., Mirbod S.M., et al. Reduced mastication stimulates impairment of spatial memory and degeneration of hippocampal neurons in aged SAMP8 mice. Brain Res. 1999;826:148–53.
-
Yassa M.A., Stark S.M., Bakker A. Highresolution structural and functional MRI of hippocampal CA3 and dentate gyrus in patients with amnestic mild cognitive impairment. 2011;51:1242–52.
-
Кастыро И.В., Иноземцев А.Н., Попадюк В.И., Торшин В.И., Хамидуллин Г.В., Баринов А.В., Гулинов К.А., Ермакова Н.В. Воздействие травматизации слизистой оболочки полости носа на поведенческие реакции у крыс в эксперименте. Голова и шея. Российский журнал = Head and neck. 2018;2(Прил.):59–60. [Kastiro I.V., Inozemtsev A.N.,
Popadyuk V.I., Torshin V.I., Khamidullin G.V., Barinov A.V., Gulinov K.A., Ermakova N.V. The impact of trauma to the mucous membrane of the nasal cavity on the behavioral reactions in rats in the experiment. Golova I Sheya. Russian Journal = Head and neck. Rus. J. 2018;2 (App.):59–60.] (In Russ).
-
Patzke N., Spocter M.A., Karlsson K.Æ., Bertelsen M.F., Haagensen M., Chawana R., Streicher S., Kaswera C., Gilissen E., Alagaili A.N., Mohammed O.B., Reep R.L., Bennett N.C., Siegel J.M., Ihunwo A.O., Manger P.R. In contrast to many other mammals, cetaceans have relatively small hippocampi that appear to lack adult neurogenesis. Brain Struct. Funct. 2015;220: 361–83.
-
Praag H. van, Schinder A.F., Christie B.R., Toni N., Palmer T.D., Gage F.H. Functional neurogenesis in the adult hippocampus. 2002;415:1030–4.
-
Spalding K.L., Bergmann O., Alkass K., Bernard S., Salehpour M., Huttner H.B., Boström E., Westerlund I., Vial C., Buchholz B.A., Possnert G., Mash D.C., Druid H., Frisén J. Dynamics of hippocampal neurogenesis in adult humans. 2013;153:1219–27.
-
Dennis C.V., Suh L.S., Rodriguez M.L., Kril J.J., Sutherland G.T. Human adult neurogenesis across the ages: an immunohistochemical study. Appl. Neurobiol. 2016;42:621–38.
-
Knoth R., Singec I., Ditter M., Pantazis G., Capetian P., Meyer R.P., Horvat V., Volk B., Kempermann G. Murine features of neurogenesis in the human hippocampus across the lifespan from 0 to 100 years. PLoS ONE. 2010;5:e8809.
-
Goncalves J.T., Schafer S.T., Gage F.H. Adult neurogenesis in the hippocampus:from stem cells to behavior. 2016;167:897–914.
Поступила 04.08.19
Принята в печать 29.11.19
Received 04.08.19
Accepted 29.11.19
Информация об авторах:
В.И. Торшин – д.б.н., профессор, заведующий кафедрой нормальной физиологии ФГАОУ ВО Российский университет дружбы народов, Москва, Россия
И.В. Кастыро – к.м.н., PhD, ассистент кафедры нормальной физиологии ФГАОУ ВО Российский университет дружбы народов, Москва, Россия; e-mail: ikastyro@gmail.com.
М.Г. Костяева – к.б.н., старший преподаватель кафедры гистологии, цитологии и эмбриологии ФГАОУ ВО Российский университет дружбы народов, Москва, Россия
И.З. Еремина – к.б.н., доцент кафедры гистологии, цитологии и эмбриологии ФГАОУ ВО Российский университет дружбы народов, Москва, Россия
Н.В. Ермакова – д.м.н., профессор кафедры нормальной физиологии ФГАОУ ВО Российский университет дружбы народов, Москва, Россия
Г.В. Хамидулин – студент VI курса медицинского института РУДН, кафедра нормальной физиологии ФГАОУ ВО Российский университет дружбы народов, Москва, Россия; e-mail: gkhamidulin@mail.ru
С.Н. Шевцова – студентка III курса медицинского института РУДН, кафедра нормальной физиологии ФГАОУ ВО Российский университет дружбы народов, Москва, Россия
И.А. Цатурова – студентка III курса медицинского института РУДН, кафедра нормальной физиологии ФГАОУ ВО Российский университет дружбы народов, Москва, Россия
Рецензия на статью
А.А. Скопич – студентка III курса медицинского института РУДН, кафедра нормальной физиологии ФГАОУ ВО Российский университет дружбы народов, Москва, Россия
В.И. Попадюк – д.м.н., профессор, заведующий кафедрой оториноларингологии ФГАОУ ВО Российский университет дружбы народов, Москва, Россия
Information about the authors:
V.I. Torshin – Doctor of Biological Sciences, Professor, Head of the Department of Normal Physiology, FSAEI of HE Peoples’ Friendship University of Russia, Moscow, Russia
I.V. Kastyro – PhD, assistant professor of normal physiology, FSAEI of HE Peoples’ Friendship University of Russia, Moscow, Russia; e-mail: ikastyro@gmail.com.
M.G. Kostyaeva – PhD of Biological Sciences, Senior Lecturer, Department of Histology, Cytology and Embryology, FSAEI of HE Peoples’ Friendship University of Russia, Moscow, Russia
O/F. Eremina – Ph.D., Associate Professor, Department of Histology, Cytology and Em.ryology, FSAEI of HE Peoples’ Friendship University of Russia, Moscow, Russia
N.V. Ermakova – Doctor of Medicine, Professor, Department of Normal
Physiology, FSAEI of HE Peoples’ Friendship University of Russia, Moscow, Russia
G.V. Khamidulin – VI-year student of the Medical Institution of FSAEI of HE Peoples’ Friendship University of Russia, Department of Normal Physiology, Moscow, Russia; e-mail: gkhamidulin@mail.ru
S.N. Shevtsova – III-year student of the Medical Institution of FSAEI of HE Peoples’ Friendship University of Russia, Department of Normal Physiology, Moscow, Russia
I.A. Tsaturova – III-year student of the Medical Institution of FSAEI of HE
Peoples’ Friendship University of Russia, Department of Normal Physiology, Moscow, Russia
A.A. Skopic – III-year student of the Medical Institution of FSAEI of HE Peoples’
Friendship University of Russia, Department of Normal Physiology, Moscow, Russia
V.I. Popadyuk – Doctor Of Medicine, Professor, Head of the Department of Otorhinolaryngology, FSAEI of HE Peoples’ Friendship University of Russia,
Moscow, Russia
Статья посвящена теме, ставшей на сегодняшний день вновь актуальной. Изучена цитоархитектоника гиппокампальных отделов при хирургическом стрессе в области перегородки носа у крыс. Показано, что качественная анальгезия способствует уменьшению образования темных нейронов в указанных структурах, а также авторами сделан вывод о возможном влиянии хирургического стресса на изменения цитоархитектоники отделов гиппокампа. Статья может быть опубликована.