Для цитирования:
Саакян С.В., Хлгатян М.Р., Цыганков А.Ю., Мякошина Е.Б., Бурденный А.М., Логинов В.И. Морфометрические и генетические предикторы опухолевой трансформации при меланоцитарных внутриглазных новообразованиях. Голова и шея. Российский журнал=Head and neck. Russian Journal. 2020;8(4):8–16
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
For citation:
Saakyan S.V., Khlgatyan M.R., Tsygankov A.Yu., Myakoshina E.B., Burdennyi A.M., Loginov V.I. OCT-morphometric and genetic predictors of the malignant transformation in melanocytic intraocular tumor. Head and neck. Russian Journal. 2020;8(4):8–16 (In Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients.
Doi: 10.25792/HN.2020.8.4.8–16
Цель исследования – определить морфометрические и генетические предикторы опухолевой трансформации меланоцитарных внутриглазных новообразований.
Материал и методы. В проспективном исследовании проанализирован 81 пациент (84 глаза) с меланоцитарными внутриглазными новообразованиями. Всем больным проводили стандартное офтальмологическое обследование и специальные инструментальные методы диагностики (ультразвуковое исследование – УЗИ, оптическая когерентная томография в режиме улучшенного глубокого изображения – ОКТ в режиме «EDI» с ангиографическим режимом – ОКТ−А). Больные были разделены на 3 группы с учетом особенностей клинической картины. Всем пациентам проводили органосохранное лазерное лечение (n=36) и брахитерапию (n=1). Для исключения отдаленных метастазов больным выполняли магнитно-резонансную томографию органов брюшной полости с контрастированием и компьютерную томографию органов грудной клетки. Изучение мутаций в генах GNAQ/GNA11 осуществляли с помощью анализа кривых плавления и метода определения полиморфизма длины рестрикционных фрагментов (ПЦР-ПДРФ-анализ). В качестве контрольной группы использовали выборку лиц без онкологических заболеваний, сопоставимую по возрасту и полу (n=31).
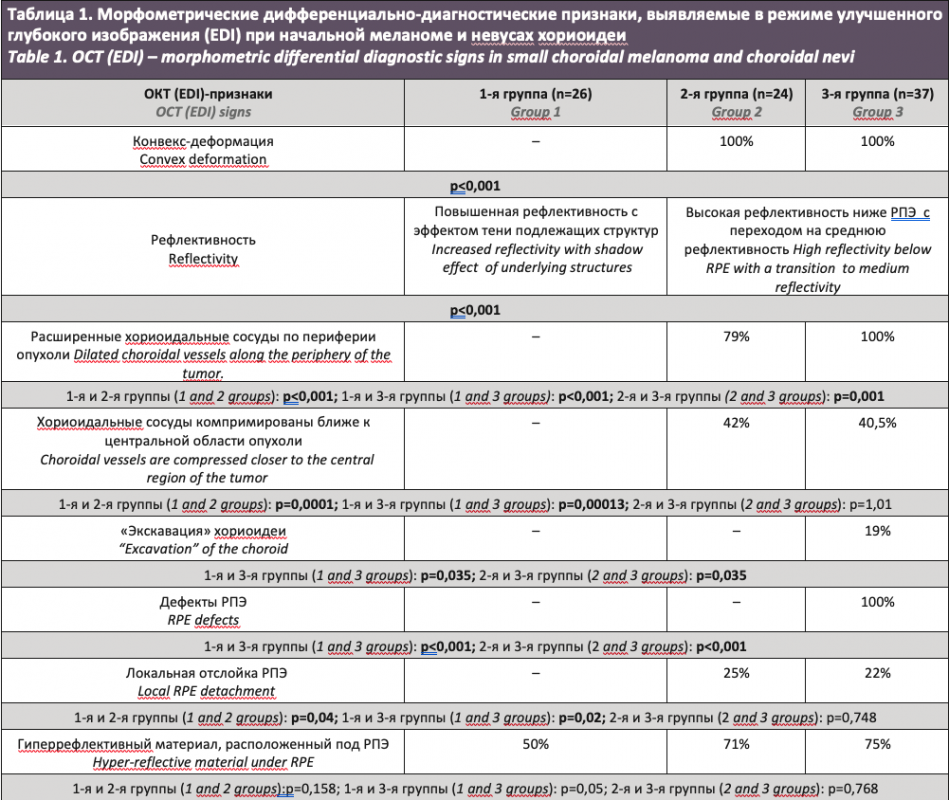
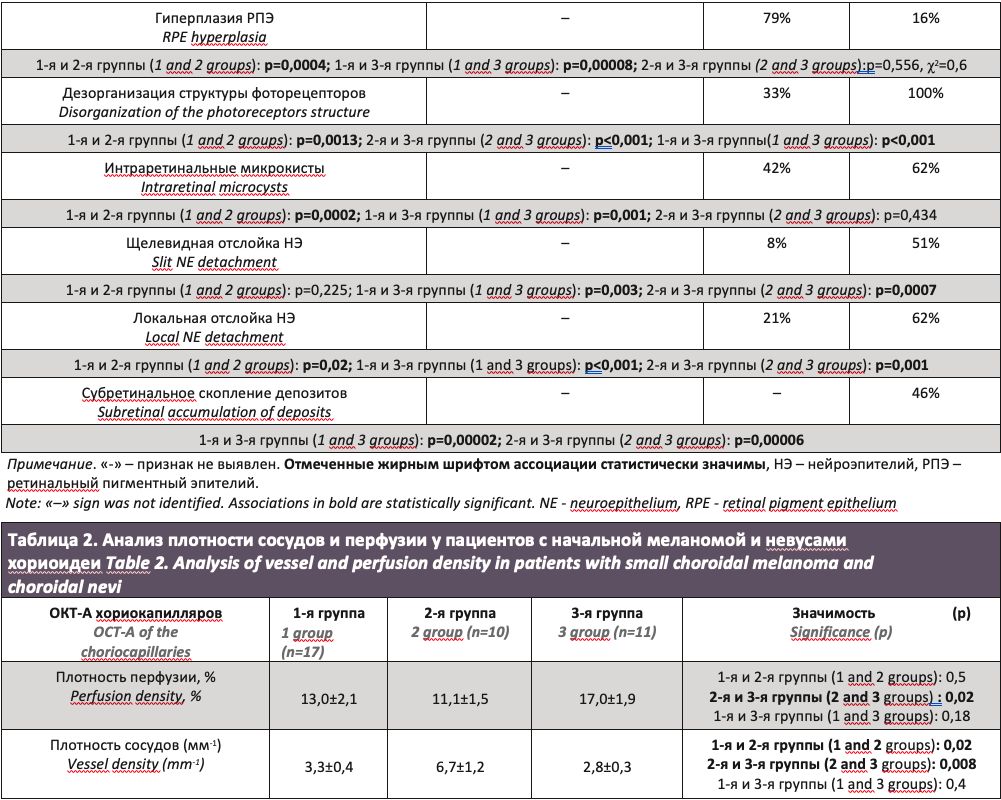
Результаты. При сравнительном анализе выявлены значимые предикторы прогрессии стационарного невуса хориоидеи в прогрессирующий, к которым относятся конвекс-деформация ретино-хориоидального профиля, ослабление гиперрефлективности на уровне хориокапилляров, расширение перитуморальных хориоидальных сосудов и компримирование их в центральной зоне, локальная отслойка и выраженная гиперплазия ретинального пигментного эпителия, щелевидная и локальная отслойка нейроэпителия, интраретинальные микрокисты, дезорганизация структуры фоторецепторов. Кроме того, определяли предикторы озлокачествления прогрессирующего невуса в начальную меланому хориоидеи. Количест-венный анализ плотности сосудов на уровне хориокапилляров показал увеличение изучаемого параметра при прогрессирующем невусе хориоидеи по сравнению с начальной меланомой и стационарным невусом, что могло служить предиктором опухолевого роста.
Заключение. В настоящей работе впервые с помощью ОКТ в режиме «EDI» и ОКТ-А выявлен симптомокомплекс предиктивных маркеров, включающих хориоидальные и опухоль-ассоциированные ретинальные изменения, характеризующие прогрессию и озлокачествление невусов хориоидеи. Кроме того, диагностированы молекулярно-генетические особенности в периферической крови у пациентов с невусами и начальной меланомой хориоидеи. Выявленные показатели могут быть использованы для скрининга пациентов с невусом хориоидеи с высоким риском малигнизации, а также для разработки современных подходов к прогнозированию течения меланомы хориоидеи на ранних стадиях онкогенеза.
Ключевые слова: невус хориоидеи, начальная меланома хориоидеи, увеальная меланома, ОКТ, ОКТА, онкогены GNAQ и GNA11
Aim. To determine OCT-morphometric and genetic predictors of the malignant transformation in melanocytic intraocular tumors.
Material and methods. 81 (84 eyes) previously untreated patients with melanocytic intraocular tumors were examined. All patients underwent standard ophthalmological examination and special instrumental diagnostic assessment (ultrasound examination (US), enhanced depth imaging (EDI) optical coherence tomography (OCT), OCT angiography). The bilateral form was diagnosed in 2 (2.4%) patients: in the first case, the benign and suspicious choroidal nevi were detected in the paired eye, in the second case, small choroidal melanoma in both eyes. Multifocal lesions were determined in 3 (4%) patients: in the first case, foci with small melanoma and suspicious choroidal nevus were diagnosed. In the second and third cases, two and three foci with a benign choroidal nevus were identified. Patients were assigned to the following groups: 1st group – with benign choroidal nevus (n=26 foci; mean age 61.1±13.6 years). Gender distribution: female – 18, male – 5. Multifocal lesions were diagnosed in 2 patients (2 and 3 lesions). Thus, the study included 26 benign choroidal nevi. US showed no detectable tumor. 2nd group consisted of patients with suspicious choroidal nevus (n=24 foci; mean age 55±13 years). Gender distribution: female – 22, male – 3. Mean tumor thickness was 0.5±0.1 mm, basal diameter – 5.4±1.9 mm. 3rd group – small choroidal melanoma (n=37 foci; mean age 56.2±14.8 years). Genotyping was performed by high resolution melting analysis. Gender distribution: female – 27, male – 9. Average tumor size according to US was 1,3±0,4 mm (thickness) and 6.9±2.1 mm (basal diameter). All patients underwent laser treatment (n=36) and brachytherapy (n=1). To exclude distant metastases, the patients underwent contrast-enhanced magnetic resonance imaging of the abdominal organs and computed tomography of the chest. Mutations in GNAQ/GNA11 oncogenes were detected using the high resolution melting and polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) analyses. The control group was a cohort of individuals without malignancies, comparable in age and sex (n=31).
Results. Comparative analysis revealed statistically significant predictors of benign choroidal nevus progression into a suspicious choroidal nevus, which include convex deformation of the retino-choroidal profile, weakening of hyperreflectivity at the choriocapillaries level, expansion of the peritumoral choroidal vessels and their compression in the central zone, local detachment and severe hyperplasia of the retinal pigment epithelium (RPE), slit-like and local detachment of the retinal neuroepithelium (NE), intraretinal microcysts, disorganization of the photoreceptor structure (p<0.05). In addition, predictors of a suspicious nevus transformation into the small choroidal melanoma were determined, which include choroidal “excavation”, defects in RPE, «shaggy» photoreceptors, accumulation of subretinal hyperreflective deposits (p<0.05). A quantitative analysis of vascular density at the choriocapillaries level showed an increase in the studied parameters in suspicious choroidal nevus compared with small melanoma and benign nevi (p<0.05), which could be a predictor of tumor growth. A significant increase in the density of perfusion of small choroidal melanoma was revealed when compared with group 2 (p=0.02). A comparative analysis of three groups and the control group revealed that mutations in the GNAQ and GNA11 genes in circulating tumor DNA are significantly more common in patients with small melanoma and choroidal nevi. In the control group, oncogenes in circulating tumor DNA were not detected. In patients with small melanoma and suspicious choroidal nevi, mutations in GNAQ/GNA11 in blood are significantly more common than in patients with benign choroidal nevi (1 and 3 groups; p=0.0004; 1 and 2 groups: p=0.0008). In groups 2 and 3, there were no significant differences depending on the presence of mutations in GNAQ and GNA11 genes (p>0.05), which may indicate a high risk of transformation of a suspicious nevus into choroidal melanoma.
Conclusion. In the present paper, a symptom complex of predictive markers was revealed for the first time using EDI-OCT and OCT-A, including the choroidal and the tumor-associated retinal changes that characterize the progression and malignancy of choroidal nevi. Genetic features in circulating tumor DNA were diagnosed in patients with nevi and small choroidal melanoma. The revealed features can be used for screening in patients with high-risk choroidal nevi, as well as for developing modern approaches to predict the course of choroidal melanoma in the early stages of oncogenesis.
Key words: choroidal nevus, small choroidal melanoma, uveal melanoma, OCT, OCT-A, GNAQ and GNA11 oncogenes
Введение
Меланома хориоидеи является злокачественной внутриглазной опухолью, которая имеет нейроэктодермальное происхож- дение и развивается из меланоцитов увеального тракта [1]. В связи с полиморфностью клинической картины меланому хориоидеи на начальных стадиях онкогенеза трудно дифференцировать с невусом [1–3]. Невус хориоидеи является доброкачественной опухолью, однако может подвергаться малигнизации в 1–51% случаев [4]. Кроме того, ряд авторов в своих работах упоминают о нетипичных («подозрительных» или «прогрессирующих») невусах, которые трудно дифференцировать с начальной меланомой хориоидеи в связи со сходной офтальмоскопической картиной [3]. В связи с этим многие специалисты продолжают рекомендовать тщательные регулярные осмотры пациентов с невусом хориоидеи для выявления первых признаков его озлокачествления [3].
В арсенал современных инструментальных методов исследования начальной меланомы и невусов хориоидеи входит оптическая когерентная томография в режиме улучшенного глубокого изображения (ОКТ в режиме «Enhanced depth imaging – EDI») и в ангиографическом режиме (ОКТ-А) [5–8]. Модификация ОКТ в режиме «EDI» обеспечивает визуализацию не только сетчатки, но и хориоидальных структур, что особенно важно в диагностике опухолей сосудистой оболочки [6–7]. В публикуемых работах существуют противоречивые мнения о значимости ОКТ-признаков в диагностике изменений в хориоидеи и выявлении опухоль-ассоциированной эпителиопатии при невусах и меланоме [5, 9, 10]. На сегодняшний день не определены дифференциально-диагностические предикторы опухолевой прогрессии невуса хориоидеи и его малигнизации с помощью морфометрического исследования.
ОКТ-А основан на оценке колебаний амплитуды отраженного сигнала между последовательными срезами, что позволяет провести оценку кровотока сосудистой сети сетчатки и хориоидеи [5]. Изучены качественные и количественные особенности сосудис- той сети в поверхностном и глубоком слоях как у пациентов с невусом хориоидеи, так с начальной меланомой хориоидеи [5, 8, 11–14]. Тем не менее наличие немногочисленных работ о применении метода ОКТ-А при начальной меланоме и невусах хориоидеи диктует необходимость выявления дифференциально-диагностических предикторов опухолевой прогрессии невуса хориоидеи и его злокачественной трансформации [5, 8, 11–14]. В современной медицине большое значение приобретают молекулярно-генетические маркеры [15]. Наличие мутации в генах GNAQ и GNA11 для пациентов с меланомой хориоидеи являются патогномоничными, частота встречаемости которой может достигать 96% случаев [15]. Указанные маркеры исследуются при молекулярно-генетическом исследовании опухолевой ткани, полученной после ликвидационного лечения или при тонкоигольной аспирационной биопсии. Однако биопсия опухолевой ткани, которая является инвазивной процедурой, не всегда может быть выполнена в связи с небольшими размерами начальной меланомы и невусов хориоиедеи (толщина <3 мм) [16]. Определение специфических онкогенов GNAQ и GNA11 в циркулирующих опухолевых ДНК периферической крови может быть альтернативой для данных групп пациентов и иметь дифференциально-диагностическую значимость [17].
Цель работы: определить морфометрические и генетические предикторы опухолевой трансформации меланоцитарных внутриглазных новообразований.
Материал и методы
В проспективном исследовании проанализирован 81 пациент (84 глаза) с меланоцитарными внутриглазными новообразованиями. Всем больным проводили общее офтальмологическое обследование в отделах офтальмоонкологии и радиологии и взрослого консультативно-поликлинического отделения ФГБУ «НМИЦ ГБ им. Гельмгольца» Минздрава России. Бинокулярную форму диагностировали у 2 (2,4%) пациентов: в первом случае выявили стационарный и прогрессирующий невус хориоидеи на парном глазу, во втором случае – начальную меланому хориоидеи в обоих глазах. Мультифокусное поражение определили у 3 (4%) больных: в первом случае диагностировали очаги с начальной меланомой и прогрессирующим невусом хориоидеи. Во втором и в третьем случаях выявили 2 и 3 очага со стационарным невусом хориоидеи. Больные были разделены на 3 группы с учетом особенностей клинической картины: 1-я группа – пациенты со стационарным невусом хориоидеи (23 глаза), средний возраст которых составил 61,1±13,6 года. Распределение по гендерному признаку: женщин – 18, мужчин – 5.
Мультифокусное поражение диагностировали у 2 пациентов _ (2 и 3 очага). Таким образом, в исследование вошло 26 очагов со стационарным невусом хориоидеи. При проведении ультразвукового исследования (УЗИ) «плюс-ткань» в области очага не определяли; 2-я группа – пациенты с прогрессирующим невусом хориоидеи (24 глаза), средний возраст которых составил 55±13 лет. Распределение по гендерному признаку: женщин – 22, мужчин – 3. Всем пациентам проводили органосохранное лазерное лечение. При проведении УЗИ средняя проминенция опухолей составила 0,5±0,3 мм и диаметр основания – 5,4±1,9 мм; 3-я группа – пациенты с начальной меланомой хориоидеи (36 глаз), средний возраст которых составил 56,2±15,0 лет. Распределение по гендерному признаку: женщин – 27 (75%), мужчин – 9 (25%). Средние размеры опухолей, по данным УЗИ. составили 1,3±0,4 мм (проминенция) и 6,9±2,1 мм (диаметр основания). Всем пациентам проводили органосохранное лазерное лечение (n=36) и брахитерапию (n=1). Для исключения отдаленных метастазов больным выполняли магнитно-резонансную томографию (МРТ) органов брюшной полости с контрастированием и компьютерную томографию (КТ) органов грудной клетки.
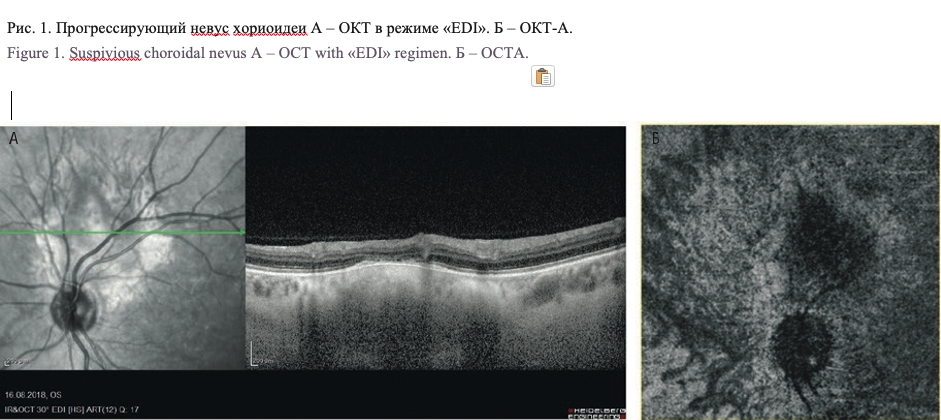
Пациентов обследовали на многофункциональной ультра- звуковой системе Voluson® 730Pro (General Electric, Healthcare, Германия). ОКТ в режиме «EDI» проводили на ретиноангиотомографе HRA+OCT («Heidelberg», Германия). ОКТ–А осуществляли с помощью оптического когерентного томографа OCT-Angiography Software for RS-3000 Advance, Nidek, (Япония) c применением алгоритма амплитудно-декорреляционной спектроскопии (SSADA) и «En Face» в режиме «AngioRetina» с количественным анализом плотности сосудов и перфузии на уровне поверхностного сосудистого сплетения, глубокого сосудистого сплетения и в слое хориокапилляров в области патологического очага. Размеры зон сканирования составляли 6×6 и 9×9 мм. ОКТ в режиме «EDI» удалось провести всем пациентам (рис. 1А). ОКТ–А провели 36 (44%) пациентам (38 глаз) с прозрачными оптическими средами при центральной локализации опухолей (рис. 1Б).
Молекулярно-генетическое исследование выполняли на базе лаборатории патогеномики и транскриптомики НИИ общей патологии и патофизиологии. Добровольное информированное согласие получено от всех пациентов. Изучение мутаций в генах GNAQ/GNA11 осуществляли с помощью анализа кривых плавления и метода определения полиморфизма длины рестрикционных фрагментов (ПЦР-ПДРФ-анализ). В качестве контрольной группы использовали выборку лиц без онкологических заболеваний, сопоставимую по возрасту и полу (n=31).
Статистическую обработку результатов при оценке мутаций генов проводили с использованием закона генетического равновесия Харди–Вайнберга для аутосомных признаков. При сравнении частот встречаемости признаков применяли точный критерий Фишера и его значимость. Для сравнения средних значений в двух группах, для которых можно предположить нормальность распределений, использовался критерий Стьюдента. Проведен расчет среднего арифметического значения (М), стандартного отклонения от среднего арифметического значения (m1). Расчеты проводили в пакетах программ Microsoft Excel, Statistica 10.1.
Результаты
При сравнительном анализе ОКТ-признаков в исследуемых трех группах (табл. 1) выделены предикторы опухолевой прогрессии невуса хориоидеи и его трансформации в начальную меланому хориоидеи.
При сопоставлении групп выявлены предикторы прогрессии стационарного невуса в прогрессирующий невус хориоидеи, к которым относятся конвекс-деформация ретино-хориоидального профиля, ослабление гиперрефлективности на уровне хориоикапилляров, расширение перитуморальных хориоидальных сосудов и компримирование их в центральной зоне, локальная отслойка и выраженная гиперплазия ретинального пигментного эпителия, щелевидная и локальная отслойка нейроэпителия (НЭ), интраретинальные микрокисты, дезорганизация структуры фоторецепторов. Кроме того, определили предикторы озлокачествления прогрессирующего невуса в начальную меланому хориоидеи, к которым относятся «экскавация» хориоидеи, дефекты в ретинальном пигментном эпителии (РПЭ), дольчатость фоторецепторов, скопление субретинальных гиперрефлективных депозитов.
Количественный анализ (табл. 2) плотности сосудов на уровне хориокапилляров показал увеличение изучаемого параметра при прогрессирующем невусе хориоидеи по сравнению с начальной меланомой и стационарным невусом, что могло служить предиктором опухолевого роста. При оценке плотности перфузии выявлено статистически значимое увеличение изучаемого параметра при начальной меланоме хориоидеи в отличие от невусов хориоидеи.
При сравнительном анализе трех исследуемых групп и кон- трольной группы выявлено, что мутации в генах GNAQ и GNA11 в циркулирующих опухолевых ДНК периферической крови достоверно чаще встречаются у пациентов с начальной меланомой и невусами хориоидеи. В то же время в контрольной группе здоровых лиц онкогены в циркулирующих опухолевых ДНК периферической крови не выявлены (табл. 3).
При сопоставлении исследуемых групп выявлено, что у пациентов с начальной меланомой и прогрессирующим невусом хориоидеи значимо чаще встречаются мутации в указанных онкогенах в периферической крови, чем у пациентов со стационарным невусом хориоидеи (1-я и 3-я группы; p=0,0004; 1-я и 2-я группы: р=0,0008). Следует отметить, что у пациентов 2-й и 3-й групп не выявлено достоверных различий в зависимости от наличия мутаций в генах GNAQ и GNA11 (p>0,05), что может указывать о высоком риске трансформации прогрессирующего невуса в меланому хориоидеи.
Обсуждение
На сегодняшний день основные исследования направлены на раннюю диагностику меланомы хориоидеи [4, 10]. По данным литературы, при проминенции опухоли до 3 мм диагностируют отдаленные метастазы в 6%, 12, 20% случаев при 5-, 10- и 20-летнем наблюдении [18]. В доступной литературе существуют работы по применению различных современных модификаций метода ОКТ в дифференциальной диагностике начальной меланомы и невусов хориоидеи [9]. Тем не менее на сегодняшний день не определены дифференциально-диагностические предикторы опухолевой прогрессии невуса хориоидеи и его малигнизации с помощью ОКТ в режиме «EDI» и ОКТ-А. По данным литературы, для меланомы хориоидеи характерна правильная дугообразная форма ретино-хориоидального профиля в связи с ее склонностью к узловому росту [19]. В настоящей работе выявлено, что значимым дифференциально-диагностическим признаком стационарного невуса хориоидеи является ровный ретино-хориоидальный профиль. В отличие от пациентов со стационарным невусом хориоидеи у пациентов с начальной меланомой и прогрессирующим невусом выявили дугообразное изменение хориоидального профиля.
При сравнении формы хориоидального профиля начальной меланомы и прогрессирующего невуса хориоидеи статистически значимых различий не выявлено.
Gowtham Jonna и соавт. [20] в своем исследовании предложили разделить невус хориоидеи на 4 типа. При 1-м типе авторы отмечают ровный хориоидальный профиль с однородной гиперрефлективностью в зоне очага, который ограничен неизменной сосудистой оболочкой, что соответствует полученными нами данными для группы пациентов со стационарным невусом хориоидеи. При 2-м и 4-м типах авторы отмечают конкав-деформацию хориоидального профиля с гиперрефлективностью в области очага с различной степенью экранирования подлежащих структур. В настоящем исследовании указанные морфометрические признаки значимо выявлены в группе пациентов с прогрессирующим невусом хориоидеи при сопоставлении с группой пациентов со стационарным невусом хориоидеи. Данный признак встречается также у пациентов с начальной меланомой хориоидеи. При сравнении 2-й и 3-й групп статистически значимых различий не выявили. Таким образом, гиперрефлективность с переходом на среднюю рефлективность с эффектом тени подлежащих структур, и куполообразная форма хориоидального профиля имеют большое значение, т.к. несмотря на неспецифичность признаков, свидетельствуют о наличии признаков роста опухоли.
При изучении хориоидеи в глазах как с начальной меланомой, так с прогрессирующим невусом хориоидеи просматривали расширенные просветы хориодальных сосудов в перифокальной зоне и компримированные сосуды, как правило, ближе к центру образования. Указанные изменения могут свидетельствовать об ишемии сетчатки на вершине образования, что приводит к дезорганизации слоев сетчатки и компенсаторному кровенаполнению по периферии образования [19]. При сравнении 2-й и 3-й групп статистически значимых различий не отмечено. Однако указанные признаки значимо не встречались в глазах со стационарным невусом хориоидеи. Таким образом, изменения в хориоидальных сосудах имеют неспецифический характер в дифференциальной диагностике начальной меланомы и прогрессирующего невуса хориодеи, однако могут свидетельствовать об активно растущей опухоли. «Экскавацию хориоидеи» области патологического очага диагностировали только у пациентов с начальной меланомой хориоидеи. Следует отметить, что в данных случаях также отметили конкав-деформацию ретино-хориоидального интерфейса с выраженными изменениями в РПЭ и НЭ. Однако, по данным литературы, указанный признак встречается также при невусе хориоидеи в 5% случаях, что может быть связано с локализацией опухоли и степенью ригидности склеры [6]. Тем не менее авторы отмечают необходимость дальнейших исследований для предупреждения опухолевой прогрессии.
При анализе сканов деструктивные процессы в РПЭ встречаются во всех трех группах в виде друз, гиперплазии и дефектов. Статистически значимым дифференциально-диагностическим признаком начальной меланомы хориоидеи являлось наличие дефектов в РПЭ и наличие субретинальных депозитов как следствие более выраженной дезорганизации РПЭ. При изучении 2-й группы отмечена ассоциация только с гиперплазией РПЭ при сопоставлении с пациентами со стационарным невусом хориоидеи. Указанные изменения объясняются медленным ростом (длительностью процесса), механическим воздействием на комплекс РПЭ [5, 9, 10, 19]. Отслойку НЭ и РПЭ над опухолью статистически значимо чаще диагностировали во 2-й и 3-й группах. По данным литературы, наличие субретинальной жидкости является прогностически неблагоприятным фактором перерождения невуса хориоидеи в меланому [21]. Однако ряд автор утверждают, что отслойка РПЭ и НЭ встречается и при невусах хориоидеи [22]. При сравнении 2-й и 3-й групп выявлено, что начальная меланома хориоидеи статистически значимо ассоциируется с локальной и щелевидной отслойкой НЭ. Таким образом, отслойка НЭ и РПЭ является неспецифическим фактором риска опухолевой прогрессии и малигнизации невусов хориоидеи. Схожие данные получили при анализе наличия интраретинальных кист при прогрессирующем невусе и начальной меланоме хориоидеи, что свидетельствует об активном росте опухоли [5, 19, 23].
По данным литературы, дольчатость фоторецепторов является дифференциально-диагностическим признаком меланомы хориоидеи [10]. Тем не менее в последних публикациях отмечено, что «лохматые фоторецепторы» могут встречаться также при невусе хориоидеи в 29% случаев и не свидетельствуют о малигнизации патологического очага. Авторы отмечают, что структурные изменения в виде «лохматых фоторецепторов» выявлены через 15 месяцев после повторного осмотра пациентов и являются следствием развития субретинальной жидкости [24]. В настоящем исследовании наличие «лохматых фоторецепторов» статистически значимо ассоциируется с начальной меланомой хориоидеи.
Число работ о применении метода ОКТ-А в офтальмоонкологии малочисленно, что связано с ограничениями метода (наличием артефактов) и локализацией опухолей не только в центральном отделе глазного дна, но и на средней и крайней периферии [11, 25]. Большинство публикаций касается применения ОКТ-А для оценки изменений, развивающихся на фоне лучевой ретинопатии после брахитерапии [12–13]. Имеются единичные работы по изучению особенностей ангиоархитектоники нелеченой меланомы хориоидеи [8, 14]. При меланоме хориоидеи выявлена тенденция к снижению плотности поверхностной и глубокой сосудистой сети по сравнению с контралатеральным глазом, особенно при наличии субретинальной жидкости. В настоящем исследование проведен сравнительный анализ плотности перфузии сосудов при невусах и начальной меланоме хориоидеи. Анализ плотности сосудов на уровне хориокапилляров показал увеличение изучаемых параметров при прогрессирующем невусе хориоидеи при сопоставлении с начальной меланомой и стационарным невусом хориоидеи, что может служить предикторами опухолевого роста.
В современной медицине большое значение приобретают молекулярно-генетические маркеры в диагностике увеальной меланомы [15, 26]. Впервые при сравнительном анализе молекулярно-генетического исследования периферической крови выявлена значимая ассоциация наличия онкогенов GNAQ и GNA11 в циркулирующих опухолевых ДНК периферической крови с развитием меланоцитарных внутриглазных новообразований. По данным общих онкологов, частота встречаемости онкогенов GNAQ и GNA11 составляет 84% случаев у пациентов с метастатической формой увеальной меланомы [17]. При этом значимых различий не выявлено при сопоставлении пациентов с начальной меланомой и прогрессирующим невусом хориоидеи, что может свидетельствовать о высоком риске трансформации прогрессирующего невуса в меланому. При сопоставлении контрольной группы и пациентов со стационарным невусом хориоидеи также выявлена достоверная разница, в связи с чем необходим скрининг пациентов данной группы для проведения своевременного лечения.
Заключение
В настоящей работе впервые с помощью ОКТ в режиме «EDI» и ОКТ-А выявлен симптомокомплекс предиктивных маркеров, включающих хориоидальные и опухоль-ассоциированные ретинальные изменения, характеризующие прогрессию и озлокачествление невусов хориоидеи. Кроме того, диагностированы молекулярно-генетические особенности в периферической крови у пациентов с невусами и начальной меланомой хорио- идеи. Выявленные показатели могут быть использованы для скрининга пациентов с невусом хориоидеи с высоким риском малигнизации, а также для разработки современных подходов к прогнозированию течения меланомы.
ЛИТЕРАТУРА/REFERENCES
- Бровкина А.Ф. Офтальмоонкология. Руководство для врачей. М., 2002. 235 с. [Brovkina A. F. Ophthalmooncology. Guide for doctors, Moscow, 2002, 235 p. (In Russ.)].
- Мякошина Е.Б. Начальная меланома хориоидеи и псевдомеланомы: методы дифференциальной диагностики. Часть 1. Офтальмоскопия. Рос. офтальмологический журнал. 2019;12(4):99–108 [Myakoshina E.B. Small choroidal melanoma and pseudomelanomas: methods of differential diagnostics. Part 1. Ophthalmoscopy. Rus. Ophthalmol. J. 2019;12(4):99-108. (In Russ.)]. doi: 10.21516/2072-0076-2019-12-4-99-108.
- Gurpinderjeet K., Scott A.A. Multimodal imaging of suspicious choroidal neoplasms in a primary eye care clinic. Exp. Optom. 2017;100(6):549–62. doi: 10.1111/cxo.12537.
- Dalvin L.A., Shields C.L., Ancona-Lezama D.A. Combination of multimodal imaging features predictive of choroidal nevus transformation into melanoma. J. Ophthalmol. 2019;103(10):1441–7. doi: 10.1136/bjophthalmol-2018-312967.
- Саакян С.В., Мякошина Е.Б., Хлгатян М.Р., Склярова Н.В. ОКТангиография в диагностике начальной меланомы и невусов хориоидеи. Офтальмология. 2020;17(3):465–72 [Saakyan S.V., Myakoshina E.B., Khlgatyan M.R., Sklyarova N.V. OCT-Angiography in Early Choroidal Melanoma and Choroidal Nevi. Rus. 2020;17(3):465–72. (In Russ.)]. doi: 10.18008/1816-5095-2020-3-465-472.
- Dolz-Marco R., Hasanreisoglu M., Shields J.A., et al. Posterior scleral bowing with choroidal nevus on enhanced-depth imaging optical coherence tomography. JAMA. Ophthalmol. 2015;133(10):1165–70. doi: 10.1001/ jamaophthalmol.2015.2677.
- Spaide R.F., Koizumi H. Enhanced depth imaging spectral-domain optical coherence tomography. J. Ophthalmol. 2008;146(4):496–500. doi: 10.1016/j.ajo.2008.05.032.
- Garcia-Arumi Fuste C., Peralta Iturburu F., Garcia-Arumi J. Is optical coherence tomography angiography helpful in the differential diagnosis of choroidal nevus versus melanoma? J. Ophthalmol. 2020;30(4):723–9. doi: 10.1177/1120672119851768.
- Torres V.L., Brugnoni N., Kaiser P.K., et al. Optical coherence tomography enhanced depth imaging of choroidal tumors. Am. J. Ophthalmol. 2011;151(4):586–93.
- Shields C.l., Kaliki S., Rojanaporn D., et al. Enhanced depth imaging optical coherence tomography of small choroidal melanoma: comparison with choroidal nevus. Arch. 2012;130(7):850–6. doi: 10.1001/ archophthalmol.2012.1135.
- Spaide R.F., Fujimoto J.G., Waheed N.K. Image artifacts in optical coherence tomography angiography. 2015;35(11):2163–80. doi: 10.1097/ IAE.0000000000000765.
- Shields C.L., Say E.A., Samara W.A., et al. Optical coherence tomography angiography of the macula after plaque radiotherapy of choroidal melanoma: Comparison of irradiated versus nonirradiated eyes in 65 patients. Retina. 2016;36(8):1493–505. https://doi.org/10.1097/IAE.0000000000001021.
- Say E.A., Samara W.A., Khoo C.T. Parafoveal capillary density after plaque radiotherapy for choroidal melanoma: Analysis of eyes without radiation maculopathy. 2016;36(9):1670–8. doi: 10.1097/ IAE.0000000000001085.
- Valverde-Megías A., Say E.A., Ferenczy S.R., et al. Differential macular features on optical coherence tomography angiography in eyes with choroidal nevus and melanoma. Retina. 2017;37(4):731–40. doi: 10.1097/IAE.0000000000001233.
- Alexander N.S., Richard D.C. GNAQ and GNA11 mutations in uveal melanoma. Melanoma Res. 2014;24(6):525–34. doi: 10.1097/CMR.0000000000000121.
- Frizziero L., Midena E., Trainiti S., et al. Uveal Melanoma Biopsy: A Review. Cancers. (Basel). 2019;11(8):1075. doi: 10.3390/cancers11081075.
- Bidard F.C., Madic J., Mariani P., et al. Detection rate and prognostic value of circulating tumor cells and circulating tumor DNA in metastatic uveal melanoma. Int. J. Cancer. 2014;134(5):1207–13. doi: 10.1002/ijc.28436.
- Shields C.L., Furuta M., Thangappan A., et al. Metastasis of uveal melanoma millimeter-by-millimetr in 8033 consecutive eyes. Arch. 2009;127(8):989–98. doi: 10.1001/archophthalmol.2009.208.
- Мякошина Е.Б. Комплексная диагностика начальной меланомы хориоидеи. 2016;6(4):19–28. [Myakoshina E.B. Complex laser diagnostics of early choroidal melanoma. REJR. 2016;6(4):19–28. (in Russ.)]. doi: 10.21569/22227415-2016-6-4-19-28.
- Gowtham J., Anthony B.D. Enhanced depth imaging OCT of ultrasonographically flat choroidal nevi demonstrates 5 distinct patterns. Retina. 2019;3(3):270–7. doi: 10.1016/j.oret.2018.10.004.
- Espinoza G., Rosenblatt B., Harbour J.W. Optical coherence tomography in the evaluation of retinal changes associated with suspicious choroidal melanocytic tumors. J. Ophthalmol. 2004;137(1):90–5.
- Michael D.Yu, Dalvin L.A., Ancona-Lezama D. Choriocapillaris compression correlates with choroidal nevus-associated subretinal fluid: optical coherence tomography analysis of 3431 cases. 2020;127(9):1273–6. doi: 10.1016/j.ophtha.2020.03.025.
- Muscat S., Parks S., Kemp E., Keating D. Secondary retinal changes associated with choroidalnaevi and melanomas documented by optical coherence tomography. J. Ophthalmol. 2004;88(1):120–4.
- Yaghy A., Yu M.D., Dalvin L.A., et al. Photoreceptor morphology and correlation with subretinal fluid chronicity associated with choroidal nevus. Br. J. Ophthalmol. 2020;104(6):863–7. doi: 10.1136/bjophthalmol-2019-314755.
- Shields C.L., Sioufi K., Fuller T., et al. Which tumor, what imaging modality. Retina Today. 2016;57–64.
- Саакян С.В., Амирян А.Г., Цыганков А.Ю. и др. Мутации в онкогенх GNAQ и GNA11 у больных увеальной меланомой. Молекулярная медицина. 2014;2(3):4–37. [Saakyan S.V., Amiryan A.G., Tsygankov A.Yu., et al. Mutations in oncogenes GNAQ and GNA11 in uveal melanoma patients. Mol.
Med. 2014;2(3):4–37. (In Russ.)].
Поступила 20.10.20
Принята в печать 15.11.20
Received 20.10.20
Accepted 15.11.20
Вклад авторов: С.В. Саакян – концепция и дизайн исследования, научное редактирование. М.Р. Хлгатян – набор материала, статистический анализ, написание текста. А.Ю. Цыганков, Е.Б. Мякошина – набор материала, научное редактирование. А.М. Бурденный, В.И. Логинов – обработка материала, научное редактирование.
Contribution of the authors: S.V. Sahakyan – research concept and design, scientific editing. M.R. Khlgatyan – material collection, statistical analysis, text writing. A.Yu. Tsygankov, E.B. Myakoshina – material collection, scientific editing. A.M. Burdenny, V.I. Loginov – material processing, scientific editing.
Информация об авторах:
С.В. Саакян – д.м.н., профессор, начальник отдела офтальмоонкологии и радиологии ФГБУ Национальный медицинский исследовательский центр глазных болезней им. Гельмгольца Минздрава РФ, Москва; ORCID: 0000-0001-8591-428X
М.Р. Хлгатян – аспирант отдела офтальмоонкологии и радиологии ФГБУ Национальный медицинский исследовательский центр глазных болезней им. Гельмгольца Минздрава РФ, Москва; e-mail: khlgatyanmariam@yandex.ru; ORCID ID: 0000-0001-7266-770X
А.Ю. Цыганков – к.м.н, младший научный сотрудник отдела офтальмоонкологии и радиологии ФГБУ Национальный медицинский исследовательский центр глазных болезней им. Гельмгольца Минздрава РФ, Москва; email: alextsygankov1986@yandex.ru; ORCID ID: 0000-0001- 9475-3545
Е.Б. Мякошина – к.м.н., научный сотрудник отдела офтальмоонкологии и радиологии ФГБУ Национальный медицинский исследовательский центр глазных болезней им. Гельмгольца Минздрава РФ, Москва; ORCID ID: 0000-0002-2087-7155
А.М. Бурденный – к.б.н., ведущий научный сотрудник лаборатории патогеномики и транскриптомики ФГБУН Научно-исследовательский институт общей патологии и патофизиологии, Москва; ORCID ID: 0000-0002-9398-8075
В.И. Логинов – к.б.н., ведущий научный сотрудник лаборатории патогеномики и транскриптомики ФГБУН Научно-исследовательский институт общей патологии и патофизиологии, Москва; ORCID ID: 00000003-2668-8096
Information about the authors:
S.V. Sahakyan – Doctor of Medical Sciences, Professor, Head of the Department of Ophthalmo-Oncology and Radiology, FSBI National Medical Research Center of Eye Diseases named after N.I. Helmholtz, Ministry of Health of the Russian Federation, Moscow; ORCID: 0000-0001-8591-428X
M.R. Khlgatyan – postgraduate student of the Department of Ophthalmo-Oncology and Radiology of the Federal State Budgetary Institution National Medical Research Center of Eye Diseases named after I. Helmholtz, Ministry of Health of the Russian Federation, Moscow; e-mail: khlgatyanmariam@yandex.ru; ORCID
ID: 0000-0001-7266-770X
A.Yu. Tsygankov – PhD in Medical Sciences, Junior Researcher, Department of Ophthalmo-Oncology and Radiology, FSBI National Medical Research Center for Eye Diseases named after V.I. Helmholtz, Ministry of Health of the Russian Federation, Moscow; email: alextsygankov1986@yandex.ru; ORCID ID: 0000-0001-9475-3545
B. Myakoshina – PhD in Medical Sciences, Researcher of the Department of Ophthalmo-Oncology and Radiology of the Federal State Budgetary Institution National Medical Research Center of Eye Diseases named after V.I. Helmholtz, Ministry of Health of the Russian Federation, Moscow; ORCID ID: 0000-00022087-7155
A.M. Burdenny – PhD in Medical Sciences, Leading Researcher, Laboratory of Pathogenomics and Transcriptomics, Federal State Budgetary Institution
Scientific Research Institute of General Pathology and Pathophysiology, Moscow;
ORCID ID: 0000-0002-9398-8075
V.I. Loginov – PhD in Medical Sciences, Leading Researcher, Laboratory of Pathogenomics and Transcriptomics, Federal State Budgetary Institution
Scientific Research Institute of General Pathology and Pathophysiology, Moscow;
ORCID ID: 0000-0003-2668-8096
Рецензия на статью
Авторы использовали в своей работе современные методики ультразвукового анализа, выполняли оптическую когерентную томографию с ангиорежимом. Кроме того, в работе приведены данные по анализу мутаций в генах GNAQ/GNA11, который осуществляли с помощью анализа кривых плавления и метода определения полиморфизма длины рестрикционных фрагментов (ПЦР-ПДРФ-анализ).
Достаточное число наблюдений (81 пациент), адекватное деление на группы и использование современных статистических методов обработки полученных результатов позволяет говорить о достоверности полученных научных данных, которые при этом хорошо иллюстрированы. Авторы выявили прогностические параметры прогрессирующего невуса хориоидеи, к которым относятся конвекс-деформация ретино-хориоидального профиля, ослабление гиперрефлективности на уровне хориоикапилляров, расширение перитуморальных хориоидальных сосудов и компримирование их в центральной зоне, локальная отслойка и выраженная гиперплазия ретинального пигментного эпителия (РПЭ), щелевидная и локальная отслойка нейроэпителия (НЭ), интраретинальные микрокисты, дезорганизация структуры фоторецепторов. Авторы привели интересные морфометрические дифференциально-диагностические признаки, выявляемые в режиме улучшенного глубокого изображения (EDI) при начальной меланоме и невусах хориоидеи. Безусловно, полученные знания были бы невозможны без использования самых современных диагностических аппаратов и методик обследования. Интересные результаты авторы получили и при анализе плотности сосудов и перфузии у пациентов с начальной меланомой и невусами хориоидеи.