Для цитирования:
Голанов А.В., Бекяшев А.Х., Тушев А.А., Банов С.М., Молдованов В.А., Дреева А.Р. Комбинированное лечение пациентов с впервые выявленными диффузными астроцитомами c низким индексом пролиферативной активности. Голова и шея. Российский журнал=Head and neck. Russian Journal. 2020;8(3):25–34
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Doi: 10.25792/HN.2020.8.3.25–34
Цель. Изучить показатели общей (ОВ) и беспрогрессивной выживаемости пациентов с впервые выявленными диффузными астроцитомами (WHO Grade II) с низким индексом пролиферативной активности после комбинированного лечения. Оценить влияние различных факторов на показатели выживаемости.
Материал и методы. Проведен анализ результатов лечения 153 пациентов (73 мужчины и 80 женщин) с впервые выявленными диффузными астроцитомами (WHO Grade II) с низким индексом пролиферативной активности (менее 5%). Среднее время клинического наблюдения составило 4,8±2,71 года.
Результаты. В ходе однофакторного анализа выявлено, что на выживаемость без прогрес — сии влияют распространенность опухоли (р=0,01) и проведенная после операции лучевая терапия (р=0,0747). На ОВ оказывали влияние неврологический дефицит до хирургического лечения (р=0,0092), распространенность опухоли (р=0,0799) и степень хирургической резекции (p=0,0377). В ходе проведения многофакторного анализа статистически значимыми факторами прогноза ОВ были головная боль (р=0,0338), размеры опухоли (р=0,0102) и полнота резекции (р=0,0164). Что касается выживаемости без прогрессии, статистичес ки значимыми были головная боль (р=0,0119), размеры опухоли (р=0,0001), послеоперационные осложнения (р=0,0196) и перенесенная после операции лучевая терапия (р=0,0496).
Выводы. Значимыми прогностическими факторами являются размеры опухоли до хирургического лечения и полнота хирургического лечения; лучевая терапия улучшает выживаемость без прогрессии, не влияя на ОВ.
Ключевые слова: диффузные астроцитомы, низкий индекс пролиферативной активности, показатели выживаемости, комбинированное лечение
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена без спонсорской поддержки.
Objective. To study the indicators of overall (OS) and disease-free survival in patients with newly diagnosed diffuse astrocytomas (WHO Grade II) with a low index of proliferative activity after combination treatment. To assess the influence of various factors on survival rates.
Material and methods. The analysis of the treatment results of 153 patients (73 men and 80 women) with newly diagnosed diffuse astrocytomas (WHO Grade II) with a low index of proliferative activity (less than 5%) was carried out. The mean time of clinical follow-up was 4.8±2.71 years.
Results. The univariate analysis revealed that disease-free survival was influenced by: tumor extent (p=0.01) and postoperative radiation therapy (p=0.0747). OS was influenced by the presence of neurological deficit before surgical treatment (p=0.0092), tumor extent (p=0.0799) and the volume of surgical resection (p=0.0377). During the multivariate analysis, statistically significant factors in the prognosis of OS were headache (p=0.0338), tumor size (p=0.0102) and resection completeness (p=0.0164). As for disease-free survival, statistically significant were headache (p=0.0119), tumor size (p=0.0001), postoperative complications (p=0.0196), and postoperative radiation therapy (p=0.0496 ).
Conclusions. Significant prognostic factors are tumor size before surgical treatment and completeness of surgical treatment; radiation therapy improves disease-free survival without affecting OS.
Key words: diffuse astrocytomas, low index of proliferative activity, survival rates, combined treatment
Conflicts of interest. The authors have no conflicts of interest to declare.
Funding. There was no funding for this study.
Введение
Глиомы представляют собой гетерогенную группу опухолей нейроэпителиального происхождения и являются самыми частыми новообразованиями головного мозга, составляя, по данным различных источников, от 15 до 45% всех первичных опухолей головного мозга [1–9].
Согласно гистологической классификации Всемирной организации здравоохранения (2007), к глиомам низкой степени злокачественности – ГНСЗ (WHO Grade I–II) относятся пилоидные, диффузные астроцитомы – ДА (фибриллярные, протоплазматические и гемистоцитарные), олигодендроглиомы и олигоастроцитомы. Из всех глиом WHO Grade II гемистоцитарные астроцитомы наиболее склонны к злокачественной прогрессии. Наиболее часто встречающимися ГНСЗ являются ДА, составляющие около 58–80%, по данным разных источников. Протоплазматические астроцитомы встречаются редко, преимущественно у мужчин (75%) молодого возраста (в среднем 20,7 года). Наибольшая серия наблюдений (16) с данным типом опухоли опубликована Prayson и Estes [10–16].
Из классификации опухолей центральной нервной системы 2016 г. были исключены фибриллярные и протоплазматические астроцитомы. В классификации ГНСЗ теперь учитываются не только фенотипические, но и генотипические особенности опухолей: мутации в генах IDH1 и IDH2.
Если при иммуногистохимиотипировании не выявлен мутантный белок R132H IDH1 и при секвенировании генов IDH1 (кодон 132) и IDH2 (кодон 172) не обнаружены мутации, или при секвенировании негативны только мутации генов IDH1 (кодон 132) и IDH2 (кодон 172), такой тип повреждения можно считать как IDH-дикого типа.
В случае, когда невозможно провести полноценное исследование, тип ДА указывается как неуточненный – NOS [17].
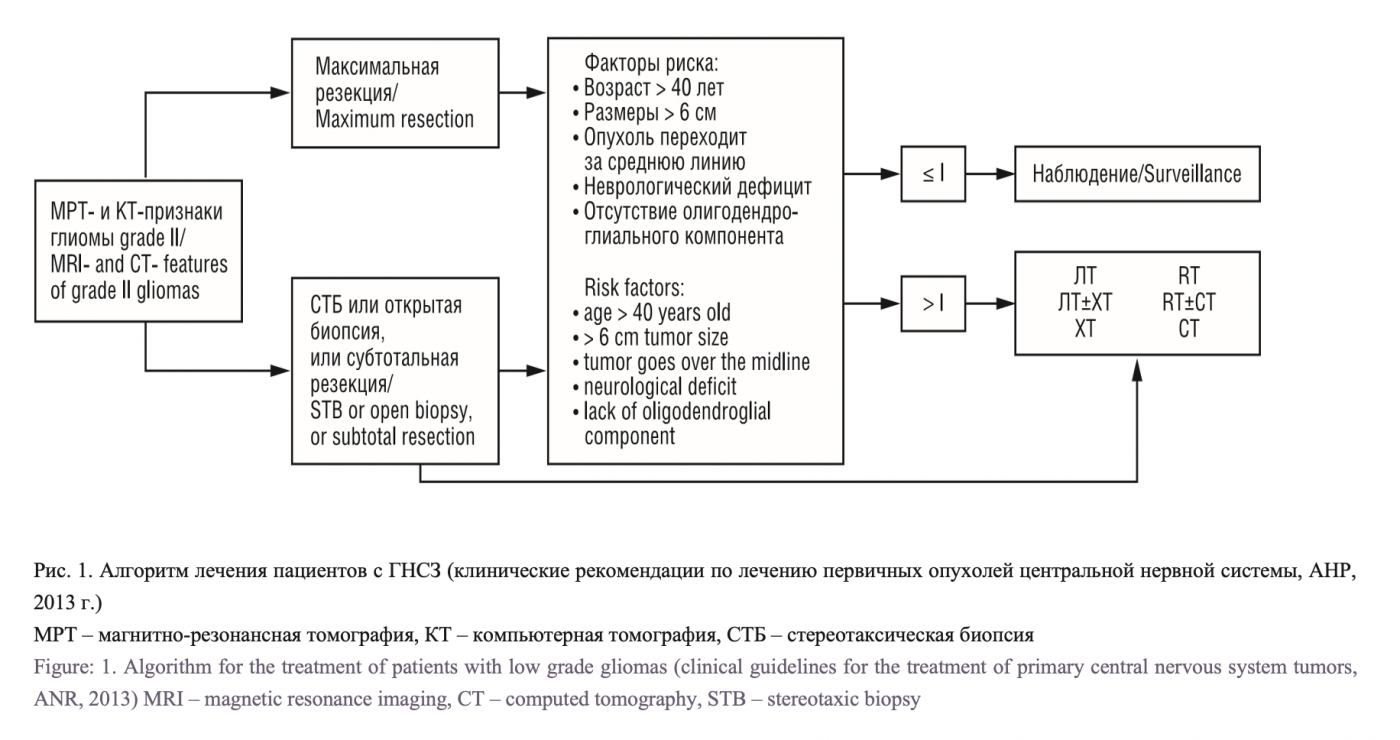
Согласно практическим рекомендациям Ассоциации нейрохирургов России (АНР, рис. 1), Российского общества клинической онкологии RUSSCO, Ассоциации онкологов России (АОР), определены подходы к лечению глиом WHO Grade I–II: хирургическое лечение с последующим проведением лучевой терапии – ЛТ (50–54 Гр) и/или химиотерапии (ХТ) в зависимости от факторов риска продолженного роста [15].
Роль ХТ при лечении ГНСЗ до сих пор не определена, в настоящее время вновь вернулись к вопросу проведения как моно- (темозоломид), так и полихимиотерапии (PCV) [18, 19]. Большинство российских и международных рекомендаций не содержит сведений о необходимости проведения ХТ при лечении первичной ГНСЗ (Ассоциация нейрохирургов России, 2015; Кобяков и др., 2015; Общероссийский союз общественных объединений «Ассоциация онкологов России», 2015; Soffietti и соавт., 2011; Stupp и соавт., 2014). Однако в рекомендациях NCCN (National Comprehensive Cancer Network) сообщается о том, что пациентам в неблагоприятной группе на 3-м этапе комплексного лечения необходимо проведение ХТ по схеме PCV (6 курсов), а при наличии противопоказаний рекомендуется применение темозоломида (TMZ) как радиомодификатора на фоне проведения радиотерапии (РТ) и в качестве монотерапии (12 курсов) (National Comprehensive Cancer Network Guidelines, 2015) [20].
Необходимость адъювантной терапии ГНСЗ базируется на факторах прогноза риска рецидива в каждом конкретном случае. Многие клинические исследования оценивают адьювантную терапию с разбивкой по группам риска. Факторами прогноза продолженного роста ГНСЗ, по данным EANO (European Association of NeuroOncology), ESMO (European Society for Medical Oncology) Ассоциации нейрохирургов России (АНР), Российского общества клинической онкологии RUSSCO, Ассоциации онкологов России (АОР), являются: возраст пациентов >40 лет на момент морфологической верификации диагноза; гистологический диагноз – ДА; умеренные или грубые неврологические нарушения; максимальный линейный размер опухоли 6 см и больше; наличие смещения срединных структур головного мозга до хирургического вмешательства. Сочетание трех и более неблагоприятных прогностических факторов свидетельствует о принадлежности к неблагоприятной группе прогноза. Степень хирургической резекции опухоли учитывается отдельно от вышеперечисленных факторов прогноза более неблагоприятным является недостаточная радикальность при удалении опухоли. В рекомендациях АНР, RUSSCO и АОР к неблагоприятной прогностической группе относят пациентов с двумя и более выявленными неблагоприятными факторами прогноза. В рекомендациях NCCN 2015 г. неблагоприятную группу прогноза составляют все пациенты, у которых возраст >40 лет, и все пациенты, у которых не было радикального удаления опухоли [21–26].
Цель. В настоящем исследовании проведена оценка общей (ОВ) и беспрогрессивной выживаемости (БВ) пациентов с ДА супратенториальной локализации с низким индексом пролиферативной активности.
Материал и методы
Материалом для настоящего исследования послужили данные 153 пациентов с доброкачественными глиомами больших полушарий головного мозга, прошедших стационарное лечение в НИИ нейрохирургии им. акад. H.H. Бурденко и НМИЦ Онкологии им. Н.Н. Блохина за период с 2005 по 2015 г. (табл. 1, 2). При отборе пациентов использовалась классификация опухолей центральной нервной системы 2007 г.
Проведен статистический анализ данных 153 пациентов с гистологическим диагнозом фибриллярная, протоплазматическая и фибриллярно-протоплазматическая (смешанная) астроцитома WHO Grade II и индексом пролиферативной активности Ki67<5 с локализацией в пределах полушарий большого мозга, исключая среднюю линию. Из исследования исключены гистологические формы: олигодендроглиомы, олиго- астроцитомы, гемистоцитарные астроцитомы.
Всем пациентам после хирургического лечения проводили МРТ головного мозга с контрастным усилением каждые 3 месяца в течение первого года наблюдения и далее каждые 6 месяцев.
ОВ определялась как время от проведения хирургического лечения до даты последнего наблюдения или смерти, в свою очередь БВ – от проведения хирургического лечения до даты продолженного роста, верифицированного по данным МРТ головного мозга с контрастным усилением.
Однофакторный анализ ОВ и БВ был проведен с применением метода Каплана–Мейера, а различия между группами рассчитывались с помощью лог-рангового критерия (log rank). Многофакторный анализ проведен с использованием регрессионной модели пропорциональных рисков Cox.
В качестве описательных статистик для коли — чественных показателей посчитаны средние±средние квадратические отклонения; медиана и квартили; минимальные и максимальные значения в выборке. Для качественных показателей посчитаны частоты встречаемости.
Статистический анализ был проведен с помощью программного обеспечения MedCalc (версия 18.6), учитывая размеры выборки, цензурируемые данные, р-значение меньше 0,05 считалось статистически значимым.
Результаты
На момент проведения статистического анализа 112 (73,2%) пациентов продолжают наблюдаться, 20 (13,1%) пациентов умерли на разных сроках клинического наблюдения. Из-под наблюдения выбыли 21 (13,7%) и данные об ОВ этих пациентов отсутствуют. Медиана ОВ составила 53,1 месяца. ОВ на сроках 12, 60 и 84 месяцев составила 97,7%, 85,7 и 76,8% соответственно.
БВ оценена у 127 пациентов, 20 (13,1%) из которых продолжают наблюдаться, признаков прогрессии нет, у 107 (69,9%) пациентов отмечается продолженный рост на различных сроках, данные о 26 (17%) пациентах отсутствуют. Медиана БВ составила 30,4 месяцев (95% доверительный интервал – ДИ 22,9–124,4). БВ на сроках 12, 36, 60 и 84 месяца составила 77,1%, 39,0, 10,5 и 3,8% соответственно.
Однофакторному анализу подвергались следующие показатели:
-
возраст (более 40 лет, 40 лет и менее);
-
структурная эпилепсия (наличие или отсутствие);
-
головная боль (наличие или отсутствие);
-
неврологический дефицит до хирургического лечения (отсутствует, очаговый неврологический дефицит любой степени выраженности);
-
сроки от манифестации опухоли до хирургического лечения (30 недель и менее, более 30 недель);
-
распространенность опухоли (6 см и более, распространяется более чем на 1 долю, менее 6 см, распространяется в пределах 1 доли). Размеры опухоли определялись до хирургического лечения с применением метода МРТ в режимах Т2, FLAIR;
-
качество жизни до хирургического лечения (Шкала Карновского): более 80 баллов, 80 баллов и менее; ни у одного из пациентов не было тяжелой соматической патологии, влияющей на этот показатель;
-
степень хирургической резекции (стереотаксическая биопсия – СТБ, частичная резекция – ЧР, полная резекция – ПР). В ходе исследования контроль степени удаления опухоли проводился с помощью МРТ с контрастным усилением в течение 24 часов после операции и СКТ головного мозга;
-
послеоперационные осложнения (отсутствуют, очаговый неврологический дефицит любой степени выраженности);
-
ЛТ после хирургического лечения.
В ходе однофакторного анализа выявлено, что на БВ влияют: распространенность опухоли и проведенная после операции ЛТ.
Пациенты с максимальным линейным размером опухоли до 6 см имели лучшие показатели БВ (р=0,01) на сроках 24, 60 и 84 месяца (67,1%, 12,7, 3,8% соответственно, против 38,5%, 3,8 и 3,8%, рис. 2) . Медиана выживаемости без прогрессии (95% ДИ) составила 34,633 месяца (28,067–124,400) против 16,400 месяца (7,167–94,300).
Пациенты, которым была проведена ЛТ после хирургического удаления имели лучшие показатели БВ (р=0,0747) на сроках 24, 60 и 84 месяца (59,7%, 14,5, 4,8% соответственно, против 60,5%, 2,6 и 0%, рис. 3). Медиана выживаемости без прогрессии (95%ДИ) составила 29,067 месяца (21,000-114,533) против 29,433 месяца (15,933-60,867).
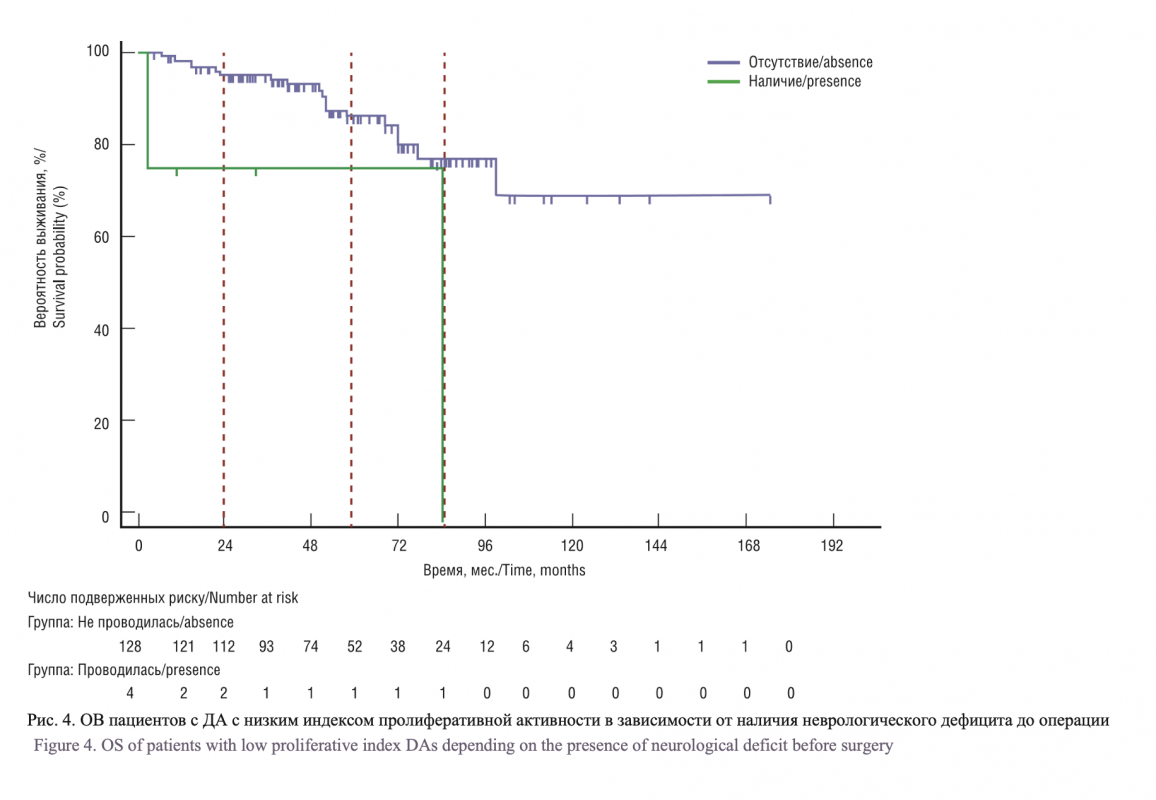
На ОВ оказывали влияние: наличие неврологического дефицита до хирургического лечения, распространенность опухоли и степень хирургической резекции (рис. 4).
Показатели ОВ были лучше в группе пациентов без неврологического дефицита на сроках 24, 60 и 84 месяца: 95,1%, 86,1, 76,9% против 75%, 75, 0%, соответственно (р=0,0092).
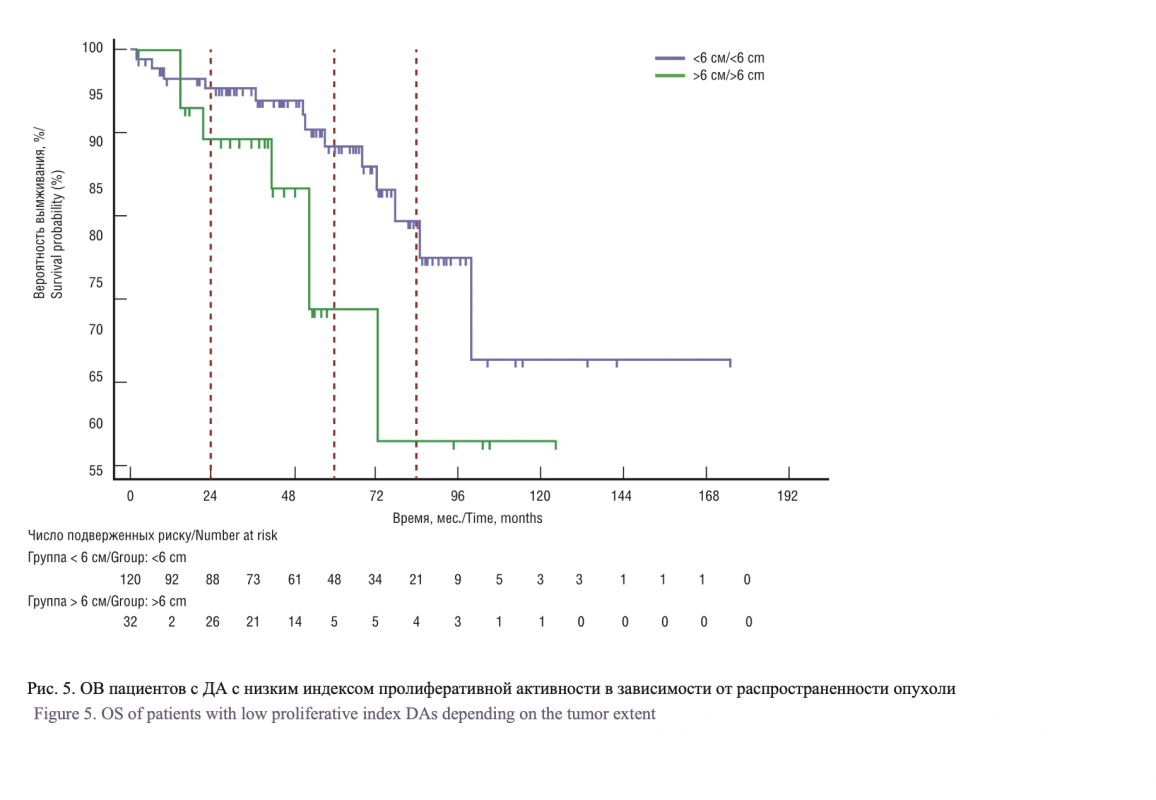
Показатели ОВ были лучше у пациентов с максимальным линейным размером опухоли до 6 см (рис. 5) на сроках 24, 60 и 84 месяца 95,8%, 89,5, 77,3% против 90,1%, 71,7, 57,4% соответственно (р=0,0799).
ОВ была лучше в группе ПР (рис. 6) на сроках 24, 60 и 84 месяца: 96,4%, 96,4, 84,3%, соответственно относительно группы с СТБ: 81,3%, 70,5, 58,7% и ЧР: 97,9%, 85,6, 79,9% (p=0,0377).
В ходе проведения многофакторного анализа статистически значимыми факторами прогноза ОВ (р=0,0135) были: головная боль (р=0,0338), размеры опухоли (р=0,0102), полнота резекции (р=0,0164). Что касается БВ, статистически значимыми (р=0,0163) были: головная боль (р=0,0119), размеры опухоли (р=0,0001), послеоперационные осложнения (р=0,0196) и перенесенная после операции ЛТ (р=0,0496).
Обсуждение
В ходе проведенного исследования получены данные, подтверждающие статистическую значимость радикальности хирургического лечения и размеров опухоли для ОВ пациентов с ДА, имеющих низкий индекс пролиферативной активности. Выявлен фактор, который не освещен в большинстве исследований, но статистически значим для показателей как ОВ, так и БВ – головная боль. Что касается ЛТ, в ходе исследования установлено, что перенесенная после хирургического этапа ЛТ улучшает БВ, но не влияет на ОВ, что соответствует данным рандомизированного исследования EORTC 22845. Другие факторы достоверно не влияли на показатели ОВ и БВ [27].
Заключение
В результате многофакторного анализа получены данные, показывающие, что при лечении ДА с индексом пролиферативной активности менее 5% значимыми прогностическими факторами являются размеры опухоли до хирургического лечения и полнота хирургического лечения. ЛТ улучшает выживаемость без прогрессии, не влияя на ОВ.
ЛИТЕРАТУРА/REFERENCES
-
Okamoto Y., Schler D., Probst-Hensch N.M., et al. Population-based study on incidence, survival rates, and genetic alterations of low-grade diffuse astrocytomas and oligodendrogliomas. Acta Neuropathol. 2004;108(1):49–56.
-
Van Veelen M.L.C., et al. Supratentorial low grade astrocytoma: prognostic factors, dedifferentiation, and the issue of early versus late surgery. J. Neurol. Psych. 1998;64(5):581–7.
-
Olson J.D., Riedel E., DeAngelis L.M. Long-term outcome of low-grade oligodendroglioma and mixed glioma. 2000;54(7):1442–8.
-
Hinsdale I.L. CBTRUS, Statistic report; primary brain tumors in United States, 1998–2002. Central Brain Tumor Registry of the United States. 2005.
-
Ohgaki H., Kleihues P. Population-based studies on incidence, survival rates, and genetic alterations in astrocytic and oligodendroglial gliomas. Neuropathol. Exp. Neurol. 2005;64(6):479–89.
-
Johannesen T.B., et al. Trends in incidence of brain and central nervous system tumors in Norway, 1970–1999. Neuroepidemiol. 2004;23(3):101–9.
-
Lönn S., et al. Incidence trends of adult primary intracerebral tumors in four Nordic countries. Intern. J. Cancer. 2004;108(3):450–5.
-
Hoffman S., Propp J.M., McCarthy B.J. Temporal trends in incidence of primary brain tumors in the United States, 1985-1999. Neuro-oncol. 2006;8(1):27–37.
-
Hess K.R., Broglio K.R., Bondy M.L. Adult glioma incidence trends in the United States, 1977–2000. 2004;101(10):2293–9.
-
Claus E.B., Black P.M. Survival rates and patterns of care for patients diagnosed with supratentorial low-grade gliomas. 2006;106(6):1358–63.
-
Okamoto Y., et al. Population-based study on incidence, survival rates, and genetic alterations of low-grade diffuse astrocytomas and oligodendrogliomas. Acta Neuropathol. 2004;108(1):49–56.
-
Walker D.G., Kaye A.H. Low grade glial neoplasms. Clin. Neurosci. 2003;10(1):1–13.
-
Becker K., et al. DNA repair protein MGMT protects against N-methyl-Nnitrosourea-induced conversion of benign into malignant tumors. Carcinogenesis. 2003;24(3):541–6.
-
Nakasu S., et al. Prognostic significance of loss of O 6-methylguanine-DNA methyltransferase expression in supratentorial diffuse low-grade astrocytoma. Surgical neurology. 2007;68(6):603–8.
-
Janny P., et al. Low grade supratentorial astrocytomas. Management and prognostic factors. Cancer. 1994;73(7):1937–45.
-
Leighton C., et al. Supratentorial low-grade glioma in adults: an analysis of prognostic factors and timing of radiation. J. Clin. Oncol. 1997;15(4):1294–301.
-
Louis D.N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. 2016;131(6):803–20.
-
Raizer J. Chemotherapy for low-grade gliomas: lessons and questions. (Williston Park, NY). 2014;28(12):1043–4.
-
van den Bent M.J. Chemotherapy for low-grade glioma: when, for whom, which regimen? Opin. Neurol. 2015;28(6):633–938.
-
Milyukov S.M. Diagnostics and treatment of primary infiltrative low grade gliomas. Vest. Ros. nauchnogo centra rentgenoradiologii Minzdrava Rossii. 2016; 16 (2). // Милюков С.М. Диагностика и лечениепервичных инфильтративных глиом низкой степени злокачественности. Вест. Рос. научного центра рентгенорадиологии Минздрава России. 2016;16(2).
-
Kobyakov G.L., Bekyashev A.H., Golanov A.V., et al. Practical recommendations for drug treatment of primary central nervous system tumors. Malignant tumors: Practical recommendations RUSSCO # 3s2, 2018; 8: 83–99. // Кобяков Г.Л., Бекяшев А.Х., Голанов А.В. и др. Практические рекомендации по лекарственному лечению первичных опухолей центральной нервной системы. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018;8:83–99.
-
Lunsford L.D., et al. Survival after stereotactic biopsy and irradiation of cerebral nonanaplastic, nonpilocytic astrocytoma. J. Neurosurg. 1995;82(4):523–9.
-
Philippon J.H., et al. Supratentorial low-grade astrocytomas in adults. Neurosurg. 1993;32(4):554–9.
-
Pignatti F., et al. Prognostic factors for survival in adult patients with cerebral lowgrade glioma. J. Clin. Oncol. 2002;20(8):2076–84.
-
Piepmeier J., et al. Variations in the History and Survival of Patients with, Supratentorial Low-grade Astrocytomas. Neurosurg. 1996;38(5):872–9.
-
Hoang-Xuan K., et al. Temozolomide as initial treatment for adults with lowgrade oligodendrogliomas or oligoastrocytomas and correlation with chromosome 1p deletions. J. Clin. Oncol. 2004;22(15):3133–8.
-
Karim A.B.M.F., et al. Randomized trial on the efficacy of radiotherapy for cerebral low-grade glioma in the adult: European Organization for Research and Treatment of Cancer Study 22845 with the Medical Research Council study BRO4: an interim analysis. Int. J. Radiat. Oncol. Biol. 2002;52(2):316–24.
Поступила 28.03.20
Принята в печать 06.07.20
Received 28.03.20
Accepted 06.07.20
Вклад авторов: Голанов А.В. – разработка дизайна исследования, научное редактирование текста статьи; Бекяшев А.Х. – разработка дизайна исследования, научное редактирование текста статьи, проведение операций; Тушев А.А. – обзор публикаций по теме статьи, получение данных для анализа, анализ полученных данных, написание текста статьи; Банов С.М. – анализ полученных данных, научное редактирование текста статьи; Молдованов В.А. – анализ полученных данных, научное редактирование текста статьи; Дреева А.Р. – обзор публикаций по теме статьи, получение данных для анализа.
Authors’ contributions: A.V. Golanov – study design development, scientific editing of the article text; Bekyashev A.H. – development of study design, scientific editing of the text of the article, operations; Tushev A.A. – review of publications on the topic of the article, obtaining data for analysis, analyzing the data obtained, writing the text of the article; Banov S.M. – analysis of the data obtained, scientific editing of the text of the article; V.A. Moldovanov – analysis of the data obtained, scientific editing of the text of the article; Dreeva A.R. – review of publications on the topic of the article, obtaining data for analysis.
Информация об авторах:
А.Х. Бекяшев – д.м.н., профессор кафедры нейрохирургии ФГБОУ ДПО РМАНПО Минздрава России, заведующий Нейрохирургическим отделением в ФГБУ Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина МЗ РФ, Москва, Россия; e-mail: abekyashev@gmail.com. https://orcid.org/0000-0003-3157-6187
А.В. Голанов – д.м.н., профессор кафедры радиологии ФГБОУ ДПО РМАНПО Минздрава России, член-корреспондент РАН, заведующий отделением Радиологии и Радиохирургии в ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» МЗ РФ, Москва, Россия;. e-mail: golanovav@gmail.com. https://orcid.org/0000-0002-3447-0241
С.М. Банов – врач-радиотерапевт, к.м.н., заведующий отделением радиохирургии и радиотерапии Центра “Гамма-нож” ФГАУ НМИЦ нейрохирургии им. акад. Н.Н. Бурденко МЗ РФ, Москва, Россия; e-mail: smbanov@gmail.com. https://orcid.org/0000-0002-7167-7989
В.А. Молдованов – врач-нейрохирург, к.м.н., ФГБОУ ВО Ростовский государственный медицинский университет МЗ РФ, Ростов-на-Дону, Россия; e-mail: v.moldovanov@yandex.ru. https://orcid.org/0000-0002-8952-2408
А.А. Тушев – врач-нейрохирург, ФГБОУ ВО Ростовский государственный медицинский университет МЗ РФ, Ростов-на-Дону, Россия; e-mail: Dr.tushev@ mail.ru. https://orcid.org/0000-0003-2816-3541
А.Р. Дреева – врач-нейрохирург, ФГБОУ ВО Ростовский государственный медицинский университет МЗ РФ, Ростов-на-Дону, Россия. https://orcid. org/0000-0002-3233-9389