Для цитирования:
Кугушев А.Ю., Лопатин А.В., Ясонов С.А., Рогожин Д.В. Продуктивный периостит нижней челюсти у детей. Голова и шея. Российский журнал = Head and neck. Russian Journal. 2020;8(3):16–24
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
For citation:
Kugushev A.YU., Lopatin A.V., Yasonov S.A., Rogozhin D.V. Productive periostitis of the mandible in children. Head and neck. Russian Journal. 2020;8(3):16–24 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, and photographs of patients.
Doi: 10.25792/HN.2020.8.3.16–24
Цель. Продуктивный периостит является одной из форм хронического остеомиелита, при котором происходит образование новой периостальной кости над кортикальной. Для данного заболевания не характерен болевой синдром, однако оно всегда связано с воспалительными изменениями в области молярных и премолярных зубов. В связи со схожей клинико-рентгенологической и гистопатологической картиной, а также редкостью встречаемости, данное заболевание всегда приходиться отличать от фиброзно-костных поражений и сарком.
Материал и методы. За 2014–2019 гг. в отделении челюстно-лицевой хирургии РДКБ на стационарном лечении по поводу безболезненной асимметрии нижней челюсти находились 8 пациентов. На основании оценки местного статуса, сроков появления асимметрии, а также данных компьютерной томографии этим детям был выставлен диагноз «продуктивный периостит». Проведено хирургическое лечение в объеме удаления фиброзно-костных разрастаний на нижней челюсти и экстракции кариозно разрушенных премаляров и маляров над областью поражения.
Результаты. При лучевой диагностике обнаружены характерные признаки, позволяющие провести дифференциальную диагностику от других форм хронического остеомиелита. Полное выздоровление отмечено во всех случаях с полным восстановлением структуры костной ткани в течение 6 месяцев наблюдения. В одном случае после иммуногистологического исследования потребовалось определение мутации MDM2 для исключения низкодифференцированной саркомы, несмотря на характерную клинико-рентгенологическую картину.
Заключение: образование новой кости может происходить при многих патологических состояниях, что требует проведения дифференциальной диагностики с обязательным иммуногистохимическим исследованием.
Ключевые слова: периостит, Гарре, остеомиелит, нижняя челюсть, фиброзно-костные поражения, кариес
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена без спонсорской поддержки
Aim of the study. Productive periostitis is a rare form of chronic osteomyelitis in which a new periosteal bone tissue over the cortical bone is formed. This disease is not accompanied by pain, but is always associated with inflammatory changes in the molars and premolars area. Differential diagnosis should be considered with fibrous bone lesions and sarcomas due to the similar clinical, radiological and histopathological picture, as well as the rarity of occurrence.
Material and methods. In 2014–2019, 8 patients were admitted to the Department of Maxillofacial Surgery of the Russian Childrens’ Clinical Hospital with a painless asymmetry of the face in the lower jaw region. Based on the local examination and computed tomography findings, a diagnosis of productive periostitis was made in these children. Surgical treatment included the removal of fibrous bone growth on the lower jaw and extraction of carious-destroyed premolars or molars above the lesion area.
Results. Radiological diagnostics revealed characteristic signs allowing differential diagnosis with other forms of chronic osteomyelitis. Complete recovery with a complete restoration of the bone structure was achieved in all cases within 6 months of observation. One of the cases required to detect the MDM2 mutation to exclude low-grade sarcoma after immunohistological assessment, despite the specific clinical and radiological picture.
Conclusion. The formation of a new bone may occur in many pathological conditions, which requires differential diagnosis with the obligatory immunohistological examination.
Key words: periostitis, Garre, osteomyelitis, lower jaw, fibrous bone lesions, dental caries
Conflicts of interest. The authors have no conflicts of interest to declare.
Funding. There was no funding for this study.
Введение
Пролиферативный периостит впервые упомянут швейцарским хирургом Карлом Гарре в 1893 г. при описании поражения большеберцовой кости [1–5]. Первый случай поражения нижней челюсти у детей принадлежит C.E. Loveman (1941) [2]. Данное заболевание характеризуется образованием новой кости над инфицированным участком губчатой вследствие реакции внутренней поверхности надкостницы на слабый инфекционный агент. Чаще всего в роли инфекционных агентов выступают стафилококки и стрептококки как причина периапикальной одонтогенной инфекции, однако формирование пролиферативного периостита – относительно редкое одонтогенное осложнение [2, 6, 7]. По мнению N.K. Wood, для развития этого заболевания должна реализоваться следующая комбинация [7]: наличие надкостницы с высокой остеобластической активностью и хроническая инвазивная инфекция, стимулирующая образование новой периостальной костной ткани, но недостаточно патогенная, чтобы вызвать резорбцию. При этом должен быть баланс между сопротивляемостью организма и вирулентностью микроорганизмов, чтобы легкая хроническая инфекция могла продолжаться достаточно долго.
По данным L.R. Eversole, это заболевание встречается исключительно у детей (средний возраст 11 лет) [8], хотя спорадические случаи были зарегистрированы у пациентов после 20 лет и у младенцев [2, 3, 9–11]. Чаще болеют лица мужского пола с преобладанием 1–1, 4:1 [2].
Для пролиферативного периостита характерно одностороннее поражение в области задних двух третей нижней челюсти [12–14]. Чаще всего причиной возникновения этого заболевания является инфицированный 1-й моляр нижней челюсти, в проекции корней которого и возникает образование [2, 4, 5, 7, 11, 14]. В анамнезе могут быть жалобы на боль, вызванную одонтогенной инфекцией, отечность по нижней границе в задних двух третях нижней челюсти [9, 12, 13]. Поражение верхней челюсти встречается редко, однако имеется описание случая с одномоментным поражением всех четырех зон моляров и премоляров [7].
Отек щеки вызывает умеренную асимметрию лица и протекает бессимптомно и безболезненно. Тем не менее болевой компонент может возникать, если очаг поражения вторично инфицирован [2, 11]. С появлением хронической инфекции под надкостницей начинает формироваться новая кость и отек начинает уплотняться.
При пальпации зоны поражения определяется образование костной плотности, как правило, без активных признаков воспаления на коже и слизистых оболочках. Несмотря на то что объем формирования кости различается, всегда имеется отек мягких тканей. Размер может варьироваться от 2 см до поражения всего тела нижней челюсти на стороне воспаления. При этом толщина костного нароста может достигать 2–3 см [2].
Несмотря на негнойный характер периостита, иногда происходит формирование наружного свища [4, 11], а также возможно наличие лимфаденопатии и лейкоцитоза, однако они являются случайными находками [2, 4, 7]. В отличие от других форм остеомиелита, гипертермия, как правило, отсутствует, а скорость оседания эритроцитов остается неизмененной. Кроме того, нет значимого увеличения числа лейкоцитов или уровня щелочной фосфатазы [9, 15].
При лучевой диагностике рентгенографические проявления зависят от продолжительности заболевания и степени кальцификации. В раннем периоде – это наличие тонкой «корки» над кортикальным слоем. Пространство между этой новой тонкой оболочкой кости и уже существующим кортикальным слоем может быть рентгенопрозрачно. По мере течения заболевания в результате последующих новых отложений утолщается кортикальный слой, который приобретает вид «луковой кожуры» на рентгенограмме [2, 3, 11, 15–18]. Прилегающая медуллярная кость может иметь смешанную структуру с зонами остеолизиса в пределах нормальной или склерозированной области [2, 9]. Такие изменения указывают на параллельное образование новой реактивной кости, которая расширяет поверхность измененной кости. В большинстве описанных случаев на рентгенограмме костная ткань выглядит нормально, но в некоторых случаях это состояние может сопровождаться остеолитическими или остеосклеротическими изменениями, а также формированием небольших секвестров [2, 20]. При проведении прицельных рентгенограмм зубов определяется рентгенопрозрачная область на верхушке корня вовлеченного кариозного зуба [14, 21, 22].
При гистологическом исследовании выявляют пролиферацию новой активной костной ткани в области компактного слоя и под надкостницей с фиброзно-костным рисунком и минимальным сосудистым пространством. Одной из особенностей этой новой кости является наличие остеобластной оправы и остеоидной ткани. Кроме того, в существующей волокнистой соединительной ткани прослеживается наличие инфильтрации хронических воспалительных клеток, микроабсцессов и микросеквестров [2, 23, 24].
В настоящий момент большинство авторов сходятся во мнении, что лечение заключается в удалении пораженного зуба. Однако описано изолированное лечение каналов пораженного зуба с положительным исходом и восстановлением симметрии нижней челюсти [2, 13, 15, 21].
Материал и методы
В отделении челюстно-лицевой хирургии РДКБ ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России за период 2012– 2019 гг. на стационарном лечении по поводу образования нижней челюсти находились 8 детей. Всем детям перед операцией была проведена мультиспиральная компьютерная томография (КТ) с трехмерной реконструкцией, на которой выявлялось образование пониженной костной плотности в пределах периоста. Оценка характера костных изменений проводилась с использованием специализированного программного обеспечения, установленного как на сервер больницы (Meddialog), так и с помощью портативных программ (Amira 5.34 – построение 3Д моделей и Vidar Dicom viewer – оценка размера и плотности образований). В анализ были включены различные переменные: возраст, пол, основная жалоба и ее продолжительность, тип поражения, локализация. Панорамные рентгеновские снимки и конусная трехмерная ортопантомограмма не использовались по причине низкого качества визуализации костной структуры. Всем детям проведено оперативное лечение – удаление образования внутриротовым доступом с последующим иммуногистопатологическим исследованием, позволившим подтвердить характер заболевания. В послеоперационном периоде все дети находились под катамнестическим наблюдением с проведением контрольных КТ не реже 1 раза в год.
Результаты
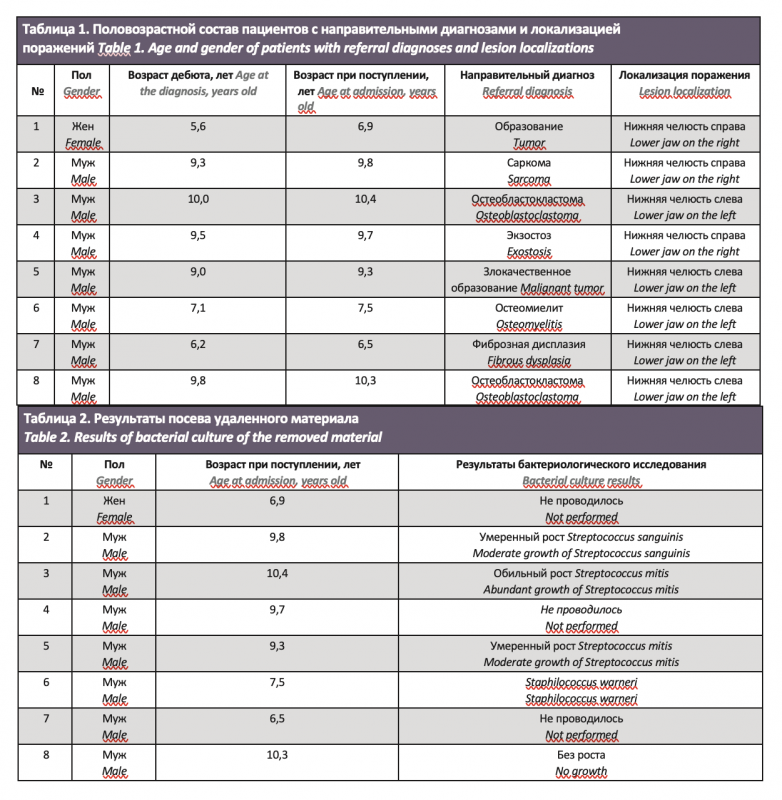
На момент поступления в стационар средний возраст пациентов составлял 8,8 года. В исследуемой группе превалировали мальчики (7:1), а поражение имело преимущественно левосторонний характер (5:3). Основной жалобой при поступлении было наличие асимметрии нижней челюсти, которую в 3 случаях связывали с травмой (рис. 1). В двух случаях заболевание развилось после неудачной попытки удаления кариозных премоляров. Появление отека и деформации сопровождалось болевым синдромом у 3 пациентов, однако воспалительный характер заболевания заподозрен только в одном случае (табл. 1). Во всех остальных случаях заболевание протекало без болевого синдрома.
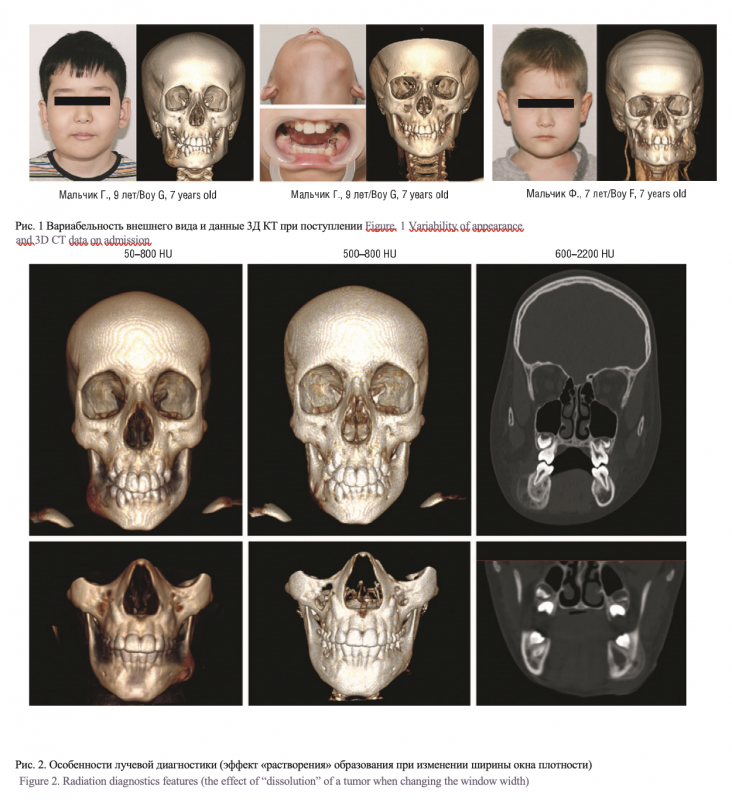
Компьютерная томография позволила выявить во всех случаях закономерность для данного заболевания. При изменении окна плотности удавалось «растворить» образование с обнажением подлежащей нижней челюсти (рис. 2).
При оценке коронарных срезов отмечалось «окутывание» фиброзными тканями нижней челюсти по плотности значительно ниже костной ткани, связанное через дефект в кортикальном слое. Образование было всегда хорошо очерчено с псевдо-кистозными низкоплотными включениями. Во всех случаях регистрировалась симметричная полиаденопатия. В трех случаях очаг воспаления располагался в проекции зуба 3.4, в четырех случае – в проекции зубов 4.6 или 3.6 и только в одном случае – в области зуба 4.5.
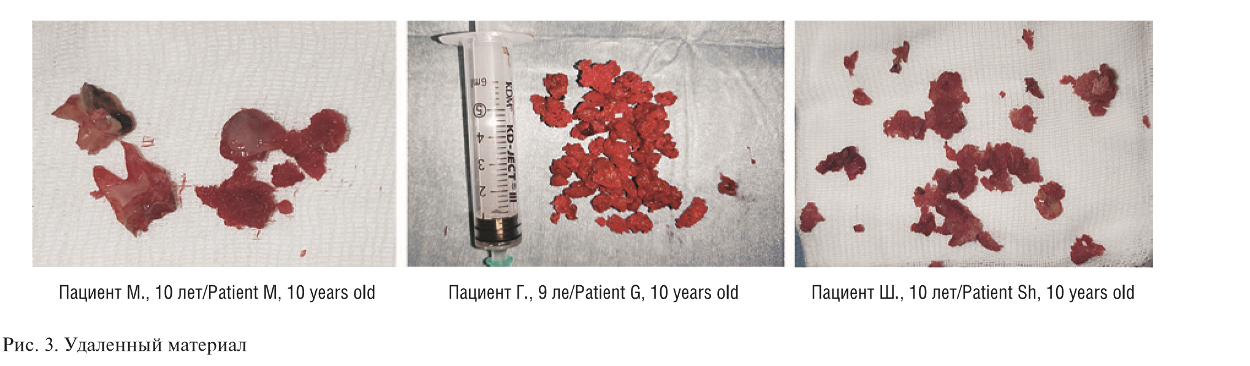
Хирургическое лечение проводилось внутриротовым доступом с разрезом по переходной складке преддверия рта. Во всех случаях выполнено удаление фибринозно-измененных тканей без проведения краевой резекции или декортикации. В 3 случаях проводилось одномоментное удаление кариозно-измененных зубов (рис. 3). В двух случаях, когда заболевание было связано с травмой, кариозного поражения зубов полости рта выявлено не было. Удаленный материал отправлялся на гистологическое и бактериологическое исследования.
Бактериологическое исследование материала удалось провести в 5 случаях, что связано с техническими трудностями. По данным проведенного исследования единой патогенной микрофлоры не обнаружено. Результаты бактериологического исследования содержали различные концентрации условнопатогенной микрофлоры полости рта и зубов (табл. 2).
При гистологическом исследовании выявлялись фрагменты губчатой кости с участками остеолизиса и реактивного остеогенеза. В зонах остеолизиса костные балки были замещены волокнистой соединительной тканью с очагами смешанного воспаления без наличия клеток атипии. В одном случае проводилось иммуногистохимическое исследование с антителами к b-catenin, SMA, SATB2, CD34, MDM2, cdk4 в связи с выявлением веретеновидных клеток. Веретеновидные клетки экспрессировали MDM2, SATB2 и cdk4. Несмотря на характерную клинико-рентгенологическую картину, в этом случае заподозрена низкодифференцированная остео — саркома, что потребовало исследование гена MDM2. Иммуногенетическое исследование гена MDM2 не подтвердило наличия данной мутации, а в ходе динамического наблюдения отмечалась полная перестройка костной ткани.
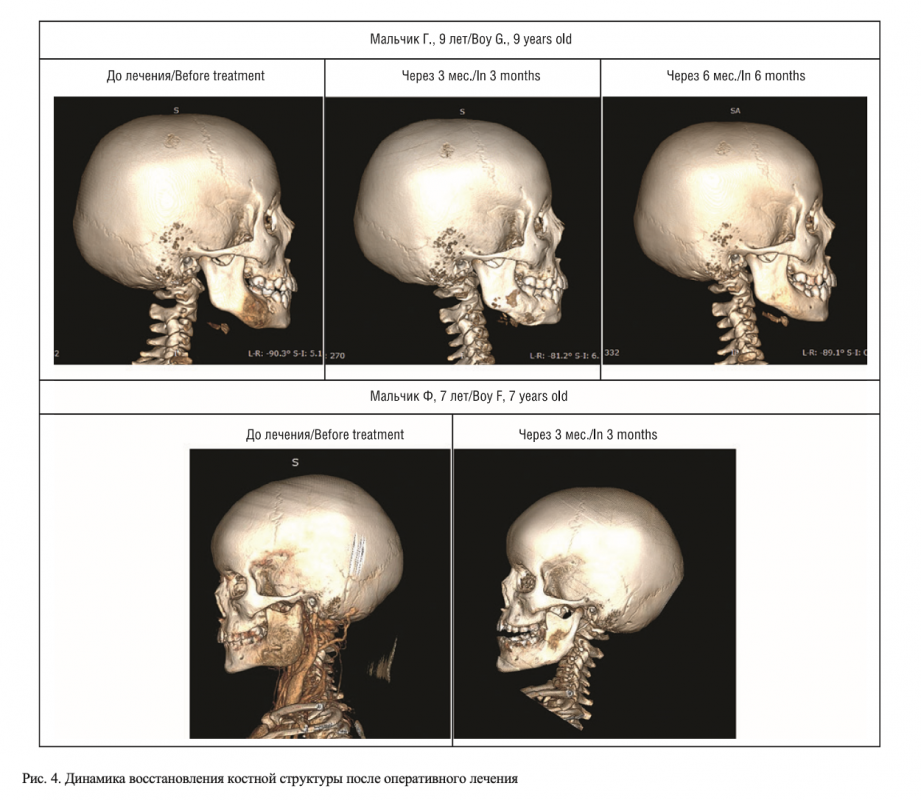
Во всех случаях при катамнестическом осмотре через 6 месяцев отмечалась полная перестройка в зоне поражения независимо от объема первичного очага с восстановлением костной структуры. При этом даже при наличии остаточных фиброзных наложений после санации очага происходило полное восстановление пораженной области (рис. 4).
Обсуждение
Продуктивный периостит (ПП) является формой хронического остеомиелита, при котором происходит образование новой периостальной кости над кортикальной. Такая патологическая реактивность была описана различными клиническими терминами, включая «хронический диффузный склерозирующий остеомиелит», «хронический остеомиелит с пролиферативным периоститом», «остеомиелит Гарре», «хронический негнойный склерозирующий остеит», «острый миелит» и «острый периостит» [13]. Термин «остеомиелит Гарре» почти полностью отвергается большинством медицинских патологов, но все еще используется стоматологами [14].
Распространенной причиной периостальной реакции является кариес зубов с сопутствующими периапикальными поражениями и вторичным инфицированием пародонта, переломами и неодонтогенными инфекциями [14, 15]. Большинство пролиферативных периоститов возникает над компактной костью в области вовлеченного зуба [13]. Чаще всего причиной является инфицированный 1-й молярный зуб, реже пролиферативный периостит возникает из-за кариеса 3-го моляра [9]. Однако в наблюдаемой нами группе причиной развития периостита являлись и премоляры. По мнению B.W. Neville, гиперплазия периоста может быть вызвана прорезыванием зуба, с чем может быть связан средний возраст дебюта – 11 лет [18]. Однако в нашей группе средний возраст составил 8,8 года, что также совпадает с периодом сменного прикуса. В большинстве случаев обширной зоны костеобразования не возникает, однако возможно ее распространение за пределы пораженных участков на ветвь и мыщелковый отросток [6, 14].
С точки зрения патофизиологии, воспалительные сигналы могут регулировать периостальный ответ с помощью матриксной металлопротеиназы-9 (MMP-9), экспрессируемой нейтрофилами и макрофагами [25] в зоне воспаления. MMP9 опосредованно влияет на дифференцировку скелетных клеток, регулируя воспалительный ответ и распределение воспалительных клеток, что приводит к локальной регуляции дифференцировки клеток в области периоста [26, 27]. Кроме того, критическим регулятором воспаления, играющим важную роль в регуляции работы периоста, является COX-2 – изоформа циклооксигеназы, фермента, ограничивающего скорость биосинтеза простагландина. Сверх экспрессия этого фермента увеличивает скорость остеогенеза [28]. Вероятнее всего, избыточная воспалительная стимуляция данных факторов на фоне хронической низковирулентной флоры, не приводящей к избыточной воспалительной реакции, а также прорезывание молярных и премолярных зубов повышают остеобластическую активность периоста. Хотя, безусловно, необходимы дальнейшие исследования роли MMP-9 и COX-2, т.к. модуляция воспалительного процесса может быть использована в периосто-опосредованной костно-регенеративной терапии [29].
Для диагностики достаточно проведения традиционных рентгенографических методов или КТ-изображений [4, 5, 30, 31]. Некоторые авторы для постановки диагноза ограничивались ортопантомограммой без биопсии или рентгенологического обследования в динамике [13, 28]. Однако, по нашему мнению, именно КТ позволяет установить правильный диагноз ПП. Характерной особенностью является «растворение» пораженной зоны при смене зон костной плотности, что отличает его от других форм хронического остеомиелита. В большинстве случаев в связи с характерной клинико-рентгенологической картиной нет необходимости в проведении биопсии, кроме случаев сомнения в диагнозе [5, 11].
При КТ пролиферативная кость образует слои рентгеноконтрастного ламинирования по типу «луковой кожуры». Расслоение кортикальной кости происходит в параллельных слоях [13]. Значительно реже встречаются остеолитические рентгенпрозрачные зоны в новой кости [32]. У наших пациентов наружная поверхность новообразованной кости была преимущественно гладкой, но смешанная внутри неокортикогенеза.
Подобные костные изменения могут встречаться при саркома Юинга и остеогенной саркоме [7], но разрушение костной ткани, связанное с этими заболеваниями, является менее упорядочным и имеет вид «изъеденной молью» [7, 14], а периостальная реакция имеет игольчатый тип [7, 14]. Кроме того, саркома Юинга часто сопровождается такими осложнениями, как невралгия и парестезия губ [2, 31], а остеосаркома – наличием периостальных реакций в форме козырька Кодмана [2, 33].
ПП также следует отличать от других патологий, которые вызывают образование новой кости, включая болезнь Каффи, фиброзную дисплазию, болезнь Педжета, периферические остеомы, экзостозы и оссифицированные поднадкостничные гематомы [4, 5, 11, 31]. Болезнь Каффи проявляется аналогично, с наличием «луковой кожуры» на рентгенограмме, однако для этого заболевания характерен возраст дебюта до двух лет, двустороннее вовлечение пазух и углов нижней челюсти, а также поражение нескольких костей [2]. Другим патологическим состоянием, требующим дифференциальной диагностики, является фиброзная дисплазия, возраст дебюта и клиническое течение которой очень похожи. Тем не менее фиброзная дисплазия отличается от ПП наличием изменения на рентгенограмме по типу «матового стекла» без четкой дифференцировки на слои, а также отсутствием связи с инфекционным агентом [2, 5, 11, 31]. Периферические остеомы и экзостоз рентгенологически представлены как высокоплотная однородная рентгеноконтрастная масса кнаружи от кортикального слоя. Клиническое проявление оссифицирующей субпериостеальной гематомы также могут быть схожи с ПП, однако она не обладает равномерной рентгеноконтрастностью и связана с травмой [2].
При гистологическом исследовании выявляют параллельные ряды трабекул в реактивной костной ткани, располагающиеся перпендикулярно поверхности компактного слоя, а в межтрабекулярном пространстве – воспаление и некроз. При пролиферативном периостите некоторые волокна трабекул связаны и широко разнесены, в связи с чем его путают с фиброзной дисплазией [34]. Однако при фиброзной дисплазии имеется фиброзная строма с трабекулами неправильной формы. Кроме того, при остеогенной саркоме можно наблюдать наличие анапласти- ческих клеток опухоли и остеоида, продуцируемых злокачественными мезенхимальными клетками [14]. В наблюдаемых нами случаях не было признаков остеоида и опухолевых клеток, однако в одном случае потребовалось проведение исследования для исключения мутации MDM2, характерной для низкодифференцированной саркомы.
Существуют различные мнения относительно наиболее подходящего вида лечения. Несмотря на то что гипербарическая оксигенация и эндодонтическое лечение оказались успешными, наиболее распространенным является использование антибиотиков и удаление инфицированного зуба [9, 13, 28, 30, 35]. После устранения источника инфекции увеличенная в объеме кость восстанавливается до ее первоначальной формы под действием вышележащих мышц [14]. Если костная деформация выражена, показано проведение ремоделирования с целью достижения первоначальной формы, т.к. спонтанный регресс маловероятен [36]. Учитывая трудности, связанные с применением эндодонтического лечения, в наших случаях была проведена антибактериальная терапия, удаление избыточных периостальных фиброзных тканей и в одном случае удаление кариозно разрушенного зуба. Во всех случаях достигнуто улучшение контуров кости на контрольных КТ, сделанных через 6 месяцев после хирургического лечения. Во всех описанных нами случаях удалось избежать радикальной резекции.
В литературе описано успешное нехирургическое лечение, заключающееся в чистке и пломбировке корневых каналов, что эффективно устраняет этиологические факторы (микроорганизмы и их побочные продукты), позволяет заменить остеобластную активность остеокластической. При данном подходе не требуется комбинации с другими методами лечения или дополнительной антибактериальной терапии [37]. Ранее многие авторы выступали за хирургическое изменение контуров кости [38], однако нехирургическое лечение корневых каналов приводит к ремоделированию кости самостоятельно [7, 13]. Мы наблюдали 2 детей, у которых ПП возникал после экстракции причинных зубов. В большинстве статей сообщается, что продолжительность полного восстановления составляет около одного года [6, 15, 39]. Хирургическое удаление фиброзных разрастаний ускоряет этот процесс, как в наших случаях, когда ремоделирование происходило в течение первых 6 месяцев.
Заключение
Описанные нами случаи демонстрируют, что ПП может возникать из-за инфекции даже после экстракции зуба, что требует хирургического лечения в объеме локальной санации очага. Клинико-гистологическое сходство этого заболевания с саркомами требует обязательного проведения биопсия для верификации диагноза.
ЛИТЕРАТУРА / REFERENCES
-
Garrè C. Ueber besondre Formen und Folgezustande d. aku-ten infekt. Osteomyelitis Beitr. Z. Kiln. Chir. 1893;10:257.
-
Karjodkar F.R., Textbook of Dental and Maxillofacial Radiology, Jaypee, Panama City, Panama, 2nd edition, 2009.
-
Çelenk P., Akgül H.M. Garre’s osteomyelitis (a casereport). J. Ondokuz. Mayıs University Dental Faculty. 2000;3:29–31.
-
Nakano H., Miki T., Aota K., Sumi T., Matsumoto K., Yur Y.A. Garré’s osteomyelitis of the mandible caused by aninfected wisdom tooth. Oral Sci. Internat. 2008;l5(2):150–4.
-
Suma R., Vinay C., Shashikanth M.C., Subba V.V. Reddy. Garre’s sclerosing osteomyelitis. J. Indian Societ. Prevent. Dent. 2007;25:30–3.
-
Children’s therapeutic dentistry. National guideline. Ed. by V.K. Leontiev, L.P. Kiselnikova. 2nd ed., rev. and add. M., 2017. 952 p. / Детская терапевтическая стоматология. Национальное руководство. Под ред. В.К. Леонтьева, Л.П. Кисельниковой. 2-е изд., перераб. и доп. М., 2017. 952 с.
-
Wood N.K., Goaz P.W. Solitary radiopacities not necessarily contacting teeth. In: Wood N.K., Goaz P.W. Oral and maxil-lofacial lesions. 5th ed. St. Luis: Mosby. 1996. Р. 488–49.
-
Eversole L.R. Proliferation periostitis of Garrè: its differentiation from other neoperiostoses. Oral Surg. 1979;37(10):725–31.
-
Tong A.C.K. Oral Pathol. Oral Radiol. Endod. 2006;102:e14–9.
-
Erişen M., Bayar Ö.F., Ak G. Garre osteomyelitis: a case report. Dent. Faculty Atatürk Univer. 2014;9:49–53.
-
Gonçalves M., Oliveira D.P., Oya Е.О., Gonçalves A. Garre’s osteomyelitis associated with a fistula: a case report. Clin. Pediatr. Dent. 2002;26(3):311–3.
-
Pell G.J. Garrè’s osteomyelitis of the mandible: report of case. J. Oral Surg. 1955;13(3):248–52.
-
Zand V., Lotfi M., Vosoughhosseini S. Proliferative periostitis: a case report.
-
Endod. 2008;34(4):481–3.
-
Seok H., Kim S.G., Song J.Y. Proliferative periostitis of the mandibular ramus and condyle: a case report. Korean Assoc. Oral Maxillofac. Surg. 2015;41(4):198–202. doi: 10.5125/jkaoms.2015.41.4.198.
-
McWalter G.M., Schaberg S.J. Garrè’s osteomyelitis of the mandible resolved by endodontic treatment. Am. Dent. Assoc.1984;108(2):193–5.
-
Smith S.N., Farman A.G. Osteomyelitis with proliferative periostitis (Garré’s osteomyelitis). Report of a case affecting the mandible. Oral Surg. 1977;43(2):315–8.
-
Asgary S., Eghbal M.J., Ehsani S., Eslami B. An unusual finding of proliferative periostitis in a child: a case report. J. Stomatol. Res. 2012;1(1):1–5. doi: 10.5923/j.ijsr.20120101.01.
-
Neville B.W., Damm D.D., Allen C.M. Oral and maxillofacial pathology. 2nd ed. Philadelphia: Saunders; 2002.
-
Lee L. Inflammatory lesions of the jaws. In: White SC., Pharoah M.J. Oral Radiol. 5th ed. St. Luis: Mosby. 2004. Р. 377–80.
-
Zhelezny P.A., Kolybelkin M.V., Izyumov A.O., Apraksina E.Yu., Zheleznaya A.P. Characteristics of odontogenic and non-odontogenic inflammatory processes of the maxillofacial region in children treated in the maxillofacial hospital. Siberian Med. Sci. 2018; 3: 31-39 / Железный П.А.,
Колыбелкин М.В., Изюмов А.О., Апраксина Е.Ю., Железная А.П. Характеристика одонтогенных и неодонтогенных воспалительных процессов челюстно-лицевой области у детей, проходивших лечение в челюстно-лицевом стационаре. J. Siberian Med. Sci. 2018;3:31–39.
-
Железный П.А., Железная А.П., Самойлов К.О. Эффективность препаратов, обладающих антисептическими и остеостимулирующими свойствами при лечении осложненного кариеса. Рос. стоматол. журн. 2015;19(2):9–12. Zhelezny P.A., Zheleznaya A.P., Samoilov K.O. The effecti- veness of drugs with antiseptic and osteostimulating properties in the treatment of complicated caries. Ros. stomatol. zhurn. 2015;19 (2): 9–12.
-
Nortje C.J., Wood R.E., Grotepass F. Periostitis ossificans versus Garrè’s osteomyelitis: part II – radiologic analysis of 93 cases in the jaws. Oral Surg. Oral Med. Oral Pathol. 1988;66(2):249–60.
-
Lichty G., Langlais R.P., Aufdemorte T. Garrè’s osteomyelitis. Oral Surg. 1980;50(4):309–13.
-
Akgül H.M., Çağlayan F., Günen Yılmaz S., Derindağ G. Garre’s Osteomyelitis of the Mandible Caused by Infected Tooth. Case Rep. Dent. 2018;2018:1409539. Published 2018 Jul 8. doi: 10.1155/2018/1409539.
-
Colnot C., Thompson Z., Miclau T., Werb Z., Helms J.A. Altered fracture repair in the absence of MMP9. 2003;130:4123–33.
-
Loveman C.E. Mandibular subperiosteal swelling in children. Am. Dent. Assoc. 1941;28:1230–5.
-
Wang X., Yu Y.Y., Lieu S., et al. MMP9 regulates the cellular response to inflammation after skeletal injury. Bone. 2013;52:111–9.
-
Zhang X., Schwarz E.M., Young D.A., et al. Cyclooxygenase-2 regulates mesenchymal cell differentiation into the osteoblast lineage and is critically involved in bone repair. J. Clin. Invest. 2002;109:1405–15.
-
Lin Z., Fateh A., Salem D.M., Intini G. Periosteum: biology and Applications in craniofacial bone regeneration. Dent. Res. 2014;93(2):109–16.
-
Brazao-Silva M.T., Pinheiro T.N. The so-called Garrè’sosteomyelitis of jaws and the pivotal utility of computedtomography scan. Contemporary Clin. Dent. 2017;8(4):645–6.
-
White S.C., Pharoah M.J. Oral Radiology: Principles and Interpretation, Mosby, St. Louis, MO, USA, 6th ed., 2009.
-
Nortjé C.J., Wood R.E., Grotepass F. Periostitis ossificans versus Garrè’s osteomyelitis. Part II: radiologic analysis of 93 cases in the jaws. Oral Surg. Oral Med. Oral Pathol. 1988;66:249–60.
-
Suei Y., Taguchi A., Tanimoto K. Diagnosis and classifi-cation of mandibular osteomyelitis. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 2005;100(2):207–14.
-
Petrocelli M., Kretschmer W. Conservative treatment and implant rehabilitation of the mandible in a case of craniofacial fbrous dysplasia: a case report. Oral Maxillofac. Surg. 2014;72:902.e1–6.
-
Jayasenthil A., Aparna P., Balagopal S. Non-surgicalendodontic management of Garre’s osteomyelitis: a casereport. J. Med. Res. 2015;9(3):1–4.
-
Belli E., Matteini C., Andreano T. Sclerosing osteomyelitis of Garré periostitis ossifcans. Craniofac. Surg. 2002;13:765–8.
-
Suei Y., Taguchi A., Tanimoto K. Diagnosis and classification of mandibular osteomyelitis. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 2005;100(2):207–14.
-
Ellis D.J., Winslow J.R., Indovina A.A. Garrè’s osteomyelitis of the mandible. Oral Surg. 1977;44(2):183–9.
-
Ferreina B.A., Barbosa A.L. Garre’s osteomyelitis: A case report. Endod. J. 1992;25(3):165–8.
Поступила 28.03.20
Принята в печать 06.07.20
Received 28.03.20
Accepted 06.07.20
Вклад авторов: Кугушев А.Ю. – написание текста рукописи, анализ данных, обзор публикаций по теме статьи, анализ полученных данных, хирургическое лечение пациентов; Лопатин А.В. – разработка дизайна исследования; Ясонов С.А. – предоставление архивных данных для анализа; Рогожин Д.В. – патологоанатомическое исследование гистологического материалов
Authors’ contributions: Kugushev A.Yu. – writing the text of the manuscript, data analysis, review of publications on the topic of the article, analysis of the data obtained, surgical treatment of patients; Lopatin A.V. – research design development; Yasonov S.A. – provision of archived data for analysis; Rogozhin D.V. – pathological examination of histological materials.
Информация об авторах:
А.Ю. Кугушев – к.м.н., врач пластический хирург, детский хирург, детский онколог отделения челюстно-лицевой хирургии РДКБ ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, доцент кафедры хирургии с курсом онкологии и реконструктивно-пластической хирургии детского возраста ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава, Москва, Россия; e-mail: drkugushev@gmail.com. https://orcid.org/0000-0002-6881-7709 А.В. Лопатин – д.м.н., профессор, заведующий отделением челюстнолицевой хирургии РДКБ ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава России,
Москва, Россия. https://orcid.org/0000-0003-0043-9059
Ясонов С.А. – к.м.н., врач челюстно-лицевой хирург отделения челюстнолицевой хирургии РДКБ ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава
России, Москва, Россия. https://orcid.org/0000-0003-0319-3103
Д.В. Рогожин – д.м.н., заведующий отделением патологической анатомии, РДКБ ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава России, Москва, Россия. https://orcid.org/0000-0003-0777-9152