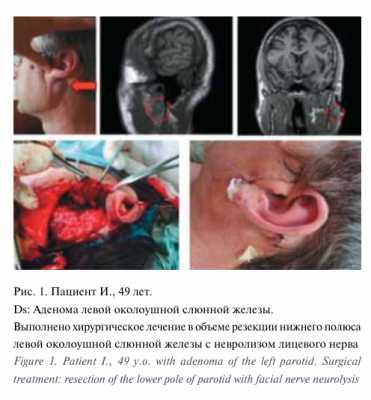
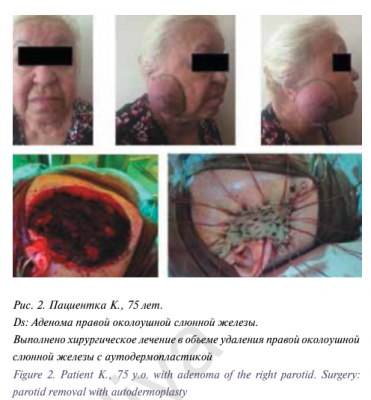
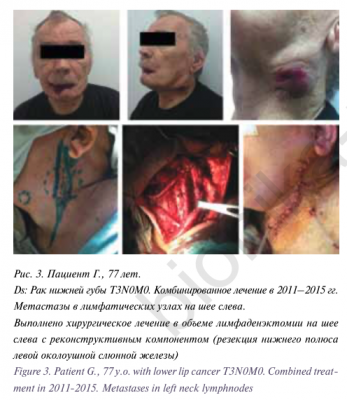
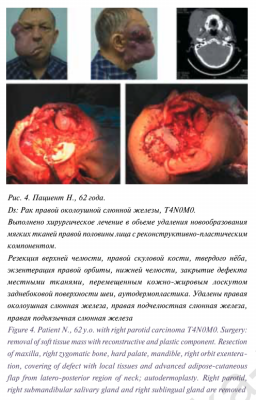
Для цитирования: Вабалайте К.В., Сомова А.Д., Романчишен А.Ф. Использование флуорисцентной ангиографии с индоцианином зеленым в эндокринной хирургии — технология будущего для идентификации околощитовидных желез или мимолетное увлечение? Голова и шея. Российский журнал Head and neck Russian Journal. 2020;8(2):95–100
For citation: Vabalayte K.V., Somova A.D., Romanchishen A.F. The use of fluorescent angiography with indocyanine green in endocrine surgery – a future technology for identification of the parathyroid glands or a fleeting hobby? Head and neck. Russian Journal. 2020;8(2):95–100 (in Russian).
Doi: 10.25792/HN.2020.8.2.95–100
Рост числа пациентов, страдающих заболеваниями щитовидной железы (ЩЖ), неизбежно приводит к увеличению числа хирургических вмешательств на данном органе. Проблема возникновения послеоперационного гипопаратиреоза (ГПТ) в настоящее время продолжает быть актуальной, несмотря на различные методы идентификации околощитовидных желез (ОЩЖ). В последние годы в различных областях хирургии успешно применяется флуоресцентная ангиография с индоцианином зеленым, позволяющая надежно оценить степень перфузии различных органов и тканей. В настоящей статье рассматривается международный опыт использования вышеуказанной методики в эндокринной хирургии в качестве метода профилактики послеоперационного ГПТ в зависимости от активности интраоперационного кровоснабжения ОЩЖ. Показано, что использование флуоресцентной ангиографии с индоцианином зеленым является надежным методом для идентификации и сохранения ОЩЖ. Таким образом, данная технология может позволить свести к минимуму риск послеоперационного ГПТ.
Ключевые слова: околощитовидные железы, послеоперационный гипопаратиреоз, тиреоидэктомия, гипокальциемия, индоцианин зеленый.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена без спонсорской поддержки
Для цитирования: Вабалайте К.В., Сомова А.Д., Романчишен А.Ф. Использование флуорисцентной ангиографии с индоцианином зеленым в эндокринной хирургии — технология будущего для идентификации околощитовидных желез или мимолетное увлечение? Голова и шея. Российский журнал Head and neck Russian Journal. 2020;8(2):95–100
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
An increase in the number of patients with thyroid gland diseases leads to an increase of cases when thyroid surgery is indicated. Despite of the existence of various methods for identifying the parathyroid glands, the issue of postoperative hypoparathyroidism is relevant until nowadays. Recently ICG fluorescent angiography has been successfully introduced into various fields of surgery. It provides reliable assessment of perfusion in various organs and tissues. This article addresses the international experience in ICG fluorescent angiography in endocrine surgery for postoperative hypoparathyroidism prevention, depending on intraoperative blood flow activity in the parathyroid glands. It is shown that ICG fluorescent angiography is a reliable method of the parathyroid glands identification and preservation. This technology may thereby minimize the risk of postoperative hypoparathyroidism.
Key words: parathyroid glands, postoperative hypoparathyroidism, thyroidectomy, hypocalcemia, ICG
Conflicts of interest. The authors have no conflicts of interest to declare. Funding. There was no funding for this study.
For citation: Vabalayte K.V., Somova A.D., Romanchishen A.F. The use of fluorescent angiography with indocyanine green in endocrine surgery – a future technology for identification of the parathyroid glands or a fleeting hobby? Head and neck. Russian Journal. 2020;8(2):95–100 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients.
Заболевания щитовидной железы (ЩЖ) занимают ведущие позиции в структуре эндокринопатий и находятся на втором месте после сахарного диабета [1–3]. Ежегодно наблюдается увеличение числа больных тиреоидной патологией, нуждающихся в хирургическом лечении [4, 5]. Несмотря на относительную безопасность операций на ЩЖ невозможно полностью исключить риск специфических послеоперационных осложнений, к которым относятся гипопаратиреоз (ГПТ), парезы и параличи мышц гортани вследствие повреждения возвратных гортанных нервов – ВГН (LRN – recurrent laryngeal nerves) [2, 6, 7].
По данным разных авторов (Y.J. Suh, 2014; Van den Bos, 2018; А.Ф. Романчишен, 2009; L.A. Orloff, 2018; Vidal Fortuny, 2016), ГПТ, вызванный нарушением кровоснабжения околощитовидных желез (ОЩЖ) в результате непреднамеренной паратиреоидэктомии – ПТЭ (PTE – parathyroidectomy) или механической травмы (раздавливание, кровоизлияние в ОЩЖ), является одним из наиболее частых осложнений после операций на ЩЖ (1–38%) [5, 8–11]. Данные осложнения характеризуются снижением в крови уровня паратгормона – ПТГ (PTH – parathyroid hormone), приводящим к нарушению обмена кальция и фосфора, что сопровождается нейромышечными синдромами [1, 9, 12]. Несмотря на то что ГПТ в большинстве случаев транзиторный, его появление в любом случае требует пролонгирования сроков госпитализации пациентов после тиреоидэктомии – ТЭ (ТЕ – thyroidectomy) или гемитиреоидэктомии – ГТЭ (HTE – hemithyroidectomy). Это определяет необходимость дополнительных лабораторных исследований и использования лекарственных препаратов, что, безусловно, приводит к увеличению как прямого, так и косвенного экономического ущерба [13, 14].
В специальной литературе описаны факторы, повышающие риск послеоперационного ГПТ [15]. В первую очередь – это объем хирургического вмешательства – ТЭ, а также ТЭ, сопряженной с лимфоаденэктомиями, которые могут сопровождаться более высокими рисками данного осложнения в силу возможной травматизации ОЩЖ. Также риск возникновения ГПТ повышается при выполнении повторных операций на ЩЖ, поскольку невозможно судить о сохранности всех ОЩЖ и об отсутствии нарушения в них кровотока во время предшествующих операций [7, 10]. Не стоит забывать и о профессиональной компетенции оперирующих хирургов: у более опытных врачей следует ожидать меньше описанных выше осложнений [12]. Одним из предикторов появления данного осложнения, по данным литературы, является дефицит витамина D в крови больных в предоперационном периоде, что подтвердило исследование Е. Alkhalili и соавт. [14]. Рекомендуемая некоторыми авторами визуализация ОЩЖ во время операции может приводить к худшим результатам в виде увеличения частоты ГПТ после операций на ЩЖ, поскольку способствует большей вероятности ятрогенного нарушения кровоснабжения ОЩЖ [6, 16]. Аутотрансплантация ОЩЖ также не всегда является надежным способом снижения риска послеоперационного ГПТ и не рекомендуется для пересадки паратиреоидной ткани в рутинной практике [11, 16]. Некоторые авторы не рекомендуют прибегать к лигированию нижней щитовидной артерии в пределах капсулы ЩЖ, поскольку данная манипуляция также способствует увеличению частоты данного осложнения [16].
G.H. Sakorafas и соавт. сообщают о том, что эпизодическая непреднамеренная ПТЭ отмечалась в 17,7% случаев. Несмотря на то что интраоперационная визуальная идентификация ОЩЖ способна снизить риск их случайной резекции, он не исключается полностью даже при операции, выполненной опытным хирургом [6]. M. Sorina и соавт. (2019) опубликовали данные, посвященные ятрогенному ГПТ, который проявился у 30,97% оперированных пациентов [17]. Группа испанских ученых во главе с J.J. Díez (2019) заявила о высокой частоте ГПТ, который в их исследованиях встретился в 48,3% наблюдений [18]. Из приведенных выше исследований становится ясно, что точная интраоперационная локализация ОЩЖ с надежной оценкой их жизнеспособности бывает затруднительна. Следовательно, существует очевидная необходимость, помимо повышения профессионализма хирургов, внедрения в их практику новых способов идентификации ОЩЖ. Кроме того, эти два мероприятия позволят выделить группы риска среди пациентов, оперированных по поводу тиреоидной и паратиреоидной патологии.
Ранее было предложено много методов, нацеленных на визуализацию ОЩЖ с использованием различных красителей. Так, в 1971 г. N.E. Dudley впервые предложил применять метиленовый синий (МС) с целью выявления данных структур [19]. S.L. Hillary и соавт. в 2018 г. представили работу, посвященную использованию указанного ранее красителя. МС вводился интраоперационно внутривенно, начиная с 0,05 мг/кг. При необходимости доза контрастного вещества увеличивалась с шагом 0,05 мг/кг (до максимума 0,5 мг/кг). Оптимальная доза МС в ходе эксперимента составляла 0,3–0,5 мг/кг. В представленной работе паратиреоидные железы проявляли флуоресценцию в течение периода времени, достаточного для оценки их жизнеспособности [20]. А.В. Зубков и соавт. в 2018 г. также исследовали применение МС для визуализации ОЩЖ. В данной работе 1 мл 0,1% водного раствора МС вводили в нижнюю щитовидную артерию. После введения контраста ОЩЖ интенсивно окрашивались в темно-фиолетовый цвет [21]. Также МС в эндокринной хирургии используется для непрямой хромотиреолимфографии (А.Ф. Романчишен, 2014) с целью определения принадлежности опухоли к той или иной доле ЩЖ и выбора тактики хирургического лечения патологии в зависимости от результатов [22]. Однако по заявлению некоторых авторов (N. Zaidi, 2016; M.A. Khan, 2007; S. Sound, 2015), краситель, предложенный N.E. Dudley, несмотря на отмеченную результативность МС для идентификации ОЩЖ, не может быть использован в практике в связи с возможностью побочных эффектов в виде токсикоэнцефалопатии [23–26]. Для этой же цели в 2004 г. К. Shimizu рассматривал использование аминолевулиновой кислоты (АЛК) [27]. И.В. Слепцов и соавт. в 2009 г. представили работу по использованию АЛК для идентификации ОЩЖ. За 2–3 часа до проведения операции пациенты получали перорально 1,5 г данного вещества (в виде порошка, растворенного в 30 мл воды). Интраоперационно облучали операционную рану синим светом, при этом отмечалось розово-оранжевое свечение ОЩЖ, в то время, когда остальные ткани были темно-синими или черными [28]. АЛК обладала достаточным флуоресцентным эффектом, накапливаясь в тканях ОЩЖ, но у нее был выявлен побочный эффект – фототоксичность, выявлявшаяся практически в половине случаев [26, 23].
В 2014 г. появилась информация о возможности использования интрооперационной флуоресцентной ангиографии с индоцианиновым зеленым (ICG) для идентификации ОЩЖ и прогнозирования ГПТ в послеоперационном периоде за счет перфузии ОЩЖ [29].
ICG был разработан в годы Великой отечественной войны как краситель для фотографии. А в 1959 г. после исследований в клинике Мейо получил одобрение FDA и начал использоваться в различных областях медицины в качестве флуоресцентного йодидного красителя. Изначально он применялся для исследований функции печени и сердца, а впоследствии стал активно использоваться в офтальмологии c целью визуализации сосудистой сети сетчатки. В связи с достаточным улучшением технических возможностей (появление качественного цифрового изображения) к началу 2000-х гг. возрос интерес к использованию интрооперационной флуоресцентной ангиографии с применением ICG для оценки перфузии тех или иных тканей [5, 30]. На данный момент данное вещество является единственным, клинически одобренным красителем в силу безопасности и хорошей флуоресценции [2, 26, 31].
и хорошей флуоресценции [2, 26, 31]. ICG представляет собой водорастворимый анионный амфифильный трикарбоцианиновый краситель с молекулярной массой 774,96 Да, способный к флуоресценции. То есть ICG способен к нетепловому свечению после поглощения им энергии возбуждения, вызываемой светом ближнего инфракрасного диапазона (с длиной волны 750 до 800 нм) [3].
Первая работа, посвященная использованию ICG в качестве контрастного вещества при операциях на ЩЖ, была выполнена в 2014 г. группой ученых, возглавляемой Y.J. Suh. В результате эксперимента на лабораторных животных (собаках) была доказана эффективность ICG для идентификации ОЩЖ. Было установлено, что доза контрастного вещества более 20 мкг/кг приводит к флуоресценции окружающих тканей и ухудшает визуализацию ОЩЖ. По данным авторов, оптимальная доза ICG в эксперименте составила 18,75 мкг/кг. Пик флуоресценции возникал через 50,2±2,0 секунд после внутривенного введения вещества. Потеря большей части данного эффекта наступала спустя 106,7±5,8 секунды [3]. Указанная доза красителя (18 мкг/кг) в ходе дальнейших экспериментов в клинических исследованиях при хирургическом лечении больных патологией ЩЖ вызывала слабую флуоресценцию ОЩЖ, развивающуюся лишь спустя 15 минут после инъекции. Было установлено, что в силу различного строения сосудистой системы, сердечной функции и времени циркуляции крови у людей и собак необходимо использовать более высокие концентрации ICG (0,17 мг/кг) [2]. В 2015 г. S. Sound и соавт. опубликовали исследование об использовании ICG для идентификации ОЩЖ у людей. Авторы описали 3 случая применения флуоресцентной ангиографии с ICG у больных первичным гиперпаратиреозом, ранее оперированных по поводу заболеваний ЩЖ. Всем пациентам за время операции было выполнено 2 инъекции контрастного вещества (с начальной дозой 5 мг). В результате его введения была выявлена более выраженная по сравнению с окружающими тканями флуоресценция ОЩЖ, что облегчало идентификацию последних. Авторы отметили, что данная методика ускоряла выявление аномально расположенных ОЩЖ, что, безусловно, сокращало время проведения операции. В работе заявлено о достаточности интраоперационного введения 8,75 мг контрастного вещества при повторных операциях в области шеи. Пик флуоресценции возникал на 50-й секунде после введения контраста. Подобные результаты аналогично были получены в работе Y.J. Suh и соавт. [26], N. Zaidi и соавт. (2016), которые также оценивали использование ICG при хирургическом лечении по поводу первичного гиперпаратиреоза. Авторы отметили точность идентификации ОЩЖ, несмотря на активную флуоресценцию ЩЖ, поскольку у пациентов, вошедших в данное исследование, не было предшествующих операций на ней. Отмечалось более активное накопление контрастного вещества у пациентов моложе 60 лет, имевших более высокие значения уровня кальция перед операцией на ЩЖ. Авторы объяснили более эффективное использование данного метода отсутствием ЩЖ вследствие более активной перфузии ОЩЖ после ТЭ. Это же обеспечило более эффективное исследование визуализации эктопированных ОЩЖ [23].
- Fortuny и соавт (2016) оценили вероятность ГПТ после операций на ЩЖ и сравнили метод визуальной оценки состояния ОЩЖ с применением ICG. В работу вошли 36 пациентов, которым после ТЭ выполнялась флуоресцентная ангиография. В ходе исследования в нескольких случаях было зафиксировано расхождение данных о жизнеспособности ОЩЖ после визуального осмотра и после использования красителя. После рассечения паренхимы ОЩЖ, визуально признанных жизнеспособными, кровотечения не возникало и выполнялась аутотрансплантация. Если у пациентов по данным ангиографии имелась хотя бы одна хорошо кровоснабжаемая ОЩЖ, в послеоперационном периоде ГПТ не было. Тем не менее авторы утверждают, что в ходе операции был риск перепутать ОЩЖ с другой хорошо васкуляризированной тканью (лимфатические узлы, узлы ЩЖ и т.д.) [11]. В другом исследовании V. Fortuny и соавт. 016) демонстрировали возможности успешного использования флуоресцентной ангиографии с ICG для оценки перфузии остатка ОЩЖ при выполнении субтотальной паратиреоидэктомии [32]. F. Vidal и соавт. (2018) представили новую работу, включившую уже 196 пациентов, страдающих тиреоидной патологией. В результате исследования авторы отметили, что ICGангиография позволяет уверенно оценивать васкуляризацию ОЩЖ, устранять необходимость в послеоперационном измерении уровня кальция и ПТГ, отказаться от превентивного лечения препаратами кальция пациентов после ТЭ, имеющих хотя бы одну хорошо перфорируемую ОЩЖ. При этом они отмечали определенную субъективность в оценке достаточности васкуляризации ОЩЖ по данным ангиографии в силу визуальной оценки оттенков флуоресценции и сопоставления их с окружающими тканями [33]. Однако трудно согласиться, имея многолетний опыт лечения больных гиперпаратиреозом, с возможностью компенсировать уровень паратгормона и кальция крови при наличии лишь одной из четырех ОЩЖ [15].
Исследование применения флуоресцентной ангиографии с использованием ICG ведутся не только в отношении открытых операций на ЩЖ и ОЩЖ. H.W. Yu и соавт. (2016) исследовали возможности данной технологии при робот-ассистированных операциях через двусторонний подмышечно-маммарный доступ (BABA). Они оперировали пациентов в возрасте от 20 до 70 лет без тяжелой сопутствующей патологии и лекарственной аллергии. Контрольная группа в исследовании соответствовала основной по половозрастным характеристикам, объемам хирургического лечения и сопутствующей патологии. Всем вошедшим в исследование пациентам проводили контроль уровня ПТГ в первые часы послеоперационного периода и на 1-е, 2, 14-е сутки после операции. Было установлено, что лучшая флуоресценция отмечалась при введении дозы ICG, равной 10 мг. При обработке результатов в группе контроля значительно чаще была выявлена непреднамеренная паратиреоидэктомия (0% – основная группа, 15,9% – контрольная группа; р=0,048), процент развития транзиторного ГПТ в послеоперационном периоде в группе контроля развивался несколько чаще, однако не достиг статистически значимого уровня (40% – группа контроля, 36,4% – основная группа; р=0,842). В результате проведенного исследования H.W. Yu и соавт. характеризуют ICG-ангиографию как хороший способ для идентификации ОЩЖ при роботических операциях на ЩЖ [2].
современных источниках литературы (Van den Bos, 2018; В.К. Лядов, 2017; F. Vidal, 2018; S. Gálvez-Pastor, 2019) встречались исследования, в которых изучали применение флуоресцентной ангиографии и возможности прогнозирования гипопаратиреоза или гипокальциемии в послеоперационном периоде [8, 29, 33, 34]. Одно из таких исследований принадлежит нашим соотечественникам. В.К. Лядов и соавт. (2017) выполнили 35 ТЭ с ICG-ангиографией и по результатам интраоперационного исследования разделили пациентов на две группы с предположительно удовлетворительной перфузией ОЩЖ и с возможной гипоперфузией по данным флуоресценции. В послеоперационном периоде всем прооперированным больным выполняли биохимическое исследование крови на содержание кальция через 4, 8 и 24 часов. Были получены значительные различия в группах спустя сутки после хирургического вмешательства, что позволило предположить эффективность флуоресцентной ангиографии для идентификации ОЩЖ и прогнозирования гипокальциемии после ТЭ [29]. S. Gálvez-Pastor и соавт. также оценивали прогностические возможности ICG относительно послеоперационной гипокальциемии. У пациентов с выявленным снижением уровня кальция в послеоперационном периоде по данным ангиографии было значительно меньше хорошо кровоснабжавшихся ОЩЖ. Авторы утверждали, что ICG позволяет точно и в реальном времени оценивать жизнеспособность каждой ОЩЖ в отдельности и их функциональную активность в совокупности. Это позволяло точно прогнозировать вероятность гипокальциемии сразу после резекции ЩЖ [34]. H. Jin и соавт. также подтвердили эффективность метода для визуализации и сохранения ОЩЖ, а также для прогнозирования ГПТ в послеоперационном периоде [33]. Van den Bos и соавт., исследуя флуоресцентную ангиографию, отметили ее безопасность, отсутствие побочных эффектов, доступность и эффективность в предотвращении ятрогенной паратиреоидэктомии [8]. Результаты проведенных исследований позволяют предположить рациональность использования ICG-ангиографии в эндокринной хирургии. За время проводимых исследований с ICG сообщается, что процент побочных эффектов составил не более 0,00167%, что преимущественно связано с содержанием в красителе 5% йода натрия. Побочные эффекты выявлены у людей с аллергией на йод, что необходимо учитывать при планировании операций с использованием ICG-ангиографии [26, 35]. Таким образом, противопоказаниями к проведению ангиографии с ICG является лишь аллергия на йод и почечная недостаточность [26].
ICG-ангиография позволила выделить группы риска среди больных послеоперационным ГПТ и гипокальциемией, сократить сроки госпитализации пациентов хотя бы с одной хорошо васкуляризированной ОЩЖ, а также избежать ятрогенной паратиреоидэктомии и решить вопрос о рациональности проведения аутотрансплантации ОЩЖ [11, 29, 33].
Необходимы дальнейшие исследования для подтверждения безопасности и эффективности метода флуоресцентной ангиографии с ICG. Во многих исследованиях выборки пациентов недостаточно велики для полноценного подтверждения положительных аспектов данной методики. Существуют опасения на счет недостаточно объективной оценки кровоснабжения ОЩЖ в ходе флуоресцентной ангиографии, т.к. она осуществлялась на основе сравнения оттенка ОЩЖ с окружающими тканями [11]. Также некоторые авторы высказывают опасения, связанные с возможностью перепутать ткань ОЩЖ с иными, хорошо кровоснабжаемыми структурами (л/у, узел ЩЖ) [11, 23].
В заключение хочется вспомнить фразу одного из докторов: «лучший способ правильно установить локализацию околощитовидных желез в ходе операции – верно найти локализацию грамотного хирурга» [35]. Однако стоит помнить о том, что процент послеоперационного ГПТ остается высоким и возможность свести к минимуму риск его появления в послеоперационном периоде стоит того, чтобы внедрять в практику новые методы визуализации ОЩЖ.
ЛИТЕРАТУРА/REFERENCES
- Кузнецов Н.С., Симакина О.В., Ким И.В. Предикторы послеоперационного гипопаратиреоза после тиреоидэктомии и методы его лечения. Клиническая и экспериментальная тиреоидология. 2012;8(2):20–30. [Kuznetsov N.S., Simakina O.V., Kim I.V. Predictors of postoperative hypoparathyroidism after thyroidectomy and methods of treatment. Klin. Eksperimental. Tireoidol. 2012;8(2):20–30. (In Russ.)].
- Yu H.W., Chung J. W., Yi J. W., et al. Intraoperative localization of the parathyroid glands with indocyanine green and Firefly(R) technology during BABA robotic thyroidectomy. Surg. Endosc. 2016;31(7):3020–7. https://doi.org/10.1007/s00464-016-5330-y.
- Матвеева З.С., Романчишен А.Ф., Гостимскмий А.В. и др. Профилактическая тиреоидэктомия у детей из семей с синдромами МЭН как метод предупреждения медуллярного рака щитовидной железы. Педиатрия. 2017;8(5):5–11. [Matveeva Z.S., Romanchishen A.F., Gostimsky A.V., et al. Prophylactic thyroidectomy as method of medullary thyroid carcinoma prevention in children from MEN syndrom families. Pediatrician (St. Petersburg). 2017;8(5):5–11.]. https://doi.org/10.17816/ PED855-11. (In Russ.).
- Попов О.С., Лян Н.И., Ларионов М.М. и др. Послеоперационный гипопаратиреоз и новый способ его профилактики. Вестник ЮУрГУ. 2010;24:88–90. [Popov O.S., Lyan N.I., Larionov M.M., et al. Posleoperatsionnyy gipoparatireoz i novyy sposob ego profilaktiki, Vestn. YuUrGU. 2010;24:88–90. (In Russ.)].
- Suh Y.J., Choi J.Y., Chai Y.J., et al. Indocyanine green as a near-infrared fluorescent agent for identifying parathyroid glands during thyroid surgery in dogs. Surg. Endoscop. 2014;29(9):2811–7. https://doi.org/10.1007/s00464- 014-3971-2.
- Sakorafas G.H., Stafyla V., Bramis C., et al. Incidental Parathyroidectomy during Thyroid Surgery: An Underappreciated Complication of Thyroidectomy. W. J. Surg. 2015;29(12):1539–43. https://doi.org/10.1007/s00268-005- 0032-y.
- Pãduraru D.N., Ion D., Carsote M., et al. Post-thyroidectomy Hypocalcemia – Risk Factors and Management. Chirurgia. 2019;114(5):564–70. https:// doi.org/10.21614/chirurgia.114.5.564.
- Van den Bos J., van Kooten L., Engelen S.M.E., et al. Feasibility of indocyanine green fluorescence imaging for intraoperative identification of parathyroid glands during thyroid surgery. Head & Neck. 2018:1–9. https://doi.org/10.1002/hed.25451.
- Романчишен А.Ф., Демидчик Ю.Н., Комиссаренко И.В. и др. Хирургия щитовидной и околощитовидных желез. СПб, 2009. 647 с. [Romanchishen A.F., Demidchik Yu.N., Komissarenko I.V., et al. Khirurgiya shchitovidnoy i okoloshchitovidnoy zhelez. SPb, 2009. 647 p. (In Russ.)].
- Orloff L.A., Wiseman S.M., Bernet V.J., et al. American Thyroid Association Statement on Postoperative Hypoparathyroidism: Diagnosis, Prevention, and Management in Adults. Thyroid. 2018; 28(7):830–41. https://doi. org/10.1089/thy.2017.0309.
- Vidal Fortuny J., Belfontali V., Sadowski S.M., et al. Parathyroid gland angiography with indocyanine green fluorescence to predict parathyroid function after thyroid surgery. Br. J. Surg. 2016;103(5):537–43. https://doi. org/10.1002/bjs.10101.
- Аюшеева А.В., Ильичева Е.А., Лепехова С.А. Послеоперационный гипопаратиреоз, способы профилактики и коррекции. Бюллетень ВСНЦ СО РАМН. 2013;1(89):160–3. [Ayusheeva A.V., Il’icheva E.A., Lepekhova S.A. Postoperative hypoparathyreosis, ways of prevention and correction. Byulleten’ VSNTs SO RAMN. 2013;1(89):160–3. (In Russ.)].
- Abboud B., Sargi Z., Akkam M., et al. Risk factors for postthyroidectomy hypocalcemia. J. Am. Coll. Surg. 2002;195(4):456–61. https://doi. org/10.1016/s1072-7515(02)01310-8.
- Alkhalili E., Ehrhart M.D., Ayoubieh H., et al. Does pre-operative vitamin D deficiency predict postoperative hypocalcemia after thyroidectomy? Endocr. Pract. 2017;23(1):5–9. https://doi.org/10.4158/ep161411.or.
- Романчишен А.Ф., Вабалайте К.В., Зенкова А.В. Причины, предупреждение и результаты лечения послеоперационного гипопаратиреоза у больных тиреоидной патологией. СПб., 2017. 96.с. [Romanchishen A.F., Vabalayte K.V., Zenkova A.V. Prichiny, preduprezhdenie i rezul’taty lecheniya posleoperatsionnogo gipoparatireoza u bol’nykh tireoidnoi patologiei. SPb. 2017, 96 p. (In Russ.)].
- Chang Y.K., Lang B.H.H. To identify or not to identify parathyroid glands during total thyroidectomy. Gland. Surg. 2017;6(Suppl. 1):20–9. https://doi. org/10.21037/gs.2017.06.13.
- Martin S., Parfeni O., Mustata T., et al. Postoperative Hypoparathyroidism in Patients After Total Thyroidectomy – Experience of a Tertiary Center in Romania. Chirurgia. 2019;114(5):602–10. https://doi.org/10.1530/ endoabs.65.P419.
- Díez J.J., Anda E., Sastre J., et al. Prevalence and risk factors for hypoparathyroidism following total thyroidectomy in Spain: a multicentric and nation-wide retrospective analysis. Endocrine. 2019. https://doi.org/10.1007/ s12020-019-02014-8.
- Dudley N.E. Methylene blue for rapid identification of the parathyroids. BMJ. 1971;3(5776):680–1. https://doi.org/10.1136/bmj.3.5776.680.
- Hillary S.L., Guillermet S., Brown N.J., et al. Use of methylene blue and nearinfrared fluorescence in thyroid and parathyroid surgery. Langenbeck’s Arch. Surg. 2017;403(1):111–8. https://doi.org/10.1007/s00423-017-1641-2.
- Зубков А.В., Краюшкин А.И., Загребин В.Л. Использование метиленового синего в интраоперационном поиске околощитовидных желез. Международный научно-исследовательский журнал. 2018;9–1(85):118– 21. [Zubkov A.V., Krayushkin A.I., Zagrebin V.L. Use of methylene blue in intraoperative search of parathyroid glands. 2018;9–1(85):118–21. https:// doi.org/10.23670/IRJ.2018.75.9.022. (In Russ.)].
- Романчишен А.Ф. Применение хромолимфографии для выбора объема операций у больных раком щитовидной железы. Эндокринная хирургия. 2014;1:47–52. [Romanchishen A.F. The Use of Chromothyrolymphography for Selection of Surgical Volume in Patients with Thyroid Cancer. Endokrin. Khirurg. 2014;1:47–52. https://doi.org/10.14341/serg2014147- 52. (In Russ.)].
- Zaidi N., Bucak E., Yazici P., et al. The feasibility of indocyanine green fluorescence imaging for identifying and assessing the perfusion of parathyroid glands during total thyroidectomy. J. Surg. Oncol. 2016;113(7):775–8. https://doi.org/doi:10.1002/jso.24237.
- Khan M.A., North A.P., Chadwick D.R. Prolonged postoperative altered mental status after methylene blue infusion during parathyroidectomy: A case report and review of the literature. Ann. R. Coll. Surg. Engl. 2007;89:W9–11. https://doi.org/10.1308/147870807X160434.
- Pollack G., Pollack A., Delfiner, et al. Parathyroid surgery and methylene blue: A review with guidelines for safe intraoperative use. Laryngoscope. 2009;119(10):1941–6. https://doi.org/10.1002/lary.20581.
- Sound S., Okoh A., Yigitbas H., et al. Utility of Indocyanine Green Fluorescence Imaging for Intraoperative Localization in Reoperative Parathyroid Surgery. Surg Innovat. 2015:1–6. https://doi.org/10.1177/1553350615613450.
- Shimizu Kazuo, Shimizu Kazuhide, Kitagawa W., et al. Clinical application of 5-aminolevulinic acid: A useful and feasible new method for intraoperative identification of pathological and normal parathyroid during endocrine neck surgery. Endocrin. Surg. 2004;21:199–202.
- Слепцов И.В., Бубнов А.Н., Черников Р.А. и др. Фотодинамическая визуализация околощитовидных желез – результаты клинического применения. Клиническая и экспериментальная тиреоидология. 2009;5(1):35–9. [SlepzovI.V., BubnovA.N., ChernikovR.A., etal. Photodynamic Vvisualisation of Paratyroid Glands – Results of Clinical use Eng. Klin. Eksp. Tireoidol. 2009;5(1):35–9.]. (In Russ.).
- Лядов В.К., Пашаева Д.Р., Неклюдова М.В. Применение флуоресцентной ангиографии с индоцианином зеленым для прогнозирования развития гипокальциемии после тиреоидэктомии. Опухоли головы и шеи. 2017;7(4):24–8. [Lyadov V.K., Pashaeva D.R., Neklyudova M.V. Use of fluorescent angiography with indocyanine green for prediction of hypocalcemia development after thyroidectomy. Opukholi golovy i shei 2017;7(4):24–8. https://doi.org/10.17650/2222-1468-2017- 7-4-24-28. (In Russ.)].
- Reinhart M.B., Huntington C.R., Blair L.J., et al. Indocyanine Green. Sur.l Innovat. 2015;23(2):166–75. https://doi. org/10.1177/1553350615604053.
- Lavazza M., Liu X., Wu C., et al. Indocyanine green-enhanced fluorescence for assessing parathyroid perfusion during thyroidectomy. Gland Surg. 2016;5(5):512–51. https://doi.org/10.21037/gs.2016.10.06.
- Vidal Fortuny J., Karenovics W., Triponez F., et al. Intra-Operative Indocyanine Green Angiography of the Parathyroid Gland. W. J. Surg. 2016;40(10):2378–81. https://doi.org/10.1007/s00268-016-3493-2
. 33. Vidal Fortuny J., Sadowski, S. M., Belfontali, V., et al. Randomized clinical trial of intraoperative parathyroid gland angiography with indocyanine green fluorescence predicting parathyroid function after thyroid surgery. Br. J. Surg. 2018;105(4):350–7. https://doi.org/10.1002/bjs.10783.
- Gálvez-Pastor S., Torregrosa N.M., Ríos A., et al. Prediction of hypocalcemia after total thyroidectomy using indocyanine green angiography of parathyroid glands: a simple quantitative scoring system. Am. J. Surg. 2019;218:993-9. https://doi.org/10.1016/j.amjsurg.2018.12.074.
- Jin H., Dong Q., He Z., et al. Application of a Fluorescence Imaging System with Indocyanine Green to Protect the Parathyroid Gland Intraoperatively and to Predict Postoperative Parathyroidism. Adv. Ther. 2018;35(12):2167–75. https://doi.org/10.1007/s12325-018-0834-6.
Поступила 14.02.20 Принята в печать 25.03.20
Received 14.02.20 Accepted 25.03.20
Вклад авторов. Концепция статьи – К.В. Вабалайте, А.Ф. Романчишен. Сбор и обработка литературных данных – А.Д. Сомова. Написание текста – К.В. Вабалайте, А.Д. Сомова. Редактирование – К.В. Вабалайте, А.Ф. Романчишен
Contribution of the authors. Сreating the concept of the article – Vabalaite K.V., Romanchishen A.F. Сollection and processing of literature data – Somova A.D. Writing the text – Vabalaite K.V., Somova A.D. Editing – Vabalaite K.V., Romanchishen A.F.
Информация об авторах:
К.В. Вабалайте – д.м.н., доцент, ФГБОУ ВО Санкт-Петербургский государственный педиатрический медицинский университет, СанктПетербург; e-mail: vabalayte@bk.ru; ORCID – https://orcid.org/0000-0002- 9122-1540
А.Д. Сомова – студент 6-го курса ФГБОУ ВО Санкт-Петербургский государственный педиатрический медицинский университет, СанктПетербург; e-mail: alexandra.sayko@mail.ru; ORCID https://orcid.org/0000- 0002-9163-3377
А.Ф. Романчишен – д.м.н., профессор ФГБОУ ВО Санкт-Петербургский государственный педиатрический медицинский университет, СанктПетербург; e-mail: afromanchishen@mail.ru; ORCID https://orcid.org/0000- 0001-7646-4360
Author information:
K.V. Vabalayte – Doctor of Medicine, Associate Professor, Department of Hospital Surgery with Traumatology and Military Surgery Courses, FSBEI of HE St. Petersburg State Pediatric Medical University, St. Petersburg, Russia; e-mail: vabalayte@bk.ru; ORCID https://orcid.org/0000-0002-9122-1540
A.D. Somova – student of the 6th course, FSBEI of HE St. Petersburg State Pediatric Medical University, St. Petersburg, Russia; e-mail: alexadra.sayko@ mail.ru; ORCID https://orcid.org/0000-0002-9163-3377
A.F. Romanchishen – Doctor of Medicine, Professor, Head of Department of Hospital Surgery with Traumatology and Military Surgery Courses, FSBEI of HE St. Petersburg State Pediatric Medical University, St. Petersburg, Russia; e-mail: afromanchishen@mail.ru