Для цитирования: Кастыро И.В., Решетов И.В., Попадюк В.И., Торшин В.И., Ермакова Н.В., Карпухина О.В., Иноземцев А.Н., Хамидулин Г.В., Шмаевский П.Е., Сардаров Г.Г., Гордеев Д.В., Скопич А.А. Изучение физиологических эффектов новой модели септопластики у крыс. Голова и шея. Российский журнал Head and neck Russian Journal. 2020;8(2):33–38
For citation: Kastyro I.V., Reshetov I.V., Popadyuk V.I., Torshin V.I., Ermakova N.V., Karpukhina O.V., Inozemtsev A.N., Khamidulin G.V., Shmaevsky P.E., Sardarov G.G., Gordeev D.V., Scopich A.A. Studying the physiological effects of a new model of septoplasty in rats. Head and neck. Russian Journal. 2020;8(2):33–38 (in Russian).
Doi: 10.25792/HN.2020.8.2.33–38
В статье исследованы физиологические реакции на предложенную модель септопластики у крыс под действием общей анестезии.
Материал и методы. Изучали двигательную активность крыс и вариабельность сердечного ритма до операции, через сутки и двое суток после операции.
Результаты. После хирургического воздействия снизилась двигательная активность, увеличилось время замирания и груминга, уменьшилось значение HF и выросло VLF.
Выводы. Хирургическая травматизация слизистой оболочки перегородки носа у крыс на раннем постоперационном этапе способствует мощному стрессовому ответу в виде смещения баланса вегетативной нервной системы в сторону симпатического звена, вызывает мобилизацию центральных механизмов регуляции, снижение исследовательской активности, провоцирует тревожное, депрессивно-подобное состояние и беспокойство у крыс.
Ключевые слова: септопластика, стресс, двигательная активность, груминг, вариабельность сердечного ритма, VLF, LF, HF, индекс централизации
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена без спонсорской поддержки
Для цитирования: Кастыро И.В., Решетов И.В., Попадюк В.И., Торшин В.И., Ермакова Н.В., Карпухина О.В., Иноземцев А.Н., Хамидулин Г.В., Шмаевский П.Е., Сардаров Г.Г., Гордеев Д.В., Скопич А.А. Изучение физиологических эффектов новой модели септопластики у крыс. Голова и шея. Российский журнал Head and neck Russian Journal. 2020;8(2):33–38
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Physiological responses to the proposed rat septoplasty model under general anesthesia were investigated. We studied the motor activity of rats and heart rate variability before experiment, one day and two days after surgery. After surgical intervention, motor activity decreased, the time of fading and grooming increased, the value of HF decreased, and VLF increased. Surgical trauma of the nasal septum mucous membrane in rats in the early postoperative stage contributes to a powerful stress response in the form of a shift in the balance of the autonomic nervous system towards the sympathetic nervous system, causes mobilization of central regulation mechanisms, reduces research activity, and provokes an anxious, depressive-like state and anxiety in rats.
Key words: septoplasty, stress, motor activity, grooming, heart rate variability, VLF, LF, HF, centralization index
Conflicts of interest. The authors have no conflicts of interest to declare.
Funding. There was no funding for this study.
For citation: Kastyro I.V., Reshetov I.V., Popadyuk V.I., Torshin V.I., Ermakova N.V., Karpukhina O.V., Inozemtsev A.N., Khamidulin G.V., Shmaevsky P.E., Sardarov G.G., Gordeev D.V., Scopich A.A. Studying the physiological effects of a new model of septoplasty in rats. Head and neck. Russian Journal. 2020;8(2):33–38 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients.
Введение
Хирургический стресс приводит к изменениям в работе вегетативной нервной системы (ВНС), которая через симпатическую (СНС) и парасимпатическую (ПНС) части обеспечивает контроль широкого спектра физиологических функций [1]. Так, нарушения в регуляции стресс-ответа приводят к формированию посттравматического дистресс-синдрома и тревожно-депрессивных состояний. Любое хирургическое вмешательство помимо болевого синдрома провоцирует эмоциональные реакции, в частности раздражение, тревожность, беспокойство и др. [2]. Такое хирургическое вмешательство в полости носа, как септопластика, сопровождается частичной постравматической обструкцией верхнего отдела дыхательных путей (полости носа), которая зачастую приводит к гипоксии и гиперкапнии, что может влиять на активацию СНС и ПНС, а также на различные реакции сердца, вызванные регуляторным действием ВНС [3, 4]. До сих пор остается не вполне ясным, как влияет травматизация слизистой оболочки полости носа на состояние организма после хирургических вмешательств на перегородке носа (ПН), которые являются мощным стрессорным фактором, учитывая наличие диффузного вегетативного ганглия в ее задненижней части [5]. В частности, мало изучена взаимосвязь поведенческих реакций и вегетативной регуляции организма при хирургических вмешательствах на ПН. Цель исследования: на примере крыс определить физиологические эффекты хирургической травматизации в полости носа (новой модели септопластики) путем анализа поведенческих реакций и ВНС.
Материал и методы
Моделирование септопластики было проведено на 10 половозрелых беспородных крысах-самцах массой 185–250 г. За сутки до операции у крыс в течение 3 минут тестировали поведение в «открытом поле» (ОП) с центральными и периферическими секторами (ЦС, ПС) и норками (ЦеН, ПеН). Для оценки состояния ВНС проводили спектральный анализ вариабельности сердечного ритма (ВСР) у крыс до операции и за 1 час до тестирования в ОП. Влияние гуморального и надсегментарного уровней регуляции ВСР оценивали при помощи анализа очень низкочастотного (VLF), а состояние ПНС и СНС – с помощью высокочастотного компонента сердечного ритма (HF) и низкочастотного компонента сердечного ритма (LF), соответственно, как процентное содержание каждого частотного показателя.
На следующий день за 10 минут до операции в целях общей анестезии внутрибрюшинно вводили раствор золетила в дозировке 15 мг/кг. Моделирование септопластики проводилось проводилась путем 2-сторонней зигзагообразной скарификации слизистой оболочки ПН на всем протяжении ПН остроконечным зондом сзади наперед. В первые и вторые сутки после операции проводили повторный анализ поведения крыс в ОП и сердечного ритма, как это было описано выше. Для оценки различий результатов до и после операции использовали критерий для связных выборок Вилкоксона.
Исследования на животных проводили согласно требованиям «Правил проведения работ с использованием экспериментальных животных» (1984) и «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (1986).
Результаты
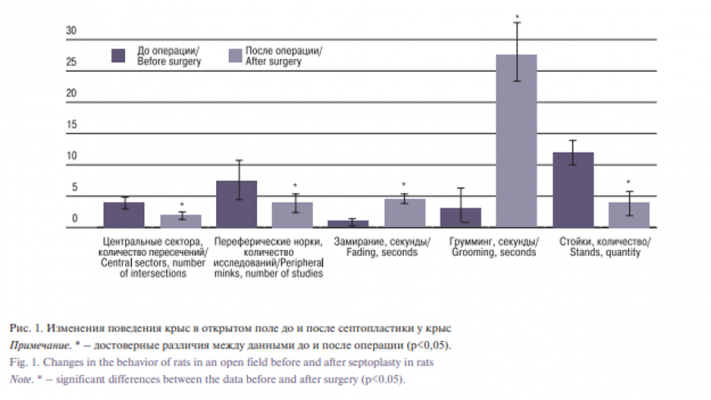
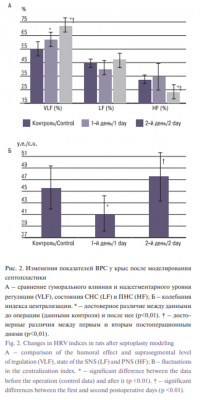
Хирургическое вмешательство резко уменьшило посещение крысами ЦС, обследования ПеН и стоек относительно величин до операции. Одновременно у животных увеличилось число актов замирания и груминга (рис. 1). Показатели VLF по сравнению с контролем (55,61±3,88%) последовательно увеличивались с 62,09±5,22% в первый день до 72,17±5,03% во второй день (p<0,01). Высокочастотный компонент частотного спектра по сравнению с контролем (32,59±3,05%) и 1-м днем после операции (33,97±7,78%) понизился только на 2-й день (23,06±5,01%) и был достоверно меньше в этот день, чем низкочастотный (47,24±5,29; p<0,01, рис. 2A). Динамики изменений LF отмечено не было. Операция привела к достоверному снижению индекса централизации (ИЦ) в 1-й первый день после операции (41,14±3,15) и его статистически значимому подъему на вторые сутки (47,556±4,12) по сравнению с первым днем до постоперационных показателей (45,62±3,55) (рис. 2Б).
Обсуждение
В данном исследовании было получено снижение исследовательской активности у крыс после моделирования септопластики, в частности в отношении ЦС, ПеН по сравнению с контролем. Подобный эффект можно объяснить, на наш взгляд, несколькими причинами. Во-первых, операция вызывает болевой синдром, который является стрессогенным фактором, влияющим на поведение. В свою очередь стресс, как правило, нарушает различные задачи, зависящие от гиппокампа, в частности памяти, т.к. происходит изменение последующей синаптической пластичности и возбуждающих свойств нейронов гиппокампа [6]. Во-вторых, дополнительным стрессогенным воздействием служат осложнения после хирургического вмешательства (отек слизистой оболочки, воспаление, гипоксемия) [7], которые, по нашему мнению, вероятнее всего могли спровоцировать болевой синдром, вызывающий тревожное состояние, проявляющееся снижением локомоторной активности в ЦС ОП [2]. В-третьих, известно, что экстренные изменения в среде, в т.ч. помещение крыс в освещенное открытое пространство, вызывают у животных состояние стресса, что резко изменяет поведение [8, 9]. Благодаря этому ОП используется для анализа поведения грызунов в условиях модели депрессивно-подобного состояния [10, 11]. Так, известно, что само по себе посещение крысами ЦС в открытом поле является стрессом для испытуемых животных [12].
Известно, что стрессор может вызывать противоположное влияние на поведение животных. Слабое однократное воздействие не вредящих раздражителей (свет, звук, вибрация) вызывают активацию поведения [13], а хроническое воздействие приводит к угнетению поведения в ОП и депрессивно-подобному состоянию [14, 15].
По нашему мнению, отсутствие постоперационной анальгезии и последующее воспаление в полости носа у крыс, подвергшихся операции, могут косвенно свидетельствовать о том, что возникший болевой синдром мог провоцировать тревожное состояние, которое выражалось в подавлении двигательной активности, уменьшении числа стоек у оперированных животных. Данный факт может свидетельствовать и о наличии депрессивно-подобного расстройства у животных, т.к. известно, что любое хирургическое вмешательство кроме болевого синдрома провоцирует и эмоциональную реакцию, в частности раздражение, тревожность, беспокойство и др. [2].
Учитывая сказанное, можно предположить, что наблюдаемое в наших опытах уменьшение исследовательской активности и увеличение груминга говорит о том, что хирургическое вмешательство вызывает у крыс депрессивно-подобное состояние. Дополнительным подтверждением нашего предположения служит то, что бульбэктомия, также вызывающая нарушение обоняния, используется как модель депрессии [14, 16].
Стабильный рост VLF и увеличение ИЦ на 2-й день после операции свидетельствуют о гиперадаптивном состоянии, мобилизации энергетических и метаболических резервов, централизации регуляции адаптивных механизмов за счет увеличения влияния высших вегетативных центров и мобилизации гипоталамо-гипофизирно-надпочечниковой оси [4]. Изменения в балансе СНС и ПНС, которые наблюдаются одновременно с поведенческими, также можно объяснить эффектом постхирургического воспаления. В исследованиях ряда авторов было подтверждено, что изменение HF в ВРС было связано с изменением уровней провоспалительных цитокинов через час после стрессового фактора [13, 17] в соответствии с нейроиммунным рефлексом [18]. В наших предыдущих исследованиях изменений ВНС при проведении септопластики у людей было показано, что неадекватное анестезиологическое пособие вызывает повышенную активность именно ПНС [15]. В полости носа после септопластики, особенно на ранних этапах, воспаление сопровождается отеком слизистой оболочки, а это приводит к сужению носовых ходов и последующей гипоксемии, которая может увеличивать активность ПНС (p<0,001, рис.2А) [7]. В исследованиях гиппокампа при моделировании септопластики также было показано, что при данном виде хирургического воздействия в различных его отделах образуются темные нейроны [19]. Этими фактами можно объяснить повышенные значения HF в 1-й день после операции по сравнению со 2-м днем (p<0,01; рис. 2А) (fig.2A). Было обнаружено, что на 2-й день после операции увеличение доли LF при спектральном анализе ВСР совпадало со снижением изучения крысами ЦС, ПеН, увеличением времени груминга. На основании этого можно предположить, что у крыс развились депрессивно-подобное состояние и тревожное расстройство на фоне хирургического стресса. Известно, что груминг, в частности представляет собой сложный поведенческий акт, очень чувствительный к различным стрессовым изменениям [20]. Увеличение времени груминга также служит подтверждением повышения стресс-обусловленного беспокойства у животных на 2-й день после операции. Так, было высказано мнение, что сложная модуляция поведения груминга может включать в себя проводящие пути, которые опосредуют стресс, тревогу и обусловленную защиту и отвечают за врожденное социальное поведение и ответ-защиту на хищника (оборонительный рефлекс) [21]. Совокупность приведенных данных подтверждает, что операция вызывает депрессивно-подобное состояние у крыс.
Заключение
Представленная модель септопластики у крыс является технически простой манипуляцией, которая приводит к серьезным физиологическим изменениям в нейрорегуляторной системе. Показанные изменения поведения сопровождаются смещением баланса ВНС в сторону симпатического компонента и увеличением мобилизации высших вегетативных центров, ростом влияния нейрогуморального и метаболического уровней регуляции. Подобная травматизация ПН у крыс на раннем постоперационном этапе способствует мощному стрессовому ответу в виде резкого снижения исследовательской активности, проявлению тревожного, депрессивно-подобного состояний и беспокойства у животных.
ЛИТЕРАТУРА
- Ulrich-Lai Y.M., Herman J.P. Neural regulation of endocrine and autonomic stress responses. Nat Rev Neurosci. 2009;10(6):397–409.
- Wetzel C.M., Kneebone R.L., Woloshynowych M., Nestel D., Moorthy K., Kidd J., Darzi A. The effects of stress on surgical performance. Am. J. Surg. 2006;191:5–10.
- Olsen K.D., Kern E.B., Westbrook P.R. Sleep and breathing disturbance secondary to nasal obstruction. Otolaryngol. Head Neck Surg. 1981;89:804–10.
- Баевский Р.М., Иванов Г.Г., Чирейкин Л.В., Гаврилушкин А.П., Довгалевский П.Я., Кукушкин Ю.А., Миронова Т.Ф., Прилуцкий Д.А., Семенов А.В., Федоров В.Ф., Флейшман А.Н., Медведев М.М. Анализвариабельности сердечного ритма при использовании различных электрокардиографических систем (часть1). Вестн. аритмологии. 2002;24:65–87.
- Kastyro I.V., Popadyuk V.I., Torshin V.I. Changes in heart rate during septoplasty with local anesthesia. Eur. J. Prevent. Cardiol. 2017;24(1):125.
- Kim E.J., Pellman B., Kim J.J. Stress effects on the hippocampus: a critical review. Learn. Mem. 2015;22(9):411–6.
- Molchan S.L., Hsu D.P. Successful Treatment of Persistent Hypoxemia by Nasal Suctioning in a Neonate with Primary Ciliary Dyskinesia. J. Clin. Neonatol. 2012;1(2):98–100.
- Inozemtsev A.N. Biological origins of protective mechanisms activated by the disruption of higher nervous activity. Moscow Univer. Biol. Sci. Bull. 2009;64(2):57–62.
- Sturman O., Germain P.L., Bohacek J. Exploratory rearing: a contextand stress-sensitive behavior recorded in the open-field test. Stress. 2018; 2(5):443–52.
- Горлова А.В., Павлов Д.А., Ушакова В.М., Зубков Е.А., Морозова А.Ю., Зоркина Я.А., Иноземцев А.Н., Чехонин В.П. Хроническое ультразвуковое воздействие вызывает ангедонию, снижение исследовательской активности и изменение уровня тревожности крыс. Журнал высшей нервной деятельности им. И.П. Павлова. 2019;69(6):752–60.
- Kim E.J., Pellman B., Kim J.J. Stress effects on the hippocampus: a critical review. Learn. Mem. 2015;22(9): 411–6.
- Киселева Н.М., Новоселецкая А.В., Зимина И.В., Москвина С.М., Иноземцев А.Н., Арион В.Я., Лопухин Ю.М. Влияние тактивина на поведение и обучение крыс. Вестн. рос. академии медицинских наук. 2010;1:23–26.
- Goebel M.U., Mills P.J., Irwin M.R., Ziegler M.G. Interleukin-6 and tumor necrosis factor-alpha production after acute psychological stress, exercise, and infused isoproterenol: differential effects and pathways. Psychosom. Мed. 2000;62:591–8.
- Katz R.J., Roth K.A., Carroll B.J. Acute and chronic stress effects on open field activity in the rat: implications for a model of depression. Neur. Biobehav. Rev. 1981;5(2):247–51.
- Popadyuk V.I., Kastyro I.V., Ermakova N.V., Torshin V.I. Septoplasty and tonsillectomy: acute stress response as a measure of effectiveness of local anesthetics. Vestn. Otorinolaringol. 2016;81(3):7–11.
- Ушакова В.М., Горлова А.В., Зубков Е.А., Морозова А.Ю., Зоркина Я.А., Павлов Д.А., Иноземцев А.Н., Чехонин В.П. Экспериментальные модели депрессивного состояния. Журнал высшей нервной деятельностиим. И.П. Павлова. 2019;69(2):230–47.
- Woody A., Figueroa W.S., Benencia F., Zoccola P.M.Stress-Induced Parasympathetic Control and Its Association With Inflammatory Reactivity. Psychosom. Med. 2017;79(3):306–10.
- Tracey K.J. Reflex control of immunity. Nat. Rev. Immunol. 2009;9:418–28.
- ТоршинВ.И., КастыроИ.В., КостяеваМ.Г., ЕреминаИ.З., ЕрмаковаН.В., Хамидулин Г.В., ШевцоваС.Н., ЦатуроваИ.А., СкопичА.А., ПопадюкВ.И. Влияние экспериментального моделирования септопластики на цитоархитектонику гиппокампа у крыс. Голова и шея. Рос. журн. = Head and neck. Rus. J. 2019;7(4):33–41.
- Kalueff A.V., Aldridge J.W., LaPorte J.L., Murphy D.L., Tuohimaa P. Analyzing grooming microstructure in neurobehavioral experiments. Nat. Protoc. 2007;2:2538–44. 21. Hong W., Kim D.W., Anderson D.J. Antagonistic control of social versus repetitive self-grooming behaviors by separable amygdala neuronal subsets. Cell. 2014;158:1348–61.
Поступила 25.01.20 Принята в печать 25.03.20
REFERENCES
- Ulrich-Lai Y.M., Herman J.P. Neural regulation of endocrine and autonomic stress responses. Nat. Rev. Neurosci. 2009;10(6):397–409.
- Wetzel C.M., Kneebone R.L., Woloshynowych M., Nestel D., Moorthy K., Kidd J., Darzi A. The effects of stress on surgical performance. Am. J. Surg. 2006;191:5–10.
- Olsen K.D., Kern E.B., Westbrook P.R. Sleep and breathing disturbance secondary to nasal obstruction. Otolaryngol. Head Neck Surg. 1981;89:804–10.
- Baevsky R.M., Ivanov G.G., Chireikin L.V., Gavrilushkin A.P., Dovgalevsky P.Y., Kukushkin Y.A., Mironova T.F., Prilutsky D.A., Semenov A.V., Fedorov V.F., Fleishman A.N., Medvedev M.M. Analysis of heart rate variability using various electrocardiographic systems (Part 1). Vestn. Аritmol. 2002;24:65–87. (In Russ.).
- Kastyro I.V., Popadyuk V.I., Torshin V.I. Changes in heart rate during septoplasty with local anesthesia. Eur. J. Prev. Cardiol. 2017;24(1):125.
- Kim E.J., Pellman B., Kim J.J. Stress effects on the hippocampus: a critical review. Learn. Mem. 2015;22(9):411–6.
- Molchan S.L., Hsu D.P. Successful Treatment of Persistent Hypoxemia by Nasal Suctioning in a Neonate with Primary Ciliary Dyskinesia. J. Clin. Neonatol. 2012;1(2):98–100.
- Inozemtsev A.N. Biological origins of protective mechanisms activated by the disruption of higher nervous activity. Moscow University Biological Sciences Bulletin. 2009;64(2):57–62.
- Sturman O., Germain P.L., Bohacek J. Exploratory rearing: a contextand stress-sensitive behavior recorded in the open-field test. Stress. 2018;2(5):443–52.
- Gorlova A.V., Pavlov D.A., Ushakova V.M., Zubkov E.A., Morozova A.Y., Zorkina Y.A., Inozemtsev A.N., Chekhonin V.P. Chronic ultrasound exposure causes anhedonia, a decrease in research activity and a change in the level of anxiety in rats. Zhurnal Vishei Nervnoi Deyatelnosti im. I.P. Pavlova. 2019; 69(6):752–60. (In Russ.).
- Kim E.J., Pellman B., Kim J.J. Stress effects on the hippocampus: a critical review. Learn. Mem. 2015;22(9):411–6.
- Kiseleva N.M., Novoseleckaya A.V., Zimina I.V., Moskvina S.M., Inozemtsev A.N., Arion V.Y., Lopukhin Y.M. The effect of tactivin on rat behavior and training. Vestn. Ros. Akad. Med. Nauk. 2010;1:23–6. (In Russ.).
- Goebel M.U., Mills P.J., Irwin M.R., Ziegler M.G. Interleukin-6 and tumor necrosis factor-alpha production after acute psychological stress, exercise, and infused isoproterenol: differential effects and pathways. Psych. Med. 2000;62:591–8.
- Katz R.J., Roth K.A., Carroll B.J. Acute and chronic stress effects on open field activity in the rat: implications for a model of depression. Neurosci. Biobehav. Rev. 1981;5(2):247–51.
- Popadyuk V.I., Kastyro I.V., Ermakova N.V., Torshin V.I. Septoplasty and tonsillectomy: acute stress response as a measure of effectiveness of local anesthetics. Vestn. Otorinolaringol. 2016;81(3):7–11.
- Ushakova V.M., Gorlova A.V., Zubkov E.A., Morozova A.Y., Zorkina Y.A., Pavlov D.A., Inozemtsev A.N., Chekhonin V.P. Experimental models of depression. Zhurnal Vishei Nervnoi Deyatelnosti im. I.P. Pavlova. 2019;69(2):230–47. (In Russ.).
- Woody A., Figueroa W.S., Benencia F., Zoccola P.M. Stress-Induced Parasympathetic Control and Its Association With Inflammatory Reactivity. Psychosom. Med. 2017;79(3):306–10.
- Tracey K/J. Reflex control of immunity. Nat. Rev. Immunol. 2009;9:418–28.
- Torshin V.I., Kastiro I.V., Kostyaeva M.G., Eremina I.Z., Ermakova N.V., Khamidulin G.V., Shevtsova S.N., Tsaturova I.A., Skopich A.A., Popadyuk V.I. The influence of experimental modeling of septoplasty on the hippocampal cytoarchitectonics in rats. Golova i sheya. Ros. J. = Head and neck. Rus. J. 2019;7(4):33–41. (In Russ.).
- Kalueff A.V., Aldridge J.W., LaPorte J.L., Murphy D.L., Tuohimaa P. Analyzing grooming microstructure in neurobehavioral experiments. Nat. Protoc. 2007;2:2538–44.
- Hong W., Kim D.W., Anderson D.J. Antagonistic control of social versus repetitive self-grooming behaviors by separable amygdala neuronal subsets. Cell. 2014;158:1348–61.
Received 25.01.20 Accepted 25.03.20
Вклад авторов: Кастыро И.В., Иноземцев А.Н. – концепция и дизайн исследования, оценка результатов исследования, написание текста рукописи. Решетов И.В., Торшин В.И., Попадюк В.И., Ермакова Н.В. – концепция и дизайн исследования, оценка результатов исследования.
Kарпухина О.В. – разработка методологии анализа, анализ полученных данных. Хамидулин Г.В., Шмаевский П.Е., Гордеев Д.В. – сбор данных, анализ полученных данных. Сардаров Г.Г., Скопич А.А. – обзор публикаций по теме статьи, редактирование текста рукописи.
Contribution of the authors: Castiro I.V., Inozemtsev A.N. – concept and design of the study, evaluation of the results of the study, writing the text of the manuscript. Reshetov I.V., Torshin V.I., Popadyuk V.I., Ermakova N.V. – conception and design of research, evaluation of research results. Karpukhina O.V. – development of an analysis methodology, analysis of the data obtained. Khamidulin G.V., Shmaevsky P.E., Gordeev D.V. – data collection, analysis of the data obtained. Sardarov G.G., Skopich A.A. – review of publications on the topic of the article, editing the text of the manuscript.
Информация об авторах:
И.В. Кастыро – к.м.н., декан медицинского факультета Московского университета им. С.Ю. Витте, старший преподаватель кафедры нормальной физиологии медицинского института РУДН, Москва, Россия; e-mail: ikastyro@gmail.com; ORCID: 0000-0001-6134-3080
И.В. Решетов – академик РАН, д.м.н., профессор, заведующий кафедрой онкологии, пластической хирургии и радиотерапии Первого МГМУ им. И.М. Сеченова, Москва, Россия; e-mail: Reshetoviv@mail.ru; ORCID: 0000-0002-0909-6278
В.И. Попадюк – д.м.н., профессор, заведующий кафедрой оториноларингологии РУДН, Москва, Россия; e-mail: lorval04@mail.ru; ORCID: 0000-0003-3309-4683
В.И. Торшин – д.б.н., профессор, заведующий кафедрой нормальной физиологии РУДН, Москва, Россия; e-mail: vtorshin@mail.ru; ORCID: 0000- 0002-3950-8296 Н.В. Ермакова – д.м.н., профессор, профессор кафедры нормальной физиологии РУДН, Москва, Россия; e-mail: n.v.ermakova@mail.ru
О.В. Карпухина – к.б.н., страший научный сотрудник кафедры физиологии высшей нервной деятельности Московского университета им. М.В. Ломоносова, Москва, Россия; e-mail: a_inozemtsev@mail.ru; ORCID: 0000-0002-7271-4008
А.Н. Иноземцев – д.б.н., ведущий научный сотрудник кафедры физиологии высшей нервной деятельности Московского университета им. М.В. Ломоносова, Москва, Россия; e-mail: a_inozemtsev@mail.ru; ORCID: 0000-0002-5059-3241
Г.В. Хамидулин – студент VI курса медицинского института РУДН, e-mail: gkhamidulin@mail.ru, Москва, Россия; ORCID: 0000-0001-6583-1890 П.Е. Шмаевский – студент V курса медицинского института РУДН, Москва, Россия; e-mail: shmaevskij@gmail.com; ORCID: 0000-0003-1330-1294
Сардаров Г.Г. – студент IV курса медицинского института РУДН, Москва, Россия; e-mail: gsardarov77@gmail.com; ORCID: 0000-0002-9657-4601
Гордеев Д.В. – студент III курса медицинского института РУДН, Москва, Россия; e-mail: dr.danila@yandex.ru; ORCID: 0000-0003-3322-5380
Скопич А.А. – студентка III курса медицинского института РУДН, Москва, Россия; e-mail: sashaskopich@mail.ru; ORCID: 0000-0002-8159-3535
Author information:
I.V. Kastyro – Ph.D., dean of the Faculty of Medicine, Moscow University S.Y. Witte, Senior Lecturer, Department of Normal Physiology, Medical University, RUDN University, Moscow, Russia; e-mail: ikastyro@gmail.com; ORCID: 0000- 0001-6134-3080
I.V. Reshetov – academician of the Russian Academy of Sciences, MD, professor, head of the Department of Oncology, Plastic Surgery and Radiotherapy of the First MGMU named after THEM. Sechenov, Moscow, Russia; e-mail: Reshetoviv@ mail.ru; ORCID: 0000-0002-0909-6278
V.I. Popadyuk – MD, Professor, Head of the Department of Otorhinolaryngology, RUDN University, Moscow, Russia; e-mail: lorval04@mail.ru; ORCID: 0000- 0003-3309-4683
V.I. Torshin – Doctor of Biological Sciences, Professor, Head of the Department of Normal Physiology, PFUR, Moscow, Russia; e-mail: vtorshin@mail.ru, ORCID: 0000-0002-3950-8296
N.V. Ermakova – MD, professor, professor of the Department of Normal Physiology, RUDN, Moscow, Russia; e-mail: n.v.ermakova@mail.ru
O.V. Karpukhina – Ph.D., senior researcher at the Department of Physiology of Higher Nervous Activity of Moscow University. M.V. Lomonosov, Moscow, Russia; e-mail: a_inozemtsev@mail.ru; ORCID: 0000-0002-7271-4008
A.N. Inozemtsev – Doctor of Biological Sciences, Leading Researcher, Department of Physiology of Higher Nervous Activity, Moscow University M.V. Lomonosov, Moscow, Russia; e-mail: a_inozemtsev@mail.ru; ORCID: 0000-0002-5059-32–1
G.V. Khamidulin – VI year student of the Medical University of RUDN, Moscow, Russia; tel.: +7 (905) 700-91-89; e-mail: gkhamidulin@mail.ru; ORCID: 0000- 0001-6583-1890
P.E. Shmaevsky – V year student at the RUDN University Medical Institute, Moscow, Russia; e-mail: shmaevskij@gmail.com; ORCID: 0000-0003-1330-1294 Sardarov G.G. – IV year student of the medical institute of RUDN University, Moscow, Russia; e-mail: gsardarov77@gmail.com; ORCID: 0000-0002-9657- 4601
Gordeev D.V. – III year student of the medical institute of the RUDN University, Moscow, Russia; e-mail: dr.danila@yandex.ru; ORCID: 0000-0003-3322-5380
Skopich A.A. – III year student of the Medical Institute of the RUDN University, Moscow, Russia; e-mail: sashaskopich@mail.ru; ORCID: 0000-0002- 8159-3535