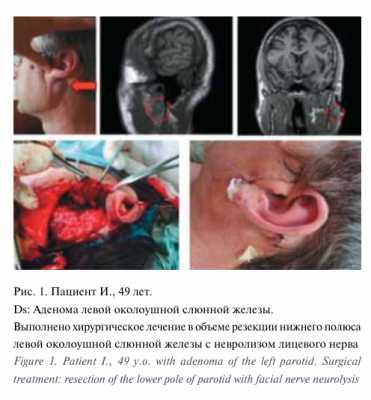
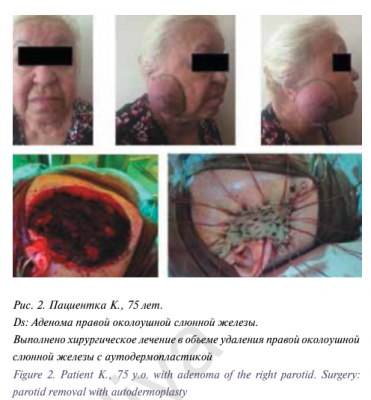
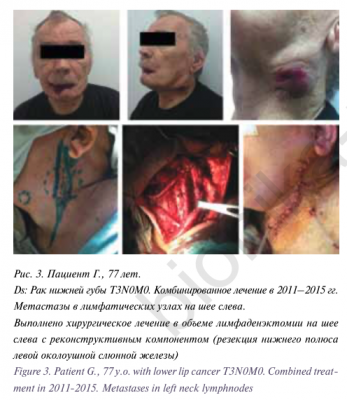
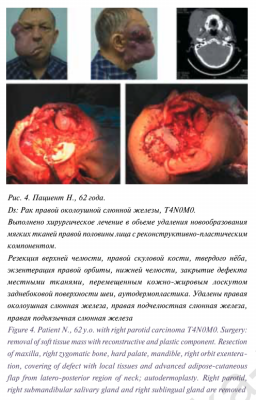
Для цитирования:
Ипполитов И.Л., Харнас С.С., Ипполитов Л.И., Метальников А.В. Хирургическое лечение больных генерализованной формой миастении при неопухолевом поражении тимуса. Голова и шея. Российский журнал Head and neck. Russian Journal. 2019;7(4):66–70.
For citation:
Ippolitov I.L., Harnas С.С., Ippolitov L.I., Metalnikov A.V. Surgical treatment of patients with generalized form of myasthenia gravis with non-tumor lesion of the thymus. Golova i sheya. Rossijskij zhurnal = Head and neck. Russian Journal. 2019;7(4):66–70 (in Russian).
Doi: 10.25792/HN.2019.7.4.66–70
Генерализованная миастения – это аутоиммунное заболевание, основой которого является нарушение нейромышечной проводимости в разных группах мышц. До появления в арсенале клиницистов антихолинэстеразной, иммуносупрессивной терапии и хирургического лечения большинство больных погибали в первые 2–3 года заболевания от развития дыхательных расстройств. Работы последних лет убедительно показывают, что выполненная тимэктомия, особенно на ранней стадии, приводит либо к ремиссии заболевания, либо к минимизации миастенических расстройств. По современным стандартам, под термином хирургическое лечение миастении понимается только полное удаление вилочковой железы с дополнительным иссечением окружающей клетчатки. В настоящее время наиболее адекватным из прямых доступов считается неполная срединная стернотомия, которая при необходимости может быть расширена до полной. Однако новые технологии и концепция миниагрессивности изменили взгляды хирургов на технику выполнения тимэктомии в сторону видео- и робот-ассистированных операций.
Ключевые слова: миастения, тимома, тимэктомия, видеоассистированная тимэктомия, трансстернальный доступ
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Ипполитов И.Л., Харнас С.С., Ипполитов Л.И., Метальников А.В. Хирургическое лечение больных генерализованной формой миастении при неопухолевом поражении тимуса. Голова и шея. Российский журнал Head and neck. Russian Journal. 2019;7(4):66–70.
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Generalized myasthenia gravis is an autoimmune disease, the basis of which is a violation of neuromuscular conduction in different muscle groups. Before the appearance of anticholinesterase, immunosuppressive therapies and surgical treatment in the clinical practice, most patients died in the first 2-3 years from the primary diagnosis due to the development of respiratory disorders. Recent studies have convincingly shown that thimectomy, especially at an early stage, leads either to remission of the disease or to minimization of myasthenic disorders. By modern standards, the term “surgical treatment of myasthenia gravis” refers only to complete removal of the thymus gland with additional excision of the surrounding connective tissue. Currently, incomplete median sternotomy which, if necessary, can be expanded to complete, is considered the most adequate of direct access methods. However, new technologies and the concept of mini-aggressiveness have changed the views of surgeons on the technique of thimectomy in the direction of video and robot-assisted operations.
Key words: myasthenia gravis, thymoma, thimectomy, videoassisted thimectomy, transsternal access
The authors declare no conflict of interest.
Source of financing: not specified.
For citation: Ippolitov I.L., Harnas С.С., Ippolitov L.I., Metalnikov A.V. Surgical treatment of patients with generalized form of myasthenia gravis with non-tumor lesion of the thymus. Golova i sheya. Rossijskij zhurnal = Head and neck. Russian Journal. 2019;7(4):66–70 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of pub-lishing illustrative material – tables, figures, photographs of patients.
Введение
Генерализованная миастения (ГМ) – это аутоимунное заболевание, основой которого является нарушение нейромышечной проводимости в разных группах мышц. По степени выраженности миастению подразделяют на локальные и генерализованные формы. С учетом неспецифичности развития симптоматики особенностью заболевания зачастую является несвоевременная диагностика и, соответственно, несвоевременная патогенетическая терапия. Это в свою очередь приводит к ухудшению неврологического статуса, вплоть до развития т.н. «кризовых» состояний. Такие нарушения, по данным различных авторов, наблюдаются более чем у 30% больных миастенией. Развитие криза является наиболее тяжелым проявлением миастении, значительно ухудшает ближайший прогноз для больного и является основной причиной фатальных исходов. До появления в арсенале клиницистов антихолинэстеразной и иммуносупрессивной терапии, хирургического лечения большинство больных погибали в первые 2–3 года заболевания от развития дыхательных расстройств.
Историческая справка
Впервые состояние, похожее на миастенический криз, было задокументировано еще в 1672 г. T. Willis. В отдельную нозологическую форму миастения была выведена гораздо позднее благодаря работам W. Wilks (1737), W. Erb (1739), S. Goldflam (1893), F. Jolly (1985), J. Campbell и P. Bromwell [1]. Сама болезнь являлась большой загадкой для исследователей и врачей, т.к. поражала население разных возрастных и социальных групп. Предположения о вовлеченности в патологию миастении вилочковой железы были описаны E. Bell (1917). А хирургическая техника тотальной тимэктомии (ТЭ) была подробно описана в 1944 г. американским хирургом A. Blalock [2]. В России первая ТЭ была выполнена А.М. Дыхно в 1940 г., а первая успешная операция при тимоме – Б.В. Петровским в 1954 г. [3]. В 1959 г. А.С. Чечулин сообщил о первых 43 операциях на вилочковой железе, а в 1962 г. М.И. Кузин – о 50 операциях при ГМ. Большая заслуга в разработке методов лечения миастении принадлежит целой плеяде отечественных и зарубежных ученых – А.А. Вишневскому, С.А. Гаджиеву, Б.М. Гехту, М.И. Кузину, В.С. Лобзину, В.Г. Цуману, О.С. Шкробу, И.Х. Ипполитову, K.E. Osserman, R.P. Lisak, R. Barchi, M. Dalakas, D. Drachman, A. Jaretzki и др.
Этиология и патогенез
При миастении вилочковая железа продуцирует в кровь целый ряд разнообразных аутоантител к различным компонентам нервно-мышечного соединения – антитела к ацетил-холиновым рецеторам (АТ к АХР), титину, рецепторам рианодина и ряду нейрональных антигенов [4, 5]. При этом для ГМ без тимомы характерен меньший набор АТ [6].
Основным аутоантигеном при миастении любого генеза является ацетилхолиновый рецептор (АХР) постсинаптической мембраны. Аутоантитела при миастении направлены к различным участкам и субъединицам АХР [7, 8].
По разным оценкам до 20% всех случаев ГМ занимают т.н. серонегативные формы, когда антител к АХР в крови нет [9, 10]. Серонегативные ГМ (СНГМ) по своему течению обычно тяжелее и в настоящее время изучаются учеными по всему миру. СНГМ могут быть вызваны различными наборами АТ, наибольшие группы из них составляют Musk-at и Lrp4-at [11].
В случаях с мышечной специфической тирозинкиназой (MuSK) ГМ-АТ связываются с Ig-регионами рецепторов на мембране, блокируя активацию agrin-LRP4-Musk комплекса. В норме агрин, высвобождаясь из нейрона, попадает на LRP4-Musk рецептор, который в свою очередь дает сигнал на активацию соседних АХР. Антитела к Musk или LRP4 нарушают передачу этого сигнала, снижая эффективность нейромышечной передачи [12].
MuSK- ассоциированная ГМ чаще всего обнаруживается у женщин и лиц молодого возраста, достигая 70% от всех СНГМ в данной выборке [9, 13]. В случаях со смешанными группами пропорции антител в СНГМ разнятся от исследования к исследованию. Например, 3,8% СНГМ дали положительный результат для MuSK в китайской когорте [14], тогда как в Италии этот показатель достиг 47,4% [15].
По данным последних исследований, доля СНГМ связана с нарушением lipoprotein-relatedprotein 4 (LRP4). Так же как и MuSK, LRP4 отвечает за работу нейромышечных сочленений [16]. Антитела к LRP4 были выявлены во многих зарубежных исследованиях, их доля в числе СНГМ также варьируется от исследования к исследованию, достигая в некоторых из них 50% всей серонегативной выборки. [17–19].
Эпидемиология
Расчеты общей заболеваемости и распространенности ГМ, основанные на 55 исследованиях, охватывающих 1950–2007 гг., позволили получить показатель распространенности в 77,7 случая на млн населения. Но стоит уточнить, что цифры распространенности ГМ увеличиваются с середины прошлого века, в первую очередь благодаря улучшению диагностики и повышению доступности медицинского обслуживания [20].
Классификация миастении
В настоящее время предложено несколько классификаций миастении. В России традиционно используется классификация, предложенная Б.М. Гехтом. В ней учитывается характер течения заболевания, степень генерализации миастенического процесса, тяжесть двигательных расстройств и степень их компенсации [21].
Вместе с тем все чаще для оценки критериев и степени тяжести используют классификацию миастении, предложенную в 2000 г. экспертами американского фонда миастении (MGFA) [22]. Классификация включает в себя 5 классов тяжести течения. Начиная от I – глазная форма, до V –полное отсутствие движения конечностей и аксиальной мускулатуры с интубацией.
Хирургическое лечение
Cовременные работы, особенно последних лет, с большим числом пациентов убедительно показывают, что выполненная ТЭ, особенно на ранней стадии, приводит либо к ремиссии заболевания, либо к минимизации миастенических расстройств [23].
В августе 2016 г. группа исследователей из Оксфорда опубликовала обобщенный результат долгосрочного исследования ТЭ. Методом рандомизированного двойного слепого исследования выполнена оценка трансстернальной ТЭ по сравнению с консервативным лечением преднизолоном. В исследование были включены две группы по 60 человек. Критериями отбора были возраст от 18 до 65 лет, течение генерализованного типа миастении не более 3 лет. Исследование показало статистически значимое преимущество ТЭ. По результатам у пациентов с ТЭ в среднем доза гормонов снизилась (44 против 60 мг только в лекарственной группе). Помимо этого, у пациентов из первой группы было меньше последующих госпитализаций по поводу ГМ, а также уменьшилось общее число больничных дней. Лишь у одного из 66 пациентов было осложнение, связанное с ТЭ [24].
Таким образом, анализ литературы показывает, что большая часть работ, посвященных лечению ГМ, рекомендует ТЭ как метод, действительно позволяющий значительно улучшить результаты.
Тем не менее в настоящее время наибольший интерес вызывает целесообразность выполнения ТЭ у пациентов с глазной формой миастении (ГФМ). Продолжаются исследования по поводу возможных рисков прогрессирования миастении от глазных форм до генерализованных. Ретроспективные данные показывают, что у 60% пациентов с ГФМ, которая прогрессирует до генерализованной, это происходит в первые 2 года [25]. Причины ухудшения миастенического статуса до конца не ясны, но одним из наиболее достоверных факторов является тимома и гиперплазия вилочковой железы [26]. В своих рекомендациях по ведению миастении Ассоциация британских неврологов указывает, что раннее начало иммунотерапии и ТЭ у больных ГФМ дают хороший результат и снижают риск генерализации [27]. Это становится все более актуальным в эпоху расширения терапевтических и хирургических вариантов лечения.
По современным стандартам, под термином хирургическое лечение миастении понимается только полное удаление вилочковой железы, с дополнительным иссечением окружающей клетчатки [28, 29].
Для того чтобы выполнить такой объем операции большое значение имеет правильный выбор доступа у каждого конкретного больного, удовлетворяющий всем требованиям: условия для обзора средостения, удобство и безопасность, хорошая ревизия операционного поля, низкая травматичность, длительность операционной травмы, метод и длительность наркоза.
Основным ограничением для хирургов является топография вилочковой железы. При ее небольшом размере, малой васкуляризации, расположении за мощным каркасом грудины часто требуется выполнение травматичных доступов [30]. С развитием эндоскопических технологий выбор оперативных доступов увеличился в разы, с ними же снизилась и травматичность операций. В настоящее время чаще всего используют различные варианты трансстернального доступа (полная продольная стернотомия или частичная продольная стернотомия, продольная стернотомия с резекцией мечевидного отростка, косая неполная стернотомия), торакотомных доступов (односторонняя правая или левая торакотомия, чрездвуплевральный доступ с поперечной стернотомией) [31]. Трансцервикальный доступ, широко применяемый ранее, в настоящее время практически не используется. Большинство специалистов сходятся во мнении, что малый угол обзора, вызванный узостью операционного поля, не дает возможности нормальной ориентации в ране. Также этот доступ ограничивает необходимую радикальность требуемого вмешательства [32, 33].
Таким образом, наиболее адекватным из прямых доступов считается неполная срединная стернотомия, которая при необходимости может быть расширена до полной [34]. Этот доступ обеспечивает самый лучший обзор операционного поля с возможностью удаления всей железы и окружающей клетчатки с минимальным риском повреждения соседних органов и ткани, давая широкий угол действия инструментам хирурга. Единственным, но существенным недостатком данного доступа является его высокая травматичность, вызванная рассечением грудины, что увеличивает восстановительный период и лекарственную нагрузку на пациента [35, 36]. Кроме того, разрушение губчатой кости, играющей важную роль в процессе кроветворения, увеличивает агрессивность этого доступа. Вкупе с косметическим дефектом после операции (большой шрам на груди после операции) все это дает толчок к использованию других, менее инвазивных техник [37].
Новые технологии и концепция миниагрессивности изменили взгляды хирургов на технику выполнения ТЭ. Наибольший интерес представляют работы, посвященные малоинвазивным доступам, таким как видео- и робот-ассистированные операции [38, 39]. На сегодняшний день малоивазивность эндоскопических операций уже прочно ассоциируется с лучшим исходом в плане послеоперационного ведения больного. Но в то же время, когда дело касается больных миастенией, вопрос об использовании видеоэндоскопических методик еще вызывает споры и является предметом дискуссий [34, 37, 40].
В литературе появились аналитические работы, в которых сравнивается видеоассистированная ТЭ с расширенным трансстернальным доступом в ретроспективном исследовании [41, 44]. Анализируя представленные сведения, можно сделать вывод, что видеоэндоскопические методы ТЭ отвечают основным требованиям радикальности и сопоставимы с таковой при традиционной операции.
Заключение
Сохраняется ряд нерешенных вопросов эндохирургической ТЭ. Это касается выработки четких показаний и противопоказаний к выполнению ТЭ в зависимости от тяжести неврологических расстройств, а также выбора научно обоснованного оптимального доступа для ее выполнения. Необходимо обоснование рационального плана подготовки больных ГМ к оперативному лечению. Техника выполнения видеоторакоскопической ТЭ требует оптимизации, а для повышения безопасности операции необходимо разработать и внедрить в практику новые методологические подходы. Также следует уделить внимание анестезиологическому обеспечению таких операций. Назрела необходимость в проведении сравнительного анализа эффективности видеоторакоскопической и открытой ТЭ у больных ГМ средней и тяжелой степеней (от класса IIb до класса IVb) на основании изучения отдаленных результатов хирургического лечения.
ЛИТЕРАТУРА/REFERENCES
- Givel J.C., Merlini M., Clarke D.B., Dusmet M., ed.. Surgery of the thymus. Pathology, associated disorders and surgical technique. Berlin, Germany: SpringerVerlag; 1990. P. 1.
- Blalock A. Thymectomy in the treatment of myasthenia gravis. Report of twenty cases. J. Thorac. Surg. 1944;13:316–39.
- Petrovsky B.V. Mediastinal Surgery. M., 1960. 177 p. [Петровский Б.В. Хирургия средостения. М., 1960. 177 с.] (In Russ.).
- Jaretzki A. 3rd, Barohn R.J., Ernstoff R.M., et al. Myasthenia gravis: recommendations for clinical research standards. Ann. Thorac. Surg. 2000;70:327–34.
- Avidan N., Le Panse R., Berrih-Aknin S., Miller A. Genetic basis of myasthenia gravis – a comprehensive review. J. Autoimmun. 2014; 52:146–53.
- Avidan N., Le Panse R., Berrih-Aknin S., Miller A. Genetic basis of myasthenia gravis – a comprehensive review. J. Autoimmun. 2014; 52:146–53.
- Punga A.R., Sawada M., Stalberg E.V. Electrophysiological signs and the prevalence of adverse effects of acetylcholinesterase inhibitors in patients with myasthenia gravis. Muscle Nerve. 2008;37(3):300–7.
- Somnier F.E. Increasing incidence of late-onset anti-AChR antibody-seropositive myasthenia gravis. Neurol. 2005;65(6):928–30.
- Hoch W., McConville J., Helms S., et al. Auto-antibodies to the receptor tyrosine kinase MuSK in patients with myasthenia gravis without acetylcholine receptor antibodies. Nat. Med. 2001;7(3):365–8.
- McConville J., Farrugia M.E., Beeson D., et al. Detection and characterization of MuSK antibodies in seronegative myasthenia gravis. Ann. Neurol. 2004;55(4):580–4.
- Binks S., Vincent A., Palace J. Myasthenia gravis: a clinical-immunological update. J. Neurol. 2016;263:826–34. 12. Ohno K., Ohkawara B., Ito M. Agrin-LRP4-MuSK signaling as a therapeutic target for myasthenia gravis and other neuromuscular disorders. Expert Opin. Ther. Targ. 2017;21(10):949–58.
- Guptill JT, Sanders DB, Evoli A. Anti-MuSK antibody myasthenia gravis: clinical findings and response to treatment in two large cohorts. Muscle Nerve. 2011;44(1):36–40.
- Yeh J.H., Chen W.H., Chiu H.C., et al. Low frequency of MuSK antibody in generalized seronegative myasthenia gravis among Chinese. Neurol. 2004;62(11):2131–2.
- Zvoli A., Tonali P.A., Padua L., et al. Clinical correlates with anti-MuSK antibodies in generalized seronegative myasthenia gravis. Brain. 2003;126(Pt. 10):2304–11.
- Yumoto N., Kim N., Burden S. Lrp4 is a retrograde signal for presynaptic differentiation at neuromuscular synapses. Nature. 2012;489(7416):438–42.
- Higuchi O., Hamuro J., Motomura M., et al. Autoantibodies to low-density lipoprotein receptor–related protein 4 in Myasthenia Gravis. Ann. Neurol. 2011;69(2):418–22.
- Pevzner A., Schoser B., Peters K., et al. Anti-LRP4 autoantibodies in AChR- and MuSK-antibody negative myasthenia gravis. J. Neurol. 2012;259:427–35.
- Zhang B., Tzartos J.S., Belimezi M., et al. Autoantibodies to lipoprotein-related protein 4 in patients with double-seronegative myasthenia gravis. Arch. Neurol. 2012;69(4):445–51.
- Vincent A., Leite M.I. Neuromuscular junction autoimmune disease: muscle specific kinase antibodies and treatments for myasthenia gravis. Curr. Opin. Neurol. 2005;18(5):519–25.
- Geht B.M., Merkulova D.M. Treatment of myasthenic crises: guidelines for doctors. M., 2000.53 p. [Гехт Б.М., Меркулова Д.М. Лечение миастенических кризов: Методические рекомендации для врачей. М., 2000. 53 с.] (In Russ.).
- Jaretzki A. 3rd, Barohn R.J., et al. Myasthenia gravis: recommendations for clinical research standards. Task Force of the Medical Scientific Advisory Board of the Myasthenia Gravis Foundation of America. Neurol. 2000; 55:16–23.
- Diaz A., Black E., Dunning J. Is thymectomy in non-thymomatous myasthenia gravis of any benefit? Interact. Cardiovasc. Thorac. Surg. 2014;18(3):381–9.
- Bourque P.R., Warman Chardon J. A crucial first randomized controlled trial of thymectomy in non-thymomatous myasthenia gravis. J. Thorac. Dis. 2016; 8(10):1375–8.
- Li F., Hotter B., Swierzy M., et al. Generalization after ocular onset in myasthenia gravis: a case series in Germany. J. Neurol. 2018;265(12,):2773–82.
- Grob D., Brunner N., Namba T., et al. Lifetime course of myasthenia gravis. Muscle Nerve. 2008;37(2):141–9. 27. Sussman J., Farrugia M.E., Maddison P., Hill M., Leite M.I., Hilton-Jones D. Myasthenia gravis: association of British Neurologists’ management guidelines. Pract. Neurol. 2015;15:199–206.
- Kalinin A.P., Maistrenko N.A., Vetshev P.S. Guide to Surgical Endocrinology. Saint-Petersburg, 2004. [Калинин А.П., Майстренко Н.А., Ветшев П.С. Руководство по хирургической эндокринологии. Питер, 2004.] (In Russ.).
- Voulaz E., Veronesi G., Infante M., Cariboni U., Testori A., Novellis P., Bottoni E., Passera E., Morenghi E., Alloisio M. Radical thymectomy versus conservative thymomectomy in the surgical treatment of thymic malignancies. J. Thorac. Dis. 2018;10(7):4127–36
- Shevchenko Y.L., Vetshev P.S., Ippolitov L.I. et al. Forty-year experience in the surgical treatment of generalized myasthenia gravis. Chirurgyia. 2004; 5: 32–8. [Шевченко Ю.Л., Ветшев П.С., Ипполитов Л.И. и др. Сорокалетнийопыт хирургического лечения генерализованной миастении. Хирургия. 2004;5:32– 8.] (In Russ.).
- Kuznetsov I.M., Pishchik V.G., Kozak A.R., et al. Diagnosis and surgical treatment of diseases of thymus gland. Scientifical-Pract. Conference of Association of surgeons in St. Petersburg: Collection of works of S.-Pb., 2001. P. 115–6. [Кузнецов И.М., Пищик В.Г., Козак А.Р. и др. Диагностика и хирургическое лечение заболеваний вилочкой железы. Науч.-практ. конференция Асс. хирургов СПб: Сборн. работ СПб., 2001. С. 115–6.] (In Russ.).
- ClarkeC.P. The evolution of surgery for myasthenia gravis. ANZ. J. Surg. 2002;72(1):1.
- Jaretzki A. 3rd., Steinglass K.M., Sonett J.R. Thymectomy in the management of myasthenia gravis. Semin. Neurol. 2004;24(1): 49–62.
- Zielinski M., Hauer L., Hauer J., Pankowski J., Nabialek T., Szlubowski A. Comparison of complete remission rates after 5 year follow-up of three different techniques of thymectomy for myasthenia gravis. Eur. J. Cardiothorac. Surg. 2010;37:1137–43.
- Kolski H.K., Kim P.C., Vajsar J. Video-assisted thoracoscopicthymectomy in juvenile myasthenia gravis. J. Child. Neurol. 2001;16(8): 569–73.
- Kumar A. Thymectomy in myasthenia gravis. J. Child. Neurol. 2003;18(5):375; author reply 375 р.
- Kondo K. Optimal therapy for thymoma. J. Med. Invest. 2008;55(Suppl. 1–2)17– 28.
- Nussbaumer P., Furrer M. The role of video-thoracoscopy in thoracic surgery. Ther. Umsch. 2005;62(2):77–84. 39. Keijzers M., de Baets M., Hochstenbag M., et al. Robotic thymectomy in patients with myasthenia gravis: neurological and surgical outcomes. Eur. J. Cardiothorac. Surg. 2015;48(1):40–45.
- Erşen E., Kılıç B., Kara H.V., İşcan M., Sarbay İ., Demirkaya A., Bakan S., Tütüncü M., Turna A., Kaynak K. Wideochir. Inne Tech. Maloinwazyjne. 2018;13(3):376–82.
Поступила 14.09.19
Принята в печать 29.11.19 Received 14.09.19 Accepted 29.11.19
Информация об авторах:
С.С. Харнас – д.м.н., профессор кафедры факультетской хирургии №1 лечебного факультета Первого МГМУ им. И.М. Сеченова, Москва, Россия; e-mail: sskharnas@yandex.ru
Л.И. Ипполитов – к.м.н., заведующий онкологическим хирургическим отделением №1, Университетская клиническая больница №1 Первого МГМУ им. И.М. Сеченова, Москва, Россия; e-mail: ippolitovl@mail.ru
И.Л. Ипполитов – врач-хирург Университетская клиническая больница №1 Первого МГМУ им. И.М. Сеченова, Москва, Россия; e-mail: wesmir@bk.ru
А.А. Метальников – аспирант кафедры факультетской хирургии №1, лечебного факультета Первого МГМУ им. И.М. Сеченова, Москва, Россия; e-mail: artem.metalnickov@yandex.ru
Information about the authors:
S.S. Harnas – Doctor of Medicine, Professor, Department of Faculty Surgery No.1, Faculty of Medicine, First Moscow State Medical University n.a. Sechenov I.M., Moscow, Russia; e-mail: sskharnas@yandex.ru L
.I. Ippolitov – PhD in Medicine, Head of the Oncological Surgery Department No. 1, University Clinical Hospital No.1 of the First MSMU n.a. Sechenov I.M., Moscow, Russia; e-mail: ippolitovl@mail.ru
I.L. Ippolitov – surgeon, University Clinical Hospital No.1 of the First MSMU n.a. Sechenov I.M., Moscow, Russia; e-mail: wesmir@bk.ru
A.A. Metalnikov – PhD student of the Department of Faculty Surgery No.1, Faculty of Medicine, First Moscow State Medical University n.a. Sechenov I.M., Moscow, Russia; e-mail: artem.metalnickov@yandex.ru