Для цитирования:
А.Ю. Кугушев, А.В. Лопатин, С.А. Ясонов, Д.В. Рогожин. Фиброзно-костные поражения челюстей у детей. Голова и шея Head and neck. Russian Journal. 2018;6(4):6–14
For citation:
Kugushev A.Yu., Lopatin A.V., Yasonov S.A., Rogozhin D.V. Fibrous and bone lesions of the jaws in children. Head and neck Head and neck. Russian Journal. 2018;6(4):6–14 (in Russian).
Doi: 10.25792/HN.2018.6.4.6–14
Доброкачественные фиброзно-костные поражения (ДФКП) костей черепа – однородная группа заболеваний со сходной микроскопической картиной, характеризующихся гиперклеточной фибробластической стромой, содержащей различные комбинации костной или цементноподобной ткани и другие кальцинированные структуры. Некоторые из этих заболеваний диагностируются только гистологически, однако большинство из них требует комбинированной оценки клинических, микроскопических и рентгенологических данных. Группа ДФКП достаточно широкая и включает реактивные, неопластические, прогрессирующие и диспластические патологические процессы, лечение которых варьируется в зависимости от типа заболевания. Некоторые фиброзно-костные поражения являются уникальными для этого места поражения, тогда как другие могут встречаться в других отделах скелета. В этом исследовании рассмотрены клинические, микроскопические и рентгенологические особенности наиболее часто встречающихся типов ДФКП костей черепа у детей, требующих разных подходов к лечению.
Ключевые слова: фиброзная дисплазия, ювенильная оссифицирующая фиброма, краниометафизарная дисплазия, херувизм, хронический остеомиелит
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: А.Ю. Кугушев, А.В. Лопатин, С.А. Ясонов, Д.В. Рогожин. Фиброзно-костные поражения челюстей у детей. Голова и шея = Head and neck. Russian Journal. 2018;6(4):6–14
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Benign fibrous and bony lesions (BFBL) of the skull bones are a homogeneous group of diseases with a similar microscopic picture, characterized by hypercellular fibroblastic stroma, containing various combinations of bone or cement-like tissue and other calcined structures. Some of these diseases are diagnosed only histologically, but most of them require a combined assessment of clinical, microscopic and radiological data. The BFBL group is quite wide and includes reactive, neoplastic, progressive and dysplastic pathological processes, the treatment of which varies depending on the type of the disease. Some of such lesions are unique just for this site of sceleton, while others may occur in other parts of it. This study examined the clinical, microscopic and radiological features of the most common types of BFBL of the skull bones in children, requiring different approaches for their treatment.
Key words: fibrous dysplasia, juvenile ossifying fibroma, cranio-metaphyseal dysplasia, cherubism, chronic osteomyelitis
The authors declare no conflict of interest.
Source of financing: not specified.
For citation: Kugushev A.Yu., Lopatin A.V., Yasonov S.A., Rogozhin D.V. Fibrous and bone lesions of the jaws in children. Head and neck = Head and neck. Russian Journal. 2018;6(4):6–14 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients
Введение
ДФКП – широкая группа поражений костей, которая включает в себя как реактивные и диспластические поражения, так и новообразования [1, 2]. Объединяет все эти заболевания замена нормальной костной ткани коллагеном, фибробластами и минерализованными материалами при их гистопатологическом исследовании.
За последние десять лет классификация этих поражений претерпела ряд изменений [3, 4]. Первоначально в эту группу C.A. Waldron включал 3 группы поражений: фиброзную дисплазию (ФД), цементно-оссифицирующую фиброму (ЦОФ), оссифицирующие фибромы (ОФ) и их варианты [5–8]. Развитие молекулярной диагностики и лучевых методов исследований позволили расширить эту группу. Согласно классификации опухолей головы и шеи Всемирной организации здравоохранения (ВОЗ), «фиброзно-костные поражения» – гетерогенная группа заболеваний, включающая ОФ, ФД, семейную гигантскую цементому и цементно костную дисплазию. С 2008 г. к ДФКП стали также относить воспалительные, реактивные процессы и метаболические заболевания с поражением костей [5].
ФД является самой часто встречающейся формой ДФКП. Данное заболевание связано с мутацией в гене GNAS1, которая имеет два клинических проявления в зависимости от пораженных костей: моноосальное и полиосальное. Кроме того, ФД может сочетаться с эндокринопатиями и участками гиперпигментации, такая форма известна как синдром МакКунаОлбрайт (MAS) [4, 8–10]. Чаще всего дебют клинического проявления ФД происходит в первые десятилетия жизни в виде деформации, с преимущественной локализацией в верхней челюсти [10]. Рост ФД имеет тенденцию к стабилизации по мере достижения скелетной зрелости, поэтому хирургическое вмешательство у детей и подростков должно быть отложено как можно дальше [8]. После стабилизации оптимальным лечением является операция по коррекции деформации [7]. Однако имеются единичные сообщения о возможности прогрессирования ФД в зрелом возрасте, что приводит к деформации лица и функциональным проблемам [9–11].
ОФ является истинным новообразованием со склонностью к прогрессирующему росту. Выделяют два типа ОФ: простой и агрессивный. Простая форма встречается у женщин в области нижней челюсти на третьем и четвертом десятилетии жизни и представляет собой медленно растущее и хорошо отграниченное поражение, не встречается у детей. Второй тип более агрессивный – ювенильная ОФ (ЮОФ), который встречается у подростков. Клинически проявляется нарастающей безболезненной деформацией, чаще всего поражает верхнюю челюсть [12]. ЮОФ требует хирургического вмешательства – полной энуклеации из окружающей кости из-за ее роста и риска рецидива [8].
Третий, наиболее частый тип ДФКР – ЦОФ у детей не встречается, поэтому не будет обсуждаться в этой статье.
Все ДФКП имеют сходные гистологические характеристики. Тем не менее существуют исследования, которые предполагают дифференциацию по данным гистопатологического анализа: связь между поврежденной и неизмененной прилегающей тканью [13], наличие остеобластического края [14], картина «китайского письма» [15], наличие перитрабекулярных расщеплений [16] или васкуляризации [17]. Однако эти показатели не используются для постановки окончательного диагноза ДФКП, который проводится с помощью клинической, рентгенографической и гистопатологической корреляции [1, 2, 18, 19]. Рентгенография и компьютерная томография (КТ) помогают определить структуру ДФКП и вовлечение в процесс соседних областей [20]. Часто встречается выраженное вздутие костей, смещение и резорбция корней зубов [21]. Типичные случаи ФД и ОФ можно отличить по КТ, т.к. более 60% случаев ФД имеют характерные рентгенографические особенности (внешний вид «матового стекла») и около 60% ОФ – однофокусное округлое поражение [7].
Интраоперационная картина также бывает показательной для определения типа ДФКП. Оболочка ОФ при центробежном поражении легко удаляется, поражение обычно бывает одиночным, большим и хорошо разграниченным [22]. При ФД часто можно наблюдать зону демаркации от неизмененной кости.
Особая трудность в проведении дифференциальной диагностики возникает при поражении челюстей в связи с редкостью их поражения. Комплексная оценка клинического течения и методов лучевой диагностики позволяет значительно сузить круг проводимой дифференциальной диагностики уже до проведения поисковой биопсии при ее необходимости. По этим причинам рентгенодиагностика может быть ключевой в постановке окончательного диагноза и в конечном счете выборе тактики лечения, будь то агрессивная хирургия или наблюдение.
Материал и методы
Проведен ретроспективный анализ данных пациентов отделения челюстно-лицевой хирургии РДКБ за период 2007–2017 гг. В ретроспективный анализ были включены все фиброзно-костные поражения по данным КТ и результатов гистологического исследования. Из исследования были исключены пациенты, которым гистопатологическое обследование не проводили. Кроме того, это исследование включало пациентов, у которых на основании послеоперационных гистопатологических результатов диагностировали фиброзно-костные поражения, несмотря на предоперационную лучевую диагностику, по данным которой данная патология заподозрена не была.
Анализ рентгенологических данных проводился с использованием специализированного программного обеспечения, установленного как на сервер больницы (Meddialog), так и с помощью портативных программ (Amira 5.34 – построение 3Д моделей, и Vidar Dicom viewer – оценка размера и плотности образований). В анализ были включены различные переменные: возраст, пол, основная жалоба и ее продолжительность, тип поражения костей черепа, локализация. Анализу были подвергнуты такие радиографические параметры, как размеры поражения, внутренняя структура, наличие области кистозной дегенерации, влияние на прилегающие структуры. Панорамные рентгеновские снимки и конусная трехмерная ортопантомография не использовались по причине низкого качества визуализации костной структуры. У пациентов, подвергшихся контурной пластике, часть резецированного материала подвергалась патологоанатомическому анализу. Пациентам с неясной картиной или подозрением на опухоль проводили поисковую биопсию. Микроскопическое исследование каждого случая проводили опытные патологоанатомы, входящие в группу по изучению костной патологии.
Результаты
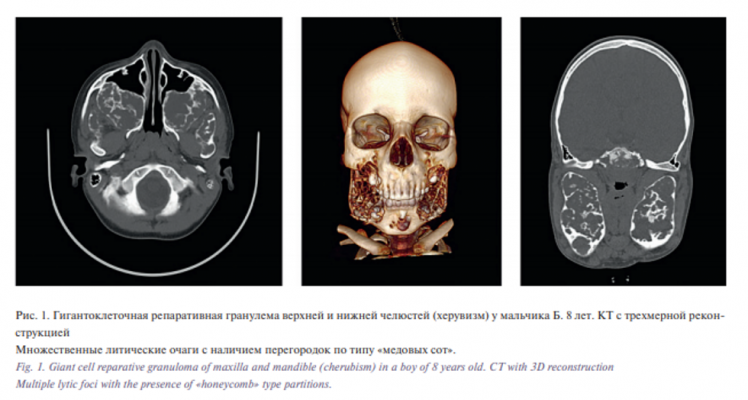
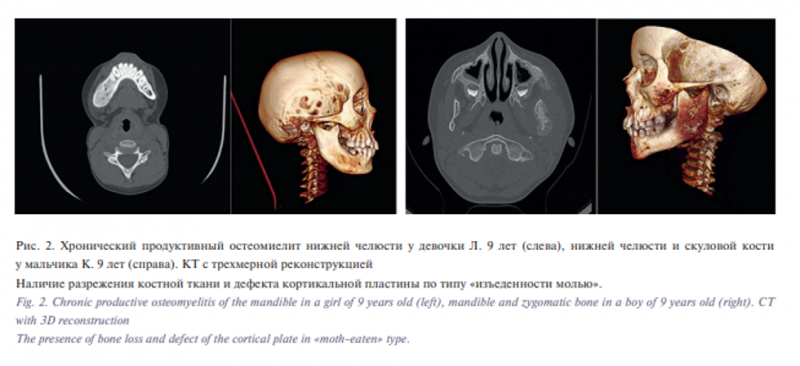
За период с 2002 по 2017 г. в отделении ЧЛХ РДКБ получили лечение 58 детей с фиброзно-костными поражением челюстей. Средний возраст дебюта заболевания составил 7,4 года, а возраст при поступления – 9,6 года, что было связано с медленным ростом образования. В двух случаях сроки от момента появления заболевания до поступления составили 11 и 15 лет. Встречаемость у девочек была незначительно выше (1,15:1), чем у мальчиков, а верхняя челюсть была поражена в 59,1% (см. таблицу). Подавляющей формой фиброзно-костных поражений была ФД (41 пациент). В 9 случаях был диагностирован хронический продуктивный остеомиелит, при этом в 7 случаях направляющим диагнозом был ФД. В одном случае ребенок обратился с жалобами на хронический синусит, и, несмотря на проведенное обследование по месту жительства, ребенку не был выставлен правильный диагноз – полиосальная форма ФД с поражением верхней челюсти. Кроме того, в 50% случаев гигантоклеточного поражения челюстей и в 2 случаях гемангиом челюстей направляющим диагнозом также была ФД, что указывает на трудности дифференциальной диагностики этих заболеваний с фиброзно-костными поражениями. Путаница с дифференциальной диагностикой с гигантоклеточной репаративной гранулемой идет от ранее причисляемого к ФД херувизма (6 детей), также называемого семейной формой ФД (рис. 1). В 4 случаях дети с херувизмом поступали с диагнозом: полиосальная форма ФД. Однако для гигантоклеточной репаративной гранулемы характерно наличие мультикистозного поражения по типу «мыльных пузырей», преимущественно верхней челюсти, в отличие от «матового стекла» при фиброзно-костных поражениях. Проблемы с дифференциальной диагностикой с хроническим остеомиелитом возникали в период продуктивной фазы при возникновении костной гиперплазии – диффузно-склерозирующего остеомиелита, при котором, как правило, не удается выявить инфекционного агента. Однако на КТ всегда было возможно найти инфекционный очаг и/или дефекты кортикального слоя, что не встречается при ФД (рис. 2). Однако ФД может осложнять остеомиелит, что затрудняет проведение дифференциальной диагностики, когда решающее значение имеет биопсия, что встречалось один раз в нашей практике. Кроме того, ФД не сопровождается болями, рецидивирующими отеками и тризмом, что характерно для остеомиелита. Исключением является наличие жалобы на головные боли при ФД при тотальном и субтотальном поражении верхнечелюстной пазухи.
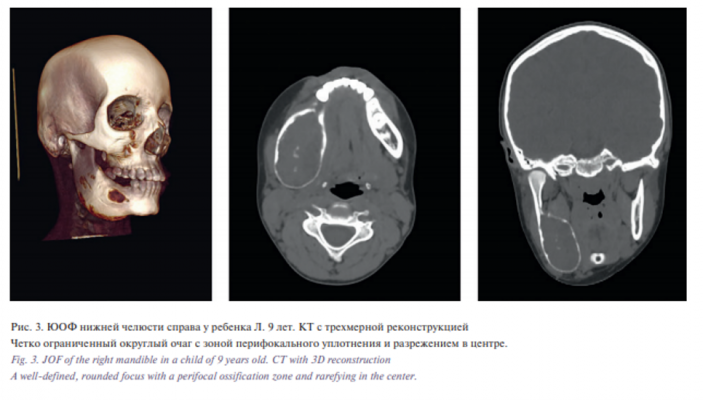
Из 189 пациентов с образованием костей у 10 детей (возраст 4,9–13,9 года) мы диагностировали ЮОФ, у которых в 7 случаях очаг располагался в челюстях с преимущественным поражением нижней челюсти (рис. 3). В 2 случаях направляющий диагноз звучал как гигантоклеточная репаративная гранулема, несмотря на отличную для данного поражения рентгенологическую картину очагов поражения. ОФ имела четкий край, в отличие от размытых границ при ФД или дефектов кортикального слоя при остеомиелите. Рентгенографически поражения были экспансивными и деструктивным. Несмотря на такую характерную рентгенологическую картину, возникали трудности при гистологической дифференциальной диагностике с ФД, когда решающим было определение Gs-alpha мутации (GNAS1).
Стоит также отметить, что дифференциальная диагностика моноосальной ФД часто была трудна, особенно когда на рентгенограмме был лишь один ограниченный очаг просветления округлой или овальной формы. В связи с этим единственным патогномоничным исследованием, подтверждающим диагноз ФД, оставалась только биопсия с последующим морфологическим исследованием.
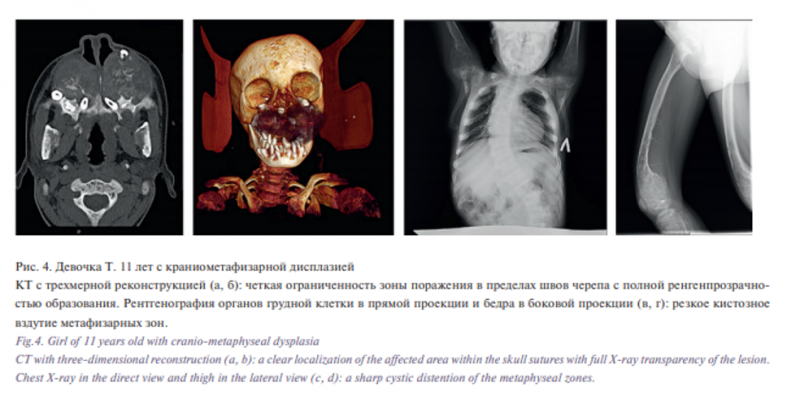
При диагностике полиосальной формы ФД, несмотря на характерные изменения, не требующие гистологического подтверждения, в одном случае у ребенка с диагностированной на момент поступления в стационар полиосальной формой ФД как по данным проведенной КТ костей черепа, так и по результатам биопсии с пересмотром в нескольких клиниках как России, так и Германии, нами была диагностирована краниометафизарная дисплазия (рис. 4). Проблема диагностики заключалась в отсутствии комплексной оценки данных обследования пациента: осмотр, лучевая диагностика и гистологическое исследование.
При оценке КТ с места жительства у ребенка с краниометафизарной дисплазией ряд фактов не укладывался в диагноз ФД: кистозная трансформация верхней челюсти, низкая плотность образования, наличие расширения метафизарных зон в ключицах и плечевых костях. При выполнении дополнительных рентгенологических снимков грудной клетки и бедра обнаружены поражения и других метафизарных зон в костях. При внешнем осмотре отмечалась выраженная экспансивная деформация альвеолярного гребня верхней челюсти. Учитывая гистологическое подтверждение в нескольких лабораториях, в т.ч. за пределами России, проведена попытка удаления образования, которая была безуспешна по причине выраженной кровоточивости и была ограничена расширенной биопсией. Полученные гистологическая, лучевая и визуальная картины образования интраоперационно позволили расценить его как гипертрофированную метафизарную зону верхней челюсти до момента перестройки костей на фоне закрытия зон роста, которое встречается при данном заболевании. Осложняли течение данного заболевания низкие антропометрические показатели по сопутствующему у ребенка детскому церебральному параличу с тетрапарезом. Тонкий слой подкожно-жировой клетчатки и низкая масса тела не позволили ребенку войти в период полового созревания и закрытия зон роста, поэтому ребенок для дальнейшего лечения был передан под наблюдение эндокринологов-гинекологов.
Обсуждение
Классификация ДФКП долгое время была предметом споров и постоянного обновления. В 1985 г. C.A. Waldron впервые выделил эту группу в отдельную, однако широкого распространения данная классификация не получила, в связи с чем для сравнительного анализа нами использованы данные из ранее опубликованных серий [5]. Как и C.O. Ogunsalu с соавт. мы обнаружили, что ФД является наиболее распространенным ДФКП челюстей, за которым следуют ЮОФ и хронический диффузно-склерозирующий остеомиелит [23]. В целом мы обнаружили, что ДФКП поражают в равной степени как женщин, так мужчин, за исключением диффузно-склерозирующего остеомиелита, где превалировал женский пол (3,5:1). Полученные данные соответствуют обзору D. MacDonald-Jankowski [24], в котором показано равное распределение по половому признаку при ФД, однако отличаются от предыдущих исследований, где превалировали женщины как при ЮОФ (1:3), так и при ФД (1:1,6) [14, 22, 23, 25–29]. Помимо различий в распределении по полу, наши данные о клинических характеристиках пациентов с ФД соответствуют описанным ранее в литературе [24, 30, 31]. Верхняя челюсть была поражена чаще, чем нижняя челюсть с преимущественным расположением очагов в задних областях [8]. Наиболее частым симптомом было медленное и безболезненное нарастание деформации, а при рентгенологическом исследовании – симптом «матового стекла» при ФД.
По данным зарубежных авторов, для ЮОФ характерно поражение верхней челюсти независимо от подтипа [32, 33]. Однако, по нашему опыту, преобладало поражение нижней челюсти с жалобами на увеличение челюсти и в 46,2% имелись жалобы на боль или парестезию. Это явно отличает ЮОФ от других типов ДФКП.
Примечательно, что наиболее часто описываемым ранним радиографическим признаком проявления всех ДФКП является наличие очагов полной рентгенпрозрачности. Чаще всего (23,1%) такая картина встречается при ЮОФ. По нашим данным, в 42% случаев ФД отмечается наличие очагов полной рентгенпрозрачности в отличие от взрослых, где такая картина встречается только в 21% случаев [34]. Частично это может быть связано с тем, что большинство пациентов обращаются за лечением спустя время, когда поражение становиться наиболее заметным. В большинстве случаев ФД не имеют симптома рентгенпрозрачности на этапе лучевой диагностики, в связи с чем могут быть невыявлены. С другой стороны, ЮОФ локально агрессивна и может быстро развиваться, в связи с чем возможна ранняя диагностика. В нашем исследовании в 10 случаях фиброзно-костные поражения нельзя было диагностировать с использованием только лучевых методов. Согласно L. Su, частота несоответствия между рентгенографическими и гистопатологическими диагнозами составляет 25% [14], однако с момента этого исследования качество лучевой диагностики значительно выросло, в связи с чем этот процент должен снижаться. В дополнение к внутреннему виду, граница поражения – еще одна важная рентгенографическая характеристика, используемая для отличия ФД, ЮОФ и хронического диффузносклерозируюего остеомиелита (ХДСО). Большинство поражений ЮОФ имеют четкую границу, в то время как границы ФД и ХДСО, как правило, плохо определены, но при ХДСО имеется изъеденность кортикального слоя. Наши данные о рентгенографической границе также подтверждают этот вывод. Кроме того, ЮОФ имеет кистозную структуру (монокистозные 75%, мультикистозный 25%) с четко выраженным кортикальным краем или имеет смешанную плотность [5, 14]. В отличие от ФД радиологическая форма ЮОФ круглая или овальная. Специфический рентгенологический признак ЮОФ представляет собой радиолюминесцентный ободок вокруг смешанного или рентгеноконтрастного очага поражения [16]. Y. Liu и соавт. [26] описали, что радиолюминесцентный контур капсулы на периферии отделяет более зрелую внутреннюю рентгеноконтрастную часть от окружающей неизмененной кости в очаге ЮОФ. ЮОФ может иметь непостоянную форму, особенно если опухоль быстро растет в течение короткого периода времени [14, 17]. Кроме того, ЮОФ часто приводит к резорбции корня соседнего зуба [6, 14, 18]. Однако гистопатологическая дифференциальная диагностика ФД и ЮОФ очень трудна, т.к. стромальный элемент представляет собой гиперцеллюляр, остеобластическая реминификация минимальна, нерегулярные трабекулы часто являются пластинчатыми, а фибробластические клетки лишены атипичных цитологических признаков [5]. Хотя перитрабекулярное расщепление может быть отличительной чертой ФД и ценным микроскопическим признаком для отличия ФД от ЮОФ [19], выявление мутации гена GNAS является надежным дополнением для дифференциации ФД и ЮОФ [8, 12, 20].
Боль была необычной жалобой у пациентов с ДФКП, на что указывают и другие авторы, ссылаясь на тот факт, что до 71,4% она была связана с инфекцией во время обращения. Вероятно, это связано с восприимчивостью ДФКП к инфекции, которая впоследствии вызывает болезненный симптом [8]. Некоторые авторы описывают фиброзно-костные поражения при инфекционно-гнойных заболеваниях, таких как хронический остеомиелит нижней челюсти [27] и хронический верхнечелюстной синусит [28]. Во всех шести случаях хронического продуктивного остеомиелита в нашем исследовании изначально дети поступали с подозрением на ФД. Фиброзно-костный очаг в нижней челюсти может имитировать хронический продуктивный остеомиелит как клинически, так и рентгенологически [27, 29]. Однако, по данным C. Ma (2016), в ретроспективном исследовании, включающем 68 пациентов, только у одного пациента с ФД, которому проводилась реконструкция аутокостным трансплантатом (1,5%), развился остеомиелит [35]. Некоторые авторы считают, что инфекция, удаление зубов и травма могут служить в качестве стимулирующих факторов пролифирации при ЮОФ [25, 36].
Интраоперационная картина также бывает показательной. Наличие соединительнотканной капсулы – важная особенность, которая встречается в 36,9% образцов ЮОФ [18], демаркируя зону поражения от прилегающей нормальной кости [21], тогда как ФД и ДСХО не имеют этой особенности. Однако ее присутствие зависит от области поражения, а также от метода проведения биопсии.
Заключение
Фиброзно-костные поражения челюстей составляют большую гетерогенную группы с разным прогнозом и подходом к лечению. Высокий процент ошибок при постановке диагноза и вследствие этого неправильного выбора объема лечения требует обязательного комплексного подхода к диагностике доброкачественных поражений костей черепа. Только тесное взаимоотношение патологоанатома, лучевого диагноста и хирурга позволяет правильно поставить диагноз и выбрать оптимальную тактику лечения.
ЛИТЕРАТУРА/REFERENCES
- Brannon R.B., Fowler C.B. Benign fibro-osseous lesions: a review of current concepts. Adv. Anat. Pathol. 2001;8:126.
- Eversole R., Su L., Elmofty S. Benign fibro-osseous lesions of the craniofacial complex. A review. Head Neck Pathol. 2008;2:177.
- Suarez-Soto A., Baquero-Ruiz de la Hermosa M.C., Minguez-Martínez I., Floría-García L.M., Barea-Gámiz J., Delhom-Valero J., Risueño-Mata P. Management of fibro-osseous lesions of the craniofacial area. Presentation of 19 cases and review of the literature. Med. Oral. Pathol. Oral. Cir. Bucal. 2013;18:e479.
- El-Naggar A.K., Chan J.K.C., Grandis J.R., Takata T., Slootweg P.J. WHO Classification of Head and Neck Tumours. 4th Ed. Lyon, IARC Press. 2017. Р. 251–5.
- Waldron C.A. Fibro-osseous lesions of the jaws. J. Oral. Maxillofac. Surg. 1993;51:828.
- Muwazi L.M., Kamulegeya A. The 5-year prevalence of maxillofacial fibroosseous lesions in Uganda. Oral. Dis. 2015;21:e79.
- Lasisi T.J., Adisa A.O., Olusanya A.A. Fibro-osseous lesions of the jaws in Ibadan, Nigeria. Oral. Health Dent. Manag. 2014;13:41.
- Phattarataratip E., Pholjaroen C., Tiranon P. A clinicopathologic analysis of 207 cases of benign fibro-osseous lesions of the jaws. Int. J. Surg. Pathol. 2014;22:326.
- Burke A.B., Collins M.T., Boyce A.M. Fibrous dysplasia of bone: craniofacial and dental implications. Oral. Dis. 201723:697.
- Yang L., Wu H., Lu J., Teng L. Prevalence of different forms and involved bones of craniofacial fibrous dysplasia. J. Craniofac. Surg. 2017428:21.
- Mohanty S., Gupta S., Kumar P., Sriram K., Gulati U. Retrospective analysis of ossifying fibroma of jaw bones over a period of 10 years with literature review. J. Maxillofac. Oral. Surg. 2014413:560.
- El-Mofty S.K. Fibro-osseous lesions of the craniofacial skeleton: an update. Head Neck Pathol. 2014;8:432.
- Slootweg P.J., Muller H. Differential diagnosis of fibro-osseous jaw lesions. A histological investigation on 30 cases. J. Craniomaxillofac. Surg. 1990;18:210.
- Su L., Weathers D.R., Waldron C.A. Distinguishing features of focal cementoosseous dysplasias and cemento-ossifying fibromas: I. A pathologic spectrum of 316 cases. Oral. Surg. Oral. Med. Oral.Pathol. Oral. Radiol. Endod. 1997;84:301–9.
- Riminucci M., Liu B., Corsi A., Shenker A., Spiegel A.M., Robey P.G., Bianco P. The histopathology of fibrous dysplasia of bone in patients with activating mutations of the Gs alpha gene: site-specific patterns and recurrent histological hallmarks. J. Pathol. 1999;187:249.
- Prado Ribeiro A.C., Carlos R., Speight P.M., Hunter K.D., Santos-Silva A.R., de Almeida O.P., Vargas P.A. Peritrabecular clefting in fibrous dysplasia of the jaws: an important histopathologic feature for differentiating fibrous dysplasia from central ossifying fibroma. Oral. Surg. Oral. Med. Oral. Pathol. Oral. Radiol. 2012;114:50.
- Shmuly T., Allon D.M., Vered M., Chaushu G., Shlomi B., Kaplan I. Can differences in vascularity serve as a diagnostic aid in fibro-osseous lesions of the jaws? J. Oral. Maxillofac. Surg. 2017;75:1201.
- Abramovitch K., Rice D.D. Benign fibro-osseous lesions of the jaws. Dent. Clin. North Am. 2016;60:167.
- Mainville G.N., Turgeon D.P., Kauzman A. Diagnosis and management of benign fibro-osseous lesions of the jaws: a current review for the dental clinician. Oral. Dis. 2017;23:440.,
- Kolomvos N., Theologie-Lygidakis N., Christopoulos P., Iatrou I. Benign fibro-osseous lesions of the jaws in children. A 12-year retrospective study. J. Craniomaxillofac. Surg. 2013;41:574.,
- Alsharif M.J., Sun Z.J., Chen X.M., Wang S.P., Zhao Y.F: Benign fibro-osseous lesions of the jaws: a study of 127 Chinese patients and review of the literature. Int. J. Surg. Pathol. 2009;17:122.
- Worawongvasu R., Songkampol K. Fibro-osseous lesions of the jaws: an analysis of 122 cases in Thailand. J. Oral. Pathol. Med. 2010;39: 703–708.
- Ogunsalu C.O., Lewis A., Doonquah L. Benign fibro-osseous lesions of the jaw bones in Jamaica: analysis of 32 cases. Oral. Dis. 2001;7:155–62.
- MacDonald-Jankowski D. Fibrous dysplasia: a systematic review. Dentomaxillofac. Radiol. 2009;38:196–215.
- Summerlin D.J., Tomich C.E. Focal cemento-osseous dysplasia: a clinicopathologic study of 221 cases. Oral. Surg. Oral. Med. Oral. Pathol. 1994;78:611–20.
- Liu Y., Wang H., You M., et al. Ossifying fibromas of the jaw bone: 20 cases. Dentomaxillofac. Radiol. 2010;39:57–63.
- MacDonald-Jankowski D.S., Li T.K. Ossifying fibroma in a Hong Kong community: the clinical and radiological features and outcomes of treatment. Dentomaxillofac. Radiol. 2009;38:514–23.
- Mintz S., Velez I. Central ossifying fibroma: an analysis of 20 cases and review of the literature. Quintessence Int. 2007;38:221–7.
- Sciubba J.J., Younai F. Ossifying fibroma of the mandible and maxilla: review of 18 cases. J. Oral. Pathol. Med. 1989;18:315–21.
- Kruse A., Pieles U., Riener M.O., Zunker C., Bredell M.G., Gratz K.W. Craniomaxillofacial fibrous dysplasia: a 10-year database 1996-2006. Br. J. Oral. Maxillofac. Surg. 2009;47:302–5.
- Nityasri V., Haris P.S., Bose T., Balan A. Fibrous dysplasia – a 13-year retrospective radiographic analysis in a south Indian population. Dentomaxillofac. Radiol. 2011;40:282–9.
- El-Mofty S. Psammomatoid and trabecular juvenile ossifying fibroma of the craniofacial skeleton: two distinct clinicopathologic entities. Oral. Surg. Oral. Med. Oral. Pathol. Oral. Radiol. Endod. 2002;93:296–304.
- Slootweg P.J., Panders A.K., Koopmans R., Nikkels P.G. Juvenile ossifying fibroma. An analysis of 33 cases with emphasis on histopathological aspects. J. Oral. Pathol. Med. 1994;23:385–8.
- Megerian C.A., Sofferman R.A., McKenna J.M., Eavey R.D., Nadol J.B. Fibrous dysplasia of the temporal bone: ten new cases demonstrating the spectrum of otologic sequelae. American. J. Otol. 1995;16:408–19. PMID: 8588639.
- Ma C., Wang H., He G., Qin X. Familial Gigantiform Cementoma: Case report of an unusual clinical manifestation and possible mechanism related to “calcium steal disorder.” Med. 2016;95:2956.
- Vegas Bustamante E., Gargallo Albiol J., Berini Aytes L., Gay Escoda C. Benign fibro-osseous lesions of the maxillas: analysis of 11 cases. Med. Oral. Patol. Oral. Cir. Bucal. 2008;13:653–6.
Поступила 30.07.18 Принята в печать 20.11.18
Received 30.07.18 Accepted 20.11.18
Информация об авторах:
А.Ю. Кугушев – к.м.н., врач-пластический хирург отделения челюстнолицевой хирургии РДКБ ФГБОУ ВО РНИМУ им. Н.И. Пирогова, Москва, Россия; e-mail: drkugushev@gmail.com. ORCID: https://orcid.org/0000-0002- 6881-7709. Персональный идентификатор в РИНЦ: 3045-0722
А.В. Лопатин – д.м.н., профессор, зав. отделением челюстно-лицевой хирургии ФГАОУ ВО Российский университет дружбы народов, Москва, Россия. ORCID: https://orcid.org/0000-0003-0043-9059
С.А. Ясонов – к.м.н., доцент, челюстно-лицевой хирург отделения челюстнолицевой хирургии РДКБ ФГБОУ ВО РНИМУ им. Н.И. Пирогова, Москва, Россия; ORCID: https://orcid.org/0000-0003-0319-3103
Д.В. Рогожин – к.м.н., зав. отделением патологической анатомии РДКБ ФГБОУ ВО РНИМУ им. Н.И. Пирогова, Москва, Россия; ORCID: https:// orcid.org/0000-0003-0777-9152
About the authors:
A.Yu. Kugushev – MD, Ph.D., plastic surgeon of the Department of Maxillofacial Surgery of the RCCH FSBEI RSRMU named after N.I. Pirogov, Moscow, Russia; e-mail: drkugushev@gmail.com. ORCID: https://orcid.org/0000-0002-6881- 7709. Personal ID in RISC: 3045-0722
A.V. Lopatin – MD, Ph.D., Professor, Head of Department of Oral and Maxillofacial Surgery, People’s Friendship University of Russia, Moscow, Russia. ORCID: https://orcid.org/0000-0003-0043-9059
S.A.Yasonov – MD, PhD, maxillo-facial surgeon of the Department of Maxillofacial Surgery of the RCCH FSBEI RSRMU named after N.I. Pirogov, Moscow, Russia; ORCID: https://orcid.org/0000-0003-0319-3103
D.V.Rogozhin – MD, PhD, head of pathomorphology department of RCCH FSBEI RSRMU named after N.I. Pirogov, Moscow, Russia; ORCID: https:// orcid.org/0000-0003-0777-9152
Рецензия на статью
Доброкачественные фиброзно-костные поражения костей – однородная группа заболеваний со сходной клинико-рентгеномикроскопической картиной. Несмотря на схожесть, эта группа достаточно обширная и включает реактивные, неопластические, прогрессирующие и диспластические патологические процессы, лечение которых варьируется в зависимости от типа заболевания. По этим причинам требуется комбинированная оценка клинических, микроскопических и рентгенологических данных для своевременного начала лечения и выбора объема лечения. В настоящий момент основной метод лечения доброкачественных поражений костей – удаление пораженного участка кости. Однако не всегда данный метод возможен без инвалидизирующих последствий или нерационален. Мультидисциплинарный подход является краеугольным камнем в диагностике образований. Развитие компьютерной спиральной томографии, возможность трехмерного моделирования с оценкой распространенности патологического процесса и структуры костей, а также развитие иммуногистохимического анализа, позволяющего выявлять характерные мутации, дают возможность дифференцированно подходить к каждому пациенту, не проводя необоснованных операций или неоправданно длительного наблюдения.
Авторы статьи привели убедительные данные об эффективности мультидисциплинарного подхода в проведении дифференциальной диагностики фиброзно-костных поражений челюстей и выработке оптимального плана лечения.
Review on the article
Benign bone fibrous lesions are a homogeneous group of diseases with a similar clinical X-ray microscopic picture. Despite the definite similarity, this group is quite extensive and includes reactive, neoplastic, progressive and dysplastic pathological processes, the treatment of which varies depending on disease type. For these reasons, a combined assessment of clinical, microscopic, and radiological data is required for the timely start of treatment and the choice of treatment volume. Currently, the main treatment for benign bone lesions is removal of the affected bone area. However, this method is not always possible without disabling consequences. A multidisciplinary approach is the cornerstone for the successful treatment. The development of computed spiral tomography, the possibility of three-dimensional modeling with an assessment of the prevalence of the pathological process and bone structure, as well as the development of immunohistochemical analysis to identify specific mutations, make it possible to compose the most appropriate plan for each patient without performing unreasonable operations or unnecessarily long observation.
The authors of the article provided convincing data on the effectiveness of a multidisciplinary approach for differential diagnosis making and the development of an optimal treatment plan for patients with fibrous bone lesions.