Для цитирования: Решетов И.В., Сукорцева Н.С., Святославов Д.С., Шевалгин А.А., Насилевский П.А. TORS операции в лечении рака полости рта и ротоглотки. Голова и шея Head and neck Russian Journal. 2018;6(2):6–13
For citations: Reshetov I.V., Sukortseva N.S., Svyatoslavov D.S., Shevalgin A.A., Nasilevsky P.A. TORS surgery in the treatment of oral cavity and oropharyngeal tumors. Golova I Sheya Head and neck Russian Journal. 2018;6(2):6–13 (in Russian).
Doi: 10.25792/HN.2018.6.2.6–13
Цель работы – внедрение в клиническую практику лечения пациентов со злокачественными новообразованиями полости рта и ротоглотки трансоральных роботических вмешательств. В настоящее время при лечении опухолей ротоглотки и полости рта требуется мультидисциплинарный подход. При выборе метода лечения пациентов на ранних стадиях развития заболевания Т1–Т2 важно учитывать его эффективность и возможные осложнения. Популяризация роботохирургии в России и в мире открыла новую эру в хирургическом подходе к лечению опухолей головы и шеи. Малоинвазивная трансоральная роботическая хирургия успешно вошла в клиническую практику врачей-онкологов благодаря высокой точности и легкости оперирования за счет использования модифицированных технологических решений. Важным фактором в лечении опухолей данной локализации является восстановление функции органа и отдаленный функциональный результат, совокупно влияющие на качество жизни пациента.
Материал и методы. В клинике пластической хирургии Первого МГМУ им. И.М. Сеченова был разработан ряд способов лечения новообразований полости рта и ротоглотки с применением трансоральной роботассистенции. Успешно проведено 10 операций. Семь трансоральных роботических резекций ротоглотки, одна резекция корня языка, а также две операции были выполнены трансоральным способом у пациентов с опухолями полости носа и решетчатого лабиринта. В одной операции применена микрохирургическая аутотрансплантация.
Результаты. Особенностью течения послеоперационного периода была ранняя активация пациентов, сокращение сроков нахождения в стационаре, а также удовлетворительные косметический и функциональный результаты.
Заключение. Применение данного подхода к лечению опухолей ротоглотки и полости рта позволяет в короткие сроки перейти к следующим этапам лечения (химиотерапия, лучевая терапия), обеспечивая комбинированный подход к лечению опухолей головы и шеи.
Ключевые слова: рак ротоглотки, онкология головы и шеи, трансоральная роботическая хирургия, реконструкция, лоскут.
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Решетов И.В., Сукорцева Н.С., Святославов Д.С., Шевалгин А.А., Насилевский П.А. TORS операции в лечении рака полости рта и ротоглотки. Голова и шея Head and neck Russian Journal. 2018;6(2):6–13
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Aim. The main aim of this work is the introduction of transoral robotic interventions in case of the oral cavity and oropharynx malignancies into clinical practice. At present, a multidisciplinary approach is required for the treatment of patients with oropharynx and oral cavity tumors. When choosing a treatment method at early stages of T1-T2 of disease, it is important to take into account both its effectiveness and risk of possible complications. The popularization of robotic surgery in Russia and all over the world has opened a new era in head and neck surgery. Minimally invasive transoral robotic surgery has successfully entered the clinical practice, mostly due to its high accuracy, ease of operation, and the use of modified technological solutions. One more important factor is the restoration of organ function and the good long-term functional outcomes that both benefit to the patient’s quality of life.
Results. The remarkable peculiarity of the postoperative period was the early activation of patients, reduction of hospital stay, and satisfactory cosmetic and functional results.
Materials and methods. A number of methods for treating patients with oral cavity and oropharynx neoplasms with the use of transoral robotic assistance were developed in the plastic surgery clinic of the First Moscow State Medical University named after I.M. Sechenov. Ten patients successfully underwent surgical treatment: 7 transoral robotic resections of the oropharynx, 1 resection of the tongue root, and 2 operations were performed in patients with nasal cavity and ethmoidal labyrinth tumors via transoral approach. The microsurgical autotransplantation was used in one case.
Conclusion. This method allows a short time proceed to the following treatment steps (chemotherapy, radiation therapy) providing the application of combined and complex approach to the treatment of head and neck tumors.
Key words: oropharyngeal cancer, head and neck oncology, transoral robotic surgery, reconstruction, flap
Authors declare no conflict of interests for this article.
Source of financing. Unspecified.
For citations: Reshetov I.V., Sukortseva N.S., Svyatoslavov D.S., Shevalgin A.A., Nasilevsky P.A. TORS surgery in the treatment of oral cavity and oropharyngeal tumors. Golova I Sheya Head and neck Russian Journal. 2018;6(2):6–13 (in Russian).
The authors are responsible for the originality of the presented data and the ability to publish illustrative material-tables, figures, photos of patients.
Введение
В настоящее время заболеваемость злокачественными новообразованиями, локализующимися на голове и шее, в Российской Федерации остается высокой и кумулятивно составляет 33 тыс. больных с первично выставленным диагнозом. В течение 10 лет (с 2003 по 2013 г.) меняется традиционная картина «лидеров» среди опухолей головы и шеи. Отмечается выраженное снижение заболеваемости передних отделов полости рта (губы и дно полости рта) в сторону значительного роста числа случаев рака ротоглотки. Одной из причин происходящих изменений являются новые канцерогенные факторы, приходящие на смену классическим (табакокурению и алкоголю): вирусы папилломы и Эпштейна-Барр, накапливающиеся в популяции мутации онкогенов и др. Важным обстоятельством является сопоставимость показателей заболеваемости раком опухолей головы и шеи в России с ведущими странами Европы, что свидетельствует об общих тенденциях в когортах онкологических больных многих стран. [1] У пациентов с опухолями головы и шеи, находящихся на I–II стадиях, общая безрецидивная выживаемость после хирургического лечения и лучевой терапии одинаковы. Пятилетняя выживаемость больных примерно 80% с опухолями Т1 и 70% – пациентов с опухолями Т2. При сочетании хирургического метода лечения с лучевой терапией значительно повышается риск осложнений. В лечении плоскоклеточного рака орофаренгеальной зоны в настоящее время используют все имеющиеся в арсенале средства: хирургия, лучевая и химиотерапия. Чувствительность рака ротоглотки к лучевому и лекарственному воздействию, сложность хирургического доступа, а также степень развития опухолевой инвазии сделали химиолучевую терапию методом выбора в лечении вышеуказанной патологии. [2]. Но, несмотря на модернизацию схем и режимов химиолучевого лечения, у части пациентов в дальнейшем развивается продолженный рост опухоли или регионарный рецидив. Таким образом, хирургический метод лечения является на текущий момент вариантом выбора в лечении опухолей данной локализации.
Операции в ротоглотке имеют ряд технических трудностей, связанных с хирургическим доступом и возможностью контроля хирургического края опухоли. До эры органосохранных операций многие злокачественные опухоли ротоглотки лечились открытой хирургией. Из-за ограниченного доступа как при резекции, так и реконструкции, часто прибегали к трансмандибуляному доступу. К сожалению, данное оперативное пособие связано с высоким риском возникновения послеоперационных осложнений и возникновения в послеоперационном периоде выраженных функциональных и эстетических нарушений, что зачастую приводит больного к отказу от оперативного вмешательства в пользу химиолучевой терапии. Стратегически химиолучевая терапия предназначена сохранить нормальную анатомию, нормальную речь и глотание у пациентов с раком ротоглотки.
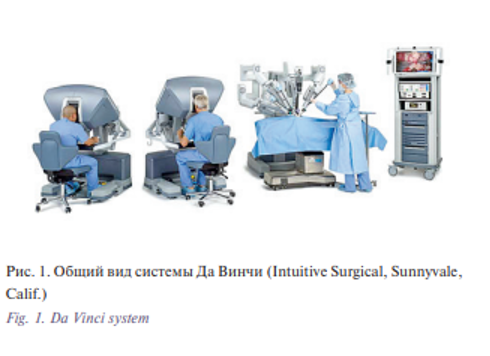
Однако ряд исследований, оценивающих долгосрочные результаты после перенесенной лучевой или химиотерапии, показали, что у пациентов возникают функциональные нарушения, в т.ч стойкие нарушения глотания, сухость во рту, снижение голосовой функции, нарушение разграничительной функции с предрасположенностью к аспирации [3, 4]. Совершенствование подходов к лечению хирургической патологии способствовало развитию малоинвазивных доступов, в т.ч. робот-ассистированных. Хирургический робот Да Винчи (Intuitive Surgical, Sunnyvale, Calif.) получил широкое применение в хирургии, исключением не является онкология опухолей головы и шеи (рис. 1). Роботохирургическая система Да Винчи состоит из консоли, за которой сидит хирург и выполняет операцию за пределами операционного поля, и стойки пациента, функцией которой является поддержка манипуляторов, трехмерного эндоскопа и инструментов. Популяризация данного подхода позволяет в настоящее время выполнить достаточно большие радикальные оперативные вмешательства с удовлетворительными функциональным и косметическим результатами, не ухудшая при этом отдаленных результатов лечения.
Изначально роботические хирургические комплексы задумывались с целью преодоления недостатков традиционной лапароскопической хирургии, вместе с этим они имеют ряд важных преимуществ. В первую очередь это инструменты с широким диапазоном движений, что позволяет проникать в глубокие анатомические структуры пациента без дополнительного расширения раны, возможностью работать в ограниченных пространствах, таких как ротоглотка, средостение. Система координации глаз и рук хирурга позволяет естественно воспроизводить движения хирурга и выполнять более точные пространственные манипуляции. Также хирургический робот оснащен трехмерной системой визуализации с эффектом реальной глубины получаемого изображения. По мнению большинства авторов, применение трехмерного изображения наряду со стабилизацией и легким позиционированием камеры позволяет значительно улучшить визуализацию и повысить возможность визуального восприятия тканей. Таким образом, повышение качества визуализации наряду с широким спектром степеней свободы рабочих манипуляторов и интуитивно понятным управлением позволяет добиться максимальной эффективности, четкости, стабильности и высочайшего качества работы оперирующего хирурга, что чрезвычайно важно при выполнении оперативных вмешательств с элементами микрохирургической техники в условиях ограниченного пространства и длительных реконструктивных операций [5, 6].
Трансоральная роботическая хирургия совсем недавно была применена для лечения злокачественных новообразований органов головы и шеи. В нескольких докладах документально описывалось достоинство миниинвазивности техники для лечения злокачественных новообразований рото-, гортаноглотки и опухолей заглоточного пространства. Таким образом, трансоральный роботический доступ – это новый подход к лечению опухолей этой локализации, который требует уникальных принципов реконструкции.
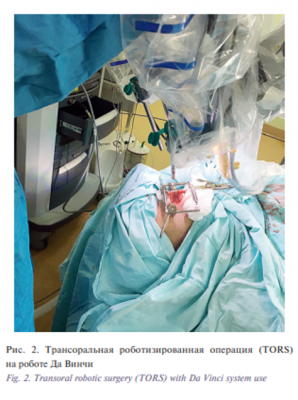
Трансоральная робот-ассистированная хирургия была разработана с целью резекции опухолей ротоглотки без проведения травмирующей мандибулотомии. В настоящий момент трансоральная роботизированная операция (TORS), разработанная в 2004 г. в университете Пенсильвании при использовании хирургической роботизированной системы да Винчи, позволяет перейти от тяжелой классической операции к процедуре минимальной инвазивности со значительным снижением дозы облучения (рис. 2). Управляя четырьмя гибкими руками робота с помощью манипуляторов и ножных педалей, хирурги обследуют образования в полости рта, доступ к которым в ходе обычной трансоральной операции затруднен. По сравнению с классической процедурой, связанной с разделением нижней челюсти, роботизированная рука TORS позволяет врачам «добраться» до опухоли без разрезов на губе или нижней челюсти [7]. Традиционно после выполнения робот-ассистированной операции в ротоглотке допускалось заживление послеоперационной раны вторичным натяжением. Данный подход был надежным в отношении небольших опухолей, но не в тех случаях, когда происходит обнажение общей сонной артерии или есть риск возникновения небно-глоточной недостаточности. В этих случаях применительно закрытие дефектов местно мягкими тканями [8].
Активное развитие роботических технологий в мире популяризовал трансоральный доступ, в связи с этим возник ряд проблем по реконструкции обширных дефектов ротоглотки. На основании этого ряд авторов ввели в практику и применили классификацию роботических дефектов ротоглотки (CORD – Classification for Oropharyngeal Robotic Defects), которая учитывает размер, положение опухоли, число вовлеченных в опухолевый процесс структурных элементов ротоглотки (небная миндалина, небная дужка, корень языка, мягкое небо, боковая стенка ротоглотки), обнажение сонной артерии, а также сообщение ротоглотки с органами шеи для дальнейшего определения способа реконструкции. Выбор способа реконструкции зависит от объема дефекта [9] При обширных дефектах возможно использование свободных лоскутов (лучевой лоскут). Кроме того, ряд авторов провели ретроспективное исследование в котором проводилось сравнение онкологических и функциональных результатов у пациентов с рецидивирующим раком ротоглотки после проведенной трансоральной роботической операции и традиционной «открытой» операции. Отмечено, что 2-летняя безрецидивная выживаемость была достоверно выше в группе робот-ассистированных вмешательств, чем традиционных: 74% против 43%, что достигалось благодаря меньшей частоте положительных краев резекции [10].
Современное лечение онкологических пациентов требует не только излечения, но и максимального восстановления функции оперированного органа. Большое значение уделяется отдаленным функциональным результатам после проведенного оперативного вмешательства. Интактная нервно-мышечная анатомия ротоглотки имеет решающее значение для нормальных речи и глотания. Изменение анатомии орофаренгеальной области после хирургической резекции опухолей может повлиять на обе функции. Неврологическое повреждение черепных нервов как следствие хирургии или радиации, а также появление рубцов и фиброза мягких тканей от хирургии и адъювантного лечения может иметь разрушительные функциональные осложнения. Хорошая восстановительная парадигма должна предвидеть эти возможные последствия и свести к минимуму заболевания сопроводительной терапии. В связи с этим применение трансоральной роботохирургии в лечении опухолей ротоглотки и полости рта представляется как вариант выбора у пациентов, находящихся на ранних стадиях развития онкологического заболевания.
Материал и методы
В клинике пластической хирургии ПМГМУ им. И.М. Сеченова с мая 2016 по ноябрь 2017 г. выполнено 10 операций с использованием трансоральной робот-ассистенции у пациентов с различной локализацией опухолевого процесса: 8 операций выполнены трансоральным способом в ротоглотке, 2 выполнены трансоральным способом при удалении опухолей полости носа и решетчатого лабиринта.
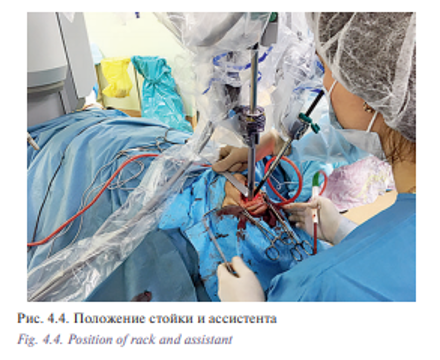
Суть трансоральной роботической операции состоит в установке роторасширителя Dingman, обеспечивающего четкий контроль положения языка и препятствующего смыканию челюстей. Роботизированная стойка инструментов находится непосредственно у операционного стола, в большинстве случаев робот Да Винчи расположен слева под углом примерно 30° относительно пациента, с 30° видеоэндоскопом, 5 мм монополярной коагуляцией и 5 мм «Мэрилэнд» диссектором по обе стороны. Это может требовать дополнительной корректировки в зависимости от положения опухоли. Три роботизированные руки выравниваются вокруг точки, сходящейся в области задней стенки ротоглотки, две руки держат инструменты, третья – трехмерный эндоскоп. Хирург, работающий за консолью, выполняет стандартную роботическую операцию. Второй хирург обычно находится у головы для аспирации дыма, крови и устранения смещения различных анатомических структур, закрывающих хирургическое поле.
Клиническое наблюдение
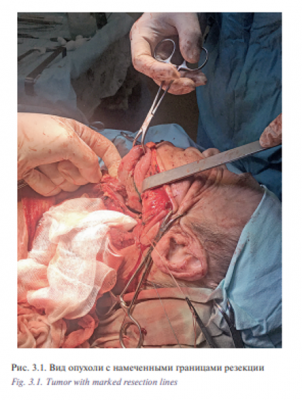
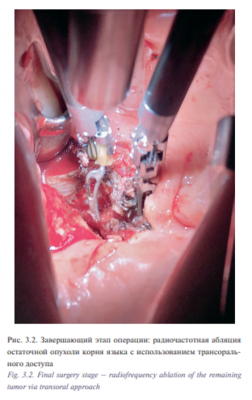
1 Пациент Д., 55 лет с диагнозом «рак корня языка T3N0M0». Состояние после курса лучевой терапии 01-03/2017 СОД 59,4 Гр. Продолжений рост. Первичное обращение в поликлинику онкологического диспансера по месту жительства 20.12.2016. При осмотре и дообследовании установлен и гистологически верифицирован рак корня языка слева T3N0M0. Гистология №59085-87 от 23.12.2016: дифференцированный плоскоклеточный рак. С 11.01.2017 по 23.03.2017 проведен паллиативный курс ДЛТ СОД 59,4 Гр. на опухоль и пути лимфооттока. При осмотре ЛОР-хирургом на предоперационной дозе предлагалось оперативное лечение, больной отказался, лучевая терапия продолжена до паллиативной дозы с положительной динамикой – остаточная инфильтрация до 1,5 см. При контрольном осмотре в мае 2017 г. констатирован продолженный рост. При ЛОР осмотре: в области корня языка, задней трети слева язва с подрытыми краями с инфильтрацией в основании до 4 см в диаметре. Инфильтрат переходит за среднюю линию, кпереди до средней трети языка. Регионарные лимфоузлы не пальпируются. При мультиспиральной компьютерной томографии (МСКТ) 640 ротоглотки от 19.05.2017 в левой половине задней трети языка определяется язвенный дефект 2×3 мм, окруженный по периферии плотным валом, активно накапливающим контраст, общий размер измененного участка 23×14×18 мм. Участок патологического контраста переходит на дорзально левую боковую поверхность корня языка, деформирует его контур. Пациент обратился в УКБ№1, Первого МГМУ им. И.М. Сеченова, рекомендовано хирургическое лечение. Выполнена операция 30.06.2017: робот-ассистированное удаление опухоли корня языка слева с замещением дефекта языка и дна полости рта слева лоскутом большой грудной мышцы; трахеостомия; лимфаденэктомия на шее слева. Первым этапом тупым и острым путем осуществлен доступ к окологлоточному пространству, боковой стенке ротоглотки, вскрыт просвет глотки на уровне корня языка слева. Язык прошит, инвертирован в сформированное хирургическое окно. При ревизии определяется изъязвленное с подрытыми краями новообразование корня языка слева, не заходящее за среднюю линию, от 35 до 20 мм в диаметре (рис. 3.1). Далее произведено прошивание краев опухоли нитью капрон 4. Язык возвращен в привычное положение. С целью создания оптимального трансорального доступа к корню языка выполнена установка роторасширителя. Далее выполнена интраоральная установка роботических манипуляторов и манипулятора камеры. С применением робот-ассистенции и использованием диссектора Prograsp и коагулятора Maryland произведено удаление опухоли корня языка слева (рис. 3.2). С помощью антисептиков произведена санация полости рта. С целью закрытия сформировавшегося дефекта полости рта и ротоглотки выполнена мобилизация ротационного лоскута большой грудной мышцы, лоскут проведен в полость рта. Дефект глотки ушит трехрядным швом. Далее в полости рта с применением роботического иглодержателя и манипулятора Maryland выполнена мобилизация лоскута в полости рта и фиксация его к краям дефекта нитью Этибонд 2.0. Общее время операции составило 180 минут. По данным послеоперационного гистологического исследования диагноз был подтвержден. Течение раннего послеоперационного периода протекало без осложнений, пациент деканюлирован на 15-е сутки после операции. Назогастральный зонд был удален на 20-е сутки после проведения рентгеноконтрастного исследования. Общее время пребывания в стационаре составило 20 дней.
Клиническое наблюдение 2
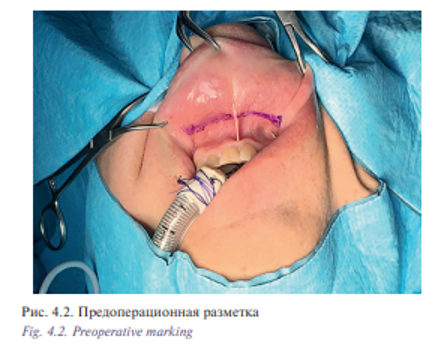
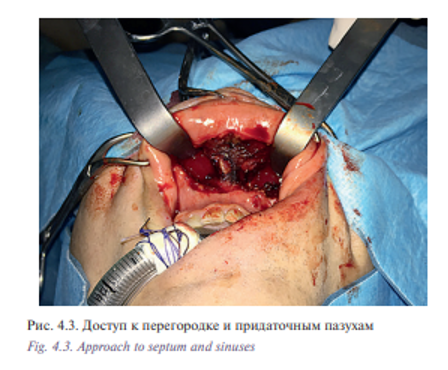
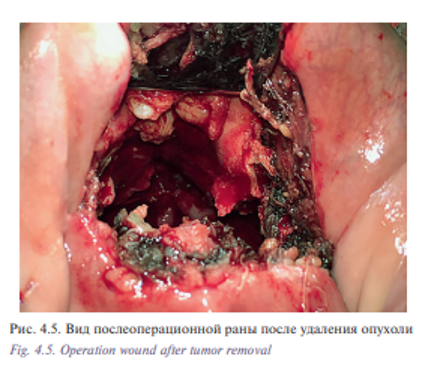
Пациент Б., 53 лет с диагнозом «лейомиосаркома полости носа и решетчатого лабиринта Т2N0M0». Пациент на протяжении 5 лет наблюдался у оториноларинголога по поводу обострения полисинусита. Проводилось пункционное, антибактериальное лечение. Обратился в УКБ №1, где в оториноларингологическом отделении №1 было проведено дообследование: по данным компьютерной томографии определялось патологическое содержимое во всех околоносовых пазухах и полости носа (признаки полипозного пансинусита). Хирургическое лечение в объеме двусторонней эндоскопической полисинусотомии с расширенной биопсией новообразования полости носа выполнено 28.06.16. Гистологическое исследование №5147/40261-66 от 29.06.2016: 1 и 2 в правой и левой половинах носа обнаружены фрагменты веретеноклеточной опухоли с признаками клеточной атипии, с обширными полями некроза и высокой митотической активностью. На отдельных участках поверхность покрыта многослойным плоским и многоядерным эпителием. Заключение: веретеноклеточная саркома полости носа. Характеристики опухолевых клеток наиболее вероятно соответствуют лейомиосаркоме. В дальнейшем больному была рекомендована химиотерапия. С 07.2016 по 02.2017 проведено 8 курсов химиотерапии. При контрольном обследовании: МСКТ 640 отмечается уменьшение размеров опухоли (рис. 4.1) Пациент обратился в клинику пластической хирургии УКБ №1 Первого МГМУ им. И.М. Сеченова, рекомендовано хирургическое лечение. Выполнена операция: робот-ассистированное удаление опухоли полости носа и придаточных пазух 29.03.2017. Операция была выполнена трансоральным доступом. В условиях гидроохлаждения при помощи костного распатора сформировано овальное костное окно, установлено соустье с правым и левым верхнечелюстными синусами (рис. 4.2, 4.3). При ревизии определялась фиброзно-измененная слизистая оболочка пазухи от 5 до 20 мм в диаметре. Далее с применением робот-ассистенции произведено тотальное удаление слизистой оболочки и боковых стенок верхнечелюстных пазух, выполнена поднадкостничная остеотомия хрящевого и костного отделов носовой перегородки. С применением робот-ассистенции и использованием диссектора Prograsp и коагулятора Maryland произведено удаление опухоли перегородки полости носа и решетчатого лабиринта, выполнена роботическая радиочастотная термоаблация области операции (рис. 4.4, 4.5). Рана промыта растворами антисептиков, тампонирована турундой, пропитанной йодопироном. Общее время операции составило 125 минут. По данным послеоперационного гистологического исследования диагноз был подтвержден. Турунда удалена на 5-е сутки после операции. Время нахождения в стационаре составило 6 дней. Пациент выписан в удовлетворительном состоянии. Уникальность операции заключается в отсутствии разрезов на лице (трансоральный доступ) и миниинвазивности без дополнительного расширения краев послеоперационной раны за счет использования роботического инструментария, позволяющего проникать в труднодоступные места за счет наличия 7 степеней свободы и угла поворота более чем 90°. В дальнейшем пациент направлен на прохождение лучевой терапии.
Клиническое наблюдение 3
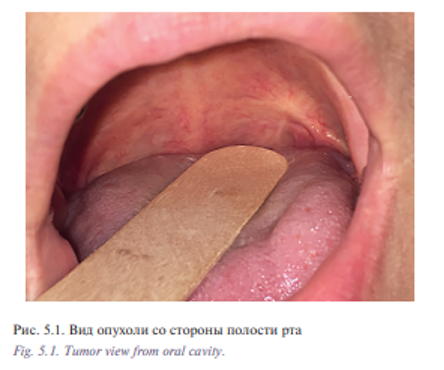
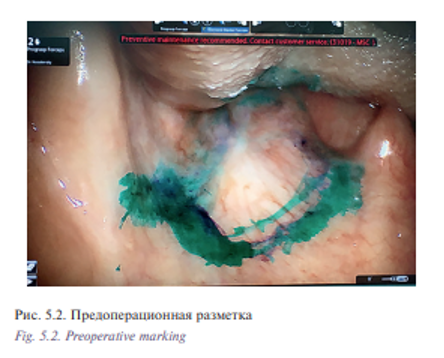
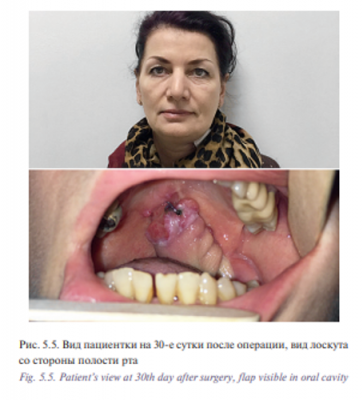
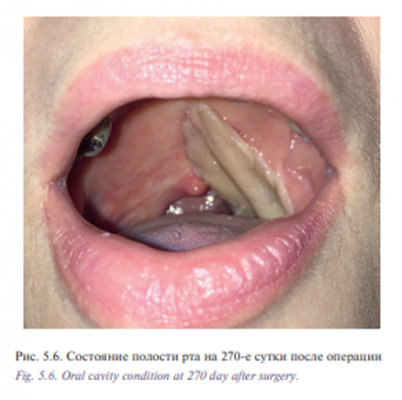
Уникальная операция была проведена с использованием хирургического робота Да Винчи у пациентки К. 53 лет с плоскоклеточным раком боковой стенки ротоглотки, Т2N0M0 (рис. 5.1) Опухоль диагностирована в августе 2016 г., в сентябре – ноябре 2016 г. пациентке проведен курс химиолучевого лечения СОД 66 Гр. Несмотря на проведенное лечение отмечен продолженный рост опухоли. В декабре 2016 г. пациентка обратилась в отделение реконструктивной и пластической хирургии УКБ №1, ПМГМУ им. И.М. Сеченова, рекомендовано хирургическое лечение. При осмотре определялась рубцово измененная слизистая оболочка боковой стенки ротоглотки с распространением на небную миндалину и корень языка, диагноз был подтвержден цитологически и гистологически. При дообследовании были выявлены метастазы в лимфатические узлы боковой поверхности шеи слева. В ходе планового предоперационного обследования пациентке выполнено ультразвуковое исследование лимфатических узлов шеи с биопсией, МСКТ 640 головы и шеи. Операцию выполняли одновременно две бригады хирургов. Первым этапом была выполнена верхнезональная лимфаден эктомия, доступ к лицевым сосудам и выделение лучевого лоскута. Вторым этапом пациентке была проведена трансоральная резекция левой боковой стенки ротоглотки, небной миндалины, корня языка, объем сформировавшегося дефекта составил 3×4 см (рис. 5.2, 5.3). Дном дефекта являлись мышцы боковой поверхности шеи, а также имелось непрямое сообщение с общей сонной артерией и яремной веной. Критерием выбора способа закрытия дефекта ротоглотки у данной пациентки послужила вышеупомянутая классификация наших зарубежных коллег, согласно которой рекомендовано использование свободного лоскута. В завершении второго этапа выполнено перемещение свободного лучевого реваскуляризированного аутотрансплантата в область сформировавшегося дефекта (рис. 5.4). Микрохирургический этап был выполнен в условиях оптического увеличения 2,5 с использованием лупы и микрохирургического инструментария. Артериальный и венозный анастомоз был выполнен нитью Пролен 5-0, шов нерва – нитью Пролен 4-0. Общее время аноксии составило 25 минут. Лоскут был проведен в полость ротоглотки через дефект боковой стенки. Далее были наложены отдельные узловые швы между слизистой оболочкой ротоглотки и кожной площадкой лоскута нитью Викрил 3-0 с использованием роботического иглодержателя и диссектора Maryland. С целью профилактики асфиксии в раннем послеоперационном периоде больной сформирована превентивная трахеостома. Общее время операции составило 155 минут. По данным послеоперационного гистологического исследования диагноз был подтвержден, в краях резекции опухолевого рост отсутствовал, был один метастаз в лимфатический узел без выхода за пределы капсулы. Ранний послеоперационный период протекал без осложнений, пациентка деканюлирована на 7-е сутки после операции. Назогастральный зонд был удален на 14-е сутки после проведения рентгенконтрастного исследования. Общее время пребывания в стационаре составило 15 дней (рис. 5.5, 5.6).
Результаты исследования
Среднее время нахождения в стационаре после выполнения робот-ассистированных операций составило 9 дней. Операция в среднем длилась 131 минуту, при этом величина кровопотери не превышала 130 мл (80–200 мл) За время проведения нашего наблюдения необходимость в конверсии (переход к открытой операции) не возникла. При сравнительно низкой величине кровопотери необходимости в трансфузии элементов крови у пациентов данной группы не было. Больные в раннем послеоперационном периоде получали наркотические анальгетики 2 дня.
В большинстве наблюдений отмечено гладкое послеоперационное течение, осложнения встретились у двух пациентов. При плановом патогистологическом исследовании положительный хирургический край не встретился ни в одном из случаев. Плоскоклеточный рак встретился в 10 случаях. У двух пациентов была диагностирована саркома полости носа. Продолженный рост опухоли встретился у двух пациентов: в первом случае у больного с перенесенной ранее робот-ассистированной резекцией правой небной миндалины был верифицирован плоскоклеточный рак в области гортаноглотки, во втором случае у пациентки после перенесенной робот-ассистированной резекции правой небной миндалины был выявлен продолженный рост опухоли в мягких тканях щеки. Данным больным в последующем были проведены резекционные операции. В рамках соблюдения онкологического протокола лечения пациентов в двух случаях после операции в полости носа потребовалась лучевая терапия, а двум пациентам была проведена адьювантная химиотерапия.
Обсуждение
В настоящее время использование трансоральной роботической хирургической техники с одномоментной микрохирургической реконструкцией боковой стенки ротоглотки открывает новые возможности в лечении опухолей (Т1, Т2) орофарингеальной области. Прецензионность хирургических действий обеспечивает полный контроль области операции и заблаговременно снижает риск появления рецидива в области операции. В результате ранее перенесенной химиотерапии или лучевого лечения у пациентов данной группы в значительной степени повышается риск развития послеоперационных осложнений со стороны реципиентной зоны. Однако четкое соблюдение клинических рекомендаций, а также динамический контроль состояния послеоперационной раны позволяет в среднем уже на 14-е сутки выполнить полноценный акт глотания.
Заключение
На основании результатов проведенного исследования следует выделить ряд преимуществ роботической хирургии для хирурга: малоинвазивности, точности хирургических действий, улучшенной системой визуализации и возможности применения усовершенствованного хирургического инструментария. Для пациента преимущества заключаются в первую очередь в отсутствии видимых шрамов и рубцов на лице, полном восстановлении утраченных функций, сокращении сроков госпитализации и быстром возвращении к привычному образу жизни. Сокращение сроков реабилитационного периода после хирургического лечения у больных данной группы позволяет в короткие сроки перейти к следующим этапам лечения (химиотерапия, лучевая терапия), улучшить качество жизни пациентов за счет комбинированного подхода в лечении опухолей головы и шеи. Внедрение в практику роботических технологий успешно продвигает хирургию вперед, позволяя комбинированно подойти к выполнению онкологического протокола в отношении пациентов, имеющих небольшие размеры новообразований в области головы и шеи.
ЛИТЕРАТУРА/REFERENCES
- Решетов И.В. Опухоли органов головы и шеи. Тверь: ОАО Тверской полиграфический комбинат. 2016. С. 12–15. [Reshetov I.V. Opukholi organov golovy i shei; Tver’: OAO Tverskoi poligraficheskii kombinat. 2016. S. 12–15 (In Russ.)].
- Forastiere A.A., Goepfert H., Maor M., Pajak T.F., Weber R., Morrison W., Glisson B., Trotti A., Ridge J.A., Chao C., Peters G., Lee D.-J., Leaf A., Ensley J., Cooper J. Concurrent chemotherapy and radiotherapy for organ preservation in advanced laryngeal cancer. N. Engl. J. Med. 2003;349:2091–8. https://doi.org/10.1056/nejmoa031317.
- Roh J.L., Kim A.Y., Cho M.J. Xerostomia following radiotherapy of the head and neck. J. Clin. Oncol. 2005;23:3016–23. https://doi. org/10.1200/jco.2005.07.419.
- Campbell B.H., Spinelly K., Marbella A.M., Myers K.B., Kuhn J.C., Layde P.M. Aspiration, weight loss, and quality of life in head and neck survivors. Arch. Otolaryngol. Head Neck Surg. 2004;130:1100–3. https:// doi.org/10.1001/archotol.130.9.1100.
- Davies B. A review of robotics in surgery. Proc Inst Mech Eng, 2000;214: 129–140.
- Satava R.M. Surgical robotics: the early chronicles: a personal historical perspective. Surg. Laparosc. Endosc. Percutan. Tech. 2002;12:6–16.
- Genden E.M., Desai S., Sung C.K. Transoral robotic surgery for the management of head and neck cancer: A preliminary experience. Head Neck. 2009;31:283–9 https://doi.org/10.1002/hed.20972.
- Jesse C. Selber. Transoral Robotic Reconstruction of Oropharyngeal Defects: A Case Series Plastic & Reconstructive Surgery. 2010;126(6):1978–87. https://doi.org/10.1097/prs.0b013e3181f448e3.
- de Almeida J.R., Genden E.M. Robotic assisted reconstruction of the oropharynx, Otolaryngol. Head Neck Surg. 2012;20:237–45 https://doi. org/10.1097/moo.0b013e328354c24e.
- White H., Ford S., Bush B., et al. Salvage surgery for recurrent cancer of the oropharynx: comparing TORS with standard open surgical approaches. JAMA. Otolaryngol. Head Neck Surg. 2013;139(8):773–8. doI: 10.1001/ jamaoto. 2013.3866.
Поступила 15.12.17 Принята в печать 20.03.18 Received 15.12.17 Accepted 20.03.18
Сведения об авторах:
И.В. Решетов – д.м.н., профессор, академик РАН, заведующий кафедрой пластической хирургии Первого МГМУ им. И.М. Сеченова (Сеченовский университет), заведующий кафедрой онкологии и пластической хирургии Института повышения квалификации Федерального медико-биологического агентства; e-mail: reshetoviv@mail.ru, orcid.org/0000-0002-0580-7052.
Н.С. Сукорцева – врач-онколог, Первый МГМУ им. И.М. Сеченова (Сеченовский университет); e-mail: sukorceva.nataly@mail.ru, orcid.org/0000- 0002-7704-1658.
Д.С. Святославов – к.м.н., ассистент кафедры пластической хирургии, врач-онколог, Первый МГМУ им. И.М. Сеченова (Сеченовский университет); e-mail: dssvyatoslavov78@mail.ru. orcid.org/0000-0003-0898-8693. А.А. Шевалгин – врач-онколог, Первый МГМУ им. И.М. Сеченова (Сеченовский университет); e-mail: doktor_kz@bk.ru, orcid.org/0000-0002- 7045-554.
П.А. Насилевский – врач-онколог, ассистент кафедры онкологии, Институт повышения квалификации Федерального медико-биологического агентства; e-mail: nassilevsky@mail.ru, orcid.org/0000-0001-6747-0056.
About the authors:
I.V. Reshetov – MD, Professor, Academician of the Russian Academy of Sciences, Head of the Department of Plastic Surgery, First Moscow State Medical University named after I.M. Sechenov (Sechenov University), Head of the Department of Oncology and Plastic Surgery, Institute for Advanced Training of the Federal Medical and Biological Agency; e-mail: reshetoviv@mail.ru, orcid.org/0000-0002- 0580-7052.
N.S. Sukortseva – MD, medical oncologist, First Moscow State Medical University named after I.M. Sechenov (Sechenov University); e-mail: sukorceva.nataly@mail. ru, orcid.org/0000-0002-7704-1658.
D.S. Svyatoslavov – MD, PhD, Assistant of the Department of Plastic Surgery, medical oncologist, First Moscow State Medical University named after I.M. Sechenov (Sechenov University); e-mail: dssvyatoslavov78@mail.ru. orcid. org/0000-0003-0898-8693.
A.A. Shevalgin – mediacl oncologist, the First Moscow State Medical University named after I.M. Sechenov (Sechenov University); e-mail: doktor_kz@bk.ru, orcid.org/0000-0002-7045-554.
P.A. Nasilevsky – MD, medical oncologist, assistant at the Department of Oncology, Institute for Advanced Training of the Federal Medical and Biological Agency; e-mail: nassilevsky@mail.ru, orcid.org/0000-0001- 6747-0056.
Рецензия на статью
«TORS операции в лечении рака полости рта и ротоглотки». И.В. Решетов, Н.С. Сукорцева, Д.С. Святославов, А.А. Шевалгин, П.А. Насилевский
Статья посвящена актуальному вопросу лечения больных с опухолевой патологией органов головы и шеи – добиться излечения пациента используя современные достижения посредством минимального воздействия на окружающие ткани. Использование такого оборудования, как робот «Da Vinci» позволяет у больных с опухолями такой труднодоступной зоны как ротоглотка выполнить радикальное оперативное вмешательство без того, чтобы формировать травматичный операционный доступ и затем, в случае необходимости, выполнить реконструкцию дефекта.
В литературной справке авторы определяют состояние проблем лечения рака ротоглотки на сегодняшний день и возможности, показания и результаты роботических операций.
Собственный опыт авторов (10 операций) является на данный момент самым крупным в РФ и представляет интерес для специалистов, которые начинают заниматься данной проблемой. Авторами приведены показания методика, техника оперативных вмешательств и онкологические результаты.
Review on the article
TORS SURGERY IN THE TREATMENT OF ORAL CAVITY AND OROPHARYNGEAL TUMORS
I.V. Reshetov, N.S. Sukortseva, D.S. Svyatoslavov, A.A. Shevalgin, P.A. Nasilevsky
The article is dedicated to the topical issue of treating patients with head and neck tumor in order to achieve complete curing with the use of modern achievements and minimizing the surrounding tissues traumatization. Da Vinci robotic system allows to perform radical surgery in patients with malignancies of such a hard-to-reach zone as oropharynx without massive tissue traumatization and then, if necessary, to reconstruct the defect region.
Based on the literature data, the authors determine the current state of oropharyngeal cancer treatment problems and the opportunities, indications and results of robotic operations.
The authors’ own experience (10 operations) is currently the largest in the Russian Federation and is of great interest for specialists who are beginning to deal with this problem. The authors define the main indications for robotic surgery, describe the surgical technique and share the results.