Для цитирования: Габаидзе Д.И., Ипполитов Л.И. Спорные вопросы в диагностике и хирургическом лечении пациентов с «фолликулярной неоплазией» щитовидной железы. Голова и шея Head and neck Russian Journal. 2019;7(2):70–74
For citation: Gabaidze D.I., Ippolitov L.I. Controversial issues in the diagnosis and surgical treatment of patients with thyroid follicular neoplasia. Head and neck Russian Journal. 2019;7(2):70–74 (in Russian).
Doi: 10.25792/HN.2019.7.2.70–74
Актуальность.
Дооперационная морфологическая верификация новообразований щитовидной железы (ЩЖ) является основой для определения лечебной тактики. При фолликулярных опухолях возможности тонкоигольной аспирационной биопсии ограничены, характер опухоли не может быть однозначно установлен при цитологическом исследовании, а вероятность злокачественного поражения составляет 10–30%, что ставит хирургов-тиреоидологов перед сложным выбором объема операции. Для таких случаев крайне актуален поиск методов уточняющей дифференциальной диагностики, среди которых наиболее перспективным в настоящее время считается тестирование соматических мутаций. К сожалению, ни один из молекулярногенетических методов пока не нашел широкого клинического применения у этой категории больных.
Материал и методы. Проведено одноцентровое проспективное исследование, в которое были включены пациенты с дооперационным диагнозом «фолликулярная неоплазия ЩЖ», получившие различные варианты хирургического лечения в УКБ №1 ПМГМУ им. И.М.Сеченова с 2015 по 2017 г.
Результаты. Рак на дооперационном этапе был не распознан у 26 (15,5%) пациентов. На интраоперационном этапе злокачественное поражение в узле фолликулярной неоплазии было заподозрено и подтверждено у 13 (7,8%) пациентов, что повлекло расширение объема операции до гемитиреоидэктомии с лимфаденэктомией либо тиреоидэктомии с лимфаденэктомией. Всего выполнено 26 тиреоидэктомий, из них 17 с лимфаденэктомией. В 3 случаях подтвержден фолликулярный вариант папиллярного рака с метастазами в лимфоузлы.
Заключение. В настоящее время сохраняется реальный риск не распознать клинически значимый рак с метастазами в ходе первичной операции по поводу фолликулярной неоплазии, что, соответственно, может обусловить необходимость в повторной, более радикальной операции. Рекомендуем в случаях фолликулярной неоплазии (Bethesda IV) считать «золотым стандартом» гемитиреоидэктомию, в случаях обоснованной онкологической настороженности дополненную при первичной операции лимфаденэктомией на стороне поражения.
Ключевые слова: фолликулярная опухоль щитовидной железы, фолликулярная неоплазия, рак щитовидной железы, тонкоигольная аспирационная биопсия, соматические мутации, гемитиреоидэктомия, тиреоидэктомия лимфаденэктомия
Авторы заявляют об отсутствии конфликта интересов. Источник финансирования. Не указан.
Для цитирования: Габаидзе Д.И., Ипполитов Л.И. Спорные вопросы в диагностике и хирургическом лечении пациентов с «фолликулярной неоплазией» щитовидной железы. Голова и шея Head and neck Russian Journal. 2019;7(2):70–74
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц.
Background. Preoperative morphological verification of thyroid neoplasms is the basis for determining the treatment tactics. With follicular tumors, the possibilities for fine-needle aspiration biopsy are limited, the tumor nature often cannot be determined by cytology, while the probability of malignant lesion existence is about 10–30%; this makes the choice of surgery volume rather difficult. For such cases, the search for methods of specifying differential diagnosis is extremely relevant, among which testing of somatic mutations is currently considered the most promising. Unfortunately, none of the molecular genetic methods has yet found widespread clinical use for this category of patients.
Material and methods. A single-center prospective study was conducted, which included patients with thyroid follicular neoplasia diagnosed preoperatively, who underwent various types of surgical treatment in the clinical hospital of the 1st MSMU named after IM Sechenov from 2015 to 2017. Results. Malignancy was not detected in 26 (15.5%) patients preoperatively. Intraoperatively, malignant lesions in the follicular neoplasia focus was suspected and confirmed in 13 (7.8%) patients, which led to hemithyroidectomy or thyroidectomy with lymphadenectomy. Follicular type of papillary cancer with lymph nodes metastases was confirmed in 3 cases.
Conclusion. Currently, there is a real risk of not recognizing thyroid carcinoma during the primary surgery for follicular neoplasia, which may necessitate a repeated extended surgery. In cases of follicular neoplasia (Bethesda IV), we recommend to consider hemithyroidectomy as the “gold standard” of treatment.
Keywords: follicular thyroid tumor, follicular neoplasia, thyroid cancer, fine-needle aspiration biopsy, somatic mutations, hemithyroidectomy, thyroidectomy lymphadenectomy
The authors declare no conflict of interest. Source of financing: not specified.
For citation: Gabaidze D.I., Ippolitov L.I. Controversial issues in the diagnosis and surgical treatment of patients with thyroid follicular neoplasia. Head and neck Russian Journal. 2019;7(2):70–74 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients.
При обнаружении в щитовидной железе (ЩЖ) узловых образований одной из основных целей обследования является исключение рака ЩЖ. Единственным методом морфологической верификации узловых образований ЩЖ на дооперационном этапе является тонкоигольная аспирационная биопсия (ТАБ), служащая основой для определения лечебной тактики. К сожалению, в 10–30% случаев цитологическое исследование не позволяет однозначно установить характер новообразования ЩЖ. В группу изменений, подозрительных на злокачественные или неопределенные изменения, включают фолликулярные и гюртлеклеточные опухоли ЩЖ. Выделение этой группы опухолей является следствием ограниченных возможностей ТАБ в диагностике этих новообразований ЩЖ. Это происходит потому, что тиреоциты фолликулярных аденом и гиперпластических узлов по морфологическим характеристикам зачастую неотличимы от клеток фолликулярной карциномы и дифференцировать доброкачественные и злокачественные опухоли возможно лишь по экспансии в окружающие ткани или инвазии в сосуды. Трудности дифференциальной диагностики вызваны тем, что не во всех фолликулярных новообразованиях изменения ядер опухолевых клеток, характерные для папиллярной карциномы, могут быть настолько очевидными, чтобы считать их достаточными для диагноза фолликулярного варианта папиллярного рака, а признаки капсулярной и/или сосудистой инвазии абсолютно бесспорными для диагноза фолликулярной карциномы. Чувствительность ТАБ ЩЖ под ультразвуковым контролем, по мнению разных авторов, составляет 55–100%, специфичность – 50–90%, точность – 87–92%, частота ложноположительных результатов – 0–20%, ложноотрицательных – 2–95% [1–5]. Эта клинико-морфологическая дилемма создает серьезные проблемы для хирурга-тиреоидолога, определяющего стратегию лечения у больного фолликулярной опухолью (ФО). Ведь в большинстве случаев, речь идет о доброкачественной опухоли – фолликулярной аденоме. Определение характера ФО является сложнейшей диагностической проблемой, прежде всего, для морфолога. Трудности столь велики, что признанные специалисты в этой области называют фолликулярные поражения ЩЖ «погибелью (проклятием) для патолога» и «серой зоной цитологии при ТАБ» [2–5]. Именно поэтому фолликулярную аденому и фолликулярный рак объединяют термином «фолликулярная неоплазия». Частота встречаемости фолликулярной неоплазии составляет 10–15% среди всех узловых образований ЩЖ. Для цитологического исследования ЩЖ в 2007 г. была создана специальная классификация TBSRTC (The Bethesda System For Reporting Thyroid Cytopathology) [1]. Авторы системы Bethesda, конечно, не повысили достоверность цитологической диагностики. Тем не менее эта система улучшила взаимопонимание между врачами разных специальностей и предоставила более точное предположение о злокачественности. Статистическая классификация из Бетесды (город в штате Мэрилэнд, США) заменила потребность в термине «фолликулярная опухоль». С 2015 г. эта классификация начала активно применяться в России. Специалисты вправе использовать понятие «фолликулярная опухоль», но могут вместо него применить более точное обозначение, указав 3, 4 или 5 категорию по Bethesda, что соответствует 15%, 30 и 75% вероятности рака [1, 2].
В последние десятилетия предпринимались многочисленные попытки найти дополнительные критерии, которые позволили бы проводить дифференциальную диагностику между неоплазиями доброкачественного и злокачественного характера. Исследования касались, прежде всего, возможностей использования иммуногистохимических и молекулярно-генетических методов, наиболее обнадеживающие результаты по последним данным получены при мутационном тестировании [2–4]. Соматические мутации генов TSHR и GNAS часто встречаются при автономно функционирующих доброкачественных узлах ЩЖ, хотя определенные точечные мутации гена TSHR связаны с фолликулярной карциномой ЩЖ [16, 17]. Для диагностики фолликулярных неоплазий (цитологическое заключение соответствует категории Bethesda IV) на сегодняшний день предложена диагностическая панель из 7 генов: BRAF, KRAS, HRAS, NRAS, RET/PTC1, RET/PTC3, PAX8/PPARγ с чувствительностью 57–75% и специфичностью 97–100% [10–15].
В случае категории, соответствующей критериям Bethesda III, может быть использована молекулярно-генетическая панель с определением BRAF, NRAS, HRAS, KRAS, RET/PTC1, RET/ PTC3, PAX8/PPARγ мутаций, которая имеет значительно более высокую чувствительность в определении злокачественного потенциала (63–80%) по сравнению с простым цитологическим исследованием (5–15%). Узлы из диагностической категории Bethesda III с точечной мутацией BRAF V600E и перестановкой генов RET/PTC или PAX8/PPARγ имеют более 95% риска злокачественности. При подозрении на папиллярный РЩЖ (Bethesda V) может быть исследован ген BRAF (чувствительность – 36%, специфичность – 100%) или панель генов BRAF, RAS, RET/ PTC, PAX8/PPARγ (чувствительность 50–68%, специфичность 86–96%) [5]. Однако, несмотря на прорыв в области молекулярной диагностики, в настоящее время не существует единого оптимального молекулярно-генетического анализа, который может окончательно исключить злокачественность новообразования во всех случаях неопределенного цитологического заключения [5]. Мнение морфологов и клиницистов о целесообразности интраоперационного срочного гистологического исследования полученного материала по замороженным срезам для уточнения характера опухоли при фолликулярной неоплазии также неоднозначно и чаще отрицательно [2, 5]. К сожалению, до сих пор ни один из указанных молекулярно-генетических методов не вышел за стадию лабораторных исследований и не нашел широкого клинического применения. Учитывая, что в группе фолликулярных неоплазий злокачественные опухоли составляют от 15 до 30%, в настоящее время подавляющее большинство специалистов все еще не располагают достаточными возможностями провести дифференциальную диагностику между злокачественной и доброкачественной ФО и придерживаются активной тактики в отношении этой категории больных, производя оперативное вмешательство всем больным с диагнозом ФО, при этом нередко – лишь с диагностической целью. В связи с этим хирургическое вмешательство на ЩЖ остается, как минимум, диагностическим стандартом лечения при подозрении на злокачественное новообразование.
Материал и методы
Нами изучены результаты хирургического лечения 167 больных (151 женщина и 16 мужчин), оперированных в период с 2015 по 2017 г. в онкологическом хирургическом отделении комбинированных методов лечения УКБ №1 ПМГМУ им. И.М. Сеченова по поводу ФО ЩЖ, классифицированной при ТАБ как «фолликулярная неоплазия» (Bethesda IV). У всех пациентов, включенных в исследование, до вмешательства исследовали уровни тиреотропного гормона (ТТГ), тетра- и трийодтиронина, антител к тиреоидной пероксидазе, кальцитонина, ТАБ узлов ЩЖ под контролем УЗИ. Операции выполняли с обязательной визуализацией возвратных гортанных нервов и околощитовидных желез. Заключительный клинический диагноз ставился по результатам планового патогистологического исследования (ПГИ).
Результаты
Согласно общепринятой методике, всем больным до операции выполняли УЗИ области ЩЖ и зон регионарного лимфооттока. Солитарная (одиночная) ФО была выявлена в 113 (67,6%) случаях, ФО в сочетании с многоузловым коллоидным зобом (МУКЗ) – у 37 (22,1%) пациентов, ФО на фоне хронического аутоиммунного тиреоидита (ХАИТ) – у 17 (10,3%) больных. Оценку состояния ЩЖ проводили с учетом протокола Thirads – ультразвуковая классификация узлов ЩЖ, учитывали такие факторы, как близость расположения узла в доле к капсуле ЩЖ, признаки аутоиммунного тиреоидита, а также состояние регионарных лимфатических узлов. У большинства пациентов – 124 (74,2%) – ФО локализовалось в непосредственной близости к капсуле ЩЖ, у 11 (6,6%) – на границе с перешейком, в 32 (19,2%) случаях узел располагался в центре доли. Полипозиционная ТАБ под УЗ-контролем была выполнена в дооперационном периоде всем 167 пациентом. Следует отметить, что 13 (7,8%) больным было проведено срочное гистологическое исследование в связи с интраоперационными «находками» (плотность, цвет), уточнена локализация узла, (данные УЗИ об инвазии в капсулу ЩЖ), что позволило установить диагноз рака и расширить объем операции в 3 случаях до тиреоидэктомии с центральной и боковой лимфодиссекцией (II–VI группа на стороне поражения), а в 10 случаях ограничиться гемитиреоидэктомией с резекцией перешейка и центральной лимфодиссекцией. Распределение больных по объему операции выглядело следующим образом (см. таблицу):
- гемитиреоидэктомия с резекцией перешейка – 109 (65%) случаев;
- гемитиреоидэктомия с резекцией перешейка+пре- и паратрахеальной клечатки – 32 (19,1%) случая;
- тиреоидэктомия – 9 (5,3%) случаев;
- тиреоидэктомия+центральная лимфодиссекция – 17 (10%) случаев.
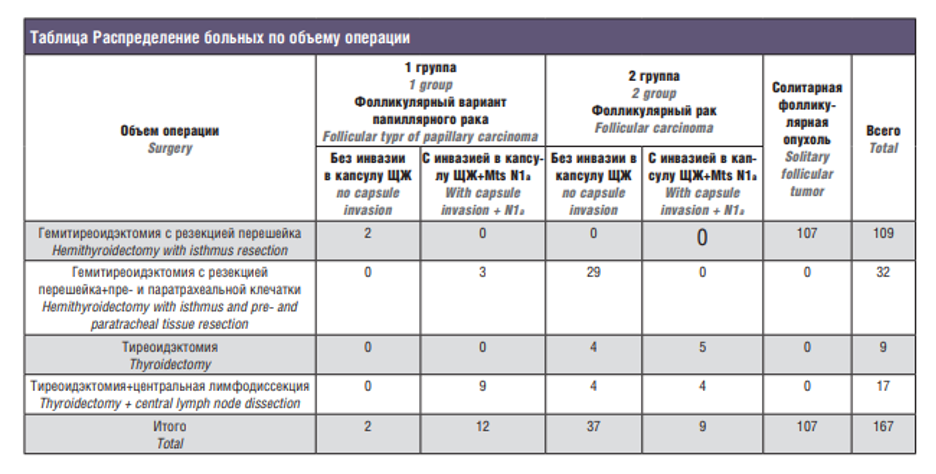
По результатам ПГИ у 26 (15,5%) пациентов результаты ТАБ оказались ложноотрицательными: в узлах фолликулярной неоплазии выявлено злокачественное поражение ЩЖ, из них в 18 (70%) случаях (первая группа) выявлен фолликулярный вариант папиллярного рака, а в 8 случаях (30%) (вторая группа) выявлен фолликулярный рак. У 9 (50%) пациентов с папиллярным раком (первая группа) имело место субкапсулярное расположение узла, по данным УЗИ до операции. Также в результате ПГИ выявлены инвазия в капсулу железы и метастазы в преи паратрахеальные лимфоузлы. Среди пациентов первой группы (фолликулярный вариант папиллярного рака) в 5 случаях были больные с клиническим диагнозом ФО в сочетании с МУКЗ, которым была выполнена тиреоидэктомия. При этом, по данным ПГИ, у них была диагностирована микрокарцинома, которая локализовалась в коллоидных узлах либо на стороне поражения, либо в другой доле железы. У 4 пациентов второй группы фолликулярный рак диагностирован на фоне ХАИТ.
Таким образом, рак на дооперационном этапе не был распознан у 26 (15,5%) пациентов.
Следует отметить, что у всех 13 пациентов, которым было выполнено срочное гистологическое исследование, по данным ПГИ также был подтвержден диагноз основного заболевания.
Выводы
1)Современные возможности УЗИ-диагностики позволяют с высокой степенью достоверности до операции выявить инвазию узла в капсулу ЩЖ.
2) Среди 167 больных с клиническим диагнозом фолликулярная опухоль Bethesda IV в 15,5% диагностирован высокодифференцированный рак ЩЖ.
3) В случаях фолликулярного варианта папиллярного рака более чем в 50% случаев диагностируются метастазы в пре- и паратрахеальные лимфоузлы первого порядка N1a.
4) Среди 17 больных с клиническим диагнозом аутоиммуный тиреоидит в 24% (n=4) диагностирован фолликулярный рак.
Заключение
Учитывая вышесказанное, хочется сказать, что на фоне наметившейся в последнее время у различных авторов тенденции к органосохраняющим операциям (субтотальная резекция доли, расширенная биопсия) сохраняется реальный риск не распознать клинически значимый рак с метастазами в ходе первичной операции по поводу фолликулярной неоплазии, что соответственно может обусловить необходимость в повторной, более радикальной операции и, как следствие, создать условия для возникновения таких общеизвестных в хирургической тиреоидологии осложнений, как повреждение гортанных нервов, послеоперационный гипопаратиреоз, кровотечение. Также нельзя сбрасывать со счетов психоэмоциональный стресс теперь уже онкологического пациента при повторной операции, снижение его трудоспособности. Подытоживая вышесказанное, рекомендуем в случаях фолликулярной неоплазии (Bethesda IV) считать «золотым стандартом» гемитиреоидэктомию, в случаях обоснованной онкологической настороженности дополненную при первичной операции лимфаденэктомией на стороне поражения.
ЛИТЕРАТУРА/REFERENCES
- Ali S.Z., Cibas E.S. The 2017 Bethesda System for Reporting Thyroid Cytopathology. J. Am. Soc. Cytopathol. 2017;6:217–22. doi: 10.1016/j. jasc.2017.09.002.
- Haugen B.R., Alexander E.K., Bible K.C., et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016;26:1–133. doi: 10.1089/thy.2015.0020.
- Hsiao S.J., Nikiforov Y.E. Molecular Approaches to Thyroid Cancer Diagnosis. Endocr. Relat. Cancer. 2014;21(5):T301–T313. doi: 10.1530/ERC-14-0166.
- Wei X., Li Y., Zhang S., Gao M., Meta-analysis of thyroid imaging reporting and data system in the ultrasonographic diagnosis of 10,437 thyroid nodules. Head Neck. 2016;38(2):309–15. doi: 10.1002/hed.23878.
- Бельцевич Д.Г., Ванушко В.Э., Румянцев П.О. и др. Российские клинические рекомендации по диагностике и лечению высокодифференцированного рака щитовидной железы у взрослых, 2017 г. Эндокринная хирургия. 2017;11(1):6–27. doi: 10.14341/serg201716-27. [Beltsevich D.G., Vanushko V.E., Rumyantsev P.O., et al. 2017 Russian clinical practice guidelines for differentiated thyroid cancer diagnosis and treatment. Endocrine Surgery. 2017;11(1):6–27. doi: 10.14341/serg201716-27 (In Russ)].
- Agrawal N., Jiao Y., Sausen M., et al. Exomic sequencing of medullary thyroid cancer reveals dominant and mutually exclusive oncogenic mutations in RET and RAS. J. Clin. Endocrinol. Metab. 2013;98:364–9. doi:10.1210/jc. 2012-2703.
- Rossi M., Buratto M., Tagliati F., et al. Relevance of BRAF(V600E) mutation testing versus RAS point mutations and RET/PTC rearrangements evaluation in the diagnosis of thyroid cancer. Thyroid. 2015;25(2): 221–8. doi:10.1089/ thy.2014.0338.
- Seo J.Y., Kim E.K., Kwak J.Y. Additional BRAF mutation analysis may have additional diagnostic value in thyroid nodules with “suspicious for malignant” cytology alone even when the nodules do not show suspicious US features. Endocrine. 2014;47(1):283–9. doi:10.1007/s12020- 013-0150-5.
- Koh J., Choi J.R., Han K.H., et al. Proper indication of BRAF(V600E) mutation testing in fine-needle aspirates of thyroid nodules. PLoS One. 2013;8(5):e64505. doi:10.1371/journal.pone.0064505.
- Gandolfi G., Ragazzi M., Frasoldati A., Piana S., Ciarrocchi A., Sancisi V. TERT promoter mutations are associated with distant metastases in papillary thyroid carcinoma. Eur. J. Endocrinol. 2015; 172:403–13. doi: 10.1530/EJE14-0837.
- Liu X., Qu S., Liu R., Sheng C., Shi X., Zhu G., Murugan A.K., Guan H., Yu H., Wang Y., et al. TERT promoter mutations and their association with BRAF V600E mutation and aggressive clinicopathological characteristics of thyroid cancer. J. Clin. Endocrinol. Metab. 2014;99:1130–6. doi: 10.1210/ jc.2013-4048.
- Liu, T., Yuan, X., & Xu, D. (2016). Cancer-Specific Telomerase Reverse Transcriptase (TERT) Promoter Mutations: Biological and Clinical Implications. Genes;7(7):38. doi:10.3390/genes7070038.
- Karunamurthy A., Panebianco F., Hsiao S., et al. Prevalence and phenotypic correlations of EIF1AX mutations in thyroid nodules. Endocr. Relat. Cancer. 2016;23(4):295–301. doi:10.1530/ERC16-0043.
- Molecular pathogenesis and mechanisms of thyroid cancer. Nat. Rev. Cancer. 2013;13(3):184–99. doi:10.1038/nrc3431.
- Oncogenesis of Thyroid Cancer. Asian Pac. J. Cancer Prev. 2017;18(5):1191– 9. doi:10.22034/APJCP.2017.18.5.1191.
- COSMIC [Internet]. Catalogue Of Somatic Mutations In Cancer [cited 2018 Dec 12]. Available from: https://cancer.sanger.ac.uk/cosmic. 17. EnsEMBL [Internet]. Genome browser [cited 2018 Dec 12]. Available from: http://www.ensembl.org.
Поступила 01.03.19
Принята в печать 01.04.19
Received 01.03.19
Accepted 01.
Информация об авторах:
Д.И. Габаидзе – ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава РФ (Сеченовский университет), Москва, Россия; е-mail: giagabaidze@mail.ru. ORCID 0000-0002-2812-9880
Л.И. Ипполитов – к.м.н., ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава РФ (Сеченовский университет), Москва, Россия
About the authors:
- Gabaidze – FSAEI the First MSMU named after I.M. Sechenov Ministry of Health of Russia (Sechenov University), Moscow, Russia; е-mail: giagabaidze@ mail.ru. ORCID 0000-0002-2812-9880
L.I. Ippolitov – MD, Ph.D, FSAEI the First MSMU named after I.M. Sechenov Ministry of Health of Russia (Sechenov University), Moscow, Russia04.18
