Для цитирования: Решетов И.В., Святославов Д.С., Самойлова С.И., Долголев А.А., Гареев А.Ф., Рубан К.М. Экспериментальное исследование репаративного остеогенеза при использовании титановых имплантатов. Голова и шея Head and neck Russian Journal. 2018;6(3):6–11
For citation: Reshetov I.V., Svyatoslavov D.S., Samoilova S.I., Dolgolev A.A., Gareev A.F., Ruban K.M. An experimental study of reparative osteogenesis with titanium implants use. Голова и шея Head and neck Russian Journal. 2018; 6(2):6–11 (in Russian).
Doi: 10.25792/HN.2018.6.3.6–11
В ходе эксперимента произведено вживление титановых имплантатов (опытных образцов), полученных по технологии селективного лазерного спекания (SLS) с использованием 3D-принтера. Имплантаты вживлялись в тело нижней челюсти кроликов. С целью изучения процессов репаративного остеогенеза были анализированы микропрепараты тканей периимплантационной зоны. В результате были выявлены признаки остео- и фибро-остеоинтеграции, что можно расценивать как предпосылку для дальнейших клинических испытаний титана данной марки.
Ключевые слова: репаративный остеогенез, титановый имплантат (опытный образец)
Авторы заявляют об отсутствии конфликта интересов. Источник финансирования. Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации, субсидия на реализацию комплексных проектов по созданию высокотехнологичного производства в рамках реализации постановления Правительства Российской Федерации от 9 апреля 2010 г. №218, очередь 8 по теме «Создание высокотехнологичного цифрового производства прецизионных металлических комплексов для имплантации на базе аддитивных технологий», номер соглашения 03.G25.31.0234 от 03.03.2017.
Для цитирования: Решетов И.В., Святославов Д.С., Самойлова С.И., Долголев А.А., Гареев А.Ф., Рубан К.М. Экспериментальное исследование репаративного остеогенеза при использовании титановых имплантатов. Голова и шея Head and neck Russian Journal. 2018;6(3):6–11
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
During the experiment the implantation of titanium implants (prototypes) obtained by the technology of selective laser sintering (SLS) using a 3D printer was made. Implants were placed into the rabbits’ mandible bodies. In order to study the processes of reparative osteogenesis, microsamples of periimplantation zone tissues were analyzed. As a result, signs of osteo- and fibro-osseointegration were identified, which can be regarded as a prerequisite for further clinical trials with titanium of this brand.
Keywords: reparative osteogenesis, titanium implant (prototype)
The authors declare no conflict of interest. Source of financing.
The work was financially supported by the Ministry of Education and Science of the Russian Federation, a subsidy for the implementation of complex projects for the creation of high-tech production as part of the implementation of the Government Decree from April 9, 2010 No. 218, line 8 on the topic “Creating high-tech digital production of precision metal complexes for implantation based on additive technologies ”, agreement number 03.G25.31.0234 of 03.03.2017.
For citation: Reshetov I.V., Svyatoslavov D.S., Samoilova S.I., Dolgolev A.A., Gareev A.F., Ruban K.M. An experimental study of reparative osteogenesis with titanium implants use. Голова и шея Head and neck Russian Journal. 2018; 6(2):6–11 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients.
Введение
Сегодня вопросы лечения пациентов с дефектами и деформациями челюстно-лицевой области приобретают особую актуальность. Это связано как с ростом числа пациентов с дефектами и деформациями нижней зоны лица вследствие травм (неогнестрельного и огнестрельного ранений), так и с ростом онкологической заболеваемости. Сегодня в структуре смертности населения России злокачественные новообразования занимают второе место (15,6%; 2015) после болезней системы кровообращения, опередив травмы и отравления. Показатель смертности населения России от злокачественных новообразований в 2016 г. составил 201,6 на 100 тыс. населения, за 10-летний период данный показатель достоверно не изменился. При этом за последние 10 лет существенно выросла заболеваемость раком слизистой оболочки полости рта – с 4,49 до 6,12 на 100 тыс. населения, что соcтавило 34,5% прироста данной патологи за 10 лет. Абсолютное число впервые выявленных пациентов со злокачественными опухолями полости рта в 2015 г. составило 6 286 человек [1].
В восстановительной хирургии дефектов и деформаций челюстно-лицевой области за последние 50 лет хорошо описаны способы применения аваскулярных аутотрансплантатов, формалинизированных или лиофилизированных аллотрансплантатов, а также их комбинация (аутоаллотрансплантаты), или комбинированная остеопластика. С развитием цифровых технологий диагностики и планирования лечения, адекватных методов обезболивания, применением во время вмешательства современного оборудования, основанного на методах пьезохирургии, применением хирургами во время вмешательства оптических устройств с адекватным освещением выполнение таких вмешательств перестало быть сложной задачей и на первое место выходят проблемы, связанные с недостатками этих методов. К ним относятся: высокий риск отторжения, частая резорбция таких трансплантатов, трудности реабилитации таких пациентов современными ортопедическим конструкциями. Кроме того, после огнестрельных ранений и оперативного удаления злокачественных опухолей наряду с дефектом нижней челюсти образуются обширные дефекты мягких тканей лица, что требует сегодня новых подходов при восстановлении [2].
Сегодня лечение дефектов и деформаций челюстно-лицевой области строятся на принципах предсказуемости и персонализации лечения. Основными этапами такого лечения являются цифровая диагностика; виртуальное планирование лечения, основанное на использовании результатов цифровой диагностики, подбор материала для 3D прототипирования имплантата, замещающего дефект, прототипирование данного имплантата методом фрезерования или 3D печати, установка имплантата и контроль функциональной нагрузки.
Целью нашей работы явилось экспериментальное гистологическое обоснование применения титановых имплантатов марки ВТ 1-0 для оптимизации процессов остеоинтеграции.
Материал и методы
Экспериментальные исследования выполнены на 4 кроликах породы Шиншила массой 2,5–3 кг (1 самка и 3 самца). Все животные содержались в стандартных условиях вивария Сеченовского университета на полноценной диете и были одного возраста. Все эксперименты содержание животных и вывод их из эксперимента осуществляли в соответствии с правилами лабораторной практики Российской Федерации №267 от 2003 г. и стандартом GLP.
Животным на базе малой операционной вивария Сеченовского университета были вживлены титановые имплантаты (опытные образцы), полученные по технологии селективного лазерного спекания (SLS) с использованием 3D-принтера.
Имлантаты (опытные образцы) подразделялись на 4 вида: центральная часть с отверстиями с размером ячеек в зонах остеоинтеграции 600–800 и 600–1000 мкм и центральная часть балочная с размерами ячеек 600–800 и 600–1000 мкм рис. 1, 2.
Имплантаты в рамках научного проекта: «Создание высокотехнологичного цифрового производства прецизионных металлических комплексов для имплантации на базе аддитивных технологий», номер соглашения 03.G25.31.0234 от 03.03.2017 предоставила Госкорпорация «Росатом» (табл. 1).
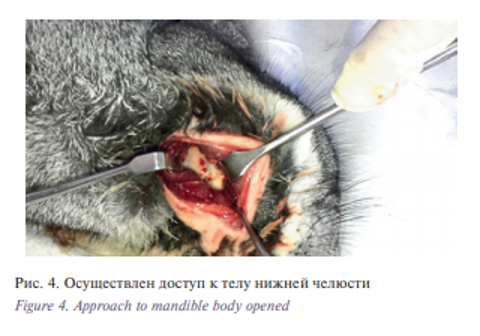
Использованные методы: световая микроскопия декальцинированных объектов (окраска парафиновых срезов гематоксилином Майера и эозином, пикрофуксином по Ван Гизону. Кроликам под комбинированным наркозом Рометар 0,25 в/м 0,05–0,1 на 1 кг массы тела и «Золетил» по 1–2 мг/кг по ДВ после подготовки и обработки операционного поля дополнительно инфильтрационной анестезией раствором «Ультракаин Д-С» форте 1:100000 – 1,7 скальпелем производился разрез до 3,0 см последовательно: кожи, жевательной мышцы. После подготовки операционного поля – рис. 3 отсепарована надкостница – т.о. осуществлен доступ к телу нижней челюсти (рис. 4).
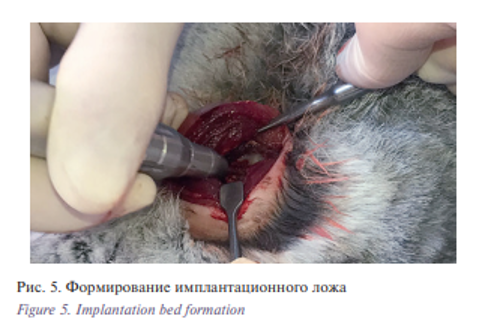
Бормашиной формировалось имплантационное ложе, соответствующее размерам имплантата 10 мм в длину и 5 мм в глубину (рис. 5).
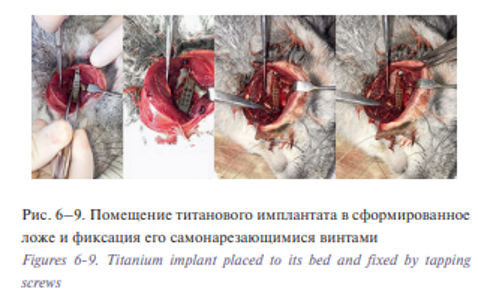
Работа бором осуществлялась прерывистыми движениями с использованием водяного охлаждения для предотвращения ожога костной ткани и развития вследствие этого осложнений. Титановый имплантат аккуратно помещался в сформированный ложе и фиксировался с двух сторон самонарезающимися винтами рис. 6–9.
После антисептической обработки рана над титановым имплантатом послойно ушивалась наглухо рассасывающимся шовным материалом рис. 10.
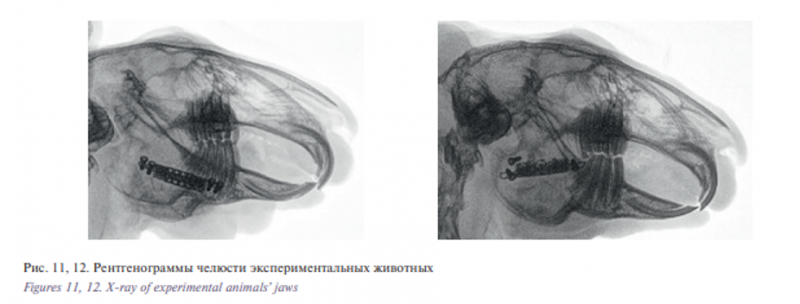
Все животные перенесли операцию и наблюдались в виварии в ходе всего эксперимента. В трех случаях раны зажили первичным натяжением. В одном случае наблюдалось нарастание костной ткани на боковую поверхность имплантата, и еще в одном случае развились реактивные изменения тканей, которые потребовали хирургической обработки рис. 11, 12.
На R-граммах челюсти с фиксированным титановым имплантатом в аксиальной и боковой проекциях очагов деструкции костной ткани в периимплантационной зоны и патологических изменений в твердых тканях не было обнаружено. Через 3 месяца животные выводились из опыта летальной дозой эфира. Выделялся сегмент нижней челюсти с вживленным имплантатом. Интегрированный в костную ткань титановый имплантат подвергался исследованию в лаборатории (независимой) патологоанатомического отделении НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава Росси. Были изучены места контакта поверхности имплантата с костной тканью при 100- и 400-кратном увеличении, где можно было наблюдать плотный контакт на границе кость/имплантат.
После механического разделения имплантата из фрагмента костной ткани были изучены участки: под увеличением в 400 раз наблюдались фрагменты костной ткани, плотно сросшиеся с поверхностью имплантата.
Фрагменты нижней челюсти были декальцинированы и подвергнуты однотипной гистологической обработке: окраска парафиновых срезов гематоксилином Майера и эозином пикрофуксином по Ван-Гизону.
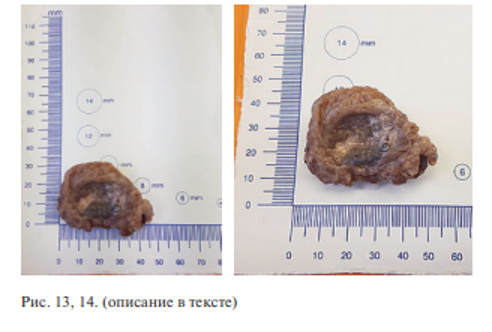
Из заключения врача-патологоанатома: «Были анализированы четыре фрагмента костной ткани размерами 4,0–3,0–1,5 см с металлическим имплантатом с мелкосетчатой поверхностью» (рис. 13, 14).
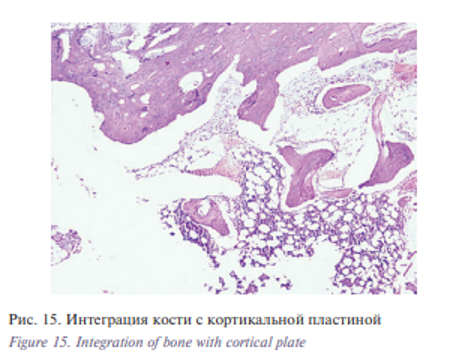
Во всех четырех случаях латеральные края титановых имплантатов были плотно фиксированы к костной ткани, ячейки имплантата заполнены костной тканью. Краевые зоны плотно сращены с костной и окружающей фиброзно-мышечной тканью (рис. 15).
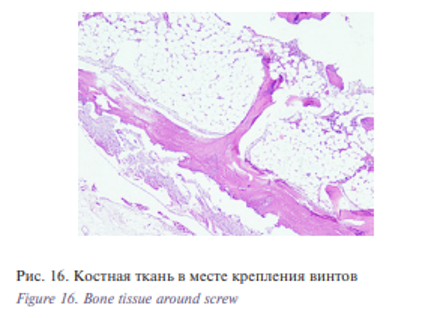
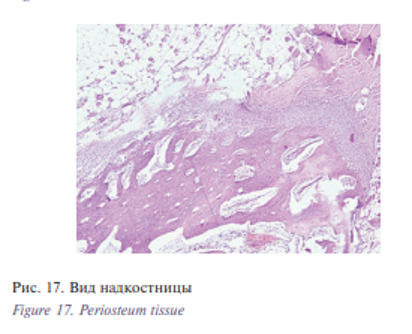
При микроскопическом исследовании фрагментов костной ткани в месте крепления винтов титанового имплантата нет признаков гранулематозного воспаления (рис. 16).м Губчатая кость с неравномерно утолщенной надкостницей и кортикальным слоем. Имеются небольшие участки лакунарной резорбции костных балок, в костномозговых ячейках – костный мозг, рис. 17.
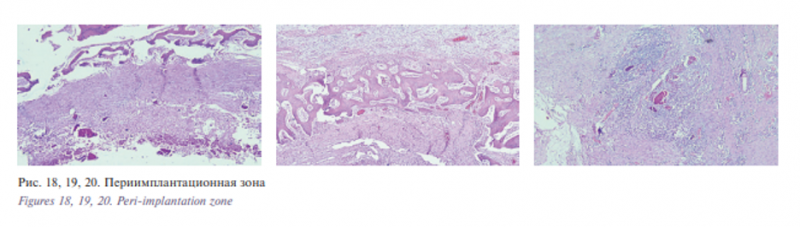
В периимплантационной зоне имеется слой плотной фиброзной ткани с фибробластами и формированием волокнистых структур, имеющих трабекулярное строение; незрелой костной ткани, имеющей петлистую структуру. Далее виден слой формирующихся костных балочек с большим количеством остеобластов по их периферии. Остеобласты имеют цилиндрическую форму, с крупными темными ядрами. Зон энхондрального окостенения нет. Широко идет процесс перестройки незрелой кости. По краям новых костных трабекул выявляются остеокласты рис. 18, 19, 20.
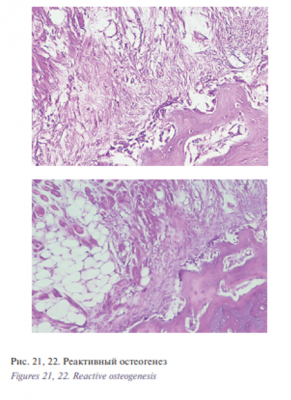
Пространство между трабекулами заполнено сетчатой ретикулярной тканью с расположенными в ней сосудами. В краевой зоне – в фиброзно-мышечной ткани имеются участки продуктивного воспаления вокруг небольших фрагментов костной ткани, рис. 21, 22.
Предварительные результаты позволяют заключить, что во всех 4 случаях установлен непосредственный контакт костной ткани с титановым имплантатом, что следует расценить как остеоинтеграцию. Также имеются участки реорганизации тканей нижней челюсти на поверхности раздела имплантат/кость с признаками фиброзно-костной интеграции.
ЛИТЕРАТУРА
1.Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2016 г. (заболеваемость и смертность). Москва. 2017.
- Вербо Е.В., Неробеев А.И. Реконструкция лица реваскуляризированными аутотрансплантатами. 2008.
Поступила 21.07.18
Принята в печать 23.08.18
REFERENCES
- Kaprin A.D., Starinsky V.V., Petrova G.V. Malignant neoplasms in Russia in 2016
- Verbo E.V., Nerobeev A.I. Facial reconstruction with revascularized autografts. 2008
Received 21.07.18 Accepted 23.08.18
Информация об авторах:
И.В. Решетов– д.м.н., профессор, академик РАН, заведующий кафедрой онкологии и реконструктивной хирургии лечебного факультета Первого МГМУ им. И.М. Сеченова (Сеченовский университет), заведующий кафедрой онкологии и пластической хирургии Института повышения квалификации Федерального медико-биологического агентства, Москва, Россия; e-mail: reshetoviv@mail.ru, orcid.org/0000-0002- 0580-7052
Д.С. Святославов – к.м.н., доцент кафедры онкологии и реконструктивной хирургии, врач-онколог, Первый МГМУ им. И.М. Сеченова (Сеченовский университет), Москва, Россия; e-mail: dssvyatoslavov78@mail.ru. orcid. org/0000-0003-0898-8693
С.И. Самойлова – врач патологоанатомического отделения НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России, Москва, Россия; e-mail: sv_samoilova75@mail. ru, orcid.org/0000-0003-2746-8554
А.А. Долгалев – д.м.н., доцент кафедры стоматологии общей практики и детской стоматологии Ставропольского государственного медицинского университета, Ставрополь, Россия; e-mail: dolgalev@dolgalev.pro
А.Ф. Гареев – аспирант кафедры онкологии и реконструктивной хирургии Первого МГМУ им. И.М. Сеченова (Сеченовский университет), Москва, Россия; e-mail: arturgareev1989@gmail.com
К.М. Рубан – аспирант кафедры онкологии и реконструктивной хирургии Первого МГМУ им. И.М. Сеченова (Сеченовский университет), Москва, Россия; e-mail: kirill200896@gmail.com
About the authors:
I.V. Reshetov – MD, Professor, Academician of the Russian Academy of Sciences, Head of the Department of Oncology and Reconstructive Surgery at the Medical Faculty of the First MSMU named after I.M. Sechenov (Sechenov University), Head of the Department of Oncology and Plastic Surgery at the Institute for Advanced Studies of the Federal Medical-Biological Agency, Moscow, Russia; e-mail: reshetoviv@mail.ru, orcid.org/0000-0002- 0580-7052
D.S. Svyatoslavov – MD, PhD, Associate Professor of the Department of Oncology and Reconstructive Surgery, oncologist, First Moscow State Medical University named after I.M. Sechenov (Sechenov University), Moscow, Russia; e-mail: dssvyatoslavov78@mail.ru. orcid.org/0000-0003-0898-8693
S.I. Samoilov – MD, Pathology Department of the Institute of Urology and Interventional Radiology named after N.A. Lopatkin – a branch of the FSBI “NMRC of Radiology” of the Ministry of Health of Russia, Moscow, Russia; e-mail: sv_samoilova75@mail.ru, orcid.org/0000-0003- 2746-8554
A.A. Dolgalev — MD, Associate Professor at the Department of General Practice of Dentistry and Pediatric Dentistry of Stavropol State Medical University, Stavropol, Russia; e-mail: dolgalev@dolgalev.pro
A.F. Gareev — postgraduate student of the Department of Oncology and Reconstructive Surgery of the First MSMU named after I.M. Sechenov (Sechenov University), Moscow, Russia; e-mail: arturgareev1989@gmail.com KM Ruban — postgraduate student, Department of Oncology and Reconstructive Surgery, First Moscow State Medical University named after I.M. Sechenov (Sechenov University), Moscow, Russia; e-mail: kirill200896@gmail.com
Рецензия на статью
«ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ РЕПАРАТИВНОГО ОСТЕОГЕНЕЗА ПРИ ИСПОЛЬЗОВАНИИ ТИТАНОВЫХ ИМПЛАНТАТОВ»
Статья посвящена одной из наиболее актуальных проблем современной челюстно-лицевой хирургии и стоматологии – поиску оптимального материла для замещения протяжных дефектов костей лицевого скелета. В последнее время разработаны современные технологии инжекционного формования (MIM), горячего изостатического прессования (HIP) и селективного лазерного спекания (SLS), которые позволяют наладить массовый выпуск имплантатов нового поколения.
Синтезируемые металлокомпозитные комплексы (МКИ), созданные методом SLS с использованием 3D-принтера, по сравнению с ауто-, алло-, ксено- и синтетическими (на основе солей кальция) трансплантатами обладают рядом преимуществ – отсутствием риска передачи от донора к реципиенту различных заболеваний бактериальной или вирусной этиологии, возможности развития реакции гистонесовместимости и хронического гранулематозного воспаления, значительным удешевлением метода за счет отсутствия необходимости хранить МКИ в условиях специализированного донорского костного банка и главное – наличием у МКИ свойств остеоиндукции с учетом пористой структуры – обеспечение остеоинтеграции. Приведенные в статье данные наглядно показывают, что спустя 3 мес. наблюдения при гистологическом исследовании препаратов удалось наглядно показать гистологически подтвержденную остеоинтеграцию опытных образцов в кости лабораторых животных.
Review on the article
“AN EXPERIMENTAL STUDY OF REPARATIVE OSTEOGENESIS WITH TITANIUM IMPLANTS USE”
The article is dedicated to one of the most pressing problems of modern maxillofacial surgery and dentistry – the search for the optimal material for replacing the vast and extended bone defects in the facial skeleton. Recently, modern injection molding (MIM), hot isostatic pressing (HIP), and selective laser sintering (SLS) technologies have been developed, which allow mass production of new generation implants.
Metal composite complexes (MKC) synthesized with the use of SLS method with 3D printing have several advantages as compared to auto, allo, xeno and synthetic (based on calcium salts) grafts that are: no risk of various bacterial and viral infection transmission from the donor to the recipient with possible histocompatibility and chronic granulomatous inflammation development; a significant cost reduction (no need to store MKI in a specialized donor bone bank); and the most important is that MKI possess an osteoinduction properties, taking into account the porous structure, providing osteointegration. The data presented in the article clearly show that after 3 months of observations it was possible to demonstrate histologically confirmed osseointegration of experimental samples into laboratory animal bones.