Для цитирования: Кононец П.В., Новожилова Е.Н., Матвеев Д.А., Чумаков И.Ф., Сороколетов А.В., Строяковский Д.Л., Шивилова М.Ю., Каннер Д.Ю. Резекция глотки и шейного отдела пищевода с сохранением гортани при раке устья пищевода. Голова и шея Head and neck Russian Journal. 2018;6(2):35–41
For citations: Kononets P.V., Novozhilova E.N., Matveev D.A., Chumakov I.F., Sorokoletov A.V., Stroyakovsky D.L., Shivilova M.Yu., Kanner D.Yu. Pharynx and upper third of esophagus resection with laryngeal preservation in case of esophageal entrance tumor. Golova I Sheya Head and neck Russian Journal. 2018;6(2):35–41 (in Russian).
Doi: 10.25792/HN.2018.6.2.35–41
Рак устья пищевода у 70–80% больных выявляют в запущенных III–IV стадиях, когда имеется распространение на гортаноглотку и/или гортань. Заболевание характеризуется высокой частотой метастазирования и агрессивным течением. Учитывая анатомическую сложность этой зоны (перекрест пищепроводных и дыхательных путей, сложные рефлекторные механизмы), большинство авторов рассматривают ларингофарингэктомию с круговой резекцией глотки и пищевода как единственный способ хирургического лечения для данной категории больных. В настоящее время в литературе описаны различные способы восстановления пищепроводного пути (за счет лоскутов с осевым кровоснабжением, с использованием висцеральных трансплантатов-сегментов – кишки или желудка). Но проблема сохранения речи у больных этой категории является весьма актуальной. Существуют способы восстановления голосовой функции у больных после ларингофарингэктомии при помощи голосовых протезов, но качество речи при этом не столь высокое, поскольку удаляется глоточно-пищеводный сегмент, а складки кишки не способны хорошо вибрировать. Нами был разработан и апробирован способ выполнения обширной резекции глотки и шейного отдела пищевода у больной раком устья пищевода. При этом удалось восстановить пищепроводный путь за счет тонкокишечного трансплантанта на микросоудистых анастомозах, сохранить гортань и обеспечить высокое качество жизни пациентки.
Ключевые слова: рак устья пищевода, рак гортаноглотки, сохранение гортани, восстановление пищепроводного пути при резекции глотки и пищевода.
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Кононец П.В., Новожилова Е.Н., Матвеев Д.А., Чумаков И.Ф., Сороколетов А.В., Строяковский Д.Л., Шивилова М.Ю., Каннер Д.Ю. Резекция глотки и шейного отдела пищевода с сохранением гортани при раке устья пищевода. Голова и шея Head and neck Russian Journal. 2018;6(2):35–41
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Esophageal entrance cancer is often detected in locally advanced or advanced stage III–IV in 70–80% of patients, when a spread to the laryngopharynx and / or larynx does exist. The disease is characterized by aggressiveness and a high incidence of metastases. Given the anatomical complexity of this zone (the intersection of the esophagus and respiratory tracts, complex reflex mechanisms), most authors consider laryngopharyngectomy with circular resection of the pharynx and esophagus as the only method of surgical treatment for this category of patients. Currently, the literature describes various ways of the alimentary tract restoration (flaps with axial blood supply, use of visceral grafts-segments – the gut or stomach). But the problem of speech preservation in this category of patients is of extreme importance and relevance. There are several ways of voice function restoration in patients after laryngopharyngectomy with voice prostheses, but the quality of speech is not so high, since the pharyngeal esophagus segment is removed, and the bowel folds are not capable of vibrating well. We have developed and tested a method for performing an extensive resection of the pharynx and cervical esophagus in a patient with esophageal entrance cancer. At the same time, it was possible to restore the esophagus canal due to a small intestine transplant on microvascular anastomoses, to preserve the larynx and to ensure a high quality of life for the patient.
Key words: esophageal canal cancer, laryngopharyngeal cancer, larynx preservation, restoration of the esophagus canal for resection of pharynx and esophagus.
Authors declare no conflict of interests for this article.
Source of financing. Unspecified.
For citations: Kononets P.V., Novozhilova E.N., Matveev D.A., Chumakov I.F., Sorokoletov A.V., Stroyakovsky D.L., Shivilova M.Yu., Kanner D.Yu. Pharynx and upper third of esophagus resection with laryngeal preservation in case of esophageal entrance tumor. Golova I Sheya Head and neck Russian Journal. 2018;6(2):35–41 (in Russian).
The authors are responsible for the originality of the presented data and the ability to publish illustrative materialtables, figures, photos of patients.
Ежегодно в России регистрируют около 7000 тыс. новых случаев рака пищевода (в 2015 г. –7431). Из них около 20% приходится на долю опухолей шейного отдела пищевода [1, 5]. При этом у 70–80% больных заболевание выявляют в III–IV стадиях, когда имеется распространение на гортаноглотку и/или гортань. Заболевание характеризуется высокой частотой метастазирования (у 60–70% больных выявляют метастазы на шее на момент первичной установки диагноза) [3, 8, 11, 13–15, 24].
Общая 5-летняя выживаемость при комплексном лечении, по данным ряда отечественных и зарубежных авторов, не превышает 25–40% [1, 8, 14, 17, 19, 45]. Необходимо отметить также и сложность этой анатомической зоны, которая характеризуется перекрестом пищепроводных и дыхательных путей, тончайшими особенностями иннервации органов и тесным контактом между ними, отсутствием четких анатомических границ и фасциальных футляров между соседними структурами.
Учитывая локализацию первичной опухоли, выполнение хирургических вмешательств у больных этой категории, как правило, сопровождается удалением гортани, глотки и шейного отдела пищевода. Большинство авторов рассматривают ларингофарингэктомию (ЛФЭ) с круговой резекцией глотки и шейного отдела пищевода как единственный способ хирургического лечения для данной категории больных. При операциях такого объема гортань сохранить нельзя, поскольку это приведет к аспирационным проблемам (и даже сохраненная гортань будет нефункциональна) [4, 12, 14–16, 25, 28, 41].
Следует отметить, что многие годы этих больных считали инкурабельными и либо отказывали им в лечении, либо проводили паллиативную химиолучевую терапию. Если же хирурги выполняли такому пациенту операцию, то, как правило, она заканчивалась формированием оро-, эзофагостомы и трахеостомы, а в дальнейшем требовалась многоэтапная пластика [6, 18, 23, 26, 36, 37, 39].
Основной задачей реабилитации больных после ЛФЭ было восстановление пищепроводного пути. Эту задачу пытались решить разными способами:
а) кожными лоскутами, помещенными вокруг стентов (М. Edgerton, 1952). Но при этом очень высокой была частота осложнений в послеоперационном периоде (свищи, фарингостомы, стриктуры) [27, 45];
б)филатовскими стеблями. Однако эти пластики были довольно сложными, многоэтапными (требовали обычно от 2 до 6 этапов). Их результативность в руках даже опытных хирургов не превышала 50–60%. В ряде случаев пациенты просто не успевали дожить до окончательного результата из-за прогрессирования опухоли. Применение этих методик было ограничено при обширном поражении кожи шеи опухолью, наличии конгломератов метастатических узлов и после больших доз лучевой терапии [1, 31, 40, 42];
в) с конца 70-х начала 80-х гг. прошлого века активно стали использовать для реконструкции лоскуты с осевым кровоснабжением (W. Bakanjiam, 1965; J. Conley, 1972; F. Demergasso, 1979; R.E. Hayden, 1989, 1991). Преимуществами этой методики являлись: одномоментность удаления опухоли и восстановительного этапа, хорошее кровоснабжение лоскутов, что способствовало быстрому заживлению ран даже при наличии свищей. Пациент мог вполне адекватно питаться через короткое время после операции [17, 20, 27, 45];
г) висцеральные трансплантаты.
В 1907 г. А. Сarel впервые описал методику использования тонкокишечного трансплантата на сосудистой ножке для пластики глотки и пищевода. Впервые операция подобного характера на человеке была выполнена в 1959 г. (M. Seidenberg, F. Rosenak, N. Hurwitt, E. Som). В 1960 г. H. Ong и Y. Lee использовали стебель желудка для пластики пищевода [10, 17, 19–21, 44]. Однако в силу несовершенства анестезиологического обеспечения и высоких показателей послеоперационной летальности подобные вмешательства не могли быть тогда широко использованы [4, 15, 16, 29, 30, 39].
В последние десятилетия интерес к этим операциям возрос в связи с развитием микрохирургической техники и анестезиологии. Появилась реальная возможность выполнения радикальных хирургических вмешательств у больных раком гортани, гортаноглотки с распространением опухоли на шейный отдел пищевода. При таком вмешательстве производят удаление гортани, глотки, шейного отдела пищевода – ЛФЭ. Образовавшийся дефект, как правило, замещают сегментом тощей или толстой кишки на микрососудистых анастамозах или стеблем, выкроенным из большой кривизны желудка [7, 10, 17, 34, 43–45].
В настоящее время четко сформулированы методологические аспекты реконструкции органов проксимального отдела пищеварительного тракта, при соблюдении которых существенно повышается безопасность хирургических операций и снижается риск осложнений. К ним относятся герметичность шва, конгруэнтность аутотрансплантанта и реципиентой зоны, максимальная мобилизация тканей в области сосудистой ножки и микрососудистых анастомозов, изоляция магистральных сосудов, отсутствие натяжения [8, 9, 17, 18, 45].
С 1995 г. в МГОБ № 62 выполнено 120 ЛФЭ с пластикой висцеральными транспантатами, несостоятельность анастомоза на шее была у 12% больных. Но у большинства из них свищи закрывались самостоятельно. Полный некроз аутотрансплантата отмечен в 4 случаях, что потребовало затем этапного лечения для пластики фарингостом.
Учитывая обширность хирургического вмешательства, без сомнения, страдает в значительной степени и качество жизни пациентов. Мы и другие авторы выполняли голосовое протезирование у больных данной категории, что позволяло восстановить голосовую функцию и хоть частично, но реабилитировать пациентов [2, 7, 12, 22, 32, 43]. Однако после ЛФЭ больные неизбежно страдают не только от отсутствия речи, но и от наличия трахеостомы, нарушения функции дыхания.
Поэтому мы считаем целесообразным поделиться нашим клиническим опытом и продемонстрировать случай сохранения гортани у пациентки с раком шейного отдела пищевода. Подобных клинических ситуаций мы ранее не наблюдали.
Клиническое наблюдение
Больная И. 60 лет поступила в МГОБ №62 в феврале 2016 г. с жалобами на затруднение при глотании твердой пищи.
При фиброгастродуоденоскопии (ФГДС) установлен диагноз «рак шейного отдела пищевода Т2Н0М0». При ФГДС от 11.02.2016 – устье пищевода на 15 см от резцов, сразу за устьем на 16–17 см определяется экзофитная багровосинюшная опухоль с участками деструкции, занимающая 1/3 просвета, около 2,0 см в диаметре. Биопсия. Гистология – плоскоклеточный ороговевающий рак.
По решению мультидисциплинарного консилиума больной было проведено 6 курсов химиотерапии по схеме ТРF в III–VII C 11.08. по 20.09.2016 проведена конформная лучевая терапия в условиях объемного планирования (3D) XIO под визуальным контролем ExacTrac Brainlab энергией фотонов 6 МэВ методикой многопольной статики на шейный и верхнегрудной отделы пищевода, параэзофагеальную клетчатку и внутригрудные л/узлы на этом уровне, нижне-шейные и надключичные л/узлы, РОД=1,8 Гр, СОД=50,4 Гр. Лечение проводилось на фоне химиотерапии цисплатином (30 мг еженедельно). На фоне лечения отмечена полная резорбция опухоли. Акт глотания полностью восстановился. При контрольной ФГДС опухоль не определялась. Дважды выполнялась ПЭТ-КТ, данных за рецидив и метастазы опухоли не выявлено.
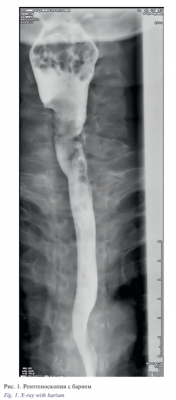
Однако через 1 год после окончания лечения у пациентки вновь появилась дисфагия. При обследовании был выявлен рецидив заболевания. При ФГДС: с 16 до 18 см от резцов по правой полукоружности определялась белесоватая бугристая полуциркулярная опухоль с преимущественно экзофитным характером роста, выражено контактно кровоточащая, аппарат диаметром 9 мм проводился с усилием. Дистальнее опухоли слизистая оболочка пищевода была бледно-розовой, гладкой, блестящей. Рентгеноскопия с барием: акт глотания не нарушен; от нижнего края тела С5 и на протяжении ~1,8 см определялось сужение просвета пищевода за счет дефекта наполнения с бугристыми контурами преимущественно по правой стенке, отмечался обрыв складок слизистой оболочки. На остальном протяжении пищевод был без особенностей (рис. 1).
Единственно возможным методом помощи больной было только хирургическое лечение.
При ЛОР-осмотре: голосовые складки и черпаловидные хрящи были подвижны в полном объеме, голос звучным, грушевидные синусы свободны. Признаков инфильтрации в заперстневидной области не определялось.
Принимая во внимание совершенно нормальную анатомическую картину гортани, на консилиуме было высказано мнение об органосохранной операции. Следует отметить, что подобных операций в нашей практике ранее не было. Всем пациентам с опухолями гортаноглотки и устья пищевода выполнялась ЛФЭ с пластикой сегментом тощей кишки на микрососудистых анастомозах (что описано и рекомендовано в современной литературе).
Во всех клинических руководствах, посвященным лечению больных распространенными опухолями гортани, гортаноглотки и устья пищевода, подробно обсуждаются различные варианты пластики пищепроводного пути с использованием или желудка, или сегмента тонкой или толстой кишки, но не приводится данных о возможности сохранения гортани у пациентов этой категории.
Наша пациентка также была предупреждена о возможности удаления гортани. Планируя операцию, мы предполагали сохранить максимально все нервы гортани (верхние сосудистонервные пучки, возвратные нервы). Обсуждался даже вопрос о пересечении левого возвратного нерва и полного пересечения трахеи на уровне 3–4 полуколец, сдвигания гортани вверх с целью наилучшего максимального доступа к пищеводу и формированию анастомоза (рис. 2).
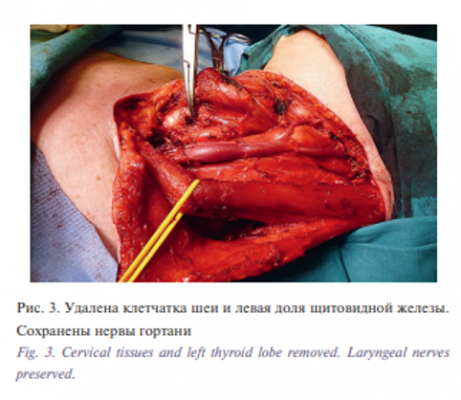
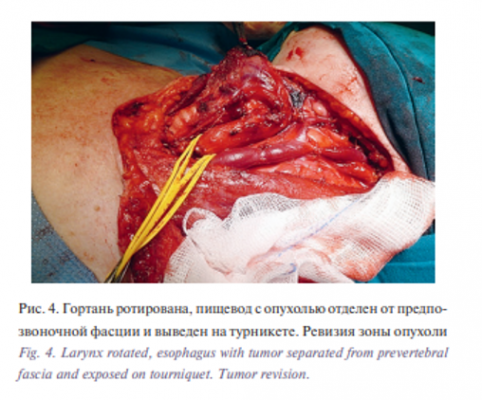
Операция была начата с выполненения шейной лимфаденэктомии. Были прецизионно сохранены все сосудисто-нервные пучки гортани, путем препаровки выделены возвратные нервы, удалена левая доля щитовидной железы. Затем гортань была сильно ротирована вправо. После этого стала хорошо пальпироваться опухоль в пищеводе, которая располагалась в области устья, не прорастала серозу, размеры ее были около 2 см. Пищевод был отделен от предпозвоночной фасции, взят на турникеты и отведен латерально. При ревизии определено, что от верхнего края опухоли возможно отступить максимально на 2 см, а вниз около 4,0 см (рис. 3, 4).
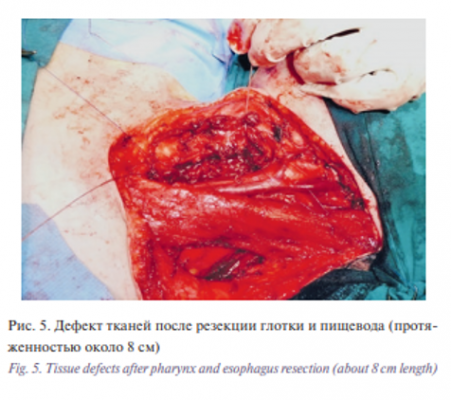
Затем была выполнена циркулярная резекция глотки и шейного отдела пищевода. При срочном гистологическом исследовании: края резекции без признаков опухолевого роста. Таким образом, после резекции глотки и пищевода образовался дефект протяженностью 8 см (рис. 5).
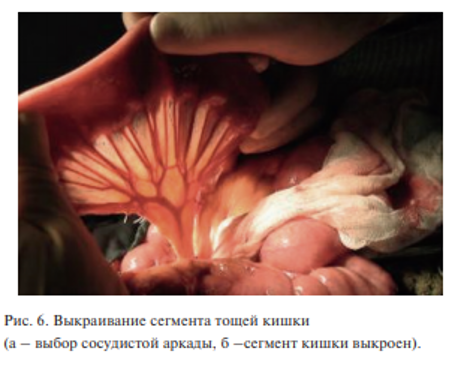
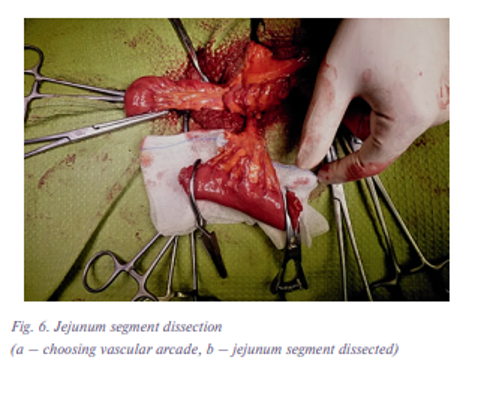
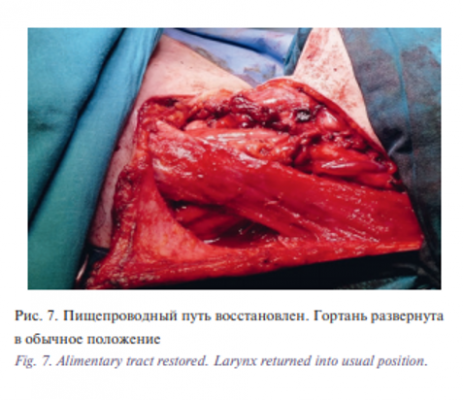
Для восстановления пищепроводного пути был использован сегмент тощей кишки на микрососудистых анастомозах (рис. 6). Сегмент кишки был подшит к глотке в проксмальном направлении и к резецированному пищеводу – в дистальном. Следует отметить, что наложение верхнего анастомоза сопровождалось значительными трудностями. Глотка была резецирована на уровне грушевидных синусов, и сохраненная ротированная гортань сильно затрудняла доступ к слизистой оболочке в этой зоне. Поэтому был наложен однорядный анастомоз полидиоксанон 4-0 (PDS). После этого гортань развернута в обычное положение (рис. 7)
В завершение операции была наложена трахеостома. Рана на шее ушита. Несмотря на сохранность иннервации гортани, мы опасались за сохранение разделительной функции после операции такого объема.
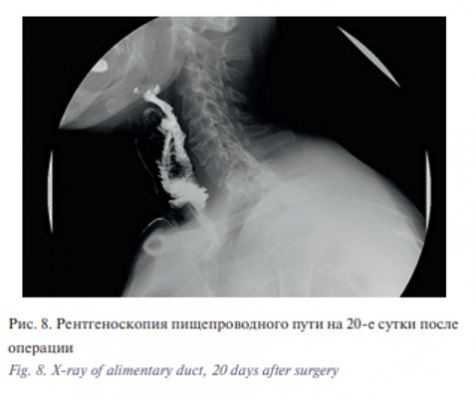
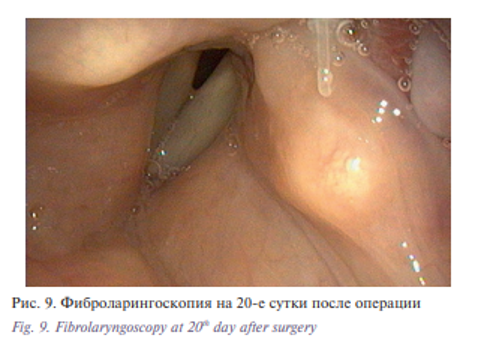
Послеоперационный период протекал без особенностей. На 14-е сутки больной была выполнена рентгеноскопия пищепроводного пути с водорастворимым контрастом, при которой отмечались явления частичной аспирации. Больная кашляла. В этой ситуации важную роль сыграла трахеостома. При ларингоскопии отмечался выраженный отек надгортанника и голосовых складок. Но уже через неделю больная смогла свободно глотать полужидкую пищу. Отек в гортани значительно уменьшился, голосовые складки стали подвижны в полном объеме. Голос стал звучным, дыхание через естественные пути свободным (рис. 8, 9).
Через 1 месяц после операции пациентка была деканюлирована и чувствовала себя хорошо.
Таким образом, данный клинический пример демонстрирует возможность сохранения гортани при раке устья пищевода при ограниченном его поражении. Несмотря на выполнение столь обширной операции удалось сохранить гортань и обеспечить нормальное качество жизни пациентки.
ЛИТЕРАТУРА
- Алферов В.С. Рак гортани – клиника, диагностика, лечение. Опухоли головы и шеи. Европейская школа онкологов. М. 1993.
- Василенко Ю.С. Реабилитация больных после экстирпации гортани. Вестник оториноларингологии. 2002;6:30–33.
- Гамбург Ю.Л. Опухоли ЛОР-органов. М., 1979. С. 118–119.
- Дайхес Н.А., Давудов Х.Ш., Трофимов Е.И., Решетов М.В., Кравцов С.А., Ратушный М.В. Современные хирургические технологии в лечении больных первичным местно-распространенным раком гортаноглотки. VIII Российский онкологический конгресс. Материалы конгресса. М., 2004. 208 с.
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2015 г. Материалы МНИОИ им. П.А. Герцена. 267 с.
- Колчанов В.М., Данилов А.А., Гусев А.В. и др. Ближайшие результаты хирургического лечения рецидивов рака гортани и гортаноглотки после радикальной лучевой терапии. VIII Российский онкологический конгресс. Материалы конгресса. М., 2004. 210 с.
- Кожанов Л.Г., Ольшанский В.О., Сорокин В.Н. Реабилитация голосовой функции с помощью усовершенствованных реконструктивных операций и протезов. Методические рекомендации. М., 1997.
- Кравцов С.А. Выбор метода реконструкции органов проксимального отдела пищеварительного тракта у больных со злокачественными опухолями головы и шеи. Автореф. дис. д.м.н., 2013.
- Кравцов С.А. Способ фарингопластикив условиях дефицита пластического материала – Патент РФ на изобретение № 2427339, 2011.
- Левченко Е.В., Барчук А.С., Канаев С.В. и соавт. Способ комплексного лечения местно-распространенного рака пищевода» Патент РФ № 2459643№, 2012.
- Матякин Е.И. Реконструктивная пластическая хирургия при опухолях головы и шеи. Опухоли головы и шеи. Европейская школа онкологов. М., 1993.
- Мухаммедов М.Р. Реабилитация больных после резекции гортани и ларингэктомии, автореферат дис. д.м.н., Томск, 2005.
- Ольшанский В.О., Трофимов Е.И. Функционально-щадящая хирургия при раке гортаноглотки. Сборник научных трудов. М., 1991. С. 27–32.
- Пачес А.И. Опухоли гортани. В книге опухоли головы и шеи. М., 2007. 369 с.
- Пачес А.И., Ольшанский В.О, Любаев В.Л., Туок Т.Х. Злокачественные опухоли полости рта, глотки, гортани. М., 1988.
- Решетов И.В., Чиссов В.И. Пластическая и реконструктивная хирургия в онкологии. М., 2001.
- Решетов И.В., Кравцов С.А. Пластическая реконструкция глотки и шейного отдела пищевода. Анналы реконструктивной, пластической и эстетической хирургии. 1999;3:114–126.
- Решетов И.В., Кравцов С.А., Маторин О.В., Поляков А.П. Микрохирургическая реконструкция глотки и шейного отдела пищеводафрагментами пищеварительного тракта у онкологических больных. Тезисы конф. «Актуальные вопросы онкологии в системе федерального управления медико-биологических и экстремальных проблем». М., 2004, С. 81–82.
- Чиссов В.И, Решетов И.В., Кравцов С.А. Перспективы развития реконструктивно-пластической микрохирургии в онкологии. Рос. онкологический журнал. 2000;1:57–61.
- Чиссов В.И, Решетов И.В., Кравцов С.А. Устранение дефектов сочетанных дефектов мягких тканей и верхних отделов пищеварительного тракта тонкокишечно-брыжеечным лоскутом. Анналы пластической, реконструктивной и эстетической хирургии. 2011;1:40–48.
- Чиссов В.И, Решетов И.В., Кравцов С.А. Способ микрохирургической пластики сочетанных дефектов глотки у онкологических больных. Патент РФ№ 2098027, 1997.
- Ackerstaff A. Quality of life assesment and its implementation in clinical practice. 8-International meeting «Diagnosis and treatment Head and Neck cancer». Netherland, Amsterdam, 2007. p. 42–43.
- Ackerstaff A., Tan I.B., Rasch C.N., et al. Quality of life assesment after supradose selective intra-arterial cisplatin and concomitant radiation for inoperable stage IV head and neck squamous cell carcinoma. Arch. Otolaryngol. Head Neck Surg. 2002;128:1185–1190.
- Balm A. Future role of the Nead and Neck surgeon in the Oncology team. 8-International meeting «Diagnosis and treatment Head and Neck cancer», Netherland, Amsterdam. 2007. P. 15–17.
- Bakanjiam W. A two-stage method for pharyngo-oesophagel reconstraction with a primary pectoral skin flap last. Surg. 1995;36:173–174.
- Cmelak A.J., Murphy B.A. Taхan-based chemoradiation for organ preservation with locally-advanced head and neck cancer: results of a phase II multi-institutional trial. Head Neck. 2007;29:315–324.
- Clevens M., Hartshorn H., Esclamado A., Levin S. Voice rehabilitation after total laryngectomy using non muscle closure, An. Otol. Rhinol. Laryngol. 1993;102:792–796.
- Cox J. Functional outcome after reconstractive surgery. 8-International meeting «Diagnosis and treatment Head and Neck cancer», Netherland, Amsterdam. 2007. Р. 34–35.
- Chen H., Tang Y. Laryngopharyngectomy with reconstration. Clin. Plastic surgery. 2001;8(28):389–402.
- Feigin I. Organ-preserving and reconstraction laryngeal and tracheal surgery. Folia othorhinolaryngologiae. 1999;6(3–4).
- Hayden R.E. Microvascular free flaps for soft-tissue defects. Otolaryngol. Clin. N. Amer. 1991;24:1343–1366.
- Isman K.A., O’Brein C.J. Videofluoroscopy of the pharyngoesophageal segment during tracheoesophageal and esophageal speech. Head Neck. 1992;14(5):352–358.
- Kravtsov S. Application of jejuno-mesenterial free-flap in pharyngeal and soft tissue reconstraction – IFHNOS, The 4-th World Congress of International Federation of Headand Neck Societies, Seul, Korea, 2010. 208 p
- Krengli M., Policarpo M., Haraf H., et al. Swallowing and voice quality after treatment Head and neck cancer. Inter. J. Oncol. Biol. Physic. 2003;57:1219–1230.
- Kreeft A., Tan I.B., v.d. Brekel M.W., Balm A. «Functional Irresectability», a realistic approch for functional sparing therapy in head and neck cancer? J. Clin. Oncol. 2007;1:398–403.
- Langius A., Bjorvell H., Lind M. Functional status and coping in patients with oral and pharyngeal cancer before and after surgery. Head and Neck. 1994;16:559–568.
- List M.A., Bilir S.P. Functional outcomes in head and neck cancer. Sem. Rad. Oncol. 2004;14:178–189.
- Reshetov I.V., Olshansky V.O., Ratushny M.V. Microsurgical reconstraction of laryngopharynx with voice rehabilitation. 8-International meeting «Diagnosis and treatment Head and Neck cancer», Netherland, Amsterdam, 2007. 123 p.
- Seidenberg M., Rosenak F., Hurwitt N., Som E. Reconstration of the cervical esophagus by a revasxularized isolated jejunal segment. Ann. Surg. 1959;149–162.
- Yu P., Robb G.L. Pharyngoesophageal reconstraction with the anterolateral thigh flap: a clinical and functional outcomes study. Plast. Reconstr. Surg. 2005;116(7):1845–1855.
- Ward E.C. Organ preservation is not (always) synonymous with function preservation: impplications for therapy and rehabilitation? 8-International meeting «Diagnosis and treatment Head and Neck cancer», Netherland, Amsterdam, 2007, p. 43.
- Ward E.C., Bishop B, Frisby J, Stevens M. Swallowing outcomes following laryngectomy and pharyngolaryngectomy. Arch. Otolaryngol. Head and Neck Surg. 2009;2:181–186.
- Ward E.C., Frisby J., O’Connor D. Assesment and management of dysphagia following pharyngolaryngectomy with free jejunal interposition:series of eight case studies. J. of Med. Speech-Language Pathol. 2006;9(1):89–105.
- Y-Sing Leu Hisao Hung-Tao, Chang Juan-Ching. Ileocolic free-flap reconstraction, concomitent chemotherapy and radiotherapy and assesment of speech and swallowing function during management of advanced cancer of the larynx and hypopharynx. Acta Otolaryngol. 2005;6:642–646.
- Shah J., Patel S, Singh B. Surgery of Head and Neck. Memorial Sloan-Kettering Cancer Center, USA, 2016.
Поступила 11.01.18
Принята в печать 20.03.18
REFERENCES
- Alferov V.S. Cancer of the larynx — clinic, diagnosis, treatment. Tumors of the head and neck. European School of Oncology. M. 1993 (In Russ.).
- Vasilenko Yu.S. Rehabilitation of patients after extirpation of the larynx. Vestnik otorinolaringologii . 2002, 6: 30–33 (In Russ.).
- Hamburg Yu.L. Tumors of LOR organs. M., 1979. S. 118–119, 1984 (In Russ.).
- Daihes N.A., Davudov H.Sh., Trofimov E.I., Reshetov M.V., Kravtsov S.A., Ratushny M.V. Modern surgical techniques in the treatment of patients with primary locally advanced cancer of the laryngopharynx. VIII Russian Cancer Congress. Materials of the Congress. Moscow, 2004. 208 pp. (In Russ.)
- Kaprin AD, Starinsky VV, GV. Petrova. State of oncological care for the population of Russia in 2015. Materials of the MSROC named after P.A. Herzen. 267 sec. (In Russ.)
- Kolchanov V.M., Danilov A.A., Gusev A.V. etc. The nearest results of surgical treatment of recurrences of larynx and laryngeal cancer after radical radiation therapy. VIII Russian Cancer Congress. Materials of the Congress. M., 2004. 210 p. (In Russ.)
- Kozhanov L.G., Olshansky V.O., Sorokin V.N. Rehabilitation of the voice function with the help of advanced reconstructive surgeries and prostheses. Guidelines. M., 1997 (In Russ.).
- Kravtsov S.A. Choice of the method of reconstruction of the organs of the proximal part of the digestive tract in patients with malignant tumors of the head and neck. Author’s abstract. dis. Doctor of Medicine, 2013. (In Russ.)
- Kravtsov S.A. Method of pharyngoplasty in conditions of deficiency of plastic material — Patent of the Russian Federation for invention №2427339, 2011 (In Russ.).
- Levchenko EV, Barchuk AS, Kanayev S.V., at al. The method of complex treatment of locally advanced esophageal cancer. Patent of the Russian Federation No. 2459643№, 2012 (In Russ.).
- Matyakin E.I. Reconstructive plastic surgery for head and neck tumors. Tumors of head and neck. European School of Oncology. M., 1993 (In Russ.).
- Mukhamedov M.R. Rehabilitation of patients after resection of the larynx and laryngectomy. Author’s abstract. dis. Doctor of medical science, Tomsk, 2005.
- Olshansky V.O., Trofimov E.I. Functional-sparing surgery for laryngopharyngeal cancer. Collection of scientific papers. M., 1991. P. 27–32 (In Russ.).
- Paches A.I. Tumors of the larynx. In the book “Tumor of the head and neck”. M., 2007. 369 p. (In Russ.)
- Paches A.I., Olshansky V.O., Lubaev V.L., Tuok T.H. Malignant tumors of the oral cavity, pharynx, and larynx. M., 1988 (In Russ.).
- Reshetov IV, Chissov VI. Plastic and Reconstructive Surgery in Oncology, Moscow, 2001 (In Russ.).
- Reshetov IV, Kravtsov S.A. Plastic reconstruction of the pharynx and cervical esophagus. Annals of reconstructive, plastic and aesthetic surgery. 1999; 3: 114–126 (In Russ.).
- Reshetov IV, Kravtsov SA, Matorin OV, Polyakov A.P. Microsurgical reconstruction of the pharynx and cervical esophagus by fragments of the digestive tract in cancer patients. Theses of conf. “Actual questions of oncology in the system of the federal management of biomedical and extreme problems”, M., 2004. P. 81–82.
- Chissov V.I., Reshetov I.V., Kravtsov S.A. Prospects for the development of reconstructive-plastic microsurgery in oncology. Rossijskij onkologicheskij zhurnal. 2000, 1: 57–61 (In Russ.).
- Chissov V.I., Reshetov I.V., Kravtsov S.A. Elimination of defects of combined defects of soft tissues and upper digestive tract with small intestine-mesenteric flap. Ann. Plastic Reconstr. Aesthet. Sur. 2011; 1: 40–48 (In Russ.).
- Chissov V.I., Reshetov I.V., Kravtsov S.A. The method of microsurgical plastics of combined pharyngeal defects in cancer patients. Patent of the Russian Federation No. 2098027, 1997 (In Russ.).
- Ackerstaff A. Quality of life assesment and its implementation in clinical practice. 8-International meeting «Diagnosis and treatment Head and Neck cancer». Netherland, Amsterdam, 2007. P. 42–43.
- Ackerstaff A., Tan I.B., Rasch C.N., et al. Quality of life assesment after supradose selective intra-arterial cisplatin and concomitant radiation for inoperable stage IV head and neck squamous cell carcinoma. Arch. Otolaryngology-Head Neck Surg. 2002;128:1185–1190.
- Balm A. Future role of the Nead and Neck surgeon in the Oncology team. 8-International meeting «Diagnosis and treatment Head and Neck cancer», Netherland, Amsterdam. 2007. P. 15–17.
- Bakanjiam W. A two-stage method for pharyngo-oesophagel reconstraction with a primary pectoral skin flap last. Surg. 1995;36:173–174.
- Cmelak A.J., Murphy B.A. Taхan-based chemoradiation for organ preservation with locally-advanced head and neck cancer: results of a phase II multi-institutional trial. Head Neck. 2007;29:315–324.
- Clevens M., Hartshorn H., Esclamado A., Levin S. Voice rehabilitation after total laryngectomy using non muscle closure. Ann. Otol., Rhinol. Laryngol. 1993;102:792–796.
- Cox J. Functional outcome after reconstractive surgery. 8-International meeting «Diagnosis and treatment Head and Neck cancer», Netherland, Amsterdam. 2007. P. 34–35.
- Chen H., Tang Y. Laryngopharyngectomy with reconstration. Clin. Plastic. Surg. 2001;8(28):389–402.
- Feigin I. Organ-preserving and reconstraction laryngeal and tracheal surgery. Folia othorhinolaryngologiae. 1999;6(3–4).
- Hayden R.E. Microvascular free flaps for soft-tissue defects. Otolaryngol. Clin. N. Amer. 1991;24:1343–1366.
- Isman K.A., O’Brein C.J. Videofluoroscopy of the pharyngoesophageal segment during tracheoesophageal and esophageal speech. Head Neck. 1992;14(5):352– 358.
- Kravtsov S. Application of jejuno-mesenterial free-flap in pharyngeal and soft tissue reconstraction – IFHNOS, The 4-th World Congress of International Federation of Headand Neck Societies, Seul, Korea, 2010. 208 p.
- Krengli M., Policarpo M., Haraf H., et al. Swallowing and voice quality after treatment Head and neck cancer. Int. J. Oncol. Biol. Physics. 2003;57: 1219–1230.
- Kreeft A., Tan I.B., v.d. Brekel M.W., Balm A. «Functional Irresectability», a realistic approch for functional sparing therapy in head and neck cancer? J. Clin. Oncol. 2007;1:398–403.
- Langius A., Bjorvell H. Lind M. Functional status and coping in patients with oral and pharyngeal cancer before and after surgery. Head and Neck. 1994; 16:559–568.
- List M.A., Bilir S.P. Functional outcomes in head and neck cancer. Sem. Rad. Oncol. 2004;14:178–189.
- Reshetov I.V., Olshansky V.O., Ratushny M.V. Microsurgical reconstraction of laryngopharynx with voice rehabilitation. 8-International meeting «Diagnosis and treatment Head and Neck cancer», Netherland, Amsterdam. 2007. 123 p.
- Seidenberg M., Rosenak F., Hurwitt N., Som E. Reconstration of the cervical esophagus by a revasxularized isolated jejunal segment. Ann. Surg. 1959;149–162.
- Yu P., Robb G.L. Pharyngoesophageal reconstraction with the anterolateral thigh flap: a clinical and functional outcomes study. Plast. Reconstr. Sur. 2005;116(7):1845–1855.
- Ward E.C. Organ preservation is not (always) synonymous with function preservation: impplications for therapy and rehabilitation? 8-International meeting «Diagnosis and treatment Head and Neck cancer», Netherland, Amsterdam. 2007. 43 p.
- Ward E.C., Bishop B, Frisby J, Stevens M. Swallowing outcomes following laryngectomy and pharyngolaryngectomy. Arch. Otolaryngol. Head and Neck Sur.. 2009;2:181–186.
- Ward E.C., Frisby J., O’Connor D. Assesment and management of dysphagia following pharyngolaryngectomy with free jejunal interposition:series of eight case studies. J. Med. Speech-Language Pathology. 2006;9(1):89–105.
- Y-Sing Leu Hisao Hung-Tao, Chang Juan-Ching. Ileocolic free-flap reconstraction, concomitent chemotherapy and radiotherapy and assesment of speech and swallowing function during management of advanced cancer of the larynx and hypopharynx. Acta Otolaryngol. 2005;6:642–646.
- Shah J., Patel S, Singh B. Surgery of Head and Neck. Memorial Sloan-Kettering Cancer Center, USA, 2016.
Received 11.01.18
Accepted 20.03.18
Сведения об авторах:
П.В. Кононец – к.м.н., главный хирург ГБУЗ «Московская городская онкологическая больница №62 ДЗМ» Московская область, Красногорский район, Россия
Е.Н. Новожилова – д.м.н., зав. отделом опухолей головы и шеи ГБУЗ «Московская городская онкологическая больница №62 ДЗМ» Московская область, Красногорский район, Россия; e-mail: E-novozhilova@yandex.ru
Д.А. Матвеев – врач-хирург, БУЗ «Московская городская онкологическая больница №62 ДЗМ» Московская область, Красногорский район, Россия
И.Ф. Чумаков – врач-хирург, БУЗ «Московская городская онкологическая больница №62 ДЗМ» Московская область, Красногорский район, Россия
А.В. Сорокалетов – БУЗ «Московская городская онкологическая больница №62 ДЗМ» Московская область, Красногорский район, Россия Д.Л. Строяковский – к.м.н., заведующий отделом химиотерапии БУЗ «Московская городская онкологическая больница №62 ДЗМ» Московская область, Красногорский район, Россия
М.Ю. Шивилова – заведующая отделом лучевой терапии БУЗ «Московская городская онкологическая больница №62 ДЗМ» Московская область, Красногорский район, Россия
Д.Ю. Каннер – к.м.н., главный врач ГБУЗ «Московская городская онкологическая больница №62 ДЗМ» Московская область, Красногорский район, Россия
About the authors:
P.V. Kononets – MD, PhD, Chief Surgeon, SBIH «Moscow City Oncological Hospital No. 62 DZM», Moscow Region, Krasnogorsk District, Russia
E.N. Novozhilova – MD, PhD, head of head&neck tumors department, SBIH «Moscow City Oncological Hospital No. 62 DZM», Moscow Region, Krasnogorsk District, Russia
D.A. Matveev – surgeon, SBIH «Moscow City Oncological Hospital No. 62 DZM», Moscow Region, Krasnogorsk District, Russia
I.F. Chumakov – surgeon, SBIH «Moscow City Oncological Hospital No. 62 DZM», Moscow Region, Krasnogorsk District, Russia
A.V. Sorokaletov – SBIH «Moscow City Oncological Hospital No. 62 DZM», Moscow Region, Krasnogorsk District, Russia
D.L. Stroyakovsky – MD, PhD, head of chemotherapy department, SBIH «Moscow City Oncological Hospital No. 62 DZM», Moscow Region, Krasnogorsk District, Russia
M.Yu. Shivilova – head of radiotherapy department, SBIH «Moscow City Oncological Hospital No. 62 DZM», Moscow Region, Krasnogorsk District, Russia
D.Yu. Kanner – MD, PhD, Chief Doctor of SBIH «Moscow City Oncological Hospital No. 62 DZM», Moscow Region, Krasnogorsk District, Russia