Для цитирования: Кастыро И.В., Попадюк В.И., Торшин В.И., Баринов А.В., Хамидулин Г.В., Меликян М.А., Пономарева Д.П., Кащенко А.Н., Дроздова Г.А. Гендерный аспект и интенсивность острого болевого синдрома после септопластики. Голова и шея Head and neck Russian Journal. 2018;6(2):27–34
For citations: Kastyro I.V., Popadyuk V.I., Tоrshin V.I., Barinov A.V., Khamidulin G.V., Melikyan M.A., Ponomareva D.P., Kashchenko A.N., Drozdova G.A. Gender aspect and intensitivity of acute pain syndrome after septoplastics. Golova I Sheya = Head and neck. Russian Journal. 2018;6(2):27–34 (in Russian).
Doi: 10.25792/HN.2018.6.2.27–34
Цель исследования: выявить особенности распределения по интенсивности острого болевого синдрома у мужчин и женщин после септопластики.
Материал и методы. Исследовался острый болевой синдром после проведения септопластики хрящевого отдела перегородки носа у 46 мужчин (16–44 года) и 36 женщин (20–37 лет) под местной аппликационной анестезией 2%-ным раствором лидокаина и инфильтрационной анестезией 5%-ным раствором прокаина. Острую боль оценивали в миллиметрах (из 100 возможных) с помощью визуально-аналоговой шкалы (ВАШ), цифровой рейтинговой шкалы (ЦРШ) и вербальной шкалы-молнии (ВШМ). Вычисляли средние значения по трем шкалам для каждого пациента. Данные по шкалам распределяли на 4 категории по интенсивности боли: слабая боль (боли нет) – 0–25 мм, средняя боль – 26–50 мм, сильная боль – 51–75 мм, очень сильная боль – 76–100 мм. Данные сравнивали между категориями как среди мужчин, так и среди женщин, а также соответствующие категории между мужчинами и женщинами.
Результаты исследования. Было выявлено, что интенсивность боли у женщин достоверно выше, чем у мужчин (p <0,01); при оценке женщинами болевого синдрома от 76 до 100 мм по ЦРШ данные результаты являются ложноположительными при сравнении таковых с ВАШ и ВШМ. Данный факт необходимо учитывать при выборе анальгетической терапии после проведения септопластики. Выводы. Интенсивность острого постоперационного болевого синдрома в раннем периоде после септопластики хрящевого отдела перегородки носа достоверно выше у женщин по сравнению с мужчинами. Это позволяет рассматривать фактор пола в качестве предиктора интенсивности боли при данном виде хирургического вмешательства и проводить соответствующее обезболивание. Применение ВАШ и ВШМ для диагностики интенсивности острой боли у пациентов после септопластики возможно без ограничений вне зависимости от пола. При использовании ЦРШ у пациентов после септопластики необходимо учитывать то, что женщины указывают на более сильную боль по сравнению с ВАШ и ВШМ.
Ключевые слова: болевой синдром, пол, аналоговые шкалы боли.
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Кастыро И.В., Попадюк В.И., Торшин В.И., Баринов А.В., Хамидулин Г.В., Меликян М.А., Пономарева Д.П., Кащенко А.Н., Дроздова Г.А. Гендерный аспект и интенсивность острого болевого синдрома после септопластики. Голова и шея Head and neck Russian Journal. 2018;6(2):27–34
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Aim. To reveal the specifics of intensity of an acute painful syndrome distribution in men and women after a septoplastics.
Material and methods. An acute pain syndrome was studied after septoplasty of the cartilaginous part of the septum of the nose in 46 men (16–44 years) and in 36 women (20–37 years) under local application anesthesia with a 2% solution of lidocaine and infiltration anesthesia with 5% procaine solution. Acute pain was assessed in millimeters (out of 100 possible) using a visual analog scale (VAS), a digital rating scale (DRS), and a verbal zipper scale (VZS). The mean values were calculated from three scales for each patient. Data derived from the scales were divided into 4 categories according to pain intensity: miserable pain (or no pain) 0–25 mm, mild pain 26–50 mm, severe pain 51–75 mm, very severe pain 76–100 mm. The data were compared between the categories for both men and women, and the corresponding categories between men and women. Results. The intensity of pain in women is significantly higher than in men (p<0.01); when women assess the pain syndrome from 76 to 100 mm according to the DRH, these results are false positive, when compared with those of VAS and VZS. This fact must be taken into account when choosing analgesic therapy after septoplasty.
Conclusions. The intensity of acute postoperative pain syndrome in the early period after septoplasty of the cartilaginous part of the septum of the nose is significantly higher in women than in men. This allows us to consider the sex factor as a predictor of the intensity of pain in this type of surgery and conduct appropriate anesthesia. The use of VAS and VZS to diagnose the intensity of acute pain in patients after septoplasty is reasonable without restrictions, regardless of gender. When using the DRS in patients after septoplasty, it is necessary to take in to account that women indicate a stronger pain compared to VAS and VZS.
Key words: pain syndrome, sex, analogue pain scales.
Authors declare no conflict of interests for this article. Source of financing. Unspecified.
For citations: Kastyro I.V., Popadyuk V.I., Tоrshin V.I., Barinov A.V., Khamidulin G.V., Melikyan M.A., Ponomareva D.P., Kashchenko A.N., Drozdova G.A. Gender aspect and intensitivity of acute pain syndrome after septoplastics. Golova I Sheya = Head and neck. Russian Journal. 2018;6(2):27–34 (in Russian).
The authors are responsible for the originality of the presented data and the possibility of publishing illustrative material – tables, drawings, photographs of patients.
Введение
Проблема диагностики острого болевого синдрома получила наибольшее развитие в таких областях медицины, как абдоминальная хирургия, травматология, ортопедия и др. [1–5]. В последнее время возникла необходимость изучения данного вопроса и в оториноларингологии, в частности в ринохирургии [6–10].
Известно, что интенсивность болевого синдрома у различных пациентов неодинакова. Она зависит от множества факторов и носит зачастую субъективный характер [11]. К факторам, предопределяющим отношение человека к боли, можно отнести возраст, социокультурные особенности, пол и т.д. [12, 13].
Например, известно, что женщины по сравнению с мужчинами более чувствительны к болезненным стимулам, воспринимают боль более серьезно, чем мужчины [13]. Принимая во внимание фактор пола, трудно объективно оценить «среднюю» боль группы, включающей пациентов обоих полов. Однако индивидуальная оценка боли конкретным человеком важнее, чем совокупность болевых ощущений нескольких больных.
Стандартными методами измерения выраженности боли являются аналоговые шкалы: визуально-аналоговая шкала (ВАШ) [8, 14, 15], цифровая-рейтинговая шкала (ЦРШ) [16–18], шкала Мак-Гилла [19, 20] и др. Также используется Likert scales для оценки назальных симптомов (образование корок, кровотечение, чихание, секреция, заложенность носа, боль) [21]. В ринологии для оценки интенсивности боли, степени дискомфорта во время передней тампонады носа и т.д. используется в основном ВАШ [10, 22], иногда ЦРШ [23]. Однако попыток применить другие модификации аналоговых шкал с целью лучшей диагностики острой боли после септопластики практически нет.
Трудно переоценить важность диагностики уровня испытываемой боли пациентами после септопластики. Так, пациентам с болью от 0 до 29 мм уже рекомендуется вводить один из препаратов, включенный в т.н. «ступень» из «анальгетической лестницы» (например, нестероидные противовоспалительные средства). Для пациентов, у которых по ВАШ боль оценена от 30 до 59 баллов, назначают от одного до двух анальгетиков из перечня «лестницы», а именно рекомендуются т.н. слабые опиоиды (например, трамадол, кодеин и дигидрокодеин). У пациентов с болью от 60 до 100 баллов по ВАШ следует применять 3 обезболивающих препарата из «лестницы» – сильные опиоиды (например, морфин, фентанил, бупренорфин и метадон) [24]. В клинической практике оценка анальгетической эффективности такой терапии также имеет большое значение.
На современном этапе изучения вопросов болевого синдрома в оториноларингологии отсутствуют какие-либо полноценные данные по распределению пациентов по интенсивности боли, а также мало данных по ее сравнению в аспекте фактора пола при септопластике.
Цель исследования. Выявить особенности распределения по интенсивности острого болевого синдрома у мужчин и женщин после септопластики.
Материал и методы
Исследовали острый болевой синдром у пациентов с искривлением перегородки носа после проведенной септопластики. Были прооперированы 46 мужчин в возрасте от 16 до 44 лет и 36 женщин от 20 до 37 лет. Септопластика проводилась под местной аппликационной анестезией 2%-ным раствором лидокаина и инфильтрационной анестезией 5%-ным раствором прокаина. В исследование были включены только те пациенты, которым проводилась пластика исключительно хрящевого отдела перегородки носа, т.к. известно, что размер операционного поля и заинтересованность вегетативных структур в хрящевом отделе при данном виде хирургического вмешательства напрямую влияют на силу послеоперационного болевого синдрома [25]. После операции проводилась передняя тампонада носа марлевыми тампонами, пропитанными антибактериальной мазью Левомиколь.
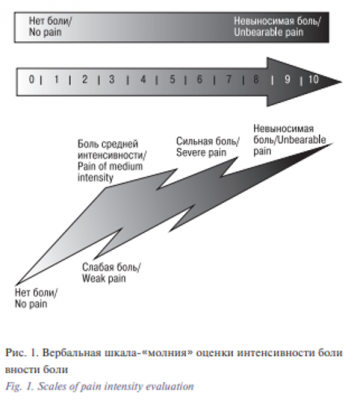
Выраженность болевого синдрома оценивали с помощью трех аналоговых шкал (ВАШ [8], ЦРШ [26] и вербальная шкала-«молния» – ВШМ; рис. 1). Интенсивность боли оценивалась пациентами через 2 часа после хирургического вмешательства и измерялась в миллиметрах [6]. Были использованы варианты шкал [27] в собственной модификации. Пациентов по результатам оценки боли распределяли в подгруппы со слабой болью (ее отсутствием – 0–25 мм), болью средней силы (26–50 мм), сильной болью (51–75 мм) и очень сильной болью (76–100 мм). Предложенная нами ВШМ в отличие от распространенных аналоговых шкал не имеет прямолинейной направленности и содержит расширенный набор вербальных характеристик боли (рис. 1). Результаты ВШМ сравнивали с таковыми по ВАШ и ЦРШ: проводили оценку средних значений по шкалам в подгруппах по интенсивности болевого синдрома по Стьюденту, а также оценку линейной регрессии результатов шкал.
Результаты исследования
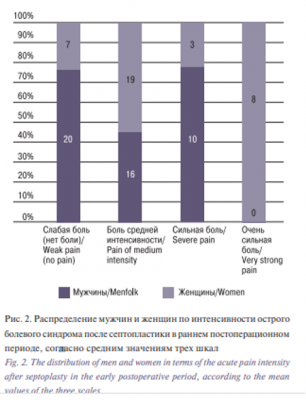
По средним значениям аналоговых шкал через 2 часа после септопластики у 39,1% мужчин боли не было или она была незначительной, у 39,1% пациентов болевой синдром был средней интенсивности, сильную боль испытывали 21,7% пациентов, а очень сильной не наблюдалось ни у кого (рис. 2). В группе женщин 8,3% отметили очень сильную боль, у 33,3% был сильный болевой синдром, 47,2% пациенток показали, что боль в области носа была средней силы. В отличие от мужчин всего 11,1 % женщин не испытывали никакой боли или она была очень слабой в первые часы после операции (рис. 2).
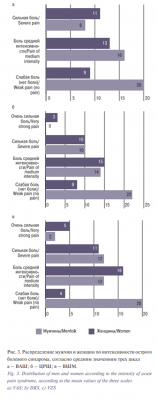
Сравнивая распределение по выраженности острого болевого синдрома среди мужчин и женщин, согласно результатам оценки по отдельным шкалам, достоверных различий выявлено не было. Так, мужчины отметили слабую боль или ее отсутствие по ВАШ, ЦРШ и ВШМ в 43,5,%, 47,8 и 43,5% случаев соответственно (рис. 3). Боль средней интенсивности по ВАШ определена у 34,8%, по ЦРШ – у 30,4%, по ВШМ – у 26,1%. Сильная боль по ВАШ выявлена у 17,4%, по ЦРШ – у 21,7%, по ВШМ – у 26,1%. Очень сильная боль была определена у 4,3% по ВАШ, по ЦРШ – у 0%, по ВШМ – у 4,4%. Женщины испытывали слабую боль или ее не ощущали по ВАШ в 25% случаев, по ЦРШ – в 22,2%, по ВШМ – в 11,1%. Болевой синдром средней степени выраженности отметили 36,1% женщин по ВАШ, 41,7% – по ЦРШ, 44,4% – по ВШМ. Сильный болевой синдром был диагностирован у 30,6% по ВАШ (рис. 3a), у 27,8% – по ЦРШ (рис. 3б), 30,6% – по ВШМ (рис. 3в). В отличие от мужчин больше женщин пожаловались на очень сильную боль. Так, по ВАШ и по ЦРШ очень сильная боль была определена у 8,3%, а по ВШМ – у 13,9% соответственно.
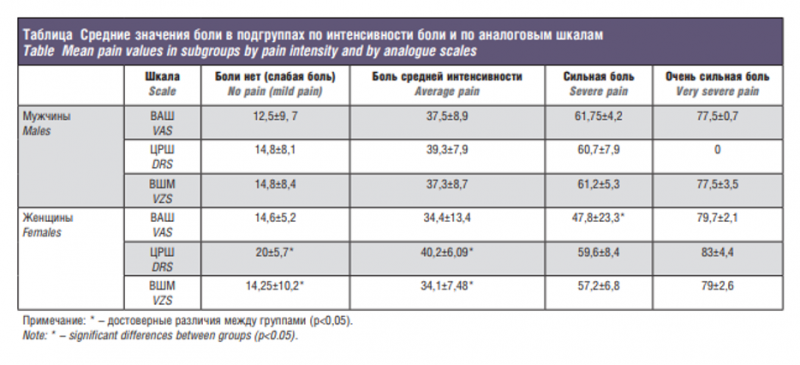
При распределении обеих групп на подгруппы по критерию интенсивности боли оказалось, что у женщин в подгруппе с минимальной болью (ее отсутствием) средние результаты по ЦРШ были достоверно выше, чем по ВШМ (20±5,7 против 14,25±10,2 мм; (р<0.05 см.таблицу).
Обсуждение полученных данных
У пациентов обеих групп использовались марлевые тампоны для передней тампонады полости носа. Носовые тампоны, устанавливаемые после септопластики, теоретически снижают риск таких послеоперационных осложнений, как кровотечения, гематомы, формирование септальных синехий. Тем не менее в литературе мало доказательств, демонстрирующих явные преимущества носовых тампонов после септопластики [28]. Напротив, послеоперационная тампонада полости носа вызывала у пациентов дискомфорт, боль, инфекционные осложнения, а также заложенность носа, которые могут ухудшить другие, как правило, сопутствующие искривлению перегородки носа состояния, такие как обструктивное апноэ сна. Дополнительным теоретическим риском, связанным с тампонадой носа, является смещение тампона и последующая аспирация. В рандомизированном контролируемом исследовании сравнивали трансептальные лоскутные швы и носовые тампоны. Те пациенты, которым накладывали швы, испытывали значительно меньше послеоперационных симптомов, включая боль и дискомфорт [29]. Кроме того, систематический обзор 7 рандомизированных контролируемых исследований с участием 869 пациентов, в которых сравнивали септальные швы и переднюю тампонаду носу, показал, что боль в носу и головная боль были значительно меньше в группе септальных швов, в то время как послеоперационные осложнения, в т.ч. кровотечения, гематома перегородки носа, образование синехий, перфорация и местные инфекционные осложнения существенно не различались в 2 группах [22]. Учитывая эти данные, можно сделать вывод, что септальные швы могут устранить необходимость в передней тампонаде носа после септопластики и, таким образом, избежать боли и дискомфорта [30]. В нашем исследовании никаких осложнений во время тампонады (3 дня) не наблюдалось. Однако нельзя исключить, что выраженность болевого синдрома была связана с присутствием тампонов в полости носа.
Большинство мужчин распределились в подгруппы с минимальной и средней болью, а женщин – со средней и сильной. Результаты оценки боли в среднем по подгруппам составили: у мужчин со слабой болью 14,03±8,7 мм, со средней болью – 38,03±8,5 мм, а у женщин 36,2±8,99 мм в подгруппе со средней интенсивностью боли, а в подгруппе с сильной болью – 58,9±12,8 мм. В исследованиях D. Malki и соавт. и I. Cukurova и соавт. выраженность боли из 10 баллов при передней тампонаде носа в первый день после септопластики составила 2,2 и 4,8 соответственно [31, 32]. Авторы использовали ВАШ. Тем не менее эти исследования не обнаружили статистически значимой разницы в интенсивности боли в этот момент времени при сравнении передней тампонады носа, септальных швов и сплинтов. В работе M.S. Awan и M. Iqbal [33] сравнивали носовые тампоны с септальными швами, однако при оценке боли сразу после операции не сообщалось о значении вероятности. Тем не менее авторы сделали вывод, что тампонада носа была связана с большей болью (7,32 из 10). M.M. Ardehali и S. Bastaninejad и J.A. Cook и соавт. сообщают, что передняя тампонада носа вызывает болевой синдром с интенсивностью 5,0 и 4,8 (из 10), что соответствует в нашем исследовании 50 и 48 мм соответственно [34, 35]. R.O. Gunaydin и соавт., T.E. Habesoglu и соавт., D.A. Nunez и F.W. Martin показали в своих исследованиях в первый день после септопластики при передней тампонаде носа интенсивность боли в 5,9, 6,09 и 4,1, соответственно [28, 36, 37]. Практически во всех исследованиях авторы приходят к выводу о том, что тампонада носа вызывает сильный болевой синдром по сравнению с септальными швами или сплинтами [38]. При тампонаде полости носа после септопластики с помощью тампонов Merocel M.S. Yilmaz и соавт. отметили у пациентов интенсивность боли в 6±2,21 условных единиц из 10, что соответствует 60 мм в нашем исследовании [39]. По данным A.K. Amin и соавт., в первый день после операции болевой синдром после септопластики у пациентов с силиконовыми тампонами составлял 27±9,52 пункта из 100 [40]. Во всех исследованиях средние значения оценки боли существенно не отличались от данных нашего исследования.
Оценивая два ряда данных (в нашем случае результаты аналоговых шкал боли), использование метода линейной регрессии для установления корреляции между двумя параметрами возможно лишь тогда, когда данные удовлетворяют следующим условиям:
- во-первых, точечный график одного параметра относительно другого должен показывать тенденцию к линейной зависимости параметров;
- во-вторых, разброс значений параметров относительно прямой регрессии должен быть равномерен вдоль всей длины прямой;
- в-третьих, разности наблюдаемых и рассчитанных из регрессии величин должны иметь нормальное распределение.
Наши данные соответствовали приведенным условиям [41].
Интересно отметить, что в нашем исследовании женщины указывали на более сильную боль по ЦРШ при слабой и сильной боли. По этой же шкале мужчины не отмечали очень сильной боли, в то время как по остальным шкалам они испытывали эти ощущения. Эти результаты подтверждаются исследованием M.A. Ferreira-Valente и соавт., в котором авторы, исследуя болевую чувствительность у испытуемых посредством холода, пришли к выводу, что ЦРШ более чувствительна и специфична по отношению к полу по сравнению с ВАШ и вербальной шкалой [42]. Для женщин и мужчин вербальная оценка боли «больно, но терпимо» не означает одинакового уровня боли. Это подтверждено в исследовании J.F.M. van Dijk и соавт [43]: женщины сообщили более высокие показатели боли по ЦРШ по сравнению с мужчинами. Значительно больше женщин, чем мужчин отметили цифры 5, 6 и 7 на ЦРШ, как «больно, но терпимо». Женщины считают промежуточные оценки на ЦРШ как «терпимую боль». Авторы полагают, что это следует учитывать при принятии решений относительно лечения.
Гендерный фактор в анальгезии рассматривается в качестве предиктора боли. В ряде исследований была выявлена положительная связь между женским полом и послеоперационным болевым синдромом [12, 44–46]. Также была показана положительная корреляция между женским полом и количеством применяемого анальгетика в постоперационном периоде [11, 44]. Однако в исследованиях Y.Y. Chia и соавт. была продемонстрирована негативная связь фактора пола и обезболивания [47]. С другой стороны, в 3 исследованиях не было выявлено существенной корреляции между полом и послеоперационной болью [48–50] и в одном – между полом и потребностью в анальгезии [51]. По мнению H.Y.V. Ip и соавт., фактор пола не является предиктором для послеоперационной боли, как принято считать [52]. Также L. Li и соавт. не обнаружили статистически значимых различий между послеоперационной болью у женщин и мужчин [53]. Однако L. Gagliese и соавт. выявили статистически значимо больший уровень послеоперационной боли у пациенток, получавших пациент-контролируемую анальгезию [46]. J.D. Greenspan и соавт. и K.J. Berkley исследовали это несоответствие как более сложное явление, анализируя уровень боли, связанный с гендерными вопросами вместе с анатомическими и гормональными различиями [54, 55]. Они пришли к выводу, что различия в болевой чувствительности не могут быть точно предсказаны.
Согласно нашим данным, было продемонстрировано, что при выполнении септопластики хрящевого отдела у женщин более сильное восприятие боли и она интенсивнее, чем у мужчин. Но эти сведения вряд ли стоит учитывать, если септопластика проводится и в костном отделе, т.к. известно, что в этой области располагается диффузный вегетативный ганглий Зазыбина, при интраоперационной заинтересованности которого возникают различные реакции со стороны вегетативной нервной системы [25]. Это предположение подтверждает исследование G.S. Özler, в котором исследуются группы с искривлением хрящевого и костного отделов перегородки носа. Пациентам обеих групп была выполнена септопластика. Пациенты, у которых был прооперирован костный отдел перегородки носа, на 1-й, 3 и 7-й дни после операции испытывали более сильные болевые ощущения, по сравнению с теми, которым проводили септопластику только в хрящевом отделе [7].
Очевидно, что фактор пола не может выступать самостоятельно в качестве предиктора для послеоперационной боли или для планирования постоперационной анальгезии. Данные по гендерным различиям в восприятии боли и потреблении болеутоляющих остаются предварительными, а возраст может быть тем фактором, который затрудняет прогнозирование болевых реакций. Механизм гендерных различий в болевом аспекте трудноуловим [52]. Существует ряд доказательств, что генетические факторы играют роль в оказании влияния на межличностные различия в клинических и экспериментальных болевых реакциях [57]. Генетические механизмы также могут быть связаны с различными процессами социализации для мужчин и женщин, которые влияют на телесный опыт и готовность к коммуникации в различных стрессовых ситуациях [46], колебания гормонов [58], нейромедиаторов, которые в свою очередь могут повлиять на восприятие боли пациентом. При этом могут также возникать и фармакокинетические различия [57]. Таким образом, в области обезболивания в ринологии остается еще ряд открытых вопросов: существует ли корреляция между количеством применяемого анальгетика в постоперационном периоде и полом; какой характер носит боль при выполнении септопластики на всем протяжении перегородки носа и зависит ли болевой синдром в данной ситуации также от пола и типа тампонады? Заключение В результате проведенного исследования было обнаружено, что интенсивность острого постоперационного болевого синдрома в раннем периоде после септопластики хрящевого отдела перегородки носа достоверно выше у женщин по сравнению с мужчинами. Это позволяет рассматривать фактор пола в качестве предиктора интенсивности боли при данном виде хирургического вмешательства и проводить соответствующее обезболивание. Применение ВАШ и ВШМ для диагностики интенсивности острой боли у пациентов после септопластики возможно без ограничений вне зависимости от пола. При использовании ЦРШ у пациентов после септопластики необходимо учитывать то, что женщины указывают на более сильную боль по сравнению с ВАШ и ВШМ.
ЛИТЕРАТУРА/REFERENCES
- Marret E., Rolin M., Beaussier M., Bonnet F. Meta-analysis of intravenous lidocaine and postoperative recovery after abdominal surgery. British. J. Surg. 2008;95:1331–1338. doi: 10.1002/bjs.6375.
- Hughes M.J., Ventham N.T., McNally S., et al. Analgesia After Open Abdominal Surgery in the Setting of Enhanced Recovery Surgery. JAMA. Surg. 2014;149(12):1224–1230. doi:10.1001/jamasurg.2014.210.
- Saito S., Furuya T., Kotake S. Therapeutic effects of hyaluronate injections in patients with chronic painful shoulder: a meta-analysis of randomized controlled trials. Arthritis care res [Hoboken] 2010;62:1009–1018. doi: 10.1002/acr.20174.
- Cappello Z.J., Kasdan M.L., Louis D.S. Meta-analysis of imaging techniques for the diagnosis of complex regional pain syndrome type I. JHS. 2012;37A:288–296. doi:10.1016/j.jhsa.2011.10.035.
- Middelkoop M., van Arden N.K., Atchia I., et al. The OA Trial Bank: meta-analysis of individual patient data from knee and hip osteoarthritis trials show that patients with severe pain exhibit greater benefit from intra-articular glucocorticoids. Osteoarthritis and Cartilag. 2016; 24(7):1143–1152. doi: http://dx.doi.org/10.1016/j.joca. 2016.01.983.
- Kastyro I.V. Postoperative pain level after septoplasty and nasal polypectomy: comparison, standardization of analgesia. Russian Otorhinolaryngol. 2012;1(56):79–82.
- Özler G.S. Is the location of a septal deviation associated with the degree of postoperative pain after septoplasty? Ear. Nose Throat. J. 2016;95(10– 11):E37-E39. PMID: 27792832.
- Bugten V., Nilsen A.H., Thorstensen W.M., et al. Quality of life and symptoms before and after nasal septoplasty compared with healthy individuals. BMC. Ear. Nose Throat. Disorders. 2016;16:13. doi 10.1186/s12901-016-0031-7.
- Kayahan B., Ozer S., Suslu A.E, et al. The comparison of the quality of life and intranasal edema between the patients with or without nasal packing after septoplasty. Eur. Arch. Otorhinolaryngol. 2017;274(3):1551–1555. doi 10.1007/s00405-016-4403-9.
- Szychta P., Antoszewski B. Assessment of early post-operative pain following septorhinoplasty. J. Laryngol. Otol. 2010;124:1194–1199. doi:10.1017/ S0022215110001519.
- Taenzer P., Melzack R., Jeans M.E. Influence of psychological factors on postoperative pain, mood and analgesic requirements. Pain. 1986;24:331– 342. doi: 10.1016/0304-3959(86)90119-3.
- Lau H., Patil N.G. Acute pain after endoscopic totally extraperitoneal (TEP) inguinal hernioplasty. Multivariate analysis of predictive factors. Surg. Endosc. 2004;18:92–96. doi: 10.1007/s00464-003-9068-y.
- Wise E.A., Price D.D., Myers C.D., Robinson M.E. Gender role expectations of pain: relationship to experimental pain perception. Pain. 2002;96:335–342. PMCID: PMC2535906.
- Meissner W., Coluzzi F., Fletcher D., et al. Improving the management of post-operative acute pain: priorities for change. Curr. Med. Res. Opin. 2015;1:11:2131-2143. doi: 10.1185/03007995.2015.1092122
- Gago M.A., Escontrela R.B., Planas R.A., Martínez R.A. Intravenous Ibuprofen for Treatment of Post-Operative Pain: A Multicenter, Double Blind, PlaceboControlled, Randomized Clinical Trial. PLoS ONE. 2016;11(5):e0154004. doi:10.1371/journal.pone.0154004.
- Holdgate A., Asha S., Craig J., et al. Comparison of a verbal numeric rating scale with the visual analogue scale for the measurement of acute pain. Emerg. Med. (Fremantle). 2003;15(5–6):441–446. PMID: 14992058.
- Tandon M., Singh A., Saluja V., et al. Validation of a new “Objective Pain Score” Vs. “Numeric Rating Scale” for the evaluation of acute pain: a comparative study. Anesth. Pain Med. 2016;6(1):e32101. doi: 10.5812/ aapm.32101.
- Bianchini C., Malagò M., Crema L., et al. Post-operative pain management in head and neck cancer patients: predictive factors and efficacy of therapy. Acta. Otorhinolaryngol. Italica. 2016;36:91–96. doi: 10.14639/ 0392-100X-499.
- Melzack R. The McGill Pain Questionnaire: major properties and scoring methods. Pain. 1975;1(3):277–299. PMID: 1235985.
- Reading A.E. A comparison of the McGill Pain Questionnaire in chronic and acute pain. Pain. 1982;13(2):185–192. PMID: 6889722.
- Haye R., Tarangen M., Shiryaeva O., et al. Evaluation of the Nasal Surgical Questionnaire for Monitoring Results of Septoplasty. Int. J. Otolaryngol. 2015;2015:1–7. doi: http://dx.doi.org/10.1155/2015/563639.
- Certal V., Silva H., Santos T., et al. Trans-septal suturing technique in septoplasty: a systematic review and meta-analysis. Rhinol. 2012;50(3):236– 225. doi: 10.4193/Rhino12.051.
- Heo S.J.,·Park C.M.,·Kim J.S. Learning Curve of Septoplasty with Radiofrequency Volume Reduction of the Inferior Turbinate. Clin. Exp. Otorhinolaryngol. 2013;6 (4):231–236. doi:http://dx.doi.org/10.3342/ ceo.2013.6.4.231.
- Wewers M.E., Lowe N.K. A critical review of visual analogue scales in the measurement of clinical phenomena. Res. Nurs. Health. 1990;13:227– 236. doi: 10.1002/nur.4770130405.
- Kastyro I.V., Medyantseva D.A. Correlation between size of the surgical site and pain syndrome intensity after resection of the nasal septum. Rus. Otorhinolaryngol. 2014;1(68):86–88.
- Farrar J.T., Young J.P. Jr., LaMoreaux L., et al. Clinical importance of changes in chronic pain intensity measured on an 11-point numerical pain rating scale. Pain. 2001;94(2):149–158. PMID: 11690728.
- dos Santos T.O.D., Estrela T.G., de Azevedo V.L.F., et al. Intravenous and Subcutaneous Tramadol for Inguinal Herniorrhaphy: Comparative Study. Rev. Bras. Anestesiol. E 2010;60:5:522–527. http://dx.doi.org/10.1590/S0034- 70942010000500008.
- Gunaydin R.O., Aygenc E., Karakullukcu S., et al. Nasal packing and transseptal suturing techniques: surgical and anaesthetic perspectives. Eur. Arch. Otorhinolaryngol. 2011;268:1151–1156. doi: 10.1007/s00405-011- 1542-x.
- Korkut A.Y., Teker A.M., Eren S.B., et al. A randomised prospective trial of trans-septal suturing using a novel device versus nasal packing for septoplasty. Rhinology. 2010;48:179–182. doi: 10.4193/Rhin09.098.
- Han J.K., Stringer S.P., Rosenfeld R.M., et al. Clinical Consensus Statement: Septoplasty with or without Inferior Turbinate Reduction. Otolaryngol. – Head and Neck Surg. 2015;153(5):708–720. doi: 10.1177/0194599815606435.
- Malki D., Quine S.M., Pfleiderer A.G. Nasal splints, revisited. J. Laryngol. Otol. 1999;113:725–727. PMID: 10748847.
- Cukurova I., Cetinkaya E.A., Mercan G.C., et al. Retrospective analysis of 697 septoplasty surgery cases: packing versus transseptal suturing method. Acta. Otorhinolaryngol. Ital. 2012;32:111–114. PMCID: PMC3383079.
- Awan M.S., Iqbal M. Nasal packing after septoplasty: a randomized comparison of packing versus no packing in 88 patients. Ear. Nose Throat. J. 2008;87:624– 627. PMID: 19006062.
- Cook J.A., Murrant N.J., Evans K.L., et al. Intranasal splints and their effects on intranasal adhesions and septal stability. Clin. Otolaryngol. Allied. Sci. 1992;17:24–27. doi: 10.1111/j.1365-2273.1992.tb00982.x.
- Ardehali M.M., Bastaninejad S. Use of nasal packs and intranasal septal splints following septoplasty. Int. J. Oral. Maxillofac. Surg. 2009;38:1022–1024. doi:10.1016/j.ijom.2009.05.012.
- Habesoglu T.E., Kulekci S., Habesoglu M., et al. Comparative outcomes of using fibrin glue in septoplasty and its effect on mucociliary activity. Otolaryngol. – Head Neck Surg. 2010;142:394–399. doi: 10.1016/j.otohns.2009.11.036.
- Nunez D.A., Martin F.W. An evaluation of post-operative packing in nasal septal surgery. Clin. Otolaryngol. Allied. Sci. 1991;16:549–550. doi:10.1111/j.1365-2273.1991.tb00971.x.
- Quinn J.G., Bonaparte J.P., Kilty S.J. Postoperative Management in the Prevention of Complications After Septoplasty: A Systematic Review. The Laryngoscope. 2013;123:1328–1333. doi: 10.1002/lary.23848.
- Yilmaz M.S., Guven M., Elicora S.S., Kaymaz R. An Evaluation of Biodegradable Synthetic Polyurethane Foam in Patients following Septoplasty: A Prospective Randomized Trial. Otolaryngol. – Head and Neck Surg. 2013;148(1):140–144. doi: 10.1177/0194599812465587.
- Amin A.K., Hasan D.A., Saleh Jaff A.M. Trans-septal suture method versus intranasal silicone splint in septoplasty. Int. J. Techn. Res. Appl. 2015;3(3):159–165. e-ISSN: 2320-8163.
- Gajasinghe S., Wijayaratna M., Abayadeera A. Correlation between numerical rating scale (NRS) and visual analogue scale (VAS) in assessment of pain in post operative patients. J. Anaesthesiol. 2010;18(2):81–83. doi: 10.4038/slja. v18i2.2445.
- Ferreira-Valente M.A., Pais-Ribeiro J.L., Jensen M.P. Validity of four pain intensity rating scales. Pain. 2011;152:2399–2404. doi:10.1016/j. pain.2011.07.005.
- Dijk J.F.M. van, Wijck A.J.M. van, Schuurmans M.J. «Bearable pain» is not the same for men and women. Eur. J. Pain. 2009;13:S223–S224. doi: 10.1016/ S1090-3801(09)60779-5.
- Cepeda M.S., Carr D.B. Women experience more pain and require more morphine than men to achieve a similar degree of analgesia. Anesth. Analg. 2003;97:1464–1468. PMID: 14570666.
- de Cosmo G., Congedo E., Lai C., et al. Preoperative psychologic and demographic predictors of pain perception and tramadolconsumption using intravenous patient-controlled analgesia. Clin. J. Pain. 2008; 24:399–405. doi: 10.1097/AJP.0b013e3181671a08.
- Gagliese L., Gauthier L.R., Macpherson A.K., et al. Correlates of postoperative pain and intravenous patient-controlled analgesia use in younger and older surgical patients. Pain Med. 2008; 9:299–314. doi: 10.1111/j.1526- 4637.2008.00426.x.
- Chia Y.Y., Chow L.H., Hung C.C., et al. Gender and pain upon movement are associated with the requirements for postoperative patientcontrolled iv analgesia: A prospective survey of 2,298 Chinese patients. Can. J. Anaesth. 2002; 49: 249–55. doi: 10.1007/BF03020523.
- Caumo W., Schmidt A.P., Schneider C.N., et al. Preoperative predictors of moderate to intense acute postoperative pain in patients undergoing abdominal surgery. Acta. Anaesthesiol. Scand. 2002; 46:1265–1271. doi:10.1034/j.1399- 6576.2002.461015.x.
- Kalkman C.J., Visser K., Moen J., et al. Preoperative prediction of severe postoperative pain. Pain 2003; 105:415–423. doi: 10.1016/S0304- 3959(03)00252-5.
- Mamie C., Bernstein M., Morabia A., et al. Are there reliable predictors of postoperative pain? Acta. Anaesthesiol. Scand. 2004;48:234–242. doi: 10.1111/j.0001-5172.2004.00298.x.
- Chang K.Y., Dai C.Y., Ger L.P., et al. Determinants of patient-controlled epidural analgesia requirements. A prospective analysis of 1,753 patients. Clin. J. Pain. 2006;22:751–756. doi: 10.1097/01.ajp.0000210924.56654.03.
- Ip H.Yun.V., Abrishami A., Peng P.W.H., et al. Predictors of postoperative pain and analgesic consumption. A qualitative systematic review. Anesthesiol. 2009;111:657–77. doi: 10.1097/ALN.0b013e3181aae87a.
- Li L., Liu X, Herr K. Postoperative pain intensity assessment: a comparison of four scales in Chinese adults. Pain Med. 2007;8:223–234. doi: 10.1111/j.1526- 4637.2007.00296.x.
- Greenspan J.D., Craft R.M., LeResche L., et al. Studying sex and gender differences in pain and analgesia: a consensus report. Pain. 2007;132:s26–s45. doi: 10.1016/j.pain.2007.10.014.
- Berkley K.J. Sex differences in pain. Behav. Brain Sci. 1997;20:371–380. PMID: 10097000.
- Fillingim R.B. Sex, gender, and pain: Women and men really are different. Curr. Rev. Pain. 2000;4:24–30. doi:10.1007/s11916-000-0006-6.
- Ciccone G.K., Holdcroft A. Drugs and sex differences: A review of drugs relating to anaesthesia. BJA. 1999;82:255–265. PMID: 10365004.
- Riley J.L. III, Robinson M.E., Wise E.A., Price D.D. A meta-analytic review of pain perception across the menstrual cycle. Pain. 1999;81:225–235. PMID: 10431710.
Поступила 25.11.17
Принята в печать 20.02.18
Received 25.11.17
Accepted 20.02.18
Сведения об авторах:
И.В. Кастыро – к.м.н., ассистент кафедры нормальной физиологии, ассистент кафедры оториноларингологии Российского университета дружбы народов; член Международной ассоциации по изучению боли, Европейского общества ринологов, Союза европейских фониатров, Российского общества по изучению боли, Москва, Россия; e-mail: ikastyro@ gmail.com
В.И. Попадюк – д.м.н., профессор, заслуженный врач РФ, заведующий кафедрой оториноларингологии Российского университета дружбы народов; член Российского общества оториноларингологов, Европейского союза фониатров, Москва, Россия; e-mail: lorval04@mail.ru
В.И. Торшин – д.б.н., профессор, заведующий кафедрой нормальной физиологии Российского университета дружбы народов, Москва, Россия; e-mail: vtorshin@mail.ru
А.В. Баринов – студент IV курса МИ РУДН. j.a.grindman@gmail.com Г.В. Хамидулин – студент IV курса Российского университета дружбы народов, Москва, Россия; e-mail: gkhamidulin@mail.ru
М.А. Меликян – ординатор кафедры оториноларингологии Российского университета дружбы народов, Москва, Россия; e-mail: meline. melikyan.90@mail.ru
Д.П. Пономарева – студентка VI курса Российского университета дружбы народов, Москва, Россия; e-mail: dariadoll@list.ru
А.Н. Кащенко – студентка V курса Российского университета дружбы народов, Москва, Россия; e-mail: lorval04@mail.ru
Г.А. Дроздова – д.м.н., профессор, заслуженный деятель науки РФ, академик РАЕН, профессор кафедры патологической физиологии и общей патологии Российского университета дружбы народов, Москва, Россия; член Международной ассоциации по гендерным исследованиям, Москва, Россия; e-mail:g-drozdova@yandex.ru
About the authors
I.V. Kastyro – MD, assistant of the Department of Normal Physiology, Assistant of the Department of Otorhinolaryngology, Peoples’ Friendship University of Russia; a member of the International Pain Research Association, the European Society of Rhinologists, the Union of European Phoniatricians, the Russian Society for the Pain Studying, Moscow, Russia; e-mail: ikastyro@gmail.com
V.I. Popadyuk – MD, Professor, Honored Doctor of the Russian Federation, Head of the Department of Otorhinolaryngology, Peoples’ Friendship University of Russia; Member of the Russian Society of Otorhinolaryngologists, European Union of Phoniatrists, Moscow, Russia; e-mail: lorval04@mail.ru
- I. Tоrshin – doctor of biology, Professor, head of the Department of normal physiology, Peoples’ Friendship University of Russia, Moscow, Russia; e-mail: vtorshin@mail.ru
A.V. Barinov – student of the IV year of the MI PFUR. j.a.grindman@gmail.com Khamidulin Georgiy — fourth-year student of Peoples’ Friendship University of Russia, Moscow, Russia; e-mail: gkhamidulin@mail.ru
MA Melikyan – medical resident of the Department of Otorhinolaryngology, Peoples’ Friendship University of Russia, Moscow, Russia; e-mail: meline. melikyan.90@mail.ru
D.P. Ponomareva – student of the VIth year of the Russian University of Peoples’ Friendship, Moscow, Russia; e-mail: dariadoll@list.ru A
.N. Kashchenko – student of the V year, Russian Peoples Friendship University, Moscow, Russia; e-mail: lorval04@mail.ru
G.A. Drozdova – MD, Professor, Honored Scientist of the Russian Federation, Academician of the Russian Academy of Natural Sciences, Professor of the Department of Pathological Physiology and General Pathology, Peoples’ Friendship University of Russia, Moscow, Russia; member of the International Association for Gender Studies, Moscow, Russia; e-mail: g-drozdova@yandex.ru
Рецензия на статью
«ГЕНДЕРНЫЙ АСПЕКТ И ИНТЕНСИВНОСТЬ ОСТРОГО БОЛЕВОГО СИНДРОМА ПОСЛЕ СЕПТОПЛАСТИКИ». И.В. Кастыро, В.И. Попадюк, В.И. Трошин, А.В. Баринов, Г.В. Хамидулин, М.А. Меликян, Д.П. Пономарева, А.Н. Кащенко, Г.А. Дроздова
В статье приводятся данные сравнения болевого синдрома в раннем послеоперационном периоде у женщин и мужчин, которым была проведена септопластика.
Необходимо обратить внимание авторов, что понятия «гендер» и «пол» не являются синонимами. В дальнейших статьях, посвященных гендерным исследованиям боли, авторам целесообразно представить данные по предварительной оценке гендерной принадлежности пациентов.
На сегодняшний день статья является крайне актуальной, т.к. в России подобных исследований проводится крайне мало и данный вопрос незаслуженно обделен вниманием клиницистов, особенно на фоне стремительно развивающегося социума и стирания граней между половой принадлежностью.
В статье представлены интересные результаты, полученные с помощью грамотно использованных методов статистической обработки. Особенно ценным представляются данные по использованию цифровой рейтинговой шкалы у женщин при выраженном болевом синдроме после операции на перегородке носа. Полученные жакты необходимо учитывать при прогнозировании и назначении анальгетической терапии после проведения cептопластики.
Review on the article
GENDER ASPECT AND INTENSITIVITY OF ACUTE PAIN SYNDROME AFTER SEPTOPLASTICS I.V. Kastyro, V.I. Popadyuk, V.I. Tоrshin, A.V. Barinov, G.V. Khamidulin, M.A. Melikyan, D.P. Ponomareva, A.N. Kashchenko, G.A. Drozdova
In the article the authors present the comparison of the pain syndrome in the early postoperative period in women and men who underwent septoplasty.
It is necessary to draw the authors’ attention that the concepts of «gender» and «sex» are not synonyms. In further articles on gender researchs of pain, it would be useful to provide data on a preliminary assessment of gender specifics of patients.
To date, the article is extremely relevant, because in Russia, such studies are very few and this issue is undeservedly avoided by clinicians, while the society rapidly develops with the erasure of facets between sex.
The article presents interesting results obtained with the help of correctly used methods of statistical processing. Especially valuable are the data on the use of the digital rating scale in women with severe pain after surgery on the septum of the nose. Such facts must be taken into account when predicting and prescribing analgesic therapy after septoplasty.