Для цитирования:
Васильева Е.С., Вашура А.Ю., Захаров И.В., Литвинов Д.В. Применение различных методов энтерального питания у ребенка с медуллобластомой на этапе противоопухолевого лечения. Голова и шея. Head and neck Russian Journal. 2018;6(4):44–47.
For citation:
Vasilyeva E.S., Vashura A.Yu., Zakharov I.V., Litvinov D.V. Different methods of enteral nutrition for a child with meddullblastoma during anti-tumor treatment. Head and neck Russian Journal. 2018;6(4):44–47 (in Russian).
Doi: 10.25792/HN.2018.6.4.44–47
У детей с онкологическими заболеваниями часто имеются нарушения нутритивного статуса, что доказанно ухудшает прогноз заболевания, снижает эффективность терапии и увеличивает ее токсичность. Нарушения вкусоощущения, потеря аппетита, появление тошноты у детей во время приема пищи значительно снижают возможность оральной алиментации во время лечения и во многих случаях делают ее почти невозможной. В то же время энтеральное питание является физиологичным и более приемлемым для многих пациентов в противовес довольно распространенному в таких случаях полному парентеральному питанию, не всегда оправданному у таких детей.
Мы приводим клинический случай пациентки 12 лет с диагнозом медуллобластома, где на этапе противоопухолевого лечения проводился подбор энтерального питания различными способами, в т.ч. через гастростому, со значительным положительным эффектом. Опыт показывает, что при возможности постановки гастростомы и сохраненной функции кишечника проблемы с аппетитом, инверсии вкуса, тошнота не являются серьезными препятствиями для проведения адекватной нутритивной поддержки энтеральным путем.
Ключевые слова: опухоли центральной нервной системы, нутритивная поддержка, энтеральное питание, чрескожная гастростомия
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Васильева Е.С., Вашура А.Ю., Захаров И.В., Литвинов Д.В. Применение различных методов энтерального питания у ребенка с медуллобластомой на этапе противоопухолевого лечения. Голова и шея. Head and neck Russian Journal. 2018;6(4):44–47.
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Children with various malignancies often have nutritional disorders, which significantly worsen the disease prognosis, reduce the effectiveness of therapy and increase its toxicity. Taste disorders, loss of appetite, and nausea reduce the possibility of oral alimentation during treatment and in many cases make it almost impossible. At the same time, enteral nutrition is physiological and more acceptable for many patients as opposed to complete parenteral nutrition, which is quite common in such cases, but is not always justified. We present a clinical case of a 12-year-old patient with medulloblastoma, when enteral nutrition in various ways was selected during treatment, including feeding through gastrostoma, with a significant positive effect. Experience shows that, with the possibility of gastrostomy and preserved intestinal function, problems with appetite, taste inversion, and nausea are not serious obstacles for adequate enteral nutrition.
Keywords: central nervous system tumors, nutritional support, enteral nutrition, percutaneous gastrostomy
Authors declare no conflict of interest
Foundation source – not specified.
For citation: Vasilyeva E.S., Vashura A.Yu., Zakharov I.V., Litvinov D.V. Different methods of enteral nutrition for a child with meddullblastoma during anti-tumor treatment. Head and neck. Russian Journal. 2018;6(4):44–47 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material — tables, pictures, patients’ photographs.
Введение
Как известно, у детей с онкологическими заболеваниями часто имеются нарушения нутритивного статуса, которые могут быть как одним из проявлений основного заболевания, так и результатом противоопухолевого лечения, сочетающего в себе токсические химиопрепараты и лучевую терапию [1–5]. Нутритивные нарушения доказанно ухудшают прогноз заболевания, снижают эффективность терапии и увеличивают ее токсичность. Кроме этого сохраняющиеся нутритивные и метаболические нарушения после окончания лечения значительно снижают качество жизни ребенка, затрудняют его комплексную реабилитацию и восстановление [1, 3, 4, 6, 7]. Также известны нарушения вкусоощущения, потеря аппетита, появление тошноты и болезненных ощущений во время приема пищи у таких детей во время лечения [1, 2, 8, 9]. Эти факторы значительно снижают возможность адекватной оральной алиментации (т.е. питания пациента естественным путем) и во многих случаях делают ее почти невозможной.
В то же время энтеральное питание является физиологичным и более приемлемым для многих пациентов во время противоопухолевого лечения хотя бы с частично сохраненной функцией кишечника, в противовес довольно распространенному в таких случаях полному парентеральному питанию, не всегда оправданному у таких пациентов, поскольку регулярное энтеральное питание, даже в малых количествах, позволяет осуществить трофику поврежденного кишечного тракта, что призвано сократить время восстановления его нормальной функции после окончания токсического воздействия. В таких случаях более целесообразно и физиологично использовать возможность энтерального питания через зонд или гастростому с целью максимально сохранить и поддержать функции гастроинтестинального тракта во время лечения и после него.
Мы приводим описание клинического случая, когда во время противоопухолевого лечения пациентки динамично применялись различные методы энтерального питания в качестве нутритивной поддержки, и оцениваем их эффективность.
Клинический случай
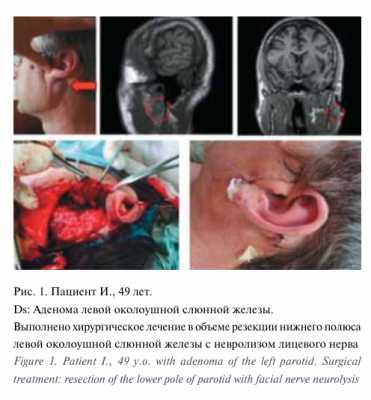
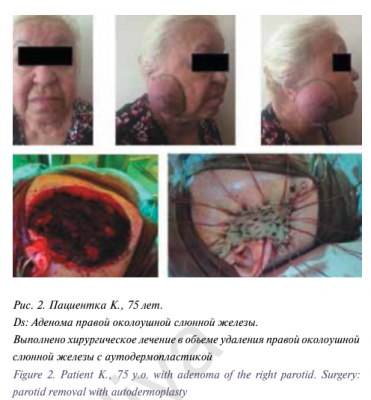
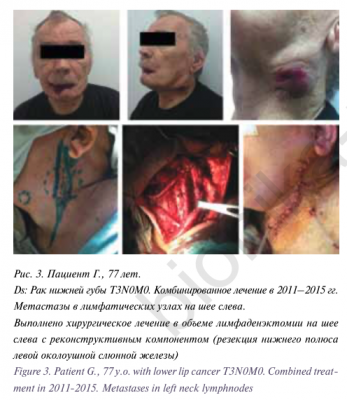
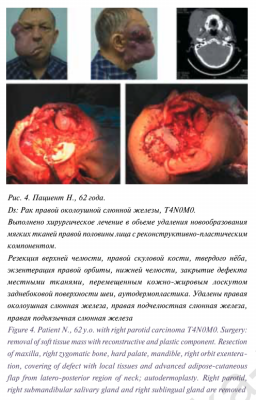
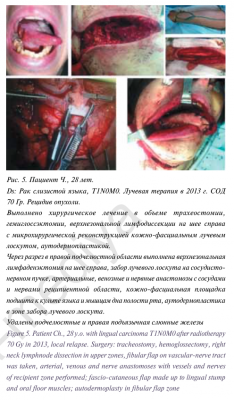
Пациентка Н., 12 лет находилась на лечении в ФГБУ «ННПЦ ДГОИ им. Дмитрия Рогачева» МЗ РФ в отделении гематологии/онкологии для подростков и молодежи с диагнозом: «Медуллобластома червя мозжечка и четвертого желудочка головного мозга. Состояние после комплексного лечения (оперативного и химиолучевого)».
При поступлении в клинику была проведена оценка нутритивного статуса (НС) пациентки по следующим показателям: рост (м), масса тела (кг), индекс массы тела (ИМТ, кг/м2 ), толщина кожно-жировой складки над трицепсом (КЖСТ, мм), окружность плеча (ОП, см), окружность мышц плеча (ОМП, см). Измерение КЖСТ проводили с помощью электронного калипера. Измерение ОП проводили гибкой сантиметровой лентой на уровне средней трети плеча левой (нерабочей) руки. ИМТ, или индекс Кетле рассчитывали по формуле: ИМТ=масса тела (кг)/рост (м2 ). Величина ОМП вычислялась по формуле: ОМП (см)=ОП (см)-0,314×КЖСТ (мм).
Перцентильные значения полученных показателей определяли по таблицам центильных величин [10, 11].
Также проводилась оценка тканевого состава тела с помощью биоимпедансного анализа (аппарат АВС-01 «Медасс»).
При первичной оценке НС у пациентки была диагностирована тяжелая нутритивная недостаточность. Так, показатели ИМТ, ОП, КЖСТ были менее 5 перцентиля. Показатель ОМП соответствовал значениям менее 5 перцентиля, что указывало на выраженный дефицит соматического пула белка.
При первичной консультации диетолога отмечались жалобы на выраженное снижение аппетита, избирательность вкуса на фоне проведения полихимиотерапии (ПХТ).
Оценка фактического питания выявила значительный дефицит поступления основных нутриентов и энергии с лечебным рационом (рис. 1). Так, обеспечение жирами и углеводами составляло 62 и 68% от индивидуальной нормы потребности соответственно. Наибольший дефицит был выявлен по белку (42%), что было обусловлено отсутствием в рационе высокобелковых продуктов. Также отмечалось снижение поступления энергии в рационе до 65% от индивидуальной нормы потребности.
По данным биоимпедансного обследования было выявлено снижение показателей жировой и тощей (безжировой) массы тела, а также активной клеточной массы.
В биохимическом анализе крови отмечалась гипопротеини гипоальбуминемия (53 и 33 г/л соответственно).
Таким образом, наличие тяжелой нутритивной недостаточности, невозможность адекватного нутритивного обеспечения за счет лечебного рациона послужили показанием к назначению активной нутритивной поддержки. Первым этапом нутритивной поддержки явилось назначение полимерной смеси для энтерального питания методом сипинга. Пациентке предлагались как изокалорические (1 ккал/мл), так и гиперкалорические (1,5 ккал/мл) смеси. Суточный объем энтеральной нагрузки определялся видом смеси, а также состоянием фактического питания. Однако, несмотря на разнообразный ассортимент и различные вкусовые варианты предлагаемых продуктов для энтерального питания, объем самостоятельно усваиваемой смеси за сутки составлял не более 150–180 мл, что в совокупности с основным рационом не могло удовлетворить потребность в белке и энергии. Через 7 дней после начала нутритивной недостаточности девочка отказалась от перорального приема смеси, что было обусловлено выраженным снижением аппетита, наличием тошноты на фоне проводимой ПХТ.
С целью оптимизации нутритивного обеспечения ребенку был установлен назогастральный зонд, через который начато питание. Период зондового питания продлился 32 дня. На начальных этапах питания через назогастральный зонд в связи с проявлениями энтероколита на фоне проводимой ПХТ была назначена олигомерная смесь на основе гидролизата белка (в течение 10 дней) с последующим переводом на полимерную смесь (сначала изо-, затем гиперкалорическую). Объем энтеральной нагрузки варьировался от 1000 до 1500 мл/сут (1500–1750 ккал/сут) в зависимости от вида смеси и состояния. Дополнительно к энтеральному питанию пациентка получала обычную пищу перорально в небольших объемах, сколько получалось съесть. На фоне зондового питания у пациентки стала отмечаться положительная динамика НС. По данным проведенных антропометрических обследований в динамике на конечном этапе (через 32 дня от начала) зондового питания прибавка массы тела составила +1,7 кг от исходного уровня. Показатели ИМТ, ОМП увеличились и уже соответствовали умеренной нутритивной недостаточности.
По результатам оценки фактического питания через месяц после начала зондового питания сохранялся выраженный дефицит поступления макронутриентов и энергии с обычным рационом. Обеспечение белком за счет основного рациона на конечных этапах зондового питания составляло 45% от индивидуальной нормы потребности, жирами и углеводами – 60 и 65% соответственно, энергией – до 62%.
В связи с сохраняющимся выраженным снижением аппетита, невозможностью обеспечения нутритивной потребности за счет основного рациона и перорального приема смеси, а также предстоящими этапами противоопухолевого лечения (химио- и лучевой терапии) с целью проведения дальнейшей оптимальной нутритивной поддержки было принято решение о наложении гастростомы. Пациентке была проведена чрескожная эндоскопическая гастростомия (питательная трубка MIC KEY 16 Fr 1,5 см), и на следующий день продолжено энтеральное питание через гастростому. На данном этапе нутритивной поддержки использовались полимерные изо- и гиперкалорийные смеси. При возникновении симптомов энтероколита на фоне проводимой ПХТ использовались полуэлементные смеси для энтерального питания (длительность применения данных смесей составляла около 5–7 дней с последующим переходом на стандартную смесь). Суточный объем энтерального питания сохранялся в пределах от 1000 до 1500 мл. Смесь вводилась болюсно (в разовом объеме 150–180 мл) с удовлетворительной переносимостью. В период возникновения тошноты и рвоты на фоне проводимого противоопухолевого лечения режим введения смеси менялся на капельный (через инфузомат).
Длительность этапа энтерального питания с использованием гастростомы составила 5 месяцев. На данном этапе нутритивной поддержки была отмечена значимая положительная динамика антропометрических показателей (рис. 2). Так, показатели ИМТ и ОМП соответствовали нормальным значениям (63,5 и 25 перцентиль соответственно). Прибавка массы тела на фоне энтерального питания через гастростому составила 9,8 кг за 5 месяцев.
По данным биоимпедансного обследования положительная динамика НС на фоне проведения зондового питания и в первые 2 месяца питания через гастростому выражалась в основном за счет увеличения показателя жировой массы тела, что было обусловлено низкой физической активностью (девочка в основном соблюдала постельный режим). При оценке тканевого состава тела на конечных этапах наблюдения была выявлена положительная динамика тощей массы тела, т.к. улучшение нутритивного обеспечения сопровождалось повышением активности пациентки, что позволило начать регулярные занятия лечебной физкультурой. На фоне нарастания физической активности было зарегистрировано также снижение показателя жировой массы тела (рис. 3).
Следует отметить, что по мере улучшения показателей НС на фоне нутритивной поддержки отмечалось значительное улучшение аппетита. После достижения стойкой нормализации НС гастростома была удалена. Пациентка переведена на нутритивную поддержку полимерными гиперкалорическими смесями методом сипинга.
Заключение
Описанный случай наглядно показывает, как использование современных методов нутритивной поддержки с использованием гастростомы позволяет добиться нормализации НС у пациентки с исходной тяжелой белково-энергетической недостаточностью на фоне проведения агрессивной противоопухолевой терапии без сопутствующего парентерального питания.
Также наглядно продемонстрирована важность своевременного назначения соответствующей нутритивной поддержки еще на первых этапах противоопухолевого лечения. Отсутствие возможности адекватной пероральной алиментации отнюдь не означает невозможности адекватного энтерального питания и обязательное назначение парентерального питания. В современных условиях при возможности постановки гастростомы, сохраненной функции кишечника и доступности специальных лечебных питательных смесей проблемы с аппетитом, инверсии вкуса, тошнота не являются серьезными препятствиями для проведения адекватной нутритивной поддержки энтеральным путем.
Полученные нами данные оценки тканевого состава тела свидетельствуют о целесообразности проведения нутритивной поддержки параллельно с применением физических методов реабилитации пациента.
ЛИТЕРАТУРА/REFERENCES
- Bauer J., Jürgens H., Michael C. Frühwald. Important Aspects of Nutrition in Children with Cancer. Adv. Nutr. 2011;2:67–77.
- Fearon K.C., Voss A.C., Hustead D.S. Definition of cancer cachexia: effect of weight loss, reduced food intake, and systemic inflammation on functional status and prognosis. Am. J. Clin. Nutr. 2006;83:1345–50.
- Arends J., Bodoky G., Bozzetti F., et al. ESPEN Guidelines on Enteral Nutrition: Non-surgical oncology. Clin. Nutr. 2006;25:245–59.
- Armstrong G.T., Stovall M., Robison L.L. Long-Term effects of radiation exposure among adult survivors of childhood cancer: results from the childhood cancer survivor study. Radiat. Res. 2010;174:840–50.
- Baltazar L.E., Omaña Guzmán L.I., Ortiz H.L., et al. Nutritional status in patients first hospital admissions service hematology National Cancer Institute. Nutr. Hosp. 2013;28(4):1259–65.
- Seyfried T.N., Flores R.E., Poff A., et al. Cancer as a metabolic disease: implications for novel therapeutics. Carcinogenesis. 2014;35(3):515–27.
- Arpaci T., Kilicarslan Toruner E. Assessment of problems and symptoms in survivors of childhood acute lymphoblastic leukaemia. Eur. J. Cancer Care (Engl). 2016;25(6):1034–43. doi: 10.1111/ecc.12561. Epub 2016 Sep 20.
- Klanjsek P., Pajnkihar M. Causes of inadequate intake of nutrients during the treatment of children with chemotherapy. Eur. J. Oncol. Nurs. 2016;23:24– 33. doi: 10.1016/j.ejon.2016.03.003. Epub 2016 May 4.
- Cohen J., Laing D.G., Wilkes F.J., Chan A., Gabriel M., Cohn R.J. Taste and smell dysfunction in childhood cancer survivors. Appetite. 2014;75:135–40. doi: 10.1016/j.appet.2014.01.001. [Epub 2014 Jan 8].
- Department of Nutrition for Health and Development, World Health Organization. WHO child growth standards: length/height-for-age, weight-forage, weight-for-length, weight-forheight and body mass index-for-age: methods and development. WHO Library Cataloguing-in-Publication Data. 2006. Р. 312.
- Department of Nutrition for Health and Development, World Health Organization. WHO child growth standards: head circumference-for-age, arm circumference-forage, triceps skinfold-for-age and subscapular skinfold-for-age: methods and development. WHO Library Cataloguing-in-Publication Data. 2007. p. 217.
Поступила 16.10.18 Принята в печать 23.11.18
Received 16.10.18 Accepted 23.11.18
Информация об авторах:
Е.С. Васильева – к.м.н., врач-педиатр группы нутритивной поддержки ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава РФ; Москва, Россия; e-mail: ekaterina-vasil@mail.ru.
А.Ю. Вашура – к.м.н., врач-диетолог, заведующий отделом научных основ питания и нутритивно-метаболической терапии ЛРНЦ «Русское поле» ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева». E-mail: avashura@gmail.com.
И.В. Захаров – врач-хирург, ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава РФ; Москва, Россия; e-mail: zah.82.82@mail.ru. Д.В. Литвинов – к.м.н., заместитель медицинского директора (главный врач) ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева». E-mail: litvinov_d_v@ mail.ru.
About the authors:
E.S. Vasilyeva – PhD physician Dmitry Rogachev National Research Center of Pediatric Hematology, Oncology and Immunology, Russian Federation, Moscow, Russia; e-mail: ekaterina-vasil@mail.ru.
A.Yu. Vashura – PhD physician Chief of department of nutrtional science and nutritional-metabolic therapy Dmitry Rogachev National Research Center of Pediatric Hematology, Oncology and Immunology, Russian Federation, Moscow, Russia; e-mail: avashura@gmail.com.
I.V. Zakcharov – surgeon Dmitry Rogachev National Research Center of Pediatric Hematology, Oncology and Immunology, Russian Federation, Moscow, Russia; e-mail: zah.82.82@mail.ru.
D.V. Litvinov – PhD head physician Dmitry Rogachev National Research Center of Pediatric Hematology, Oncology and Immunology, Russian Federation, Moscow, Russia; e-mail: litvinov_d_v@mail.ru.