Для цитирования:
Решетов И.В., Сукорцева Н.С., Шевалгин А.А., Агакина Ю.С., Багдасаров П.С., Насилевский П.А. Комбинированный метод лечения рака ротоглотки – клиническое наблюдение. Голова и шея Head and neck Russian Journal. 2018;6(4):37–43
For citation:
Reshetov I.V., Sukortseva N.S., Shevalgin A.A., Agakina Yu.S., Bagdasarov P.S., Nasilevsky P.A. Combined method of oropharyngeal cancer treatment: a clinical case. Head and neck Russian Journal. 2018;6(4):37–43 (in Russian).
Doi: 10.25792/HN.2018.6.4.37–43
Определение тактики лечения у пациентов с раком ротоглотки в настоящее время является сложным вопросом, в котором найдены не все ответы на важные вопросы. Метод лечения складывается на основании клинического проявления заболевания, его стадии. При резектабельных опухолях ротоглотки (плоскоклеточный рак, аденокарцинома) применяются различные методы лечения, одним из которых является трехкомпонентная индукционная химиотерапия (TPF, 2–3 цикла) с оценкой клинического эффекта и дальнейшим проведением хирургического лечения. При раннем раке ротоглотки возможно применение трансоральной робот-ассистированной операции, которая в России и в мире открывает новую эру в хирургической тактике лечения злокачественных новообразований ротоглотки. Трансоральная роботическая хирургия успешно вошла в клиническую практику врачей онкологов благодаря малоинвазивности, прецизионности и простоте оперирования за счет использования модифицированных технологических решений. Не менее важным фактором в лечении опухолей данной локализации является восстановление функциональности оперируемого органа, вкупе влияющее на качество жизни пациента.
Цель работы: внедрение в клиническую практику лечения пациентов с раком ротоглотки на ранних стадиях развития заболевания (Т1–Т2) неоадьювантной химиотерапии по схеме TPF в сочетании с трансоральной роботической операцией (TORS).
Материал и методы. В онкологическом центре Сеченовского университета разработан комбинированный подход к лечению пациентов со злокачественными новообразованиями ротоглотки с применением индукционной химиотерапии по схеме TPF 2–3 курса (доцетаксел 75 мг/м2, цисплатин 75 мг/м2, 5-фторурацил 1000 мг/м2 ) и последующим проведением трансоральной робот-ассистированной резекции ротоглотки. Данное исследование посвящено описанию клинического примера применения индукционной химиотерапии и роботохирургии у пациента с плоскоклеточным раком ротоглотки.
Результаты. В ходе проведенного лечения у больного после 3 курсов неоадьювантной химиотерапии по схеме TPF отмечена частичная регрессия опухоли (более 50%) с дальнейшим проведением трансоральной робот-ассистированной резекции ротоглотки. Отличительной чертой течения послеоперационного периода была ранняя активация пациента, сокращение сроков нахождения в стационаре, а также удовлетворительный косметический и функциональный результаты. Заключение. Использование настоящей тактики при лечении опухолей ротоглотки и полости рта позволяет в короткий период перейти к следующим этапам лечения (химиотерапия, лучевая терапия), обеспечивая комбинированный подход к лечению опухолей головы и шеи. Ключевые слова: рак ротоглотки, трансоральная роботическая хирургия, индукционная химиотерапия, TORS
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Решетов И.В., Сукорцева Н.С., Шевалгин А.А., Агакина Ю.С., Багдасаров П.С., Насилевский П.А. Комбинированный метод лечения рака ротоглотки – клиническое наблюдение. Голова и шея Head and neck Russian Journal. 2018;6(4):37–43
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Background. Determining the treatment tactics for patients with oropharyngeal cancer is always a challenging problem. The treatment method choice is usually based on the clinical manifestation of the disease and its stage.
For resectable oropharyngeal tumors (squamous cell carcinoma, adenocarcinoma), various treatment methods are used, one of which is three-component induction chemotherapy (TPF regimen, 2-3 cycles) with clinical effect assessment and further surgical treatment. In case of early cancer, transoral robot-assisted surgery is possible, which opens up a new era in oropharyngeal malignancies surgery being minimally invasive, precise and easy. One more equally important factor is the possibility to restore the function of the operated organ, coupled with affecting the patient’s quality of life.
Purpose: the introduction of neoadjuvant chemotherapy (TPF regimen) in combination with transoral robotic surgery (TORS) into clinical practice of early (T1-2) oropharyngeal cancer patients’ treatment.
Material and methods. An induction chemotherapy (TPF regimen, 2–3 courses with docetaxel 75 mg/m2 , cisplatin 75 mg/m2 , 5-fluorouracil 1000 mg/m2 ) followed by transoral robot-assisted resection of the oropharynx was used for the treatment of a patient with oropharyngeal squamous cell carcinoma and presented as a clinical case. Conclusion: such treatment tactics allows proceeding to the next stages of therapy (chemotherapy, radiation therapy) in the short period, providing complex treatment of patients with oropharyngeal and oral cavity tumors.
Key words: oropharyngeal cancer, transoral robotic surgery, induction chemotherapy, TORS
The authors declare no conflict of interest.
Source of financing: not specified.
For citation: Reshetov I.V., Sukortseva N.S., Shevalgin A.A., Agakina Yu.S., Bagdasarov P.S., Nasilevsky P.A. Combined method of oropharyngeal cancer treatment: a clinical case. Head and neck Russian Journal. 2018;6(4):37–43 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients.
Введение
Заболеваемость злокачественными новообразованиями головы и шеи в общей структуре онкологической заболеваемости составляет 15%, а основной морфологической формой заболевания в 90% случаев является плоскоклеточный рак. Изменилась классическая картина «лидеров» среди локализации опухолей головы и шеи. При этом наблюдается снижение заболеваемости передних отделов полости рта (губы и дно полости рта) в сторону значительного роста случаев рака ротоглотки. Одной из причин происходящих изменений являются новые канцерогенные факторы, приходящие на смену классическим (табакокурение и алкоголь): вирусы папилломы и Эпштейна-Барр, накапливающиеся в популяции мутации онкогенов и др. [1]. В 2017 г. заболеваемость раком ротоглотки составила 5043 впервые выявленных случаев, в т.ч. впервые выявленных активно 9,8% случаев, в то время как абсолютное число больных злокачественными опухолями глотки составило 17 539 (0,48%) среди всех больных злокачественными опухолями. Так как злокачественные новообразования головы и шеи обладают высокой степенью злокачественности, быстрым ростом и распространением на физиологически и анатомически важные структуры головы и шеи, проблема полноценного лечения этих опухолей по сей день не решена. Выживаемость в группе больных раком глотки остается низкой. Показатель применения хирургического метода лечения в комбинации другими методами в целом по России составил 85,9% [2]. Плоскоклеточный рак ротоглотки составляет приблизительно 12% от всех злокачественных опухолей головы и шеи в мире. Плоскоклеточный рак ротоглотки – заболевание, связанное с курением и употреблением алкоголя. Хотя эти два канцерогена продолжают играть значительную роль в развитии плоскоклеточного рака ротоглотки, вирус папилломы человека (ВПЧ, особенно тип 16) был признан наиболее распространенным фактором, связанным с возникновением этого заболевания в Соединенных Штатах. ВПЧ 16 также является наиболее распространенным фактором развития рака шейки матки у женщин, а заболеваемость раком ротоглотки, связанная с ВПЧ 16, как предполагается, превзойдет заболеваемость раком шейки матки к 2020 г. [3]. Рак ротоглотки лечится хирургическим путем, лучевой терапией, химиотерапией или комбинацией этих методов. Ротоглотка – сложная область, в которой непросто провести хирургическое вмешательство. Традиционное хирургическое лечение осуществляется путем мандибулотомии и фаринготомии. Эти «открытые подходы» требуют наложения трахеостомы и проведения реконструктивного этапа и часто подвергаются критике в связи с хирургическими послеоперационными осложнениями (кровотечение, формирование свищей, затеков, диастаз краев раны) и длительным временем заживления. С ростом популярности сопутствующей химиотерапии и лучевой терапии при лечении злокачественных новообразований головы и шеи лечение плоскоклеточного рака ротоглотки в начале 2000-х гг. было преимущественно неоперационным [4]. Но прогресс в хирургических технологиях, изменение возраста пациентов, прогноз, связанный с ростом заболеваемости раком ротоглотки, ассоциированным с ВПЧ, и результаты длительности заболеваемости после моно-, химиолучевой терапии привели к возрождению интереса к трансоральной хирургии в рамках проведения комплексного лечения больных [5, 6]. Анализируя данные литературы по лечению начальных форм рака ротоглотки, можно выделить 2 основные тактики: проведение лучевой терапии, где общая двухлетняя выживаемость составляет 84–96%, и хирургическое вмешательство с выживаемостью 82–94% [7]. При одинаковой эффективности методов лечения на первое место выходит функциональность органа и качество жизни пациента. Ряд исследований, оценивающих долгосрочные результаты после перенесенной лучевой терапии, показывают, что у пациентов возникают функциональные нарушения, в т.ч. стойкие нарушения глотания, сухость во рту, снижение голосовой функции, нарушение разграничительной функции с предрасположенностью к аспирации [8, 9]. При применении индукционной химиотерапии (TPF) у больных плоскоклеточным раком ротоглотки можно достигнуть положительного клинического результата в 93,3% случаев, причем в 26,6% случаев достигается полная резорбция опухоли [10]. Исследование Young Min Park и соавт. [11] показало хорошие онкологические и функциональные результаты для пациентов орофарингеальным раком после проведения неоадьювантной химиотерапии и роботической резекции опухоли. Несмотря на то что необходимы дальнейшие масштабные многоцентровые исследования с более длительными периодами наблюдения, это исследование показало, что неоадьювантная химиотерапия в сочетании с трансоральной роботической хирургией эффективна при лечении рака ротоглотки. Все пациенты переходили на прием пищи через рот в среднем на 8-е сутки после операции, 83,9% пациентов отмечали улучшение глотания, и ни одному из пациентов не потребовалась трахеостомия. Авторы не сталкивались с периоперационными осложнениями, связанными с химиотерапией. Все хирургические дефекты заживали вторичным натяжением, и никаких осложнений, таких как отсроченное заживление ран, не отмечалось. Современными требованиями лечения пациентов со злокачественными новообразованиями являются не только излечение, но и восстановление функции оперированного органа. Особое значение уделяется отдаленным функциональным результатам после проведенного оперативного вмешательства. В связи с этим применение неоадьювантной химиотерапии в сочетании с трансоральной роботохирургией в лечении опухолей ротоглотки представляется как вариант выбора у больных, находящихся на ранних стадиях развития онкологического заболевания.
Материал и методы
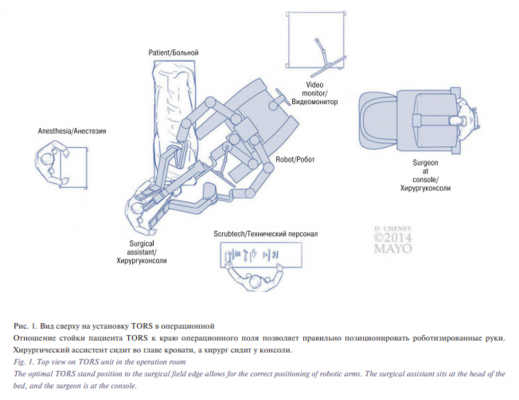
Техника проведения операции. После завершения интубации, при этом пациент лежит на спине, операционный стол располагается так, что голова повернута на 90° от анестезиолога, устанавливается роторасширитель, чтобы получить максимально возможный доступ к опухоли. Робот своим основанием устанавливается справа от пациента и слегка отклонен от операционного стола. Для TORS используются три роботизированных руки: камера размещена посередине, левая рука используется для удержанияивания зажима/диссектора, а правая рука используется для удерживания монополярной коагуляции. Для боковой резекции устанавливается 00 камера, а для резекции основания языка используется 300-бинокулярная камера. Руки располагаются так, что точка поворота находится на уровне комиссуры полости рта, а руки расположены так, что они имеют наименьший шанс столкновения. Ассистент, имеющий опыт в роботических операциях, сидит во главе с доступом к различным инструментам, включая эвакуатор дыма, зажимы, биполярный коагулятор, достаточно длинный, чтобы добраться до основания языка, и эндоскопические сосудистые клипсы. Мониторы должны быть размещены так, чтобы ассистент и медсестра имели четкую визуализацию роботизированного хирургического поля (рис. 1).
Клинический случай
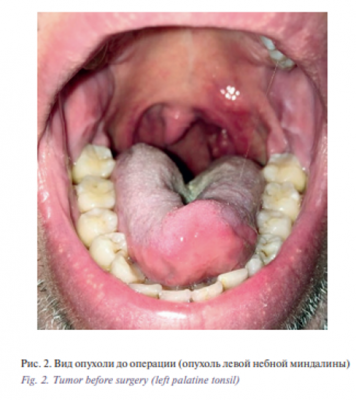
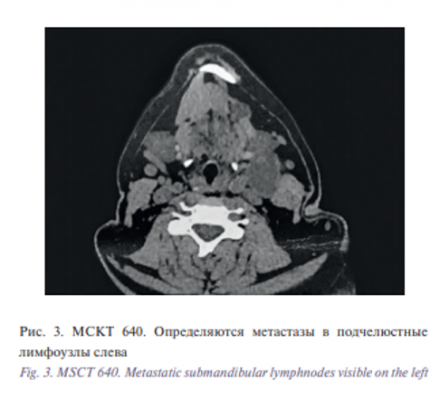
Клиническое наблюдение пациента Т., 59 лет, с клиническим диагнозом: «Рак ротоглотки (левая небная миндалина) с метастазами в л/у шеи слева T2N2M0, IVа стадия». В июне 2017 г. пациент отметил першение в горле, в августе 2017 г. отметил уплотнение в левой половине глотки. Тогда же появилась отечность в левой подчелюстной области. Обратился за медицинской помощью. По назначению ЛОР-врача в течение 3 дней принимал аугментин 1000 мг 2 раза в сутки, без эффекта. В клинической больнице №1 УДП РФ проведено дообследование, по данным которого выявлен рак левой небной миндалины. Гистологическое исследование от 10.08.2017 №3690 (биопсия левой небной миндалины) – участок фиброзированной основы с диффузной лимфоидноклеточной инфильтрацией и разрастанием высокодифференцированного плоскоклеточного рака. Цитологическое исследование образования шеи от 11.08.2017: клетки злокачественной опухоли в исследованном материале не обнаружены (рис. 2). Пациент обратился в онкологический центр Сеченовского университета, обсужден на консилиуме от 18.08.2017 во главе с академиком И.В. Решетовым, рекомендовано комбинированное лечение: на первом этапе проведение 3 курсов индукционной химиотерапии по схеме TPF (доцетаксел 75 мг/м2 , цисплатин 75 мг/м2 , 5-фторурацил 1000 мг/м2 ) в зависимости от переносимости и гематотоксичности под контролем показателей крови, с дальнейшим проведением хирургического малоинвазивного робот-ассистированного вмешательства. Пациенту в период с 18.08.2017 по 11.10.2017 проведено 3 курса химиотерапии по схеме TPF. Учитывая антропометрические данные: рост 185 см, масса тела 105 кг, площадь поверхности тела 2,34 м2 , индекс массы тела 30,6 кг/м2 , больному рассчитан режим дозирования химиопрепаратов:1) доцетаксел 150 мг+0,9% р-р NaCl 500 мл в течение 1 часа; 2) цисплатин 150 мг+0,9% р-р NaCl 500 мл в течение 3 часов; 3) 5-фторурацил 6800 мг, 96-часовая инфузия. Терапия сопровождения: антиэметики – ондансетрон 8 мг внутримышечно перед началом курса и при предъявлении жалоб на тошноту; кортикостероиды – дексаметазон 8 мг внутримышечно, 1 раз в сутки в течение 3 дней. Лечение перенес удовлетворительно, токсические реакции были выражены умеренно. У больного после проведения 3 курсов химиотерапии отмечена положительная динамика – регрессия опухоли на 50%. В рамках предоперационной подготовки больному проведена мультиспиральная томография (МСКТ) 640 головы и шеи от 09.11.2017: мягкие ткани шеи симметричны, просветы носоглотки, ротоглотки симметричны, не сужены, при введении контрастного препарата очагов патологической плотности в данной области не выявлено. В проекции среднего отдела левой челюстно-лицевой мышцы определяется структура с четкими и ровными контурами, размерами до 11,7×11×10 мм, средней плотностью +3 ед.Н. В окологлоточном пространстве слева определяется образование овальной формы с четкими, ровными контурами, размерами до 33,1×25,6×40,6 мм (без изменения по сравнению с данными от 10.08.2017), неоднородной плотности (с нативную фазу в среднем +34 ед.Н), неоднородной структуры, в артериальную фазу неравномерно накапливает контраст: в периферических отделах плотность составляет до +110 ед.Н, в центральных – до +40 ед.Н. Выявленная структура интимно прилежит и оттесняет кпереди левую поднижнечелюстную слюнную железу, кзади – левую грудино-ключично-сосцевидную мышцу. Убедительных признаков прорастания не выявлено (рис. 3).
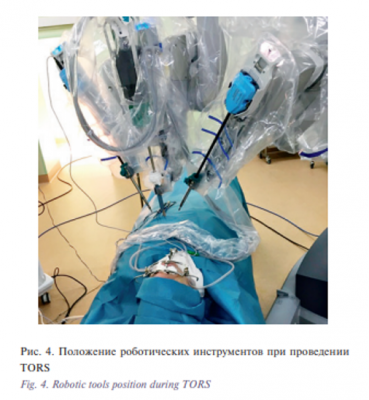
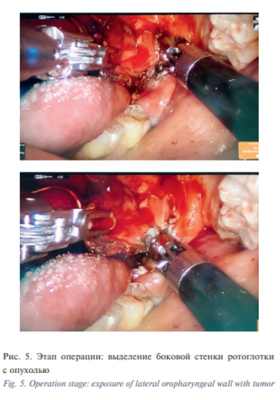
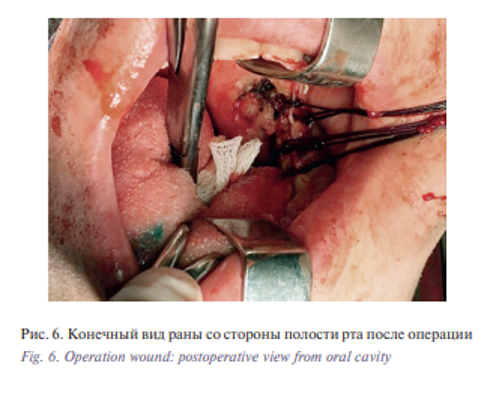
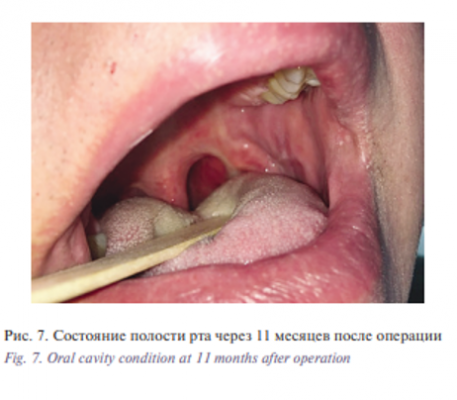
В дальнейшем 17.11.2017 больному выполнена операция – робот-ассистированная резекция боковой стенки ротоглотки слева. Лимфаденэктомия на шее слева. Резекция ротоглотки была выполнена трансоральным доступом. После обработки операционного поля и рук хирурга в условиях эндотрахеального наркоза, по предварительной разметке первым этапом выполнена лимфаденэктомия на шее слева, удалены 1–5 группы лимфоузлов боковой поверхности шеи, рана дренирована трубчатым дренажем, послойное ушивание раны нитью Викрил 3-0, интрадермальный шов – нитью Пролен 5-0. Далее выполнена установка роторасширителя Dingman, обеспечивающего четкий контроль положения языка и препятствующего смыканию челюстей, и интраоральная установка роботических манипуляторов и манипулятора камеры (рис. 4) В условиях трехмерного эндоскопа визуализируется остаточная опухоль в области левой небной миндалины с распространением на ротоглотку. Роботическими манипуляторами выполнена фиксация новообразования с его последующим выделением с помощью биполярного диссектора Maryland Bipolar forceps и зажима Proqrasp (рис. 5). Препарат удален, гемостаз. Далее выполнена радиочастотная термоаблация области операции. Края раны сведены. Ушивание раны нитью Викрил 4-0 (рис. 6) Общее время операции составило 120 минут. Течение раннего послеоперационного периода протекало без осложнений. Назогастральный зонд был удален на 9-е сутки после операции после проведения рентгенконтрастного исследования. Общее время пребывания в стационаре составило 10 дней. По данным послеоперационного гистологического исследования №71 924/17 исследованы фрагменты ткани миндалины с признаками лечебного патоморфоза IV степени, в 1–4 группе лимфатических узлов шеи выявлены признаки лечебного патоморфоза III степени, всего исследовано 9 лимфатических узлов и ткань слюнной железы – без признаков опухолевого роста. В ходе динамического наблюдения данных за рецидив и метастазы нет (рис. 7)
Обсуждение
Исходя из вышеизложенного, проведение комбинированного лечения пациентов данной группы с использованием индукционной полихимиотерапии по схеме TPF с последующей трансоральной роботической резекцией боковой стенки ротоглотки открывает новые возможности в лечении опухолей (Т1,Т2) орофаренгеальной области. Проведение химиотерапии приводит к регрессу опухолевого процесса и уменьшению биологической активности новообразования. Точность хирургических действий гарантирует полный контроль области операции и уменьшает риск появления рецидива в области первичного очага. Четкое соблюдение клинических рекомендаций, а также динамический контроль состояния послеоперационной раны позволяет в среднем уже на 9–12-е сутки выполнить полноценный акт глотания.
Заключение
На основании результатов проведенного исследования следует выделить ряд преимуществ при проведении комбинированного лечения больных раком ротоглотки, находящихся на ранних стадиях развития заболевания (Т1–Т2). Трансоральная роботизированная хирургия превратилась в важный инструмент в арсенале онкологического хирурга, который занимается лечением злокачественных опухолей головы и шеи. Неоадьювантная индукционная полихимиотерапия обеспечивает положительный, порою полный клинический эффект. Комбинированный подход к применению индукционной трехкомпонентной полихимиотерапии с последующей малоинвазивной трансоральной роботической хирургией приводит к удовлетворительному клиническому результату, а самое главное – восстановлению функции оперируемого органа. Также преимуществами являются отсутствие видимых шрамов и рубцов на лице пациента, сокращение сроков госпитализации и быстрое возвращение к привычному образу жизни.
ЛИТЕРАТУРА
- Решетов И.В. Опухоли органов головы и шеи; Тверь, 2016. С 12–15.
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2017 году. М., 2018. С. 61–2.
- Charturvedi A.K., Engels E.A., Pfeiffer R.M., et al. Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J. Clin. Oncol. 2011;29:4224–30. https://doi.org/10.1200/JCO.2011.36.4596.
- Chen A.Y., Schrag N., Hao Y., Stewart A., Ward E. Changes in treatment of advanced oropharyngeal cancer, 1985–2001. Laryngoscope. 2007;117(1):16– 21. https://doi.org/10.1097/01.mlg.0000240182.61922.31.
- Van Abel K.M., Moore E.J. The rise of transoral robotic surgery in the head and neck: emerging applications. Expert. Rev. Anticancer. Ther. 2012;12(3):373–80. https://doi.org/10.1586/era.12.7.
- Moore E.J., Henstrom D.K., Olsen K.D., Kasperbauer J.L., McGree M.E. Transoral resection of tonsillar squamous cell carcinoma. Laryngoscope. 2009;119(3):508–15. https://doi.org/10.1002/lary.20124.
- De Almeida J.R., Byrd J.K., Wu Ruim, et al. A systematic review of transoral robotic surgery and radiotherapy for early oropharynx cancer. Laryngoscope. 2014;124(9):2096-102. https://doi.org/10.1002/lary.24712.
- Roh J.L., Kim A.Y., Cho M.J. Xerostomia following radiotherapy of the head and neck. J. Clin. Oncol. 2005;23:3016–3023. https://doi.org/10.1200/ jco.2005.07.419.
- Campbell B.H., Spinelly K., Marbella A.M., Myers K.B., Kuhn J.C., Layde P.M. Aspiration, weight loss, and quality of life in head and neck survivors. Arch. Otolaryngol. Head Neck Surg. 2004;130:1100–3. https://doi.org/10.1001/ archotol.130.9.1100.
- Алиева С.Б., Романов И.С., Подвязников С.О., Задеренко И.А., Тюляндин С.А. Эффективность индукционной химиотерапии с использованием доцетаксела, цисплатина и 5-фторурацила и последующей одновременной химиолучевой терапии в лечении рака глотки и полости рта III-IV стадии. Опухоли головы ишеи. 2011;2:14–9.
- Young Min Park, Chan Min Jung, Dongchul Cha, Da Hee Kim, Hye Ryun Kim, Ki Chang Keum, Nam Hoon Cho, and Se-Heon Kim. A New Clinical Trial of Neoadjuvant Chemotherapy Combined With Transoral Robotic Surgery and Customized Adjuvant Therapy for Patients With T3 or T4 Oropharyngeal Cancer. Ann. surg. Oncol. 2017. doi.org/10.1245/s10434-017-6001-5.
Поступила 12.09.18 Принята в печать 20.11.18
REFERENCES
- Reshetov I.V. Opukholi organov golovy i shei; Tver’, 2016. рр. 12–15. (In Russ.).
- Kaprin A.D., Starinsky V.V.,.Petrova G.V. The state of oncological assistance to the population of Russia in 2017. M., 2018. p. 61–2 (In Russ.).
- Charturvedi A.K., Engels E.A., Pfeiffer R.M., et al. Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J. Clin. Oncol. 2011;29:4224–30. https://doi.org/10.1200/JCO.2011.36.4596.
- Chen A.Y., Schrag N., Hao Y., Stewart A., Ward E. Changes in treatment of advanced oropharyngeal cancer, 1985–2001. Laryngoscope. 2007;117(1):16– 21. https://doi.org/10.1097/01.mlg.0000240182.61922.31.
- Van Abel K.M., Moore E.J. The rise of transoral robotic surgery in the head and neck: emerging applications. Expert. Rev. Anticancer. Ther. 2012;12(3):373–80. https://doi.org/10.1586/era.12.7.
- Moore E.J., Henstrom D.K., Olsen K.D., Kasperbauer J.L., McGree M.E. Transoral resection of tonsillar squamous cell carcinoma. Laryngoscope. 2009;119(3):508–15. https://doi.org/10.1002/lary.20124.
- De Almeida J.R., Byrd J.K., Wu Ruim, et al. A systematic review of transoral robotic surgery and radiotherapy for early oropharynx cancer. Laryngoscope. 2014;124(9):2096-102. https://doi.org/10.1002/lary.24712.
- Roh J.L., Kim A.Y., Cho M.J. Xerostomia following radiotherapy of the head and neck. J. Clin. Oncol. 2005;23:3016–3023. https://doi.org/10.1200/ jco.2005.07.419.
- Campbell B.H., Spinelly K., Marbella A.M., Myers K.B., Kuhn J.C., Layde P.M. Aspiration, weight loss, and quality of life in head and neck survivors. Arch. Otolaryngol. Head Neck Surg. 2004;130:1100–3. https://doi.org/10.1001/ archotol.130.9.1100.
- Aliyev, S. B., Romanov, I.S., Podvyaznikov, S.O., Zaderenko, I.A., Tylyandin, S.A. The effectiveness of induction chemotherapy using docetaxel, cisplatin and 5-fluorouracil and subsequent simultaneous chemoradiotherapy in the treatment of pharynx and oral cavity cancer of stage III-IV. Tumors of the head and neck. 2011; 2: 14–19 (In Russ.).
- Young Min Park, Chan Min Jung, Dongchul Cha, Da Hee Kim, Hye Ryun Kim, Ki Chang Keum, Nam Hoon Cho, and Se-Heon Kim. A New Clinical Trial of Neoadjuvant Chemotherapy Combined With Transoral Robotic Surgery and Customized Adjuvant Therapy for Patients With T3 or T4 Oropharyngeal Cancer. Ann. surg. Oncol. 2017. doi.org/10.1245/s10434-017-6001-5.
Received 12.09.18 Accepted 20.11.18
Информация об авторах:
И.В. Решетов – д.м.н., профессор, академик РАН, зав. кафедрой пластической хирургии Первого московского государственного медицинского университета им. И.М. Сеченова (Сеченовский университет); зав. кафедрой онкологии и пластической хирургии Института повышения квалификации Федерального медико-биологического агентства, Москва, Россия; e-mail: reshetoviv@mail.ru. Orcid.org/0000-0002-0580-7052.
Н.С. Сукорцева – врач-онколог; Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский университет), Москва, Россия; e-mail: sukorceva.nataly@mail.ruorcid. org/0000-0002-7704-1658.
Ю.С. Агакина – врач-химиотерапевт, Первый московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет), Москва, Россия; e-mail: y.agakina@gmail.com orcid. Org/0000-0002-3556- 2703.
П.С. Багдасаров – врач-анестезиолог Первого Московского государственного медицинского университета им. И.М. Сеченова (Сеченовский университет), Москва, Россия; e-mail: pbagdasarov@inbox.ruorcid. Org/0000-0002-1917- 7493.
А.А. Шевалгин – врач-онколог Первого Московского государственного медицинского университета им. И.М. Сеченова (Сеченовский университет), Москва, Россия; e-mail: doktor_kz@bk.ru. Orcid.org/0000-0002-7045-5540. П.А. Насилевский – врач онколог, ассистент кафедры онкологии Института повышения квалификации Федерального медико-биологического агентства, Москва, Россия; e-mail: nassilevsky@mail.ru. Orcid.org/0000- 0001-6747-0056.
About the authors:
I.V. Reshetov – MD, Ph.D., professor, academician of RAS, head of Department of Plastic Surgery, First Moscow State Medical University named after I.M. Sechenov (Sechenov University); Head of Department of Oncology and Plastic Surgery, Institute of Advanced Studies of the Federal Medical-Biological Agency, Moscow, Russia; e-mail: reshetoviv@mail.ru. Orcid.org/0000-0002-0580-7052.
N.S. Sukortseva – MD, oncologist; First Moscow State Medical University named after IM. Sechenov (Sechenov University), Moscow, Russia; e-mail: sukorceva. nataly@mail.ruorcid. org / 0000-0002-7704-1658.
Yu.S. Agakina – MD, medical oncologist, First Moscow State Medical University named after I.M. Sechenov (Sechenov University), Moscow, Russia; e-mail: y.agakina@gmail.com orcid. Org / 0000-0002-3556-2703.
P.S. Bagdasarov – MD, anesthesiologist at the First Moscow State Medical University named after I.M. Sechenov (Sechenov University), Moscow, Russia; e-mail: pbagdasarov@inbox.ruorcid. Org / 0000-0002-1917-7493.
A.A. Shevalgin – MD, medical oncologist of the First Moscow State Medical University named after I.M. Sechenov (Sechenov University), Moscow, Russia; e-mail: doktor_kz@bk.ru. Orcid.org/0000-0002-7045-5540.
P.A. Nasilevsky – MD, oncologist, Assistant, Chair of Oncology, Institute for Advanced Studies, Federal Medical-Biological Agency, Moscow, Russia; e-mail: nassilevsky@mail.ru. Orcid.org/0000-0001-6747-0056.