Для цитирования: Белова И.А., Бройнингер Х. Преимущества трехмерной гистологии по сравнению с обычной гистологией. Голова и шея Head and neck Russian Journal. 2019;7(1):47–58
For citation: Belova I., Breuninger H. The advantages of three-dimensional histology in comparison with conventional histology. Head and neck Russian Journal. 2019;7(1):47–58 (in Russian).
Doi: 10.25792/HN.2019.7.1.47–58
При рутинном гистологическом исследовании удаленного операционного материала с использованием параллельных разрезов участки между срезами остаются непредставленными в гистологических препаратах, что может привести к неполному удалению опухоли по краю резекции и ухудшает результаты лечения пациента. Для гарантированного выявления опухолевых инфильтратов в хирургическом крае резекции операционный материал должен препарироваться методом 3D-гистологии: отделяя тонкую полоску от вертикального внешнего края операционного материала (краевой срез), затем – тонкий слой нижней стороны (базисный срез) и под конец – поперечный срез из оставшейся середины (серединный срез). Краевой и базисный срезы изучаются на наличие опухолевых инфильтратов, по серединному срезу устанавливается морфологический тип опухоли.
Цель исследования: сравнение эффективности 3D-гистологии и обычной гистологии при исследовании операционных материалов со злокачественными новообразованиями кожи (ЗНК) в рамках математической модели.
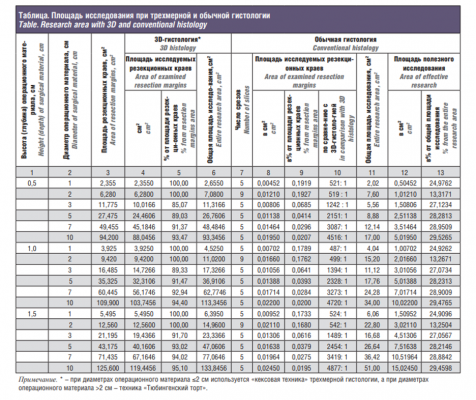
Материал и методы. Рассмотрены 18 вариантов размеров операционных материалов в форме кругового цилиндра: диаметром 1 см, 2, 3, 5, 7, 10 см и высотой 0,5 см, 1,0 и 1,5 см. Для обычной гистологии принимались операционные материалы, препарируемые, как в ОКД №1 г. Москвы: при диаметре ≤2 см – параллельными разрезами полностью, начиная от центра (серединная вырезка), и от него – к краям препарата, а при диаметре >2 см делали три вырезки по центру и по одной – по бокам препарата. Толщина вырезок при обоих методах принималась равной 2 мм. После парафинизации при обычной гистологии по центру каждой вырезки и при 3D-гистологии – с внешнего края вырезок изготавливали гистологические срезы толщиной 5 микрон, исследуемые под микроскопом. Были рассчитаны и сравнены доли исследуемой площади резекционных краев при 3D- и обычной гистологии, определена доля площади полезного исследования (для определения типа опухоли и выявления опухолевых инфильтратов по краям резекции) в общей площади исследования.
Результаты. Обычная гистология обеспечивает проверку поверхности краев резекции лишь на 0,02–0,2%, а 3D-гистология – на 85–100%. При обычной гистологии c пятью серийными срезами 70–75%, а с девятью серийными срезами – почти 87% рабочего времени и материалов расходуется впустую.
Выводы. Обычная гистология не дает гарантии выявления опухолевых инфильтратов в краях резекции и не защищает пациента от появления рецидивов после хирургического удаления опухоли. Целесообразно при исследовании операционного материала со ЗНК вместо обычной применять 3D-гистологию.
Ключевые слова: трехмерная гистология, злокачественные новообразования, рак, злокачественные новообразования кожи, рак кожи, микроскопически контролируемая хирургия Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Белова И.А., Бройнингер Х. Преимущества трехмерной гистологии по сравнению с обычной гистологией. Голова и шея Head and neck Russian Journal. 2019;7(1):47–58
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Routine histological examination of specimen using parallel cuts usually skips the areas between the sections, which increases the risk of incomplete tumor removal along the resection margin and, therefore, worsens patient outcomes. To ensure the detection of tumor cells in the surgical resection margin, the specimen should beprepared by 3D histology, with the separation of the thin strip from the vertical outer edge (marginal slice), then a thin layer of the lower part (basic slice), and finally a cross section of the remaining middle part (middle slice). Marginal and basic slices are to be examined for the presence of tumor cells, while the middle slice determines the morphological type of tumor.
The purpose of the study: a comparison of the effectiveness of 3D histology and conventional histology for the specimen examination using a mathematical model. Material and methods. Surgical cylinder shaped specimens of 18 various sizes (1 cm, 2, 3, 5, 7, 10 cm in diameter and 0.5 cm, 1.0 and 1.5 cm in height) were examined. Surgical materials were obtained in Moscow clinical dispensary #1. Specimens with ≤2 cm in diameter were studies using conventional histology, and specimens with >2 cm – using 3D histology. The proportions of the studied areas in 3D and conventional histology were calculated and compared, the percentage of the effective examination area (to determine the tumor type and identify tumor cells along the resection margin) was specified.
Results. Conventional histology provides a revision of the resection margins by only 0.02–0.2%, and 3D histology – by 85–100%. Conventional histology with five serial sections leads to 70-75% of working time and agents waste, and with nine serial sections — to almost 87% of waste.
Conclusions. Conventional histology does not guarantee the detection of tumor burdens in the resection margins and does not protect the patient from recurrence after surgical removal of the tumor. It is more reasonable to use 3D-histology for the examination of the removed material.
Keywords: three-dimensional histology, malignant neoplasms, cancer, skin malignant neoplasms, skin cancer, microscopically controlled surgery.
The authors declare no conflict of interest. Source of financing: not specified.
For citation: Belova I., Breuninger H. The advantages of three-dimensional histology in comparison with conventional histology. Head and neck Russian Journal. 2019;7(1):47–58 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients.
Вступление
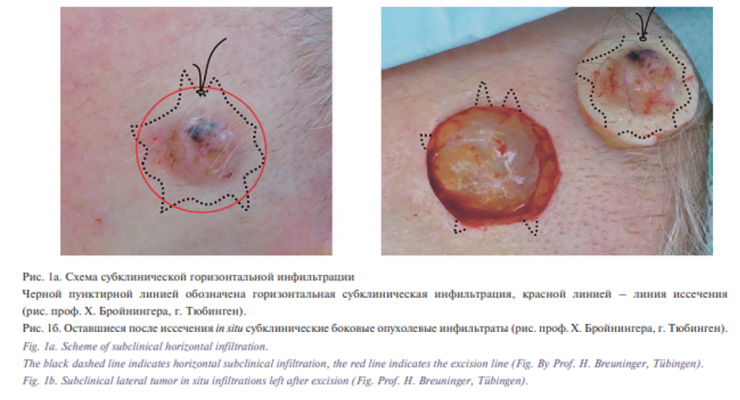
Большинство злокачественных новообразований кожи (ЗНК) образовывает по краям и в глубину инфильтраты, которые распознать клинически при удалении опухолей невозможно (рис. 1а и 1б). Предпосылкой для локального излечения должно служить полное удаление опухолевых клеток [1].
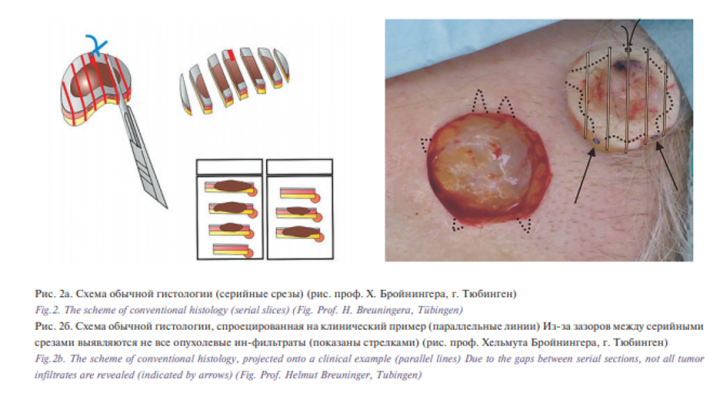
Для диагностики ЗНК используется гистология. При обычной гистологии патоморфолог препарирует операционный препарат параллельными разрезами (рис. 2a) и из полученных вырезок после парафинизации (проводки) делает тонкие срезы для изучения под микроскопом. Чем больше срезов, тем вероятнее выявить эти субклинические инфильтраты. Патоморфолог устанавливает морфологический тип опухоли и определяет, достигает ли опухоль в каждом гистологическом срезе его края. Этот метод сопряжен с диагностическими пробелами, т.к. малые инфильтраты по краям могут остаться невыявленными (рис. 2б), что приведет к возникновению локальных рецидивов опухоли, которые при плоскоклеточном раке кожи могут вести к повышенной частоте возникновения метастазов.
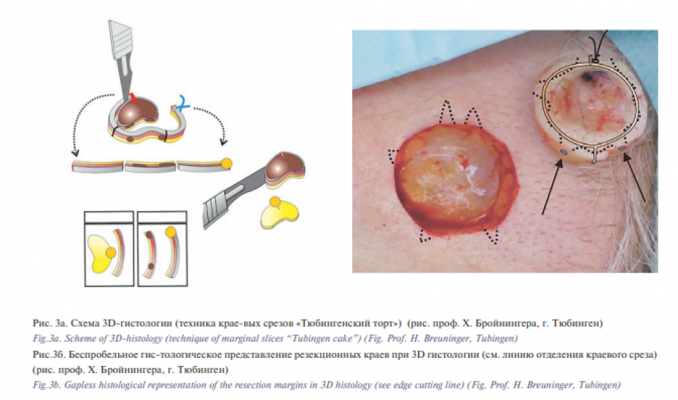
Чтобы гистологически выявить все опухолевые инфильтраты, операционный материал нужно препарировать другим способом: техникой краевых срезов (трехмерной гистологией). При этом вначале отделяют тонкую полоску в 2–4 мм от вертикального внешнего края операционного материала (краевой срез), потом – тонкий слой с нижней стороны (базисный срез, срез основы) и под конец – поперечный срез из оставшейся середины (серединный срез) (рис. 3а и 3б).
Краевой и базисный срезы изучаются на наличие опухолевых инфильтратов, по серединному срезу устанавливается диагноз [2]. Перед удалением опухоли хирург маркирует ее надрезом или отдельным узловым швом на уровне 12 часов по отношению к оси тела пациента, а дефект временно закрывает наклейками для ран. Патоморфолог на следующий день в случае обнаружения опухолевого инфильтрата в краях резекции определяет, где именно надо еще доиссечь ткань. Окончательно дефект закрывается только после гистологически подтвержденного полного удаления опухолевых клеток. Такой метод удаления ЗНК называется микроскопически контролируемой хирургией. Помимо полного удаления опухоли трехмерная гистология позволяет существенно уменьшить радиус резекции, что особо важно для пациентов со ЗНК в области головы и шеи, а также других сложных локализаций [2]. Целью данного исследования является сравнение эффективности обычной и трехмерной гистологии при диагностике ЗНК в рамках математической модели.
Материал и методы
В операционном материале информационную нагрузку о типе опухоли и наличии опухолевых инфильтратов у пациента, определяющую дальнейшие действия врачей, несут середина опухоли и края резекции. Следовательно, эффективность гистологического метода определяется полнотой представления данной информации при минимальных затратах труда и расходных материалов.
Опираясь на порядок проведения трехмерной гистологии в университетской дерматологической клинике г. Тюбинген (ФРГ), разработавшей еще 30 лет назад этот метод, и обычной гистологии в Онкологическом клиническом диспансере (ГБУЗ ОКД) №1 департамента здравоохранения (ДЗ) г. Москвы построены модели этих гистологических методов. За основу взято положение, что опухоли иссекаются в виде кругового цилиндра. Рассмотрены 18 вариантов объема иссекаемой ткани: диаметром в 1 см, 2, 3, 5, 7, 10 см, глубиной – в 0,5 см, 1,0, и 1,5 см.
С помощью геометрических формул проведены расчеты следующих параметров:
- площадь края резекции операционного материала в см2 ;
- исследуемая площадь края резекции в рамках трехмерной и обычной гистологии в см2 и ее доля в процентах в площади краев резекции;
- общая площадь исследования при каждом методе в см2 .
На основании рассчитанных данных соотнесены доли исследуемых площадей края резекции при трехмерной и обычной гистологии, а также для обычной гистологии определена площадь полезного исследования в см2 и ее доля в процентах в общей площади исследования операционного материала. Под полезно исследуемой площадью понимается гистологически исследуемая площадь для определения типа опухоли и выявления опухолевых инфильтратов по краям резекции.
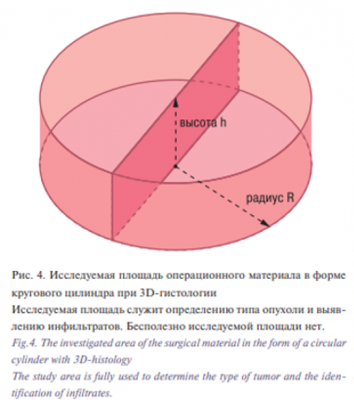
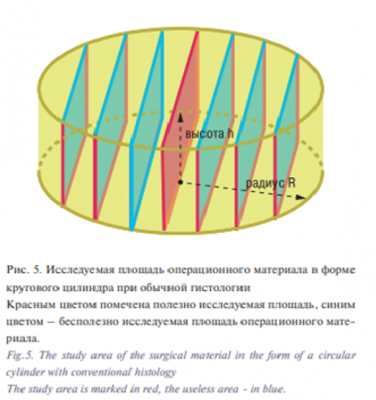
На рис. 4 показана исследуемая площадь операционного материала в форме кругового цилиндра при трехмерной гистологии, на рис. 5 – при обычной гистологии.
Порядок проведения срезов при трехмерной гистологии техникой «Тюбингенский торт» описан во Введении, для нашего анализа толщина вырезки принимается равной 2 мм (0,2 см). При малом операционном материале (диаметром ≤2 см) применяется «кексовая техника» трехмерной гистологии: на ткани производится циркулярный надрез глубиной до жировой ткани на расстоянии около 2 мм от края резекции. Вследствие гибкости жировой ткани края разрезов могут быть разложены плашмя вплоть до основания и выступающие таким образом края располагаются на одном уровне с базисом. Эта часть используется для нахождения опухолевых инфильтратов в краях резекции. Центральная часть операционного материала выбирается горизонтально скальпелем или ножницами. На ней делается серединный вырез для определения типа опухоли (рис. 6). После парафинизации с внешнего края полученных вырезок делаются гистологические срезы, которые переносятся на стекло и исследуются под микроскопом.
Для создания модели обычной гистологии принимается, что при малых размерах удаляемой ткани (диаметром ≤2 см) операционный материал препарируется параллельными разрезами полностью, начиная от центра (делается серединная вырезка), и от нее – к краям препарата, а при операционном материале диаметром >2 см делаются три вырезки по центру и по одной – по бокам препарата толщиной 2 мм (0,2 см). После парафинизации по центру каждой вырезки изготавливается гистологический срез толщиной 5 микрон (0,0005 см). Формулы для расчетов: 1. Площадь резекционных краев операционного материала Площадь резекционных краев операционного материала в форме кругового цилиндра можно рассчитать сложением площади его боковой поверхности и площади его основания. Площадь боковой поверхности операционного материала (боковой поверхности кругового цилиндра) рассчитывается умножением длины окружности основания на высоту операционного материала (цилиндра):
S боковой поверхности операцион. материала=S боковой поверхности кругового цилиндра=Lокружности основания×h=2× ϖ ×R1×h, где
L – длина окружности основания операционного материала,
h – высота (глубина) операционного материала,
ϖ – 3,14,
R1 – радиус круга 1 (радиус операционного материала) (рис. 7).
- Площадь основания операционного материала (круга 1) рассчитывается по формуле:
S основания операционного материала=S круга 1=π×R12
Поэтому площадь резекционных краев операционного материала можно рассчитать по формуле:
S резекционных краев операционного материала=S основания операционного материала+S боковой поверхности операционногоматериала=π×R12+2×π×R1×h=π×R1×(R1+2×h)
- Площадь исследования при трехмерной гистологии Исследуемая площадь при трехмерной гистологии «кексовой» техникой (при операционных материалах диаметром ≤ 2 см) в рассматриваемой модели складывается из площади основания операционного материала (круга 1), площади приводимой в горизонтальное положение надрезанной боковой поверхности операционного материала (боковой поверхности кругового цилиндра) и площади серединного среза (параллелограмма) из выбранной скальпелем середины операционного материала. Площадь основания операционного материала (круга 1) определяется по формуле:
S основания операционного материала = Sкруга1=π×R12
Площадь боковой поверхности операционного материала (боковой поверхности кругового цилиндра) рассчитывается, как выше определено, по формуле:
S боковой поверхности операционного материала=S боковой поверхности кругового цилиндра=2×π×R1×h
Площадь серединного среза (параллелограмма) рассчитывается умножением длин его сторон, в данном случае – по формуле:
S серединного среза=S параллелограмма=2×R2×h=2×(R1-d) ×h,
где R2 – радиус круга 2=R1-d,
d – толщина краевого среза (рис. 7).
Следовательно, исследуемую площадь при трехмерной гистологии «кексовой техникой» в рассматриваемой модели можно рассчитать по формуле:
S 3D-исследования «кексовой техникой» =2×π×R1×h+π×R12 +2×(R1-d) ×h=π×R1×(R1+2×h) +2×h×(R1-d).
Исследуемая площадь при трехмерной гистологии техникой «Тюбингенский торт» (при операционных материалах диаметром >2 см) в рассматриваемой модели представляет собой также сумму площади краевого среза (боковой поверхности кругового цилиндра), площади базисного среза (круга) и площади серединного среза (параллелограмма).
Площадь краевого среза (боковой поверхности кругового цилиндра) рассчитывается путем умножения длины окружности основания на высоту операционного материала (цилиндра):
S краевого среза=S боковой поверхности кругового цилиндра=2×π×R1×h
Площадь базисного среза (круга 2) из оставшегося материала после отделения краевого среза рассчитывается по формуле:
S базисного среза=S круга2=π×R22 =π×(R1-d)2.
Площадь серединного среза (параллелограмма) рассчитывается умножением длин его сторон, в данном случае – по формуле:
S серединного среза=S параллелограмма=2×R2×h=2×(R1-d) ×h.
Таким образом, исследуемую площадь при трехмерной гистологии техникой «Тюбингенский торт» нашей модели можно рассчитать по формуле:
S3D-исследования техникой «Тюбингенский торт» =π×(R1-d)2 +2×π× R1×h+2×(R1-d)×h=π×R12-π×2×R1×d+π×d2+2×π×R1×h+2×R1×h-2×d×h=π×[R1×( R1-2×d+2×h)+d2 ]+2×h×(R1-d).
- Площадь резекционных краев, исследуемая в рамках трехмерной гистологии
Площадь резекционных краев, исследуемая в рамках трехмерной гистологии «кексовой» техникой, равна площади резекционных краев операционного материала
S3D-исследования резекционных краев «кексовой техникой» = S резекционных краев операционного материала=π×R1×(R1+2×h).
Площадь резекционных краев, исследуемая в рамках трехмерной гистологии техникой «Тюбингенский торт», можно рассчитать следующим образом:
S3D-исследования резекционных краев техникой «Тюбингенский торт» = S базисного среза+S краевого среза=π×(R1-d)2+2×π×R1×h=π×[R12 -2×R1×d+ d2 +2×R1×h]=π×[R1×(R1+2×h-2×d)+d2 ].
- Доля площади резекционных краев, исследуемая в рамках трехмерной гистологии
Доля площади резекционных краев, исследуемая в рамках трехмерной гистологии, определяется делением площади исследуемых резекционных краев при соответствующей технике на площадь резекционных краев операционного материала и умножением результата на 100 процентов:
При использовании «кексовой» техники исследуется 100% площади резекционных краев.
- Площадь исследования при обычной гистологии Площадь исследования операционного материала при обычной гистологии равна сумме площадей всех срезов. Так как срезы в нашей модели имеют форму параллелограммов, то площадь каждого определяется умножением длины среза L на высоту h, общую для всех срезов.
Длина серединного среза равна диаметру операционного материала или двум его радиусам:
L 1-серединного среза=2×R.
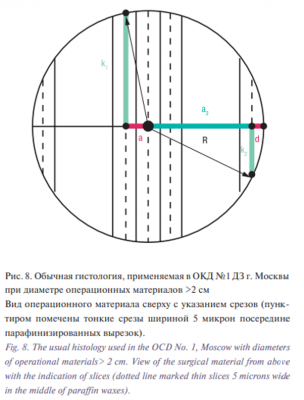
Длина остальных срезов определяется с помощью теоремы Пифагора, согласно которой в прямоугольном треугольнике квадрат гипотенузы равен сумме квадратов катетов (рис. 8) и, следовательно,
b=√R2 -a2, где, а – расстояние между соседними тонкими срезами, проходящими по середине вырезок, (в нашей модели а=0,2 см), а
L первого среза от центра=2×b1=×√R2 -a2
L второго среза от центра=2×b2=2×√R2 -(2×a)2 =2×√R2 -4×a2
L третьего среза от центра=2×b3=2×√R2 -(3×a)2 =2×√R2 -9×a2
L четвертого среза от центра=2×b4=2×√R2 -(4a)2 =2×√R2 -16a2 и т.д.
Если диаметр операционного материала ≤2 см, то максимально можно сделать 9 вырезок (одну серединную и по четыре боковых, начиная с серединной) и, следовательно, получить 9 тонких срезов из их середин для исследования под микроскопом.
Если диаметр операционного материала >2 см, то, согласно нашей модели, делаются три среза по центру (серединный и по одному – рядом с ним с двух его сторон), а также по одному срезу с боков операционного материала (рис. 8). Длину этих боковых срезов можно рассчитать по формуле:
L бокового среза=2×√R2 -(R-с)2 =2×√R2 -R2 +2×R×с-с2 =2×√с×(2×R-с),
где
с – расстояние от края до середины вырезки, а 2 (в нашей модели с=0,1 см).
Площадь исследования обычной гистологией можно рассчитать путем умножения суммы длин всех срезов на высоту срезов h при операционных материалах диаметром ≤2 см:
S обычного гистол. исследования=S серединного среза+S остальных срезов= L всех срезов×h=[2×R+2×(×√R2 -a2 +2×√R2 -4×a2+2×√R2 -9×a2 +2×√R2 — 16×a2 +???????)]×h=2×[R+2×(√R2 -a2 +√R2 -4×a2 +√R2 -9×a2 +√R2 -16×a2 +??????)]×h
S обычного гистол. исследования=S серединных срезов+S боконых срезов=L всех срезов×h=2×[R+2×(√R2 -a2 +√R2 -(R-с)2)]×h=2×[R+2×(√R2 -a2 +√R2 — R2 +2×R×с-с2 )]×h=2×[R+2×(√R2 -a2 +√с×(2×R-с)]×h.
- Площадь резекционных краев, исследуемая в рамках обычной гистологии
При обычной гистологии резекционные края могут быть представлены только по нижнему и боковым краям гистологических срезов толщиной в несколько микрон (рис. 8).
Поэтому исследуемая площадь края резекции при обычной гистологии рассчитывается путем умножения суммы длин краев резекции всех срезов на их толщину (в нашей модели равную 0,0005 см).
Резекционный край среза представляет собой сумму длины среза (нижний край резекции) и его высоты, умноженной на два (с двух сторон среза) (боковые края резекции). Следовательно, площадь резекционных краев при обычной гистологии можно определить по формулам:
– при операционных материалах диаметром ≤ 2 см с числом срезов до 9
S исследуемых резекционных краев обычной гистологией (d≤2)=2×[R+2×(√R2 — a2 +√R2 -4×a2 +√R2 -9×a2 )+n×h]×f, где
n – число срезов, f – толщина тонкого среза (в нашем случае 0,0005 см).
– при операционных материалах диаметром > 2 см с пятью срезами
S исследуемых резекционных краев обычной гистологией (d>2)=2×f×[R+2×(√R2 — a2 +√с×(2×R-с))+5×h].
- Доля площади резекционных краев, исследуемая в рамках обычной гистологии
Доля площади резекционных краев, исследуемая в рамках обычной гистологии, определяется делением исследуемой площади резекционных краев всех срезов на площадь резекционных краев операционного материала и умножением результата на 100 процентов:
S исследуемых резекционных краев всех срезов
Доля исследуемой площади резекционных краев=100% операционного материала при обычной гистологии S резекционных краев операционного материала
- Cоотношение долей исследуемых площадей резекционных краев при трехмерной и обычной гистологии
Соотношение долей исследуемых площадей резекционных краев при трехмерной и обычной гистологии рассчитывается делением одной доли на другую.
- Площадь полезного исследования при обычной гистологии
Площадь полезного исследования при обычной гистологии, т.е. сумма площади исследуемых резекционных краев для нахождения опухолевых инфильтратов и площади самого большого серединного среза для постановки диагноза, может быть определена по следующей формуле:
S полезного исследования=(L всех срезов+2×h×n) ×f+L серединного среза×h.
11. Доля площади полезного исследования при обычной гистологии
Если при трехмерной гистологии вся площадь исследования служит вышеуказанным задачам контроля, то при обычной гистологии часть заготавливаемой и изучаемой площади операционного материала не несет искомой информации (рис. 8).
Доля площади полезного исследования в общей площади исследования при обычной гистологии определяется соотношением площади полезного исследования к общей площади исследования, умноженным на 100 процентов.
S полезного исследования при обычной гистологии
Доля площади полезного исследования операционного×100% материала при обычной гистологии S площади исследования при обычной гистологии.
Доля бесполезно проводимого исследования определяется вычитанием доли площади полезного исследования в процентах из 100%.
Результаты исследования
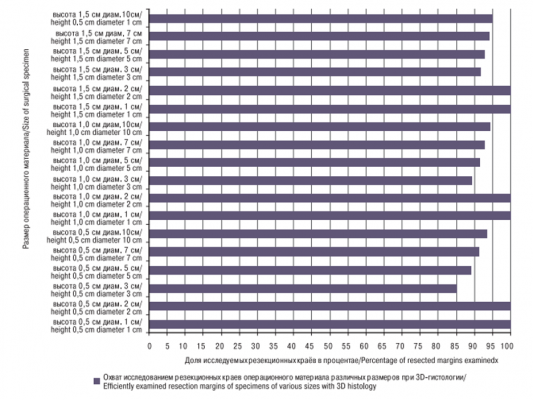
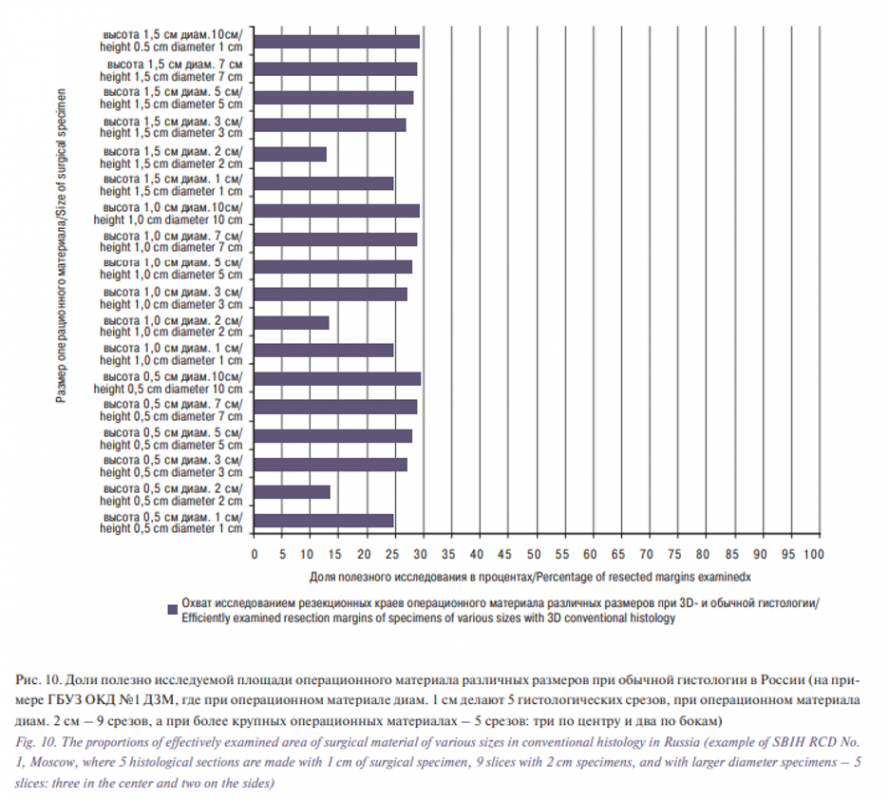
Результаты расчетов представлены в таблице. Как показывает смоделированный пример ГБУЗ ОКД №1 ДЗМ, обычная гистология обеспечивает проверку поверхности резекционных краев лишь на 0,02% (при 5 срезах), 0,2% (при 9 или 5 срезах и малом диаметре операционного материала в 1 см). При трехмерной гистологии охват изучаемых резекционных краев при малых операционных материалах (диаметром ≤2 см) – в 500 раз, а при бо`льших операционных материалах – в 1,200– 5,000 раз выше, чем при обычной гистологии (таблица, рис. 9). Трехмерная гистология позволяет определить не только тип опухоли, но и основательно (на 85–95% при использовании техники «Тюбингенский торт» и на 100% при «кексовой» технике) исследовать площадь резекционной поверхности для наиболее полного выявления опухолевых инфильтратов.
Обращает на себя внимание то, что при трехмерной гистологии общая площадь исследования больше, если при обычной гистологии изготавливают 5 срезов, но меньше, если число срезов при обычной гистологии – 9 (см. таблицу, см. пример операционного материала диаметром 2 см с 9 срезами).
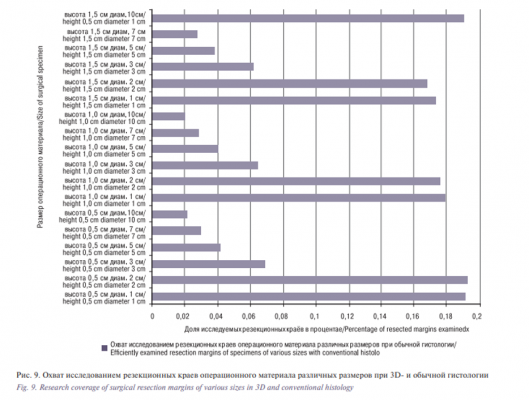
При трехмерной гистологии ресурсы гистопатологической службы используются максимально эффективно: полезно исследуемая площадь составляет 100%. При обычной гистологии ЗНК в ГБУЗ ОКД №1 ДЗМ площадь полезного исследования составляет от 25% (при диаметре операционного материала 1 см) до 30% (при диаметре операционного материала 10 см) от общей площади исследования (таблица, рис. 10), т.е. 70–75% рабочего времени патоморфолога и лабораторных материалов расходуются впустую. Пример с операционным материалом диаметром 2 см, в котором при обычной гистологии число срезов было увеличено с пяти до девяти, что повлекло за собой увеличение доли исследуемых резекционных краев всего лишь на доли процента при снижении доли полезного исследования почти вдвое (в среднем с 24,9 до 13,3%), показывает, что при бо`льшем числе срезов, чем в представленной модели для ОКД №1 ДЗМ, непродуктивность работы российской гистопатологической службы в области ЗНК, выражающаяся в необоснованно высокой трудо- и материалоемкости, несоответствующей современным медицинским знаниям, становится еще выше (таблица, рис. 10).
Обсуждение
Как показывает данный анализ, обычная гистология не дает гарантии выявления опухолевых инфильтратов в краях резекции и не защищает пациента от появления рецидивов после хирургического удаления злокачественной опухоли. Пациенты вынуждены полагаться только на счастливый случай при удалении обширного участка здоровой ткани вокруг клинической границы опухоли, если ее локализация вообще позволяет сделать большой радиус резекции, что несколько снижает вероятность остатка опухолевых инфильтратов у пациента. Высокая рецидивность ЗНК (базальноклеточного рака кожи – до 50% [3]) и в 6,4 раза более высокая смертность от немеланоцитарных раков кожи в России по сравнению с Германией [4] (при почти одинаковой стоимости хирургического лечения ЗНК в Германии и России*) – следствие в т.ч. и неполного удаления опухолевых инфильтратов при лечении пациентов в России.
По сути, обычная гистология может служить только для определения морфологического типа опухоли с помощью изучения серединного среза. Все остальные манипуляции ведут только к потере рабочего времени и расходных материалов и созданию иллюзии тщательного исследования. При использовании микроскопически контролируемой хирургии с трехмерной гистологией частота возникновения рецидивов составляет при первичном базальноклеточном раке кожи 0,7–1,1%, при распростертом рецидивном базальноклеточном раке кожи – 5,3%, спустя 10 лет [7, 8], а при первичном плоскоклеточном раке кожи вертикальной толщиной (глубиной) менее 5 мм – 3,25% и вертикальной толщиной более 5 мм – 12%, спустя 7 лет после лечения [7, 9, 10].
* Средняя стоимость лечения больных базальноклеточным раком кожи хирургическим методом составила в России в 2007 г. в ГВКГ им. Бурденко 60,255,9 руб. (1,675 евро по курсу на 31.12.2007: 1 евро=35,986 руб. согласно http://de.exchange-rates.org), исключая пациентов с тяжелым течением заболевания, требующим многокурсового дорогостоящего лечения и длительного пребывания в стационаре [5], а в ФРГ в 2008 г. по ОМС – 1,624–1,800 евро (при поверхностной, инвазивной или склеродермоподобной базалиоме) [6].
Немецкие стандарты лечения рекомендуют при базальноклеточном и плоскоклеточном раке кожи микроскопически контролируемую хирургию с трехмерной гистологией в качестве терапии первого выбора [2, 11, 1,], она также рекомендуется и при ряде других ЗНК [1, 2, 13–15]. В Германии немеланоцитарные виды рака кожи удаляют хирургически в 97,7% случаев [16].
Российские патоморфологи, незнакомые с трехмерной гистологией, могут предполагать, что этот метод исследования операционного материала по сравнению с обычной гистологией сопряжен с дополнительными трудозатратами и, следовательно, более дорогой, но это не так. Как показывают результаты исследования дерматологической клиники г. Тюбинген (ФРГ), разработавшей трехмерную гистологию, университетской временные затраты на препарирование больших операционных материалов при трехмерной гистологии, наоборот, значительно меньше, чем при обычной гистологии [17]. Патоморфологу требует ся только привыкнуть к трехмерному способу рассмотрения материала.
Так как при использовании техники «Тюбингенский торт» трехмерной гистологии не исследуется нижняя сторона краевой вырезки толщиной 2 мм, то имеется небольшой гистологический пробел (рис. 11) и охват гистологическим исследованием резекционных краев составляет 85–96% в зависимости от диаметра операционного материала (см. таблицу). Но на это можно не обращать внимания, т.к. в этом круговом кольце упущение опухолевых инфильтратов очень маловероятно. Для достижения 100-процентного охвата исследованием резекционных краев имело бы смысл приспособить «кексовую технику» трехмерной гистологии, применяемую сейчас при удалении ткани диаметром ≤2 см, и для больших операционных материалов, но это было бы намного более трудоемким.
Повсеместный переход при лечении немеланоцитарных раков кожи (самых распространенных онкологических заболеваний [18]) на использование микроскопически контролируемой хирургии с трехмерной гистологией может привести в России, где ежегодно выявляется более 71 тыс. случаев этих заболеваний [18], а показатель рецидивности, как отмечено выше, достигает 50%, с учетом того, что при рецидивных заболеваниях он обычно еще выше [13], к уменьшению числа пациентов за счет снижения рецидивности вплоть на 50 тыс. человек в год.
Принцип трехмерной гистологии, нацеленный на исследование операционного материала без гистологических пробелов, применим не только в отношении опухолей кожи. Изучение этого метода и адаптация его для исследований операционных материалов из других органов представляется чрезвычайно полезным и перспективным для диагностики и лечения онкологических заболеваний.
Заслуживает внимания также немецкий опыт беспробельного гистологического исследования лимфоузлов, разработанный в той же университетской дерматологической клинике г. Тюбинген 15 лет назад. Там удаленные сторожевые лимфоузлы пациентов с меланомой продавливают через мелкое ситечко, с тем, чтобы получить расцепленную клеточную массу, и иммунохимиогистологически опеределяют, есть ли в ней опухолевые клетки, и если они имеются, то в каком количестве. От результатов этого исследования зависит прогноз и дальнейшая стратегия лечения пациента. Этот метод в 3,7 раза чувствительнее, чем обычная гистология: при нем позитивными на наличие опухолевых клеток признается в 3,7 раза больше лимфоузлов, чем при обычной гистологии тех же лимфоузлов [19].
Выводы
Как показывает смоделированный пример ГБУЗ ОКД №1 ДЗ Москвы, применяемая в России обычная гистология обеспечивает проверку поверхности резекционных краев лишь на 0,02–0,2%, что сопряжено с развитием локальных рецидивов опухолей кожи, которые при плоскоклеточном раке кожи могут вести также к повышенной частоте возникновения метастазов. Трехмерная гистология позволяет не только определить тип злокачественной опухоли, но и на 85–96% при использовании техники «Тюбингенский торт» и на 100% при «кексовой» технике исследовать площадь резекционной поверхности для полного выявления опухолевых инфильтратов.
При трехмерной гистологии рабочее время патоморфолога и расходные материалы используются максимально эффективно. При обычной гистологии ЗНК c пятью серийными срезами 70–75%, а с девятью серийными срезами – почти 87% рабочего времени патоморфолога и лабораторных материалов расходуются впустую. При бо`льшем числе срезов, чем в представленной модели ОКД №1 ДЗ Москвы, непродуктивность работы гистопатологической службы в области ЗНК, выражающаяся в необоснованно высокой трудо- и материалоемкости, несоответствующей современным медицинским знаниям, значительно выше.
Для исследования ЗНК целесообразно вместо обычной применять трехмерную гистологию. Особо предпочтительна «кексовая» техника. Это позволит гарантированно удалять опухолевые клетки при сбережении здоровой ткани, уменьшить число пациентов с рецидивами и метастазами (в России почти на 50 тыс. человек в год), снизить народно-хозяйственные затраты на лечение ЗНК: самых распространенных онкологических заболеваний и повысить эффективность здравоохранения.
Авторы благодарят патологоанатома ГБУЗ ОКД №1 ДЗ г. Москвы В.Г. Шаталова за разъяснение порядка проведения патоморфологических исследований операционных материалов с новообразованиями кожи в ОКД №1 г. Москвы.
ЛИТЕРАТУРА
- Löser C., Rompel R, Breuninger H., Möhrle M., Häfner H.-M., Kunte C., Hassel J., Hohenleutner U., Podda M., Sebastian G., Hafner J., Konz B., Kaufmann R. Mikroskopisch kontrollierte Chirurgie − MKC. S1-Leitlinie der Deutschen Dermatologischen Gesellschaft. Hrg. Arbeitsgemeinschaft der wissenschaftlichen medizinischen Fachgesellschaften (AWMF), AWMF-Leitlinien-Register Nr. 013/064, 2009, Stand: 05/2014.
- Бройнингер Х., Белова И. Микроскопически контролируемая хирургия с трехмерной гистологией (Тюбингенские методы) в лечении злокачественных новообразований кожи (литературный обзор). Опухоли головы и шеи. 2018;3.
- Kотова О.Е. Применение аутофлюоресцентного исследования в диагностике рецидива базально-клеточного рака кожи. Дисс. канд. мед. наук. М., 2007.
- Бройнингер Х., Белова И. Инструкция к проведению микроскопически контролируемой хирургии и трехмерной гистологии для удаления злокачественных новообразований кожи. Голова и шея=Head and neck. Rus. J. 2017;4:83–93.
- Волгин В.Н. Клинико-эпидемический мониторинг базально-клеточного рака кожи и оптимизация лечения методом фотодинамической терапии. Дисс. докт. мед. наук. М., 2009.
- Gemeinsamer Bundesausschuss. (2008) Hautkrebsscreening, Zusammenfassende Dokumentation des Unterausschusses “Prävention” des Gemeinsamen Bundesausschusses, Siegburg: 19, 44, 45, 102, 107.
- Medical Tribune Kongressbericht. Mit “Tübinger Torte” und Flunder-Technik Basaliome garantiert entfernen. MTD 2001;51–52:36.
- Eberle F.C., Kanyildiz M., Schnabl C.S., Häfner H.M., Adam P., Breuninger H. Three dimensional (3D) histology in daily routine: practical implementation and its evaluation. JDDG. 2014:1610–0379.
- Brantsch K.D., Meisner C., Schönfisch B., Trilling B., Wehner-Caroli J., Röcken M., Breuninger H. Analysis of risk factors determining prognosis of cutaneous squamouscell carcinoma: a prospective study. Lancet. Oncol. 2008;9(8):713–20.
- Häfner H.M., Breuninger H., Moehrle M., Trilling B., Krimmel M. 3D histologyguided surgery for basal cell carcinoma and squamous cell carcinoma: recurrence rates and clinical outcome. IJOMS. 2011;40(9):943–8.
- Hauschild A., Breuninger H., Kaufmann R., Kortmann R.-D., Klein M., Werner J., Reifenberger J., Dirschka T., Tischendorf L., Becker J.C., Löser C., Vordermark D., Bootz F., Pistner H., Grabbe S., Garbe C. Kurzleitlinie − Basalzellkarzinom der Haut. AWMF-Register Nr. 032/021 Klasse: S2k (Update 2012), Stand: 12/2013: 8.
- Breuninger H., Eigentler T., Bootz F., Hauschild A., Kortmann R.-D., Wolff K., Stockfleth E., Szeimies R.-M., Rompel R., Tischendorf L., Becker J.C., Löser C., Vordermark D., Pistner H., Garbe C., Grabbe S. Kurzleitlinie − Plattenepithelkarzinom der Haut. AWMF-Register Nr. 032/022 Klasse: S2k (Update 2012), Stand: 12/2013: 16–7.
- Breuninger H., Konz B., Burg G. Mikroskopisch kontrollierte Chirurgie bei malignen Hauttumoren. Deutsches Ärzteblatt, Jg. 104, Heft 7, 16. 2007;427–32.
- Breuninger H. DermOPix und die Hautchirurgie. Springer Verlag. 2008.
- Breuninger H., Sebastian G., Garbe C. (2003) Deutsche Leitlinie: Plattenepithelkarzinom der Haut, Vers. 2.8, 14.07.2003, http://www.krebsbei-frauen-genitaltumoren.de/leitlinie_plattenepithel-karzinom.pdf
- Pritzkuleit R., Holzmann M., Eisemann N., Gerdemann U., Richter A., Tobis J., Katalinic A. Krebs in Schleswig-Holstein. Band 11. Inzidenz und Mortalität in den Jahren 2012 bis 2014. Institut für Krebsepidemiologie e.V. 2017:76.
- Boehringer Н., Adam P., Schnabl S.M., Häfner H.-M., Breuninger H. Analysis of incomplete excisions of basalcell carcinomas after breadloaf microscopy compared with 3D-microscopy: a prospective randomized and blinded study. J. Cutan. Pathol. 2015;42(8):542–53.
- Злокачественные новообразования в России в 2014 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М. 2016. ISBN 978-5-85502-219-3. 19. Ulmer A., Fischer J.R., Schanz S., Sotlar K., Breuninger H., Dietz K., Fierlbeck G., Klein C. Detection of melanoma cells displaying multiple genomic changes in histopathologically negative sentinel lymph nodes. Clin. Cancer Res. 2005;11– 15:5425–32.
Поступила 16.10.18
Принята в печать 01.02.
REFERENCES
- Löser C., Rompel R., Breuninger H., Möhrle M., Häfner H.-M., Kunte C., Hassel J., Hohenleutner U., Podda M., Sebastian G., Hafner J, Konz B., Kaufmann R. Mikroskopisch kontrollierte Chirurgie − MKC. S1-Leitlinie der Deutschen Dermatologischen Gesellschaft. Hrg. Arbeitsgemeinschaft der wissenschaftlichen medizinischen Fachgesellschaften (AWMF), AWMF-Leitlinien-Register Nr. 013/064, 2009, Stand: 05/2014.
- Breuninger H., Belova I. Microscopically controlled surgery with threedimensional histology (Tübingen methods) in the treatment of malignant skin tumors (literature review). Tumors of the head and neck 2018;3 (In Russ.).
- Kotova O.E. The use of autofluorescent studies in the diagnosis of recurrence of basal cell carcinoma of the skin. Author. diss. Cand. med. sciences. MSMSU named after Evdokimov, M., 2007 (In Russ.).
- Breuninger H., Belova I. Instructions for microscopically controlled surgery and three-dimensional histology to remove malignant skin tumors. Head and neck= Head and neck. Rus. J. 2017; 4: 83–93 (In Russ.).
- Volgin V.N. Clinical and epidemic monitoring of basal cell carcinoma of the skin and optimization of treatment with photodynamic therapy. Authoref. diss. on Ph.D. MMA named after. Kirov SPb, SMCH named after N.N. Burdenko EO RF. M., 2009. p. 18, 37 (In Russ.).
- Gemeinsamer Bundesausschuss. (2008) Hautkrebsscreening, Zusammenfassende Dokumentation des Unterausschusses “Prävention” des Gemeinsamen Bundesausschusses, Siegburg: 19, 44, 45, 102, 107.
- Medical Tribune Kongressbericht. Mit “Tübinger Torte” und Flunder-Technik Basaliome garantiert entfernen. MTD 2001; 51/52: 36.
- Eberle F.C., Kanyildiz M., Schnabl C.S., Häfner H.M., Adam P, Breuninger H. Three dimensional (3D) histology in daily routine: practical implementation and its evaluation. JDDG 2014: 1610-0379.
- Brantsch K.D., Meisner C., Schönfisch B., Trilling B., Wehner-Caroli J., Röcken M., Breuninger H. Analysis of risk factors determining prognosis of cutaneous squamouscell carcinoma: a prospective study. Lancet Oncol. 2008;9(8):713–20.
- Häfner H.M., Breuninger H., Moehrle M., Trilling B., Krimmel M. 3D histologyguided surgery for basal cell carcinoma and squamous cell carcinoma: recurrence rates and clinical outcome. IJOMS 2011;40(9):943–8.
- Hauschild A., Breuninger H., Kaufmann R., Kortmann R.-D., Klein M., Werner J., Reifenberger J., Dirschka T., Tischendorf L., Becker J.C., Löser C., Vordermark D., Bootz F., Pistner H., Grabbe S., Garbe C. Kurzleitlinie − Basalzellkarzinom der Haut. AWMF-Register Nr. 032/021 Klasse: S2k (Update 2012), Stand: 12/2013: 8.
- Breuninger H., Eigentler T., Bootz F., Hauschild A., Kortmann R.-D., Wolff K., Stockfleth E., Szeimies R.-M., Rompel R., Tischendorf L., Becker J.C., Löser C., Vordermark D., Pistner H., Garbe C., Grabbe S. Kurzleitlinie − Plattenepithelkarzinom der Haut. AWMF-Register Nr. 032/022 Klasse: S2k (Update 2012), Stand: 12/2013: 16–7.
- Breuninger H., Konz B., Burg G. Mikroskopisch kontrollierte Chirurgie bei malignen Hauttumoren. Deutsches Ärzteblatt, Jg. 104, Heft 7, 16. Februar 2007: 427–32.
- Breuninger H. DermOPix und die Hautchirurgie. Springer Verlag 2008.
- Breuninger H., Sebastian G., Garbe C. (2003) Deutsche Leitlinie: Plattenepithelkarzinom der Haut, Vers. 2.8, 14.07.2003, http://www.krebs-beifrauen-genitaltumoren.de/leitlinie_plattenepithel-karzinom.pdf.
- Pritzkuleit R., Holzmann M., Eisemann N., Gerdemann U., Richter A., Tobis J., Katalinic A. Krebs in Schleswig-Holstein. Band 11. Inzidenz und Mortalität in den Jahren 2012 bis 2014. Institut für Krebsepidemiologie e.V. 2017: 76.
- Boehringer Н., Adam P., Schnabl S.M., Häfner H.-M., Breuninger H. Analysis of incomplete excisions of basalcell carcinomas after breadloaf microscopy compared with 3D-microscopy: a prospective randomized and blinded study. J. Cutan Pathol. 2015;42(8):542–53.
- Malignant neoplasms in Russia in 2014 (morbidity and mortality). Ed. A.D. Kaprin, V.V. Starinsky, G.V. Petrova. M .: MSROI named after P.A. Herzen, branch of the Federal State Budgetary Institution “NMRC” of the Ministry of Health of Russia, 2016. ISBN 978-5-85502-219-3 (In Russ.).
- Ulmer A., Fischer J.R., Schanz S., Sotlar K., Breuninger H., Dietz K., Fierlbeck G., Klein C. Detection of melanoma cells displaying multiple genomic changes in histopathologically negative sentinel lymph nodes. Clin Cancer Res 2005; 11/15: 5425-5432. Received 16.10.18 Accepted 01.02.19
Сведения об авторах:
И.А. Белова – Dr. rer. pol., должность: соискатель на степень Dr. rer. medic., отделение минимально инвазивной хирургии, хирургическая клиника больничного комплекса «Шарите» – университетская медицина Берлина (кампус клиники им. Вирхова), Берлин, ФРГ; e-mail: Belova-Irina@mail.ru. Х. Бройнингер – проф. д.м.н., ведущий врач, отделение операционной дерматологии, дерматологическая клиника университета, г. Тюбинген, ФРГ; e-mail: Helmut.Breuninger@med.uni-tuebingen.de.
About the authors:
I.A. Belova – MD, Department of Minimally Invasive Surgery, Surgical Clinic of the Charite Hospital Complex – University Medicine Berlin (campus of the Virchow Clinic), Berlin, Germany, e-mail: Belova-Irina@mail.ru. H. Breuninger – prof. Ph.D. (Prof. Dr. med.), Position: Leading Doctor, Department of Operating Dermatology, Dermatology Clinic of the University, Tubingen, Germany, e-mail: Helmut.Breuninger@med.uni-tuebingen.de.