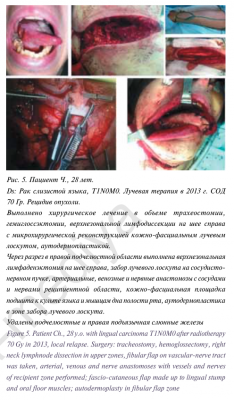
Для цитирования: Свиридов Е.Г., Дробышев А.Ю., Омарова П.Н., Хабибуллина А.А. Обоснование проведения гениопластики как этапа ортогнатической операции у пациентов со скелетными аномалиями и деформациями челюстей. Голова и шея Head and neck Russian Journal. 2019;7(1):59–68
Doi: 10.25792/HN.2019.7.1.59–68
Цель исследования – обоснование проведения гениопластики как этапа ортогнатической операции.
Материал и методы. На базе кафедры челюстно-лицевой и пластической хирургии Московского государственного медико-стоматологического университета им. А.И. Евдокимова был проведен анализ 1332 историй болезни пациентов со скелетными аномалиями и деформациями челюстей. Из них 308 пациентам была проведена ортогнатическая операция в объеме «Остеотомия верхней челюсти по Ле-Фор I, межкортикальная остеотомия нижней челюсти с постановкой в ортогнатическое соотношение. Остеотомия подбородка». В исследуемую группу вошли 80 пациентов, фотографии в профиль которых были отобраны для проведения фотометрического анализа. Число мужчин со II скелетным классом составило 21 человек, с III скелетным классом – 8. Число женщин со II скелетным классом составило 24 человека, с III скелетным классом – 27. Для оценки эффективности проведения гениопластики были выбраны такие параметры, как ментолабиальный угол, подбородочно-шейный угол, угол выпуклости лица по G.A. Arnett и R.T. Bergman, лицевой угол, профильный угол T по Шварцу, расстояние от губ до линии В по C.J. Burston и до эстетической E-линии R.M. Ricketts. Была дана оценка антропометрическим изменениям лиц пациентов через 6 месяцев после проведения хирургического этапа комбинированного лечения.
Результаты. По данным антропометрического обследования, у женщин со II скелетным классом отмечалось статистически значимое различие до и после проведенной операции по 8 параметрам, у женщин с III скелетным классом отмечалось статистически значимое различие до и после проведенной операции по 5 параметрам. У мужчин со II скелетным классом отмечалось статистически значимое различие до и после проведенной операции по 8 параметрам, у мужчин с III скелетным классом отмечалось статистически значимое различие до и после проведенной операции по 4 параметрам. Ключевые антропометрические параметры, изменения которых обусловлены перемещением подбородочной части нижней челюсти, достигли нормальных значений после проведения хирургического этапа комбинированного лечения.
Выводы. Таким образом, выполнение операции «Остеотомия верхней челюсти по Ле-Фор I, межкортикальная остеотомия нижней челюсти с постановкой в ортогнатическое соотношение в сочетании с остеотомией подбородка» у пациентов со II и III скелетными классами позволяет достичь наиболее предсказуемого эстетического результата, а также в результате проведенного комплексного лечения у данных пациентов происходит нормализация ключевых морфометрических параметров, изменения которых обусловлены перемещением подбородочной части нижней челюсти.
Ключевые слова: остеотомия подбородка, гениопластика, ментопластика, ортогнатическая операция, антропометрический анализ, пластика подбородка
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Свиридов Е.Г., Дробышев А.Ю., Омарова П.Н., Хабибуллина А.А. Обоснование проведения гениопластики как этапа ортогнатической операции у пациентов со скелетными аномалиями и деформациями челюстей. Голова и шея Head and neck Russian Journal. 2019;7(1):59–68
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Введение
Подбородочная часть нижней челюсти (НЧ) рассматривается как одна из наиболее эстетически значимых структур лицевого скелета. Размер и расположение подбородка вносят вклад в индивидуальность лица, а также оказывают влияние на восприятие его привлекательности [1].
На сегодняшний день стандартом оказания медицинской помощи пациентам с врожденными и приобретенными деформациями лица является комбинированное лечение: ортодонтическое лечение и ортогнатическая операция. Аномалии и деформации зубочелюстной системы широко распространены в популяции и среди всех стоматологических заболеваний занимают одно из ведущих мест [2, 3]. Хирургическим этапом лечения являются остеотомия верхней челюсти по Ле-Фор I, межкортикальная остеотомия НЧ в сочетании с остеотомией подбородка [4].
К методам гениопластики относятся остеотомия подбородка с его перемещением, увеличение подбородка при помощи подбородочных имплантатов, аутотрансплантация жировой ткани, а также увеличение подбородка филлерами [5–8]. Для аллопластики подбородка могут использоваться различные материалы, например, аутогенная кость или гидроксиапатитовые блоки, силикон и т.д. [9]. По данным литературы, наиболее стабильный и долгосрочный результат достигается при применении метода остеотомии подбородочной части НЧ [10]. Также было доказано, что число пациентов, которым была проведена остеотомия подбородка, были удовлетворены результатом операции больше (90–95%), чем пациенты, которым проводилось увеличение подбородка имплантатами (85–90%) [11].
Остеотомия позволяет изменить форму подбородка в трех пространствах, в то время как показанием к проведению аллопластического увеличения подбородка при помощи имплантатов возможно только при микро-/ретрогении в сочетании с неглубокой подбородочно-губной складкой [6].
По данным литературы, наиболее часто применяемыми методами остеотомии подбородочной части НЧ являются горизонтальная (скользящая) остеотомия, «chin-wing» остеотомия [12, 13]. Представленные методики имеют ряд модификаций, которые, по сути, сводятся к проведению различного вида остеотомий с перемещением подбородочной части НЧ. Объективно данных о преимуществах одной из описанных методик по данным литературы не обнаружено.
Для получения оптимального эстетического и функционального результата требуется тщательная оценка лицевых параметров пациента.
Целью данного исследования явилось обоснование проведения гениопластики как этапа ортогнатической операции, а также выявление комплекса морфометрических особенностей лиц пациентов со скелетными аномалиями и деформациями челюстей до и после проведения ортогнатической операции в сочетании с гениопластикой.
Материал и методы
На базе кафедры челюстно-лицевой и пластической хирургии МГМСУ им. А.И. Евдокимова был проведен анализ 1332 историй болезни пациентов со скелетными аномалиями и деформациями челюстей. Из них 308 пациентам была проведена остеотомия подбородка, как этап ортогнатической операции. В исследуемую группу вошло 80 пациентов со скелетными аномалиями и деформациями челюстей, фотографии в профиль которых до и после ортогнатической операции в сочетании с остеотомией подбородка были отобраны для проведения фотометрического анализа. Исследуемая группа была разделена на 2 подгруппы по половому признаку. Число мужчин со II скелетным классом – 21, с III скелетным классом – 8. Число женщин со II скелетным классом – 24, с III скелетным классом – 27 (рис. 1).
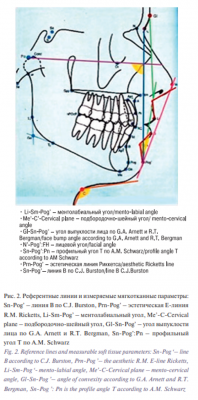
Для оценки эффективности проведения гениопластики были выбраны параметры, изменения которых в основном обусловлены перемещением подбородочной части НЧ, такие как ментолабиальный угол, подбородочно-шейный угол, угол выпуклости лица по G.A. Arnett и R.T. Bergman, лицевой угол, профильный угол T по Шварцу, расстояние от губ до линии В по C.J. Burston и до эстетической E-линии R.M. Ricketts (рис. 2).
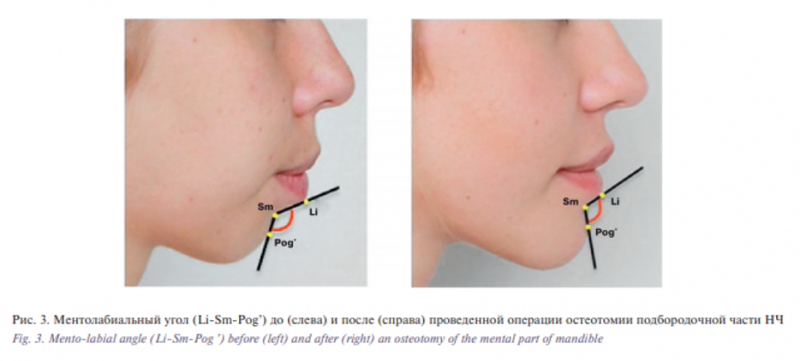
Область супраментальной складки формирует переход от нижней губы к мягким тканям подбородка и является одним из важнейших эстетических параметров лица. Если контур подбородочной складки выражен, нижняя губа будет «вялой». Это отмечается в случае дистальной окклюзии и/или уменьшения высоты нижнего отдела лица. Сглаженная подбородочная складка, напротив, сопровождает нижнюю прогнатию,и при этом наблюдается напряжение нижней губы [14]. Ментолабиальный (подбородочно-губный) угол образован пересечением в точке Submentale (Sm) касательной к нижней губе, проходящей через точку Labiale inferius (Li) и касательной к верхней части мягких тканей подбородка, проходящей через наиболее переднюю точку мягких тканей подбородка – точку Pogonion (рис. 3).
Диапазон нормальных значений ментолабиального угла составляет 107–118° [15].
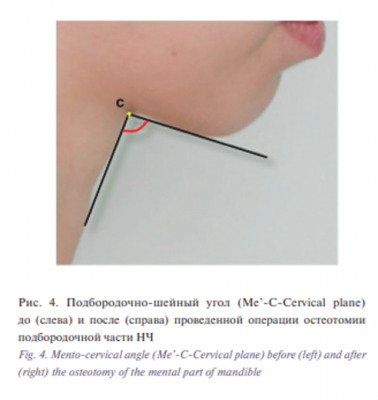
Подбородочно-шейный угол меняется в результате ортогнатических операций и также является важным эстетическим параметром лица для сравнительной диагностики и планирования лечения. Морфология подподбородочной области влияет на эстетику нижней трети лица, а подбородочно-шейный угол является важным фактором, определяющим привлекательность лицевого профиля. К этиологическим факторам формирования неэстетичного подбородочно-шейного контура относятся сниженный тонус кожи подбородочно-шейной области и мышц дна полости рта, жировые отложения в подподбородочном треугольнике, над и под подкожной мышцей шеи, особенности анатомического строения НЧ и подбородка [16]. Подбородочношейный угол образован пересечением подподбородочной (субментальной) и шейной (цервикальной) линиями. Субментальная линия расположена между точкой C и наиболее нижней мягкотканной точкой подбородка (Me’) и проводится касательно к подподбородочному контуру через точку Me’, а цервикальная линия проводится касательно к передней поверхности шеи над и под выступанием щитовидного хряща. Шейная точка (C-point) – задняя верхняя точка шеи, расположенная на пересечении данных линий (рис. 4). Нормальные значения для данного параметра составляют 90–105о [17].
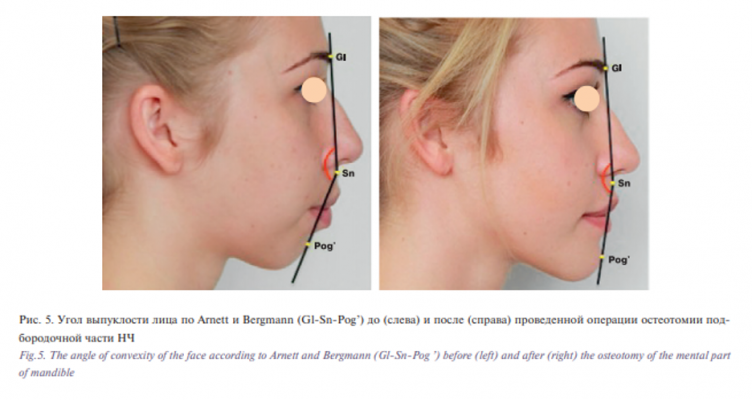
Для определения гармоничности профиля важным параметром является угол выпуклости лица по Arnett и Bergmann, образованный двумя линиями, одна из которых проходит через точки Gl и точку Sn, расположенную у основания носа, а вторая – от точки Sn вниз до подбородка (рис. 5). В норме угол составляет 165–175° [14].
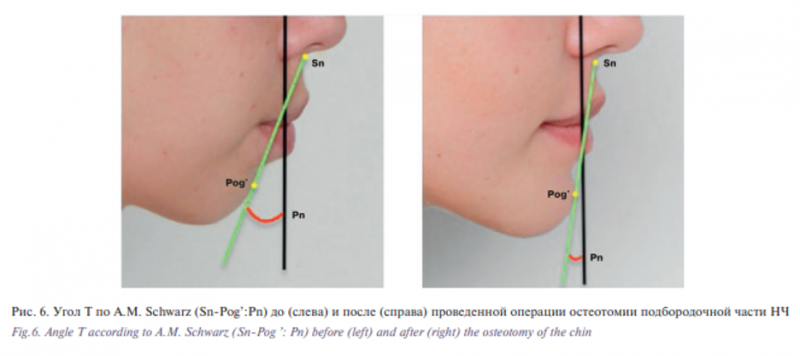
Линия T, которая проходит через точки Subnasale (Sn) и Pogonion (Pog’) и носовой перпендикуляр Pn, пересекаясь образуют угол Т, который в норме равен 10° (рис. 6). Такой профиль, по мнению A.M. Schwarz, идеален в эстетическом отношении и назван прямым. Если профильный угол больше 10°, то профиль называется скошенным кзади, если меньше – скошенным кпереди. Величина угла Т характеризует положение подбородка к подносовой точке и обусловливает форму профиля, а, следовательно, имеет значение при планировании лечения пациентов с сагиттальными аномалиями [18].
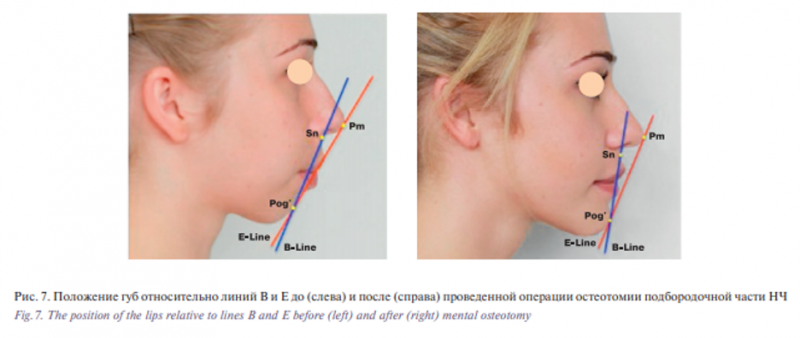
R.M. Ricketts (1957) рекомендовал определять положение губ относительно эстетической линии (Е-линии), которая проходит через наиболее выступающую точку носа (Prn) и подбородка – точку Pog’ (рис. 7). При гармонично развитом лице губы располагаются позади этой плоскости – верхняя губа на 2–3 мм, нижняя на 1–2 мм [14].
C.J. Burson (1967) предложил использовать В-линию, соединяющую мягкотканные точки Sn и Pog’ (рис. 7). Верхняя губа должна располагаться впереди этой линии на 3,5±1,4 мм, а нижняя губа – впереди на 2,2±1,6 мм [14].
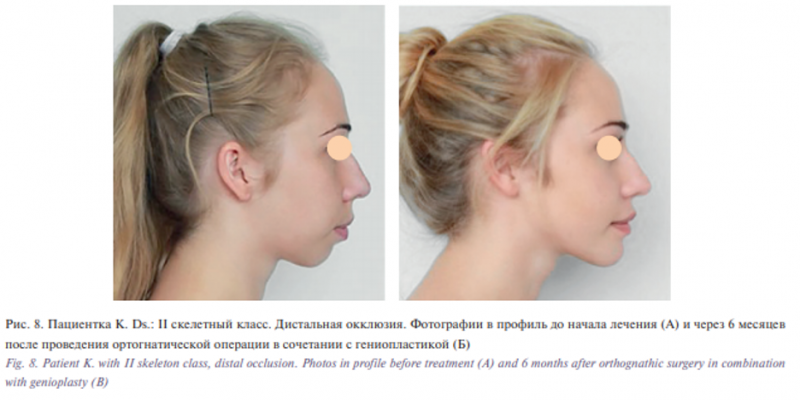
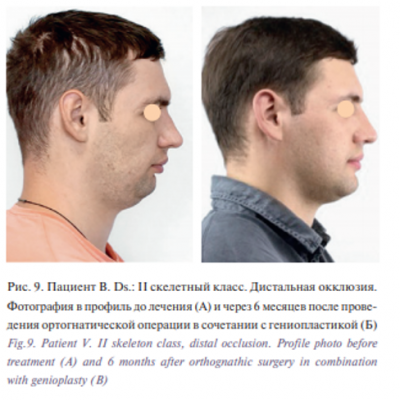
Сравнение по данным параметрам (рис. 2) проводилось по стандартизированным фотографиям пациентов в профиль до и через 6 месяцев после проведенного лечения (рис. 8, 9).
Статистическая достоверность полученных данных анализировалась путем расчета параметрического t-критерия Стьюдента с учетом нормальности распределения данных и непараметрического t-критерия Вилкоксона, применяемого для оценки различий между двумя зависимыми выборками, взятыми из закона распределения, отличного от нормального, в программном обеспечении Statistica 10. Результаты интерпретировались в соответствии со степенью достоверности р менее 0,05. Также нами было проведено сравнение средних значений исследуемых параметров (рис. 1) после проведенного лечения с нормальными значениями.
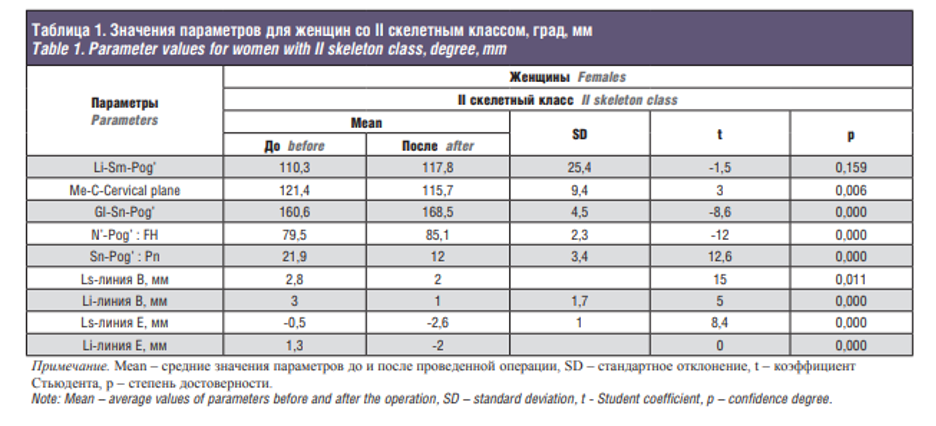
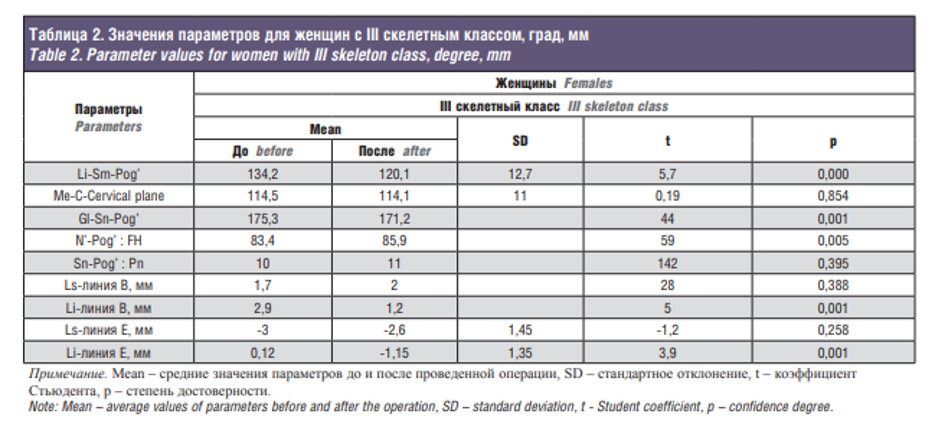
Результаты исследования Таким образом, при проведении статистической обработки данных были выявлены достоверно значимые отличия исследуемых параметров (рис. 1) до и после проведения ортогнатической операции в сочетании с гениопластикой. В табл. 1 представлены различия параметров до и после хирургического этапа комбинированного лечения в группе пациентов женского пола со II скелетным классом. Так, статистически достоверное различие значений до и после проведенной операции отмечалось в таких параметрах, как Me-C-Cervical plane (p=0,006), Gl-Sn-Pog’ (p=000), N’-Pog’:FH (p=0,000), Sn-Pog’:Pn (p=0,000), Ls-линия B (p=0,011), Li-линия B (p=0,000), Ls-линия Е (p=0,000), Li- линия E (p=0,000). Изменение значения параметра Li-Sm-Pog’ произошло незначительно (p=0,159). В табл. 2 представлены различия параметров до и после хирургического этапа комбинированного лечения в группе пациентов женского пола с III скелетным классом. В данной группе пациентов отмечалось статистически достоверное изменение значений таких параметров, как Li-Sm-Pog’ (p=0,000), Gl-Sn-Pog’ (p=0,001), N’-Pog’:FH (p=0,005), Li-линия B (p=0,001) и Li- линия E (p=0,001). Изменение значений параметров Me-C-Cervical plane (p=0,854), Sn-Pog’:Pn (p=0,395), Ls-линия B (p=0,388), Ls-линия Е (p=0,258) произошло незначительно.
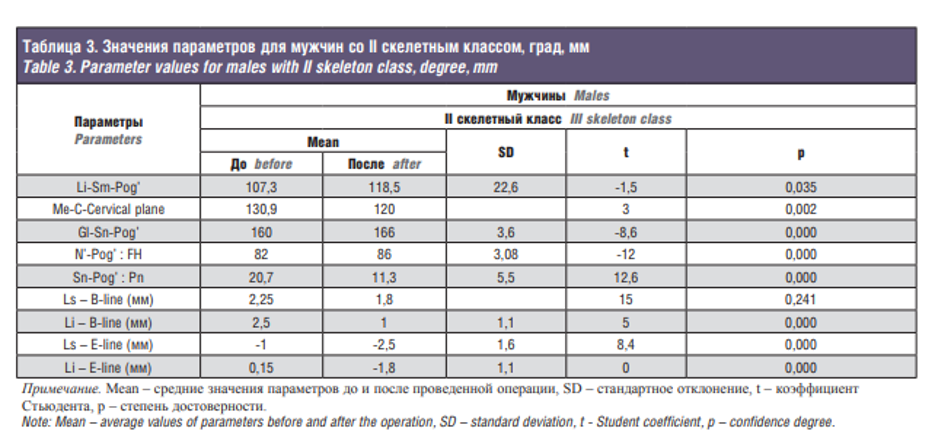
В табл. 3 представлены различия параметров до и после хирургического этапа комбинированного лечения в группе пациентов мужского пола со II скелетным классом. Так, статистически достоверными оказались параметры Li-Sm-Pog’ (p=0,035), Me-C-Cervical plane (p=0,002), Gl-Sn-Pog’ (p=0,000), N’-Pog’ : FH (p=0,000), Sn-Pog’ : Pn (p=0,000), Li-линия B (p=0,000), Ls-линия Е (p=0,000), Li-линия E (p=0,000). Уменьшение значения параметра Ls-линия B (p=0,241) произошло незначительно.
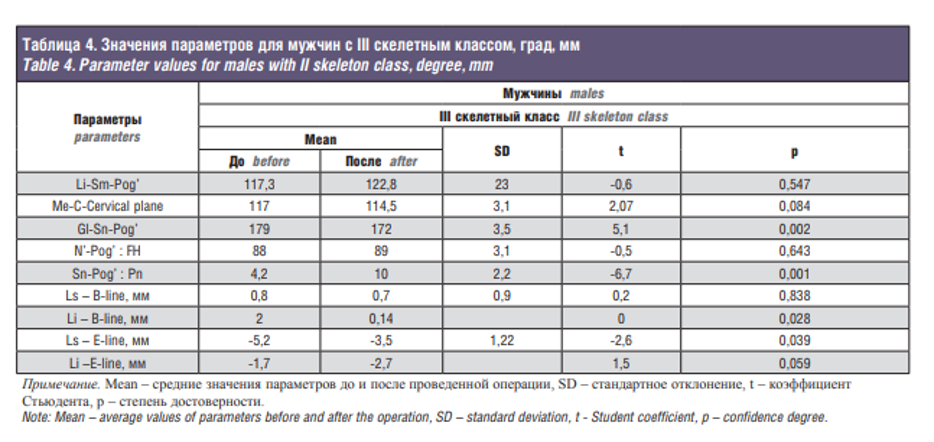
В табл. 4 представлены различия параметров до и после ортогнатической операции в сочетании с гениопластикой в группе пациентов мужского пола с III скелетным классом. После проведенной операции произошло значительное изменение таких параметров, как Gl-Sn-Pog’ (p=0,002), Sn-Pog’ : Pn (p=0,001), Li – B-line (p=0,028), Ls – Е-line (p=0,039). Незначительно увеличились значения параметров Ls-линия B(p=0,838) и Li — E-line (p=0,059).
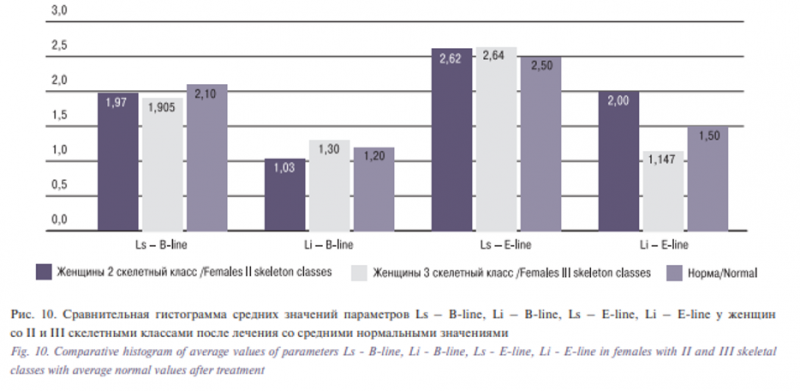
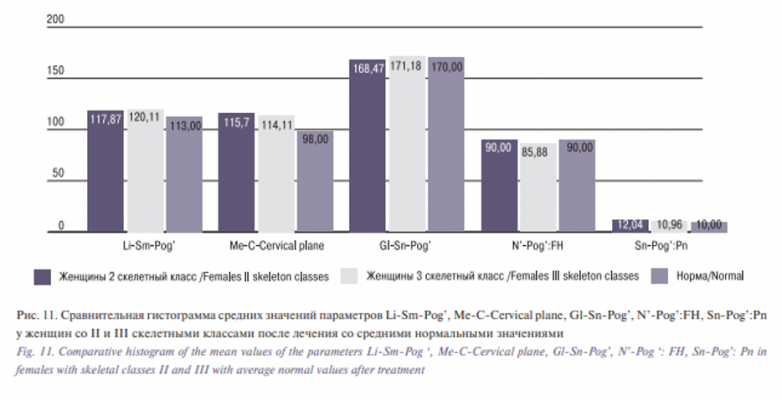
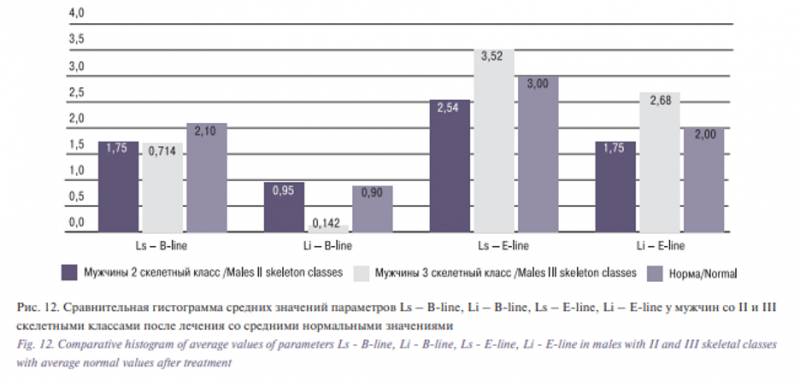
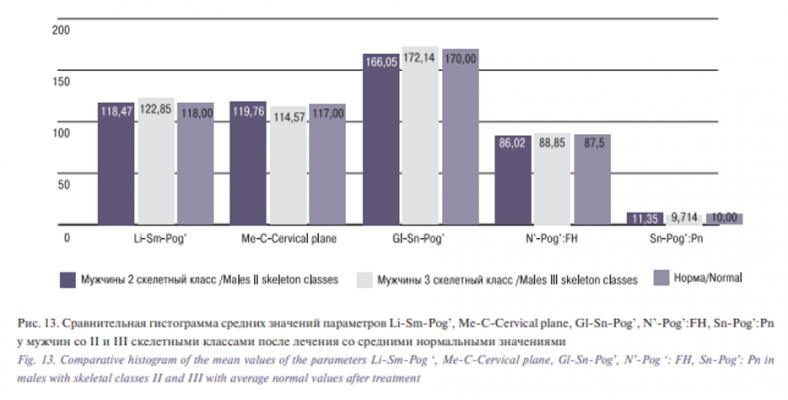
На рис. 10–13 представлена сравнительная характеристика средних значений исследуемых параметров после ортогнатической операции в сочетании с гениопластикой (табл. 1–4) со средними нормальными значениями, по которым мы можем отметить приближение значений указанных параметров к нормальным после хирургического этапа комбинированного лечения.
В результате анализа выяснено, что положение губ у мужчин с III скелетным классом относительно эстетической линии Рикеттса (Ls – E line; Li – E line) после проведенного лечения не соответствует «идеальному» положению губ (рис. 12), нормой для которого автор указывает положение верхней и нижней губ кзади от данной на линии на 2–3 и 1–2 мм соответственно. Тем не менее границы вариабельности сагиттального положения губ у исследуемой нами группы были достаточно близки к допустимым показателям по Риккетс. Что касается расстояния от губ до линии В по C.J. Burston (Ls – B line; Li – B line) у мужчин с III скелетным классом, полученные нами значения несколько выбиваются из указанного автором диапазона (рис. 12), а именно: положение верхней губы впереди этой линии на 3,5±1,4 мм, а нижняя губа – впереди на 2,2±1,6 мм, однако у мужчин со II скелетным классом эти значение параметра Ls – B line приближено, а значение параметра Li – В line попадают в указанную автором границу нормы. Все вышеизложенное позволяет нам говорить о наличии тенденции к более ретрузивному положению губ для данной выборки. В ходе анализа литературы было выявлено, что по данным некоторых авторов костные перемещения фрагментов не сопровождаются выраженными мягкотканными изменениями [19–21], но один конкретно взятый параметр не отражает целостности эстетического восприятия лица пациента.
Обсуждение
В ходе данного исследования были изучены изменения параметров лиц восточно-европейского антропологического типа мужчин и женщин с гнатическими формами мезиальной и дистальной окклюзии до и после хирургического этапа комбинированного лечения для оценки эффективности проведения гениопластики, как этапа ортогнатической операции (рис. 2).
Таким образом, в результате данного исследования оказалось, что выполнение операции «Остеотомия верхней челюсти по Ле-Фор I, межкортикальная остеотомия нижней челюсти с постановкой в ортогнатическое соотношение. Остеотомия подбородка, гениопластика». у пациентов со II и III скелетными классами позволяет достичь наиболее предсказуемого эстетического результата, а также в результате проведенного комплексного лечения у данных пациентов происходит нормализация ключевых морфометрических параметров, изменения которых обусловлены перемещением подбородочной части нижней челюсти (рис. 10-13).
ЛИТЕРАТУРА/REFERENCES
- Abadi M., Pour O.B. Genioplasty. Facial. Plast. Surg. 2015;31(05):513–22.
- Obraztsov Yu.L., Larionov S.N. Propaedeutic orthodontics: Study guide. SPb., 2007. 160 p.
- Kuroyedova V.D., Makarova A.N. Prevalence of malocclusion in adults and share of asymmetric forms among them. Poltava: Mir. Meditsin. Biol. 2012. Р. 31–4.
- Drobyshev A.Yu., Yanushevich O.O. Maxillofacial Surgery: Textbook. М., 2018. 880 p.
- Chang E.W., Lam S.M., Karen M. Sliding genioplasty for correction of chin abnormalities. Arch. Facial. Plast. Surg. 2001;3(1):8–15.
- Thorne C.H., Rosen H.M. Osseus Genioplasty. Grabb and Smith’s plastic surgery. 6th ed., 2007;55:557–62.
- Sykes J.M., Fitzerald R. Choosing the best procedure to augment the chin: is anything better than an implant? Facial. Plast. Surg. 2016;32(5):507–12.
- Meara D.J. Osteotomy vs Augmentation Genioplasty. JAMA. Facial. Plast. Surg. 2016;18(2):118–9.
- Drobyshev A.Yu., Anastasov G.А. Fundamentals of orthognathic surgery. М., 2007. Р. 36–8.
- Bertossi D., Galzignato P.-F., Albanese M., et al. Chin microgenia: a clinical comparative study. Aesthet. Plast. Surg. 2015;39(5):651–8.
- Guyuron B., Raszewski R.L. A critical comparison of osteoplastic and alloplastic augmentation genioplasty. Aesth. Plast. Surg. 1990;14:199–206.
- Triaca A. Chin wing osteotomy – a new facial concept. Head Face Med. 2014;10(Suppl. 1):6.
- Kashani H., Rasmusson L. Osteotomies in Orthognathic Surgery. A Textbook of Advanced Oral and Maxillofacial Surgery Volume 3 Mohammad Hosein Kalantar Motamedi (red.). 2016. Р. 617–49.
- Persin L.S. Orthodontics. Diagnosis and treatment of dentofacial anomalies: Guide for doctors. М., 2015. 495–522 p.
- Naini F.B., Cobourne M.T., Garagiola U., et al. Mentolabial angle and aesthetics: a quantitative investigation of idealized and normative values. Maxillofac. Plast. Reconstr. Surg. 2017;39(1):4.
- Naini F.B. Facial aesthetics: concepts and clinical diagnosis. Oxford: Wiley. 2011. Р. 335–48.
- Naini F.B., Cobourne M.T., McDonald F. et al. Submental-Cervical angle: perceived attractiveness and threshold value of desire for surgery. J. Maxillofac. Oral Surg. 2016;15(4):469–77.
- Nettsel F., Shults K. Practical Guide for orthodontic diagnosis. L’vov: GalDent. 2006. Р. 152–6.
- Rustemeyer J., Martin A. Soft tissue response in orthognathic surgery treated by bimaxillary osteotomy: cephalometry compared with 2-D photogrammetry. Oral Maxillofac. Surg. 2013;17(1):33–41.
- Ribeiro H.T., Faria A.C., Terreri A.L., et al. A cephalometric analysis for evaluation of changes in soft tissues in the regions of the upper and lower lips and chin due to orthognathic maxillary advancement surgery. Int. Arch. Otorhinolaryngol. 2014;18(1):57–62.
- Singh S., Mehrotra D., Mohammad S. Profile changes after conventional and chin shield genioplasty. J. Oral Biol. Craniofac. Res. 2014;4(2):70–5.
Поступила 20.10.18
Принята в печать 01.02.19
Received 20.10.18
Accepted 01.02.19
Информация об авторах:
Е.Г. Свиридов – к.м.н., ассистент кафедры челюстно-лицевой и пластической хирургии МГМСУ им. А.И. Евдокимова, Москва, Россия, orcid.org/0000-0001-5093-4811
А.Ю. Дробышев – д.м.н., профессор, заслуженный врач РФ, заведующий кафедрой челюстно-лицевой и пластической хирургии МГМСУ им. А.И. Евдокимова, Москва, Россия, orcid.org/0000-0002-1710-6923
П.Н. Омарова – клинический ординатор, кафедра челюстно-лицевой и пластической хирургии МГМСУ им. А.И. Евдокимова, Москва, Россия; e-mail: patyusman@mail.ru, orcid.org/0000-0002-0243- 8589
А.А. Хабибуллина – аспирант кафедры челюстно-лицевой и пластической хирургии МГМСУ им. А.И. Евдокимова, Москва, Россия, orcid.org/0000- 0001-7817-0569
About the authors:
E.G. Sviridov – MD, Ph.D., Assistant of the Department of Maxillofacial and Plastic Surgery, Moscow State University of Medicine and Dentistry named after. A.I. Evdokimov, Moscow, Russia, orcid.org/0000-0001-5093-4811
A.Yu. Drobyshev — MD, Professor, Honored Doctor of the Russian Federation, Head of the Department of Maxillofacial and Plastic Surgery, Moscow State University of Medicine and Dentistry named after. A.I. Evdokimov, Moscow, Russia, orcid.org/0000-0002-1710-6923
P.N. Omarova – MD, medical resident of the Department of Maxillofacial and Plastic Surgery, Moscow State University of Medicine and Dentistry named after. A.I. Evdokimov, Moscow, Russia, orcid.org/0000-0002-0243-8589
A.A. Khabibullina – MD, post-graduate student of the Department of Maxillofacial and Plastic Surgery, Moscow State University of Medicine and Dentistry named after. A.I. Evdokimov, Moscow, Russia, orcid.org/0000-0001-7817-0569
Введение
Соматостатин был впервые выделен и описан P. Brazeau et al. в 1973 году как вещество, способное тормозить высвобождение гормона роста [1], в этом же году он был впервые синтезирован в лабораторных условиях.
Изначально соматостатин был выделен из гипоталамуса, однако впоследствии оказалось, что он синтезируется во многих клетках, расположенных вне его, в том числе в желудке, кишечнике, поджелудочной железе, в области периферических нервных окончаний, в надпочечниках и сетчатке глаза. Как и другие пептидные гормоны, сома тостатин взаимодействует с рецепторами плазматиче- ской мембраны, при этом различают 5 типов рецепторов, которые экспрессируются в гипофизе, органах пищева- рительной системы и других, а также присутствуют во многих опухолевых клетках [2–4].
Соматостатин и его синтетические аналоги применяются не только при акромегалии и опухолях гипоталамуса, но и при панкреатитах и панкреонекрозах, а также при хирургических вмешательствах на ЖКТ и при лечении свищей пищеварительного тракта в связи с ингибирующим действием на секрецию соляной кислоты, пепсина и гастрина в желудке, угнетающим действием на эндо- и экзокринную функции поджелудочной железы, а также угнетением моторной активности желудочно-кишечного тракта, секреторной активности печени, желудка и тон- кого кишечника [5, 6]. Препарат Октреотид (Octreotide) представляет собой аналог гормона соматостатина и относится к фармакологической группе «Гормоны гипо- таламуса, гипофиза, гонадотропины и их антагонисты». В отличие от соматостатина, период полувыведения кото- рого составляет около 2–3 минут, период полувыведения препарата Октреотид составляет 100 минут, что делает возможным и целесообразным его применение для про- филактики осложнений при хирургических вмешательствах [7]. Эффективность и возможность применения в хирургической практике соматостатина и его производных была подробно рассмотрена и изучена в России и за рубежом [8–11], исследовалось использование препаратов в том числе при консервативной терапии послеоперационного хилоторакса, хилезного асцита [12–14]. Ряд исследователей получили положительный результат, применяя данные препараты в педиатрической практике [15–17]. В настоящее время Октреотид входит в список средств, рекомендованных в том числе в хирургической практике, код по МКБ-10 Z.100.
Наиболее распространенными заболеваниями слюнной железы являются сиаладенит, сиалолитиаз и паротит. После воспалительного процесса или травмы в результате закрытия общего протока или протока, отходящего от дольки железы, образуются ретенционные кисты, чаще в малых слюнных железах (нижней губы, щеки), реже – больших слюнных желез. Опухоли слюнных желез составляют по отношению к новообразованиям других органов 1–2%. Наиболее часто поражаются околоушные слюнные железы, реже – подчелюстные, подъязычная и малые слюнные железы [18–20]. При лечении доброкачественных новообразований слюнных желез опухолевый узел осторожно удаляется вместе с капсулой с последующим гистологическим исследованием удаленных тканей [21, 22].
В ряде научных работ рассматривалось положительное влияние препарата Октреотид при хирургическом лече- нии, затрагивавшем слюнные железы, – в частности, предотвращение развития и более быстрое закрытие слюнных свищей [23], а также лучший прогноз при пал- лиативных операциях на экскреторных железах [24], положительный эффект при добавлении Октреотида к консервативной терапии ксеростомии, вызванной луче- вым воздействием на большие слюнные железы [25], также исследовалось влияние препарата Октреотид на саливацию и концентрацию амилазы в секрете слюнных желез [26].
Материалы и методы
Настоящее исследование с результатами в формате экспертной оценки проводилось на базе отделения плас- тической хирургии Университетской клинической боль- ницы No1 Первого МГМУ им. И.М.Сеченова во временном интервале май-ноябрь 2015 года. Целью исследования была оценка влияния препарата Октреотид, применяемо- го в пред- и послеоперационном периоде, на количество осложнений при хирургическом лечении, включавшем удаление или резекцию одной или более слюнных желез. Также оценивалась безопасность препарата Октреотид при использовании в послеоперационном периоде после операций на больших слюнных железах.
Исследование проводилось с очным участием и под руководством проф., руководителя отделения пласти- ческой хирургии, д.м.н. Решетова И.В. В исследовании приняли участие пациенты мужского и женского пола в возрасте от 18 лет, которым было выполнено хирургиче- ское вмешательство на одной или более больших слюнных железах в объеме резекции или удаления. Исключались из исследования пациенты с непереносимостью ком- понентов исследуемого препарата и общесоматической патологией в стадии декомпенсации. Препарат Октреотид вводился подкожно в дозировках, рекомендованных при профилактике осложнений при хирургических операциях на поджелудочной слюнной железе: 100 мкг за 1 час до хирургического вмешательства, затем по 100 мкг 3 раза в сутки на протяжении 7 дней подряд.
Контрольное обследование проводилось через 2 недели после хирургического лечения, результат оценивался по наличию или отсутствию послеоперационных осложнений – инфицирования раны, гематомы, серомы или лимфореи, такие осложнения, как синдром Фрея и парез лицевого нерва, не рассматривались в связи со значительной зависимостью частоты их развития от объема и тактики хирургического лечения.
Были предусмотрены критерии выхода пациента из исследования при невозможности проведения контроль- ного осмотра через 2 недели после хирургического лечения, при развитии аллергических реакций на компоненты препарата, полиорганной недостаточности или летальном исходе в период наблюдения.
В исследовании приняли участие 56 пациентов, про- ходивших хирургическое лечение в отделении пластической хирургии Университетской клинической боль- ницы No1 Первого МГМУ им. И.М.Сеченова. Пациенты в возрасте 21–77 лет; среди них мужчин – 71,4% (40), женщин – 28,6% (16) были прооперированы; по поводу злокачественного новообразования, включая первичные операции, шейные и подчелюстные лимфаденэктомии, операции по поводу рецидивов и продолженного роста опухоли, реконструктивно-пластические операции после предшествующего лечения – 92,8% (52 пациента), также среди них – получавшие лучевую или химиотерапию в прошлом; по поводу доброкачественных новообразований слюнных желез – 7,2% (4 пациента); при этом была выполнена резекция или удаление околоушной слюнной железы в 71,4% (40 пациентов), одной подчелюстной слюнной железы или обеих – в 48,2% (24 пациента), одной подъязычной слюнной железы или обеих – в 14,2% (8 пациентов).
Результаты
За время наблюдения в послеоперационном периоде (в течение 2 недель) у пациентов на фоне стандартной терапии в сочетании с подкожными инъекциями Октреотида в указанной выше дозировке не было выявлено случаев развития инфицирования раны, гематомы или лимфореи; в 1,8% (1 случай) была выявлена серома околоушной области, потребовавшая дренирования послеоперационной раны на 5-е сутки после операции, дренаж был удален на 8-е сутки после операции с наложением отсроченных швов, после чего рана зажила первичным натяжением.
Также в 3,6% (2 случая) были отмечены участки диастаза швов послеоперационной раны, однако данных за связь данного осложнения с наличием кровотечения, лимфореи или развитием слюнного свища получено не было. В обоих случаях раны зажили вторичным натяжением, не потребовав дополнительного хирургического лечения.
Ни один из принявших участие в эксперименте пациентов не вышел из исследования, также у наблюдаемых пациентов не наблюдалось побочных или нежелательных явлений на введение препарата Октреотид.
Обсуждение
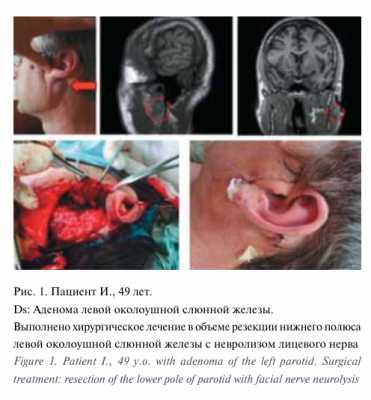
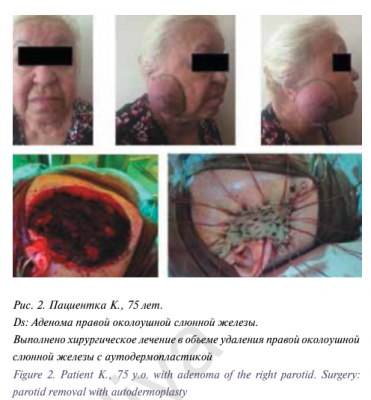
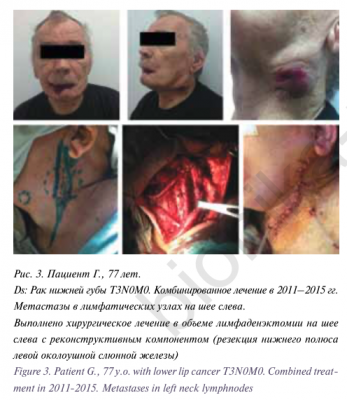
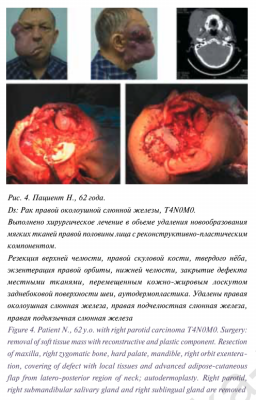
Одними из наиболее частых осложнений при хирургическом лечении больших слюнных желез являются инфициро- вание раны (2,3–3,8%), гематома (3,4–3,8%), серома/лимфорея (1,1–6,5%), синдром Фрея (1,7–4,8%) и парез лицевого нерва [27–29]. Как уже было указано, такие осложнения, как синдром Фрея и парез лицевого нерва, не рассматривались в связи со значительной зависимостью частоты их развития от объема и тактики хирургического лечения. Единственный случай развития учитываемого осложнения – серомы послеоперационной раны, составившей 1,8% всех случаев, можно считать хорошим показателем с учетом данных предше- ствующего опыта хирургического лечения, включающего резекцию или удаление одной или нескольких слюнных желез, кафедры пластической хирургии Университетской клинической больницы No1 Первого МГМУ им. И.М.Сеченова, а также данные мировой литературы. Особо следует отме- тить разнообразие выполненных операций, включающих резекцию одной слюнной железы при доброкачественном новообразовании (рис. 1), полное удаление одной слюнной железы по поводу доброкачественных или злокачественных новообразований (рис. 2), шейные лимфаденэктомии в связи с метастатическим поражением лимфатических узлов шеи или в профилактическом порядке (рис. 3), обширные резекции по поводу местно-распространенных опухолей (рис. 4), операции с одномоментным реконструктивным компонентом, включая реконструкцию свободным лоскутом с использованием микрохирургической техники (рис. 5). Особо следует отметить гладкий послеоперационный период пациентов, прошедших ранее лучевую терапию, так как в связи с пост лучевыми изменениями слюнных желез и прилежащих к ним мягких тканей у таких пациентов гораздо чаще встречаются не только послеоперационные осложнения, но и фоновые жалобы на ксеростомию и дискомфорт в полости рта.
В настоящее время проводится проспективное рандо- мизированное двойное слепое плацебо-контролируемое клиническое исследование в параллельных группах 2-й фазы по изучении эффективности Октреотида в профилактике развития слюнных свищей после хирургических операций по жизненным показаниям у пациентов, прошедших лучевую терапию. В ходе исследования также будут оцениваться секреторная активность слюнных желез и выраженность болевого синдрома. Режим дозирования соответствует дозам при профилактике хирургических осложнений на поджелу- дочной железе, 100 мкг перед операций и аналогичная доза трижды в день на протяжении двух недель после операции. Результаты исследования ожидаются в 2018 г. [30].
Помимо влияния препарата Октреотид непосредственно на рецепторы слюнных желез, следует рассмотреть возможный положительный эффект при резекции и удалении больших слюнных желез с точки зрения профилактики осложнений после хирургического вмешательства на органах лимфатической системы – учитывая соседствующее положение слюнных желез с лимфатическими узлами (подчелюстная и околоушная группы), возможность расположения лимфатических узлов, протоков и скопления лимфатической ткани внутри желез, а также выполнение резекции нижнего полюса околоушной слюнной железы или подчелюстной слюнной железы при шейной лимфаденэктомии [31]. Ранее исследована эффективность препарата Октреотид по этим показаниям, отмечено положи- тельное воздействие при лечении и профилактике лимфореи при хирургическом удалении подмышечных [32, 33], тазовых [34], шейных и подчелюстных [35] лимфатических узлов, лим- фодиссекциях при хирургических операциях по поводу рака желудка [36], а также в терапии массивных лимфорей после иссечения лимфатических мальформаций [37].
Выводы
Учитывая положительный опыт применения препарата Октреотид при хирургических операциях на больших слюнных железах, мы считаем целесообразным проведение дальней- ших клинических исследований с большим уровнем доказа- тельности. Помимо обоснованности применения Октреотида для профилактики осложнений, связанных с резекцией или удалением больших слюнных желез, особое внимание следует уделить положительному эффекту при терапии пациентов, прошедших лучевую терапию, затрагивавшую большие слюнные железы. В связи с положительным эффектом препарата Октреотид в профилактике и терапии осложнений, связанных с лимфатической системой, в том числе развития лимфорей и сером, перспективным видится его применение при проведении шейных лимфаденэктомий, при проведении которых могут быть резецированы или удалены подчелюстная или нижний полюс околоушной слюнной железы.
ЛИТЕРАТУРА/REFERENCES
- Brazeau P., Vale W., Burgus R., et al. Hypothalamic polypep tide that inhibits the secretion of immuno-reactive pituitary growth hormone Science. 1973;179:77–9.
- Csaba Z., Peineat S., Dournaud P. Molecular mechanisms of somatostatin receptor trafficking. J Mol Endocrinol. February 1, 2012;48:R1–R12.
- Csaba Z., Dournaud P. Cellular biology of somatostatin receptors. 2001;35(1):1–23.
- Unger N., Ueberberg B., Schulz S., Saeger W., Mann K., Petersenn S. Differential expression of somatostatin receptor subtype 1-5 proteins in numerous human normal tissues. Exp Clin Endocrinol Diabetes. 2012;120(08):482–489.
- Гельфанд Б.Р., Бруневич С.З., Гройзик К.Л. Препараты соматостатина в неотложной панкреатологии: состояние и перспективы. Вестникинтенсивной терапии. 1998;3:19–24. Gelfand B.R., Brunevich S.Z., Groizik K.L. Somatostatin in urgent pancreatology: status and prospects. Intensive therapy bulletin. 1998;3:19–24.
- Гринберг А.А., Затевахин И.И., Щеголев А.А. Хирургическая тактика при язвенных гастродуоденальных кровотечениях. М.: Принтэкспресс. 149 с. Grinberg A.A., Zatevakhin I.I., Schyogolev A.A. Syrgical tactics in ulcerous gastroduodenal bleedings. : Printexpress, 149 p.
- Моисеенко С.В. Октреотид – перспективы клинического применения. Клиническая фармакология и терапия. 1998; 8:73–77. Moiseenko S.V. Octreotide: clinical use prospects. Clinical pharmacology and therapy. 1998;8:73–77.
- Аль Сибунчи О.А., Павлычев А.В., Товмасян Р.С. Применение октреотида в хирургической гастроэнтерологии. М.: ГБОУ ВПО «РНИМУ имени Н И. Пирогова», 2013. 26 с. Al Sibunchi O.A., Pavlychev A.V., Tovmasyan R.S. Octreotide usage in surgical gastroenterology. M.: SBEI Pirogov Russian scientific research medical university. 2013. 26 p.
- Hwang S.J., Lin H.C., Chang C.F., Lee F.Y., Lu C.W., Hsia H.C., et al. A randomized controlled trial comparing octreotide and vasopressin in the control of acute oesophageal bleeding. J Hepatol. 1992;16:320–5.
- Christiansen J., Ottenjann R., Von Arx F. Placebo-controlled trial with the somatostatin analogue SMS 201-995 in peptic ulcer bleeding. 1989;97:568–74.
- Binder M., Uhl W., Friess H., Malfertheiner P., Bachler M.W. Octreotide in the treatment of acute pancreatitis: results of a unicentric prospective trial with three different octreotide dosages. 1994;55(Suppl 1):20–3.
- Rosti L., Bini R.M., Chessa M., Butera G., Drago M., Carminati M. The effectiveness of octreotide in the treatment of post-operative chylothorax. Eur J Pediatr. 2002;161:149–50.
- Cheung Y., Leung M.P., Yip M. Octreotide for treatment of post-operative chylothorax. J Pediatr. 2001;139:157–9.
- Bhatia C., Pratap U., Slavik Z. Octreotide therapy: a new horizon in treatment of iatrogenic chyloperitoneum. Arch Dis Child. 2001;85:234–5.
- Al-Hussaini A., Butzner D. Therapeutic Applications of Octreotide in Pediatric Patients. Saudi J Gastroenterol. 2012 Mar-Apr;18(2):87–94.
- Tissieres P., Bugmann P., Rimensberger P.C., Mentha G., Lencoultre C., Belli D.C. Somatostatin in the treatment of pancreatic pseudocyst complicating acute pancreatitis in a child with liver transplantation. J Pediatr Gastroenterol Nutr. 2000;31:445–7.
- Lam J.C., Aters S., Tobias J.D. Initial experience with octreotide in the pediatric population. Am J Ther. 2001;8:409–15.
- Eskander A., Irish J., Freeman J., Gullane P., Gilbert R., Groome P.A., Hall S.F., Urbach D.R., Goldsteinco D.P. Overview of major salivary gland cancer surgery in Ontario (2003–2010). J Otolaryngol Head Neck Surg. 2014;43(1):50.Toronto, On: Canadian Cancer Society; 2013. [updated May, 2013; cited March 15, 2014]. Available from: http://www.cancer.ca/en/en/cancer- information/cancer-type/salivary-gland/statistics/?region=ns.
- Speight P.M., Barrett A.W. Salivary gland tumours. Oral Dis. 2002;8(5):229–240.
- Ellis G.L., Auclair P.L. Tumors of the salivary glands. Washington, DC: Armed Forces Institute of Pathology; 1996. Benign epithelial neoplasms: 57–68. Rosai J. (Series Editor) Atlas of tumor pathology: series 3, fascicle 17.
- Papadogeorgakis N., Skouteris C.A., Mylonas A.I., Angelopoulos A.P. Superficial parotidectomy: technical modifications based on tumour characteristics. Journal of Cranio-Maxillofacial Surgery. December 2004; 32(6): 350–353.
- Spinell C., Ricci E., Berti P., Miccoli P. Postoperative salivary fistula: Therapeutic action of octreotide. Surgery (Impact Factor: 3.38). 02/1995;117(1):117–8.
- Harvey M., Dunlop R. Octreotide and the secretory effects of advanced cancer. Palliative medicine 1996;10:346–7.
- Belzile M., St-Amant M., Mathieu D., Doueik A.A., Fortier P.H., Dorion D. Radiation-induced xerostomia: is octreotide the solution? Otolaryngol Head Neck Surg. 2009;38(5):545–51.
- Loguercio C., de Sio I., Romano M., del Vecchio Blanco C., Coltorti M. Effect of somatostatin on salivary secretion in man. Digestion. 1987;36(2):91–5.
- Bova R., Saylor A., Coman W.B. Parotidectomy: review of treatment and outcomes. ANZ J Surg 2004;74:563–568.
- Papaspyrou G., Werner J.A., Sesterhenn A.M. Transcervical extirpation of the submandibular gland: the University of Marburg experience. European Archives of Oto-Rhino-Laryngology. 2014;271(7):2009–2012.
- Upton D.C., McNamar J.P., Connor N.P., Harari P.M., Hartig G.K. Parotidectomy: ten-year review of 237 cases at a single institution. Otolaryngol Head Neck Surg. 2007;136(5):788–92.
- Weinberger J. Octreotide VS Placebo in Prevention of Salivary Fistulae After Post Radiation Salvage Surgery. ClinicalTrials.gov Identifier: NCT02437825.
- Nageris B., Feinmesser R. Complications of parotidectomy: Surgical techniques of repair. Operative Techniques in Otolaryngology-Head and Neck Surgery. 1996;7(4):374–376.
- Carcoforo P., Soliani G., Maestroni U., Donini A., Inderbitzin D., Hui T.T., Lefor A., Avital I., Navarra G. Octreotide in the treatment of lymphorrhea after axillary node dissection: a prospective randomized controlled trial. J Am Coll Surg. 2003;196(3):365–9.
- Mahmoud S.A., Abdel-Elah K., Eldesoky A.H., El-Awady S.I. Octreotide can control lymphorrhea after axillary node dissection in mastectomy operations. Breast J. 2007;13(1):108–09.
- Kim W.T., Ham W.S., Koo K.C., Choi Y.D. Efficacy of octreotide for management of lymphorrhea after pelvic lymph node dissection in radical prostatectomy. Urology. 2010 Aug;76(2):398–401. doi: 10.1016/j. urology.2009.04.104. Epub 2010 Mar 25.
- Campisi C.C., Boccardo F., Piazza C., Campisi C. Evolution of chylous fistula management after neck dissection. Curr Opin Otolaryngol Head Neck Surg. 2013;21(2):150–6.
- Sheng-Zhang L., Hong-Fei T., Zhong-Lin N., Yao-Jun Y., Tao Y., Wei Z. Treatment and prevention of lymphorrhea after radical gastrectomy of gastric cancer. J Cancer Res Clin Oncol. 2009;135(4):613–6.
- Suver D.W., Perkins J.A., Manning S.C. Somatostatin treatment of massive lymphorrhea following excision of a lymphatic malformation. Int J Pediatr Otorhinolaryngol. 2004;68(6):845–50.