Для цитирования: Сукорцева Н.С., Решетов И.В., Агакина Ю.С., Шевалгин А.А., Быков И.И. Нутритивная поддержка как важный и обязательный компонент терапии сопровождения при лучевом и химиолучевом лечении пациентов, страдающих раком полости рта и ротоглотки. Голова и шея Head and neck Russian Journal. 2020;8(2):75–85
For citation: Sukortseva N.S., Reshetov I.V., Agakina Yu.S., Shevalgin A.A., Bykov I.I. Nutrition support as an important and mandatory component of radio-and chemoradiotherapy for patients with oral cavity and oropharyngeal cancer. Head and neck Head and neck Russian Journal. 2020;8(2):75–85 (in Russian).
В современной онкологии применение максимально эффективных схем противоопухолевой терапии у пациентов со злокачественными опухолями полости рта и ротоглотки часто ограничено их состоянием и требует адекватной поддерживающей терапии как в рамках подготовки, так и в процессе всех этапов терапии. Возможность успешного проведения противоопухолевого лечения напрямую зависит от исходного состояния пациента. У пациентов, страдающих раком полости рта и ротоглотки, при первичном обращении за медицинской помощью чаще всего выявляются запущенные стадии заболевания и, как правило, имеются признаки нутритивной недостаточности. Также не стоит забывать об отрицательном энергетическом балансе у таких пациентов. Адекватная нутритивная поддержка пациентов является обязательной составляющей комплексной терапии сопровождения и может быть рекомендована на всех этапах ведения пациентов. Своевременное выявление пациентов группы риска питательных нарушений позволяет предотвратить прогрессирующую потерю массы тела и развитие рефрактерной кахексии.
Ключевые слова: рак полости рта и ротоглотки, орофаренгиальная карцинома, нутритивная поддержка, кахексия, нутритивный дисбаланс, энергетический баланс, комплексное лечение, энтеральное питание, сипинг, смеси для нутритивного питания
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Сукорцева Н.С., Решетов И.В., Агакина Ю.С., Шевалгин А.А., Быков И.И. Нутритивная поддержка как важный и обязательный компонент терапии сопровождения при лучевом и химиолучевом лечении пациентов, страдающих раком полости рта и ротоглотки. Голова и шея Head and neck Russian Journal. 2020;8(2):75–85
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Current schemes of treatment of patients with oral cavity and oropharynx malignancies are often restricted by patients’ condition and require adequate supportive therapy both in pretreatment period and during all phases of therapy. The success of treatment depends on the initial patients’ performance status, however, most of them are diagnosed with locally advanced disease accompanied by symptoms of nutritive insufficiency. In addition, we should not forget about the negative energy balance in this group of patients. Adequate nutritional support is a mandatory component of the complex therapy and should be recommended at all stages of patient’s management. Timely identification of patients at risk of nutritional disorders can prevent progressive weight loss and the development of refractory cachexia.
Key words: oral cavity carcinoma, oropharyngeal carcinoma, nutritional support, cachexia, nutritional imbalance, energy balance, complex treatment, enteral nutrition, sipping, nutritional mixtures.
The authors declare no conflict of interest.
Source of financing: not specified.
For citation: Sukortseva N.S., Reshetov I.V., Agakina Yu.S., Shevalgin A.A., Bykov I.I. Nutrition support as an important and mandatory component of radio-and chemoradiotherapy for patients with oral cavity and oropharyngeal cancer. Head and neck Head and neck Russian Journal. 2020;8(2):75–85 (in Russian).
The authors are responsible for the originality of the data presented and
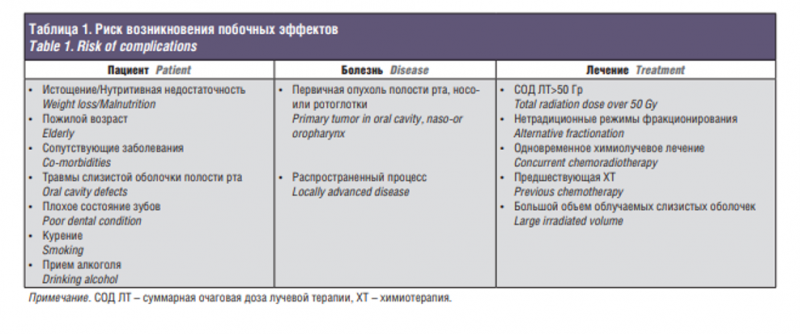
Применение максимально эффективных схем противоопухолевой терапии у пациентов со злокачественными опухолями полости рта и ротоглотки часто ограничено их состоянием и требует адекватной поддерживающей терапии в рамках подготовки и на всех этапах терапии. Последние современные тенденции изменения подходов к ведению таких пациентов, в т.ч. активное применение терапии сопровождения, заметно улучшили результаты лечения и повысили качество жизни пациентов. Химиолучевая терапия и хирургическое лечение на сегодняшний день являются одними из основных методов лечения при раке полости рта и ротоглотки. Их сочетание обеспечивает высокие показатели локорегионарного контроля, общей и безрецидивной выживаемости [1–9]. Кроме того, химиолучевая терапия, не уступая хирургическому лечению в эффективности, является по сравнению с ним функционально и косметически щадящей. При значительной распространенности опухолевого процесса часто применяется лучевая терапия как ключевой этап комбинированного и комплексного лечения [3]. Выбор схемы лечения должен обязательно учитывать как его эффективность, так и все возможные осложнения. Одно из основных направлений эволюции лучевой и лекарственной терапии заключается во внедрении все более агрессивных методов противоопухолевого воздействия, что позволяет эффективно лечить больных на поздних стадиях опухолевого процесса, однако сопровождается высоким риском развития побочных эффектов, приводящих к снижению качества жизни пациентов, а иногда к глубокой инвалидизации и даже смерти [10–13]. Особую роль играет адекватный выбор алгоритма ведения больного с оценкой потенциальных рисков и персонализированным подбором сопроводительной терапии, которая позволяет не только успешно провести лечение в полном объеме, но и обеспечить реабилитацию и сохранение высокого качества жизни пациента. Следует отметить, что сама возможность успешного проведения противоопухолевого лечения зависит от исходного состояния пациента (табл. 1).
Так, факторами риска раннего возникновения и развития тяжелых побочных эффектов являются истощение и тяжелое психологическое состояние пациента, пожилой возраст, тяжелые сопутствующие заболевания, травмирование слизистых оболочек полости глотки и рта, наличие кариозных зубов, интенсивный болевой синдром, курение и прием алкоголя [14–18].
Исключение влияния этих факторов является очень важной задачей и в рекомендациях указывается как обязательное условие для успешного лечения рака полости рта и ротоглотки [19]. Другую группу факторов высокого риска возникновения побочных эффектов составляют показатели опухолевого процесса. Локализация в полости рта и глотке, а также обширное местное распространение злокачественного новообразования позволяют говорить о высокой вероятности проявления выраженных побочных эффектов химиолучевой терапии [20, 21]. Третья группа факторов объединяет параметры противоопухолевого лечения. Следует ожидать появления выраженных побочных эффектов при применении высоких суммарных доз ионизирующего излучения (более 50–60 Гр), нетрадиционных режимов фракционирования с интенсивным подведением доз, одновременном химиолучевом лечении, предшествующей индукционной химиотерапии, большом объеме облучаемых тканей [15, 16, 18, 20].
Как известно, большинство пациентов со злокачественными опухолями полости рта и ротоглотки обращаются в специализированные онкологические учреждения уже на поздних стадиях процесса и с признаками нутритивной недостаточности. Истощение белка мышечной ткани является отличительной чертой раковой кахексии, значительно влияющей на переносимость противоопухолевого лечения [22, 23]. Исследования состава тела больных раком показали, что именно потеря скелетной мускулатуры с или без потери жировой ткани является ключевым аспектом развития нутритивной недостаточности у данных пациентов, которая в свою очередь является фактором риска развития послеоперационных осложнений, токсичности химиотерапии и худшей выживаемости [22–25]. Важно отметить, что потерей массы тела на фоне опухолевой прогрессии врачи нередко пренебрегают, в то время как сам пациент не может адекватно скорректировать свою диету. В ряде исследований было доказано, что более чем у 50% больных лечение начинают на фоне нутритивной недостаточности, а к моменту завершения лечения случаи ее наличия превышают 80% [26–28]. Как сама опухоль орофарингеальной области, так и лучевые реакции в виде мукозита могут препятствовать нормальному пероральному питанию. С другой стороны, следствием выраженной нутритивной недостаточности является раннее проявление и более тяжелое течение лучевых реакций, что приводит к вынужденным перерывам в курсе облучения и потере его эффективности [29, 30]. Также значительно страдает качество жизни больных [31]. Очевидно, что в результате роста числа больных местнораспространенным раком полости рта и ротоглотки, а также применения агрессивных методов противоопухолевого лечения, онкологи все чаще будут сталкиваться с побочными эффектами лучевой и лекарственной терапии [32, 33]. В итоге в последние годы все большее внимание уделяется переносимости лечения и качеству жизни пациентов. Побочные эффекты лучевого и лекарственного лечения нередко нивелируют положительные результаты противоопухолевого воздействия, требуют незапланированных перерывов, отдаляют возможность проведения дальнейших этапов комбинированного и комплексного лечения, создают риск развития осложнений, усугубляют психическое состояние пациентов и снижают качество их жизни [34–36]. Адекватная терапия сопровождения с обеспечением высокого качества жизни в процессе и после лечения основного заболевания – это одна из основных задач современной онкологии. Адекватная нутритивная поддержка пациентов является обязательной составляющей комплексной терапии сопровождения и может быть рекомендована на всех этапах ведения пациентов. При этом преемственность рационального лечебного и диетического питания, сбалансированного как по белку, так и по энергетической ценности, необходима для максимально успешного лечения пациентов со злокачественными опухолями полости рта и ротоглотки. Сегодня нутритивная поддержка пациентов указывается как обязательное условие успешного ведения онкологических пациентов в международных и отечественных рекомендациях и основывается на регламентирующих документах: приказ Минздрава России от 05.08.2003 №330 «О мерах по совершенствованию лечебного питания в лечебно-профилактических учреждениях Российской Федерации» с изменениями и дополнениями, методические рекомендации «Специализированное лечебное питание в лечебно-профилактических учреждениях» (утв. Научным советом по медицинским проблемам питания при Минздравсоцразвития РФ и Российской академии медицинских наук 25.07.2005), приказы Минздравсоцразвития РФ №624 от 07.10.2005, №2 от 10.01.2006 и №316 от 26.04.2006 «О внесении изменений в Инструкцию по организации лечебного питания в лечебно-профилактических учреждениях, утвержденную приказом №330 Минздрава РФ от 5 августа 2003 г.», приказ Минздрава РФ №395н «Об утверждении норм лечебного питания» от 21.06.2013, практические рекомендации RUSSCO 2019 по нутритивной поддержке онкологических больных [37], NCCN Guidelines. Version 02.2016 [21]. Согласно последним полученным данным, в т.ч. представленным членами консенсусной группы Европейского общества клинического питания и метаболизма и Европейского общества химиотерапевтов (ESPEN–ESMO), в онкологии, как ни в одной из отраслей клинической медицины, показана нутритивная поддержка, которая при этом не имеет влияния на рост опухоли. Несмотря на это врачи часто не догадываются о реальных потребностях в энергии и белке своих пациентов. Часто рекомендации по питанию ограничиваются назначением диеты, предписанный состав которой может расходиться с действительным объемом полученной энергии и нутриентов. В итоге нутритивная поддержка носит формальный характер и не имеет реального отношения к основным принципам сопроводительной терапии.
Подготовка пациента к лечению. Оценка нутритивного статуса и рисков
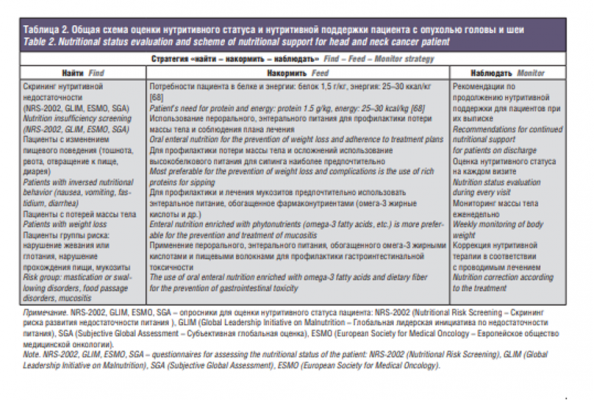
Профилактические мероприятия в рамках подготовки к лучевому, хирургическому и химиолучевому лечению имеет смысл начинать уже за несколько недель до проведения лечения. Обязательно следует заранее санировать ротовую полость и глотку. Пациентам рекомендуют ежедневно обрабатывать полость рта теплыми дезинфицирующими растворами, применять механически и химически щадящую, богатую белком диету, запрещают курение, употребление алкогольных напитков, а также острой, пряной, кислой, горячей и холодной пищи. Наиболее подходящей пищей является приготовленная на пару, вареная, измельченная или протертая. Приемы пищи должны быть частыми и небольшими порциями. Рекомендуется употреблять больше жидкости. Предварительная оценка нутритивного статуса и обеспечение нутритивной поддержки является обязательной задачей (табл. 2).
Своевременное выявление пациентов группы риска питательных нарушений позволяет предотвратить прогрессирующую потерю массы тела и развитие рефрактерной кахексии.
Международная группа исследователей разработала систему определения стадии кахексии у онкологических больных [23]:
- прекахексия: – потеря массы тела на )5 % за последние 6 мес.;
– признаки системного воспалительного ответа;
– анорексия и метаболические изменения;
- кахексия:
– потеря массы тела на >5% за последние 6 мес. (при условии, что пациент не голодал специально) или
– продолжающаяся потеря массы тела более, чем на 2%, индекс массы тела менее 20 кг/м2 или
– потеря скелетной мускулатуры и продолжающаяся потеря массы тела более 2%;
– признаки системного воспалительного ответа, анорексия, снижение потребления объема пищи;
- рефрактерная кахексия:
– критерии кахексии на фоне выраженного катаболизма, отсутствие эффекта противоопухолевой терапии, ECOG 3–4, ожидаемая продолжительность жизни менее 3 мес.
Согласно рекомендациям ESPEN, суточные потребности пациента в белке составляют 1,5 г/кг, а энергии – 25–30 ккал/кг/сут. Скрининг и мониторинг недостаточности питания должны проводиться на протяжении всего времени лечения онкологического больного. С этой целью применяются специальные опросники NRS-2002 (Nutritional Risk Screening – Скрининг риска развития недостаточности питания), SGA (Subjective Global Assessment – Субъективная глобальная оценка), ESMO (European Society for Medical Oncology – Европейское общество медицинской онкологии), GLIM (Global Leadership Initiative оn Malnutrition) критерии оценки недостаточности питания, а также оцениваются антропометрические и лабораторные показатели, характеризующие недостаточность питания [39].
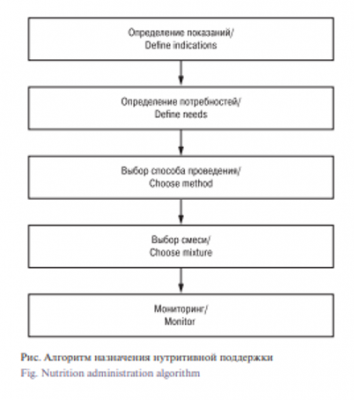
В целом алгоритм назначения нутритивной поддержки выглядит так:
1) определение показаний к назначению нутритивной поддержки (оценка нутритивного статуса);
2) определение потребности пациента в основных нутриентах (белок, энергия);
3) выбор способа проведения нутритивной поддержки;
4) подбор препаратов для нутритивной поддержки;
5)мониторинг (см. рисунок).
Для скрининговой оценки нутритивного риска ESPEN рекомендует использовать шкалы NRS-2002 или GLIM, состоящие из двух блоков [39]. В соответствии с рекомендациями ESMO можно использовать балльную шкалу. Учитывая основные показатели тяжести синдрома гиперметаболизма-гиперкатаболизма (потеря массы тела, гипоальбуминемия и др.), можно рассчитать индекс нутритивного риска по Базби (G.P. Buzby). Основные варианты скрининга подробно описаны в Практических рекомендациях RUSSCO-2019 по нутритивной поддержке онкологических больных [37]
Важнейшим показателем нутритивной недостаточности является скорость снижения массы тела. Потеря более 2–5% массы тела за неделю или более 10% за 6 месяцев свидетельствует об одинаково тяжелом истощении организма [40, 41]. На основании полученных данных проводится расчет потребностей конкретного пациента. У лиц с избыточной массой тела он ведется на идеальную (рекомендуемую) массу тела, тогда как при гипотрофии ориентируются на существующие показатели.
Идеальная масса тела не всегда совпадает с внешним видом пациента. У пациентов с ожирением может развиваться нарушение белкового питания, и несмотря на избыточную массу тела при этом отмечаться нутритивный дефицит [42]. Нутритивная поддержка должна начинаться еще до начала лечения, поскольку большинство исследователей отмечают ее положительный эффект на всех этапах ведения онкологических пациентов [40, 43]. В современной онкологии применяют несколько способов нутритивной поддержки: энтеральное питание через зонд или гастростому, сипинг и парентеральное питание. Энтеральное питание через назогастральный или назоинтестинальный зонд не является оптимальным в связи с травмированием самим зондом слизистых оболочек полости рта и глотки, которые облучены. Гастростомия помогает доставлять питательные смеси в желудочно-кишечный тракт в обход области облучения, ее применение возможно при невозможности или недостаточности перорального питания. Сипинг подразумевает пероральный прием питательных смесей мелкими глотками. Этот метод наиболее предпочтителен, т.к. более физиологичен, помогает сохранению нормального акта глотания и более ранней реабилитации пациентов. Основная суть перорального использования энтеральных смесей заключается в употреблении энтеральных смесей/сипинга с высоким содержанием белка на фоне повышенной потребности в белке у пациентов с онкологическими заболеваниями, когда сохранена возможность самостоятельного питания через рот [40, 44]. Энтеральное питание через зонд или гастростому рекомендовано в случаях неадекватного перорального приема пищи при дисфагии и выраженном болевом синдроме. Назогастральный зонд устанавливается в тех случаях, когда такой вариант питания предполагается на срок не более 4 недель [66, 67]. Парентеральное питание играет меньшую роль, чем энтеральное, поскольку усвоение питательных веществ естественным путем более эффективно и сохраняет функцию желудочно-кишечного тракта [37, 45]. Парентеральное питание включает введение донаторов энергии (растворы углеводов и жировые эмульсии) и донаторов пластического материала для синтеза белка (растворы аминокислот). Наиболее эффективным является применение систем «все в одном». В ряде случаев оптимальным является применение смешанного варианта в виде комбинации лечебного энтерального и парентерального питания.
Таким образом, нутритивная поддержка начинается еще до начала лучевого, хирургического или химиолучевого лечения, при нарушении нутритивного статуса: потеря массы тела >5% за последние 2 месяца или ИМТ <20,5кг/м2 , или потребление пищи в объеме <60%от обычной нормы в предшествующую неделю. По возможности назначают сипинг, а в качестве альтернативы устанавливают назогастральный зонд или накладывают гастростому. При этом калораж пищи определяют из расчета 25–30 ккал/кг/сут при суточной дозе белка не менее 1,5 г/кг. Пациентам удобно использовать готовые смеси с повышенным содержанием белка.
Среди имеющихся на сегодняшний день смесей наибольшее содержание белка в меньшем объеме (18 г белка в 125 мл) содержится в смеси Нутридринк Компакт Протеин (Нутриция). Особо следует обратить внимание на необходимость повторного скрининга непосредственно перед началом лечения и в течение того или иного этапа лечения. Принципиальным является нормализация уровней общего белка, альбумина, лимфоцитов и положительная динамика массы тела. Предварительная подготовка к лечению, а также своевременный индивидуальный подбор терапии сопровождения с учетом соматического состояния больных и объема планируемого противоопухолевого воздействия являются обязательными для успешного излечения и сохранения качества жизни пациентов.
Общие принципы нутритивной поддержки
Рассмотрим основные принципы ведения и нутритивной поддержки больных в процессе лучевой и химиолучевой терапии. Лучевая терапия является локальным методом, и побочные эффекты при лечении злокачественных опухолей полости рта и ротоглотки, за исключением общей слабости, также носят местный характер и ограничиваются облучаемой областью. Как известно, локальные лучевые побочные эффекты подразделяют на ранние, наступающие в процессе лучевой терапии или в ближайшие 3 месяца после нее, и поздние, возникающие после этого срока. Связь между клиническим проявлением ранних и развитием поздних лучевых повреждений удается установить не во всех случаях, однако непосредственная патогенетическая связь между ними определенно существует [12, 13, 21, 46, 47]. Лучевые реакции обратимы и со временем купируются самостоятельно. Лучевые повреждения являются необратимым патологическим процессом с морфологическими и функциональными нарушениями. Самым распространенным побочным эффектом, возникающим в ходе лучевой терапии у больных орофарингеальным раком, является лучевой мукозит (эпителиит), возникающий более чем у 60% пациентов при проведении стандартного режима фракционирования и практически у всех больных при нетрадиционных режимах или химиолучевой терапии [16, 18, 89]. Зарубежные радиотерапевты указывают, что более чем в 40% случаев при проведении облучения с лекарственной модификацией развиваются побочные эффекты тяжелой степени [2, 4, 12, 13, 14, 21]. В отечественных работах частота тяжелых лучевых повреждений, как правило, не превышает 10–20% [49, 50]. Мукозит (радиоэпителиит) играет зачастую ключевую роль в переносимости лучевой терапии пациентов, страдающих раком полости рта и ротоглотки, а также значительно влияет на качество их жизни в процессе лечения, а также после его завершения. Важно отметить, что спектр ранних побочных эффектов значительно шире и включает дерматит, ксеростомию, накопление вязкого секрета, дисгевзию, дисфагию, одинофагию, алопецию в области облучения, осиплость, присоединение вторичной инфекции в зоне облучения или в результате аспирации. Позже, в зависимости от локализации облучения и лучевой нагрузки на здоровые ткани, может наблюдаться ксеростомия, дисгевзия, дисфагия, повышенный риск аспирации, дисфункция щитовидной железы, тризм, остеонекроз, кариес, трофические язвы слизистой оболочки и кожи, лимфостаз, катаракта, снижение слуха, стриктура пищевода [51, 52]. Побочные эффекты во многом взаимосвязаны патогенетически и провоцируют друг друга, причем неадекватное ведение пациента с ранними лучевыми реакциями может приводить к поздним лучевым повреждениям [53–56]. Следует учитывать также побочные эффекты лекарственного компонента химиолучевой терапии. Чаще всего речь идет о тошноте и рвоте, снижении аппетита, общей слабости, нефро-, гепато-, кардио-, ото- и гематологической токсичности, стоматите и других поражениях желудочно-кишечного тракта, а также алопеции и дисбиозе [4, 5, 57, 58]. Альтернативным вариантом лекарственной модификации является селективное повышение радиочувствительности опухоли путем таргетной модификации цетуксимабом. Важно отметить, что согласно мировому клиническому опыту, применение таргетных препаратов не сказывается на степени тяжести и длительности проявлений лучевого эпителиита и дисфагии, а также не влияет на качество жизни больных [59, 60]. При комбинации лучевой и химиотерапии следует быть готовым к суммации побочных эффектов этих методов и учитывать риски как при планировании, так и при проведении лечения со своевременной коррекцией терапии сопровождения.
Соответственно, любой вариант лучевого лечения с лекарственной модификацией пациентов с плоскоклеточным раком орофарингеальной области требует адекватной сопроводительной терапии, в т.ч. нутритивной поддержки, локальной ранозаживляющей терапии, своевременной профилактики и лечения присоединившейся вторичной инфекции, постоянного контакта и психологической поддержки пациентов, а также адекватного обезболивания. Анальгезирующая терапия показана пациентам как при болевом синдроме, обусловленном опухолевым поражением, так и при возникающих в процессе терапии лучевых реакциях. Сама боль вызывает мощный и стойкий вазоспазм, тем самым снижает скорость заживления тканей, затрудняет естественное питание через рот, нарушает сон и ухудшает психическое состояние пациента. Часто обезболивание может сопровождаться заторможенностью и запорами, что имеет особое значение у пациентов с опухолями орофарингеальной области. Так, заторможенность и гиподинамия приводят к неадекватной обработке полости рта и ротоглотки и, как следствие, к дисбактериозу, усилению лучевых реакций и еще большему затруднению перорального питания. В результате недостаточность питания в сочетании с гиподинамией и лекарственным обезболиванием приводит к запорам с последующей интоксикацией. Таким образом, формируется порочный круг, что ухудшает состояние пациента и приводит к срыву противоопухолевой терапии. Таким образом, любой компонент терапии сопровождения одинаково важен, поскольку его отсутствие или неадекватное применение может сказаться как на качестве жизни больного, так и на результатах лечения основного заболевания.
С момента возникновения клинических проявлений лучевого мукозита и до купирования реакций показано применение различных ранозаживляющих местных средств. При частой обработке полости рта и ротоглотки изотоническим раствором удаляются остатки пищи и накопившиеся выделения. Для аппликаций в полости рта или для закапывания в нос рекомендуются масла (оливковое, персиковое, облепихи или шиповника). При наличии болевого синдрома применяют местные и системные обезболивающие средства [48]. Обезболивающие средства должны назначаться в соответствии со шкалой ВОЗ. Чаще всего требуется лечение опиатами, причем следует обратить внимание на их трансдермальные формы [51]. Нутритивная терапия должна начинаться сразу при выявлении нутритивной недостаточности или при отсутствии достаточного питания через рот в течение как минимум 7–14 дней (табл. 3) [68].
Энтеральное лечебное питание начинают при неадекватности диетического питания через рот (т.е. при менее 60% от суточной потребности в течение 1–2 недель) [22]. В качестве сипинга предпочтительно использовать высокобелковые смеси. Примером высокобелковой смеси для сипинга, специально разработанной для пациентов с онкологическими заболеваниями, является Нутридринк Компакт Протеин (Нутриция), в одной бутылочке которой содержится 18 г белка и 300 ккал.
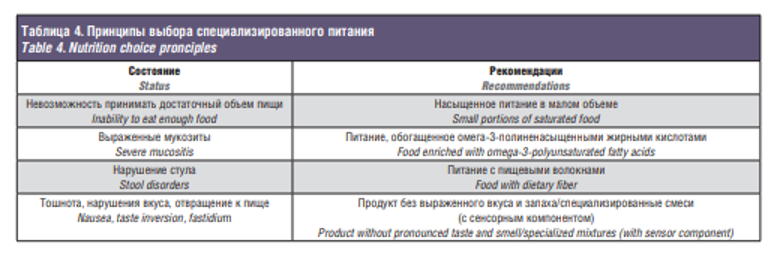
Расчет основных потребностей пациента ориентирован на суточную потребность в белке и энергии и на количественное соотношение различных субстратов. Для пациентов, получающих лучевое и химиолучевое лечение, оптимальными являются смеси, обогащенные омега-3 жирными кислотами и пищевыми волокнами (табл. 4) [62].
При этом, согласно рекомендациям ESPEN (2017), суточная потребность в белке у пациентов с онкологическими заболеваниями должна определяться из расчета 1,5 г/кг массы тела в сутки (что для сравнения практически в 2 раза выше средней потребности здорового человека в белке, которая составляет 0,8 г/кг/сут), а энергии – 25–30 ккал/кг/сут [68]. Как известно, омега-3 жирные кислоты обладают противовоспалительным, антиоксидантным действиями, а также повышают аппетит, что оптимально для пациентов с его снижением и нарушением вкуса на фоне выраженного лучевого мукозита полости рта и глотки [64]. Нурушение восприятия вкуса (дисгевзия) встречается довольно часто среди онкологических пациентов и может проявляться в виде снижения (гипогевзия) или усиления (гипергевзия) восприятия вкусов. Частота встречаемости дисгевзии при проведении химиотерапии или лучевой терапии может достигать 70% [69]. Нарушения вкуса негативно влияют на нутритивный статус, что ассоциируется с ухудшением переносимости и результатов противопухолевого лечения. Последние разработки смесей с сенсорными компонентами (охлаждающий, согревающий и нейтральный вкусы смесей) позволяют дифференцированно подходить к выбору смеси у пациентов с инверсией вкуса [70]. Так, при развитии у пациентов гипогевзии на фоне лекарственной терапии может помочь смесь с согревающим эффектом, которая за счет активации соматосенсорной системы тройничного нерва, позволяет делать восприятие вкусов пищи более ярким. Такие сенсорные нарушения как ощущение жжения на фоне лучевой терапии можно облегчить применением смеси с охлаждающим эффектом. При гипергевзии применение смеси с нейтральным вкусом может уменьшить дополнительные раздражители и снизить неприятные вкусовые ощущения во рту. Пищевые волокна в составе смесей помогают решить вопрос с нарушением работы кишечника – традиционной проблемой больных заболеваниями орофарингеальной зоны с неадекватным питанием и применяемым обезболиванием. Предпочтительно сочетание пероральной диеты с приемом энтеральных смесей, обогащение натуральных продуктов, а также другие сочетания вариантов питания, в т.ч. с частичным применением парентерального питания. Усиление проявлений лучевого эпителиита, как правило, сопровождается нарушением акта глотания за счет отека и воспаления мягких тканей и мышц ротоглотки. Кашель после глотания, изменение тембра голоса («журчащий») или клинические признаки инфекции органов грудной полости свидетельствуют о высоком риске аспирации с развитием в последующем пневмонии. При нарастании дисфагии целесообразно обеспечить энтеральное питание через зонд или гастростому. Важно учитывать, что на пике лучевых реакций постановка назогастрального зонда может быть сопряжена с повышенным риском травматизации облученных тканей. При дисфагии обязателен контроль возникновения вторичной инфекции и важно специальное обучение пациента профилактике аспирации. Как правило, присоединение вторичной инфекции в полости рта и глотке (грибковая или бактериальная инфекция) требует своевременного назначения антибиотической терапии. После окончания лучевой терапии нормальные ткани, подвергшиеся облучению, очень ранимы, поэтому к ним следует относиться бережно. В ранние постлучевые сроки не рекомендуется выполнять инвазивные диагностические процедуры и биопсию без абсолютных показаний. Показан подбор адекватной диеты, при необходимости в сочетании с противорефлюксными препаратами [10, 65]. Травмы, алкоголь, курение, раздражающая пища легко вызывают изъязвление слизистой оболочки, что нередко сопровождается обнажением кости нижней челюсти с последующим развитием остеомиелита и остеорадионекроза. Также пациенту следует рекомендовать продолжать контролировать массу тела. При каждом контрольном обследовании необходимо проводить оценку нутритивного статуса и степени нутритивной недостаточности. По показаниям возможно дальнейшее применение нутритивной терапии, предпочтительно сипинга.
Исходя из вышесказанного, обращаем внимание на то, что в последние годы все большее внимание уделяется переносимости лечения и качеству жизни пациентов. Неблагоприятные эффекты лучевого и лекарственного лечения часто нивелируют положительные результаты противоопухолевого воздействия, тем самым требуют незапланированных перерывов и отдаляют возможность проведения дальнейших этапов комбинированного и комплексного плана, создают риск развития осложнений, усугубляют психическое состояние пациентов и снижают качество их жизни [34–36]. Адекватная персонализированная нутритивная поддержка пациентов, страдающих раком полости рта и ротоглотки, является одной из основных задач и играет важную роль на всех этапах лечения и реабилитации.
ЛИТЕРАТУРА/REFERENCES
- Radiation Oncology: An Evidence-Based Approach. Ed. by J.J. Lu, L.W. Brady. New York: Springer, 2008.
- Pignon J.P., le Maître A., Maillard E., Bourhis J. Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): an updateon _ 93 randomised trials and 17,346 patients. Rad. Oncol. 2009:92;4–14. doi: 10.1016/j.radonc.2009.04.014. PMID: 19446902.
- Handbook of Evidence-Based Radiation Oncology. By eds.: E.K. Hansen Roach III Mack. Springer, 2010.
- Adelstein D.J., Li Y., Adams G.L., et al. An intergroup phase III comparison of standard radiation therapy and two schedules of concurrent chemoradiotherapy in patients with unresectable squamous cell head and neck cancer. J. Clin. Oncol. 2003;21(1):92–8. doi: 10.1200/JCO.2003.01.008. PMID: 12506176.
- Pignon J.P., Bourhis J., Domenge C., Designé L. Chemotherapy added to locoregional treatment for head and neck squamous-cell carcinoma: three metaanalyses of updated individual data. MACH-NC Collaborative Group. MetaAnalysis of Chemotherapy on Head and Neck Cancer. Lancet. 2000;355(9208):949–55. PMID: 10768432.
- Bourhis J., Amand C., Pignon J.P. Update of MACH-NC (Meta-Analysis of Chemotherapy in Head & Neck Cancer) database focused on concomitant chemoradiotherapy. J Clin Oncol, ASCO Annual Meeting Proceedings (PostMeeting Edition) 2004;22:5505.
- Calais G., Alfonsi M., Bardet E., et al. Randomized trial of radiation therapy versus concomitant chemotherapy and radiation therapy for advanced-stage oropharynx carcinoma. J. Natl. Cancer Inst. 1999;91(24):2081–6. PMID: 10601378.
- Brizel D.M., Albers M.E., Fisher S.R., et al. Hyperfractionated irradiation with or without concurrent chemotherapy for locally advanced head and neck cancer. N. Engl. J. Med. 1998;338(25):1798–804.
- Posner M.R., Hershock D., Le Lann L., et al. TAX 324: A phase III trial at TPF vs. PF induction chemotherapy followed chemoradiotherapy in locally advanced SCCHN. Paper presented at American Society of Clinical Oncology (ASCO) annual meeting, Atlanta GA, 2006.
- Scully С., Epstein J., Sonis S. Oral mucositis: a challenging complication of radiotherapy, chemotherapy and radiochemotherapy. Part 2: diagnosis and management of mucositis. Head Neck 2004;26(1):77–84. DOI: 10.1002/ hed.10326. PMID: 14724910.
- Argiris A., Brockstein B.E., Haraf D.J., et al. Competing causes of death and second primary tumors in patients with locoregionally advanced head and neck cancer treated with chemoradiotherapy. Clin. Cancer Res. 2004;10:1956–62. doi: 10.1158/1078-0432.CCR-03-1077. PMID: 15041712.
- Epstein J.B., Thariat J., Bensadoun R.J., et al. Oral complications of cancer and cancer therapy: from cancer treatment to survivorship. CA Cancer J. Clin. 2012;62(6):400–22. doi: 10.3322/caac.21157. PMID: 22972543.
- Kang H.S., Roh J.L., Lee S., et al. Noncancer-related health events and mortality in head and neck cancer patients after definitive radiotherapy: a prospective study. Medicine (Baltimore). 2016;95(19):e3403. doi: 10.1097/ MD.0000000000003403.
- Bensinger W., Schubert M., Ang K.K., et al. NCCN Task Force Report. prevention and management of mucositis in cancer care. J. Natl. Compr. Canc. Netw. 2008;6(Suppl. 1):1–21;quiz S22–4. PMID: 18289497.
- Rosenthal D.I., Trotti A. Strategies for managing radiation-induced mucositis in head and neck cancer. Semin. Radiat. Oncol. 2009;19:29–34. doi: 10.1016/j.semradonc.2008.09.006. PMID: 19028343.
- Trotti A., Bellm L.A., Epstein J.B., et al. Mucositis incidence, severity and associated outcomes in patients with head and neck cancer receiving radiotherapy with or without chemotherapy: A systematic literature review. Radiother. Oncol. 2003;66:253–62. doi: 10.1016/S0167-8140(02)00404-8. PMID: 12742264.
- Campos M.I., Campos C.N., Aarestrup F.M., Aarestrup B.J. Oral mucositis in cancer treatment: natural history, prevention and treatment. Mol. Clin. Oncol. 2014;2,337–40. doi: 10.3892/mco.2014.253 PMID: 24772297.
- Zhu G., Lin J., Kim S., et al. Asian expert recommendation on management of skin and mucosal effects of radiation, with or without the addition of cetuximab or chemotherapy, in treatment of head and neck squamous cell carcinoma. BMC. Cancer. 2016;16:42. doi: 10.1186/s12885-016-2073-z. PMID: PMC4730602.
- NCCN Guidelines. Version 2.2016. Available at: www.nccn.org/professionals/ physician_gls/pdf/head-and-neck.pdf.
- Vera-Llonch M., Oster G., Hagiwara M., Sonis S. Oral mucositis in patients undergoing radiation treatment for head and neck carcinoma. Cancer. 2006;106:329–36. doi: 10.1002/cncr.21622. PMID: 16342066.
- Mortensen H.R., Overgaard J., Jensen K., et al. Factors associated with acute and late dysphagia in the DAHANCA 6 & 7 randomized trial with accelerated radiotherapy for head and neck cancer. Acta Oncol. 2013;52:1535–42. doi: 10.3109/0284186X.2013.824609. PMID: 24047339.
- Arends J. et al. ESPEN guidelines on nutrition in cancer patients. Clin. Nutr. 2017;36:11–48.
- Практические рекомендации по лечению синдрома анорексии-кахексии у онкологических больных. RUSSCO, 2019. (https://rosoncoweb.ru/standarts/ RUSSCO/2019/2019-42.pdf).
- Baracos V., Kazemi-Bajestani S.M. Clinical outcomes related to muscle mass in humans with cancer and catabolic illnesses. Int. J. Biochem. Cell. Biol. 2013;45: 2302–8.
- Martin L., Birdsell L., Macdonald N., Reiman T., Clandinin M.T., McCargar L.J., et al. Cancer cachexia in the age of obesity: skeletal muscle depletion is a powerful prognostic factor, independent of body mass index. J. Clin. Oncol. 2013;31:1539–47.
- Langius J.A., Doornaert P., Spreeuwenberg M.D., et al. Radiotherapy on the neck nodes predicts severe weight loss in patients with early stage laryngeal cancer. Radiother. Oncol. 2010;97(1):80–5. doi: 10.1016/j. radonc.2010.02.017. PMID: 20223540.
- Matthews T.W., Lampe H.B., Dragosz K. Nutritional status in head and neck cancer patients. J. Otolaryngol. 1995;24(2):87–91. PMID: 7602677.
- Unsal D., Mentes B., Akmansu M., et al. Evaluation of nutritional status in cancer patients receiving radiotherapy: a prospective study. Am. J. Clin. Oncol. 2006;29(2):183–8. doi: 10.1097/01.coc.0000198745.94757.ee. PMID: 16601440.
- Meyer F., Fortin A., Wang C.S., et al. Predictors of severe acute and late toxicities in patients with localized head-and-neck cancer treated with radiation therapy. Int. J. Radiat. Oncol. Biol. Phys. 2012;82(4):1454–62. doi: 10.1016/j.ijrobp.2011.04.022. PMID: 21640495.
- Capuano G., Grosso A., Gentile P.C., et al. Influence of weight loss on outcomes in patients with head and neck cancer undergoing concomitant chemoradiotherapy. Head Neck. 2008;30(4):503–8. doi: 10.1002/hed.20737. PMID: 18098310.
- Langius J.A., van Dijk A.M., Doornaert P., et al. More than 10 % weight loss in head and neck cancer patients during radiotherapy is independently associated with deterioration in quality of life. Nutr. Cancer. 2013;65(1):76–83. doi: 10.1080/01635581.2013.741749. PMID: 23368916.
- Mourad W.F., Hu K.S., Puckett L., et al. Five-year outcomes of squamous cell carcinoma of the tonsil treated with radiotherapy. Am. J. Clin. Oncol. 2014;37:57–62. doi: 10.1097/COC.0b013e31826b9920. PMID: 23357967.
- Prevost V., Joubert C., Heutte N., Babin E. Assessment of nutritional status and quality of life in patients treated for head and neck cancer. Eur. Ann. Otorhinolaryngol. Head Neck. Dis. 2014;131:112–20. doi: 10.1016/j. anorl.2013.06.007. PMID: 24657191.
- Горбунова В.А., Бредер В.В. Качество жизни онкологических больных. Материалы IV ежегодной Российской онкологической конференции, 21–23 ноября 2000 г., М.. С. 125. Доступно по: http://www.rosoncoweb. ru/ library/congress/ru/04/43.php. [Gorbunova V.A., Breder V.V. Quality of life of oncological patients. Proceedings of the IV Annual Russian Oncological Conference, November 21–23, 2000, M. P. 125. Available at: http://www. rosoncoweb.ru/library/congress/ru/04/43. php. (In Russ.)].
- Kumari A.C., Shanmughakumar S., Balasubramaniam P. Assessment of quality of life in head and neck cancer patients with enteral tube feeding. J. Cancer Res. Ther. 2012;8:176.
- Husaini H., Lazarus C., Hu K., et al. EORTC QOL rating, performance status, and oral outcomes in head-and-neck cancer patients treated with chemoradiation therapy. Int. J. Radiat. Oncol. Biol. Phys. 2013;7:441–2.
- Практические рекомендации RUSSCO по нутритивной поддержке онкологических больных, 2019 г. Доступно по: https://rosoncoweb. ru/standarts/RUSSCO/2019/2019-41.pdf. [RUSSCO practical guidelines on nutritional support in oncological patients, 2019. Available at: https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-41.pdf. (In Russ.)]. 38. Обухова О.А., Курмуков И.А., Кашия Ш.Р. Питательная поддержка в онкологии. Онкогинекология. 2014;1:34–45. www.osors.com/ oncogynecology/JurText/j2014_1/01_14_C34.pdf. [ObukhovaO.A., Kurmukov I.A., Kashiya Sh.R. Nutritional support in oncology. Onkoginekologiya = Oncogynecology. 2014;1:34–45. Available at: www. osors. com/oncogynecology/JurText/ j2014_1/01_14_C34.pdf. (In Russ.)]
- Cederholm T. et al. GLIM criteria for the diagnosis of malnutrition – A consensus report from the global clinical nutrition community. Clin. Nutr. 2019;38:1-9.
- Duguet A., Bachmann P., Lallemand Y. Summary report of the standards, options and recommendations for malnutrition and nutritional assessment in patients with cancer. Br. J. Cancer. 2003;89(1):92–7. doi: 10.1038/ sj.bjc.6601089. PMID: PMC2753013.
- Heys S.D., Schofield A. C., Wahle K.W., Garcia-Caballero M. Nutrition and the surgical patient: triumphs and challenges. Surgeon. 2005;3(3):139–44. PMID: 16075997.
- Снеговой А.В., Сельчук В.Ю., Салтанов А.И. Нутрикомп АДН Браун Файбер у больных раком желудка с послеоперационными осложнениями. Вестник интенсивной терапии 2003;2:86–7. [Snegovoy A.V., Selchuk V.Yu., Saltanov A.I. Nutricomp ADN Brown Fibre in patients with stomach cancer and postoperative complications. Vestnik intensivnoy terapii = Intensive Care Herald 2003;2:86–7. (In Russ.)].
- Снеговой А.В., Лейдерман И.Н., Салтанов А.И., Стрельчук В.Ю. Основные принципы и технологии клинического питания в онкологии: Методическое руководство для врачей. М., 2006. [Snegovoy A.V., Leyderman I.N., Saltanov A.I., Strelchuk V.Yu. Main principles and technologies of clinical nutrition in oncology: Guidelines for doctors. M., 2006. (In Russ.)].
- Sánchez Alvarez C., Nuñez Ruiz R., Morán García V. Nutritional support in the patient with GI malignancy. Nutr. Hosp. 2005;20(2):38–40.
- Луфт В.М., Луфт А.В. Нутриционная поддержка онкологических больных: возможности и противоречия. Вестн. интенсивной терапии 2008;2:43–50. [Luft V.M., Luft A.V. Nutritional support of oncological patients: Possibilities and challenges. Vestn. Intensiv. Ter. = Intensive Care Herald 2008;2:43–50. (In Russ.)].
- Лучевая терапия злокачественных опухолей. Рук-во для врачей. Под ред. Е.С. Киселевой. М., 1996. [Beam therapy of malignant tumors. Guidelines for doctors. Ed. E.S. Kiselyova. M., 1996. (In Russ.)].
- Ярмоненко С.П., Коноплянников А.Г., Вайнсон А.А. Клиническая радиобиология. М., 1992. [Yarmonenko S.P., Konoplyannikov A.G., Vaynson A.A. Clin. Radiobiol. M., 1992. (In Russ.)].
- Roopashri G., Jayanthi K. Radiotherapy and chemotherapy induced oral mucositis – prevention and current therapeutic modalities. IJDA. 2010;2:174–9.
- Гладилина И.А., Шабанов М.А. Лучевое и химиолучевое лечение распространенного рака ротоглотки. Тверь: Губернская медицина, 2001. [Gladilina I.A., Shabanov M.A. Beam therapy and chemoradiotherapy of advanced oropharyngeal cancer. Tver: Gubernskaya meditsina, 2001. (In Russ.)].
- Алиева С.Б., Ткачев С.И., Любаев В.Л. и др. Химиолучевая терапия местнораспространенного рака головы и шеи III–IV стадии. Вестн. РОНЦ им. Н.Н. Блохина РАМН 2007;18(2): 39–42. [Alieva S.B., Tkachev S.I.,Lubaev V.L., et al. Chemoradiotherapy of stage III–IV locally advanced head and neck cancer. Vestn. RONC im. Blokhina = J. N.N. Blokhin Russian Cancer Res. Center RAMS. 2007;18(2):39–42. (In Russ.)].
- Сопроводительная терапия в онкологии. Практическое руководство. Под ред. С.Ю. Мооркрафта, Д.Л.Ю. Ли, Д. Каннингэма. Пер. с англ., под ред. А.Д. Каприна. М., 2016. [Clinical problems in oncology: A practical guide to management. Eds. S.Y. Moorkraft, D.L.Y. Lee, D.D. Cunningham; Translation from English. Ed. A.D. Kaprin. M., 2016. (In Russ.)].
- Brady O., Donnelly M., Horgan A., Maher M. Post-radiotherapy side effects for head and neck cancer – the patient’s perspective. Proceedings of the Nutrition Society. Harrogate; E283 p.
- Galloway T., Amdur R. Management and prevention of complications during initial treatment of head and neck cancer. In: Posner M., Brockstein B., Brizel D., Deschler D. (eds). UpToDate, Waltham, MA, 2014.
- Langius J.A., Zandbergen M.C., Van Tulder M.W., et al. Effect of nutritional interventions on nutritional status of patients with head and neck cancer receiving(chemo)radiotherapy: A systematic review. Clin. Nutr. 2013;32:671– 8. doi: 10.1016/j.clnu.2013.06.012. PMID: 23845384.
- Payakachat N., Ounpraseuth S., Suen J.Y. Late complications and long-term quality of life for survivors (>5 years) with history of head and neck cancer. Head Neck 2013;35:819–25. doi: 10.1002/hed.23035. PMID: 22807083.
- Paleri V., Roe J.W.G., Strojan P., et al. Strategies to reduce long-term postchemoradiation dysphagia in patients with head and neck cancer: An evidence-based review: Strategies to reduce dysphagia after chemoradiation. Head Neck 2014;36: 431–43. doi: 10.1002/hed.23251. PMID: 23828486.
- Wendt T.G., Grabenbauer G.G., Rodel C.M., et al. Simultaneous radiochemotherapy versus radiotherapy alone in advanced head and neck cancer: A randomized multicenter study. J. Clin. Oncol. 1998;16:1318–24. doi: 10.1200/JCO.1998.16.4.1318. PMID: 9552032.
- Практические рекомендации по лекарственному лечению злокачественных опухолей (RUSSCO). Под ред. В.М. Моисеенко. М., 2015. Доступно по: http:// www.rosoncoweb.ru/standarts/ RUSSCO/2014/. [Practical guidelines on drug therapy of malignant tumors (RUSSCO). Ed. V.M. Moiseenko. M., 2015. (In Russ.)].
- Bonner J.A., Harari P.M., Giralt J., et al. Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer: 5-year survival data from a phase 3 randomised trial, and relation between cetuximab-induced rash and survival. Lancet. Oncol. 2010;11:21–8. doi: 10.1016/S1470-2045(09)70311- 0. PMID: 19897418.
- Curran D., Giralt J., Harari P.M., et al. Quality of life in head and neck cancer patients after treatment with high-dose radiotherapy alone or in combination with cetuximab. J. Clin. Oncol. 2007;25:2191–7. doi: 10.1200/JCO.2006.08.8005. PMID: 17538164.
- Bozzetti F., Bozzetti V. Efficacy of enteral and parenteral nutrition in cancer patients. Nestle Nutr. Workshop Ser. Clin. Perform. Programme. 2005;10:127–39. doi: 10.1159/000083302. PMID: 15818026.
- Снеговой А.В., Салтанов А.И., Манзюк Л.В. и др. Оценка эффективности нутритивной поддержки энтеральной смесью «Фортикер» у пациентов с онкологическими заболеваниями в период лучевой и химиотерапии. Вестн. интенсивной терапии 2009;(4):77–83. [Snegovoy A.V., Saltanov A.I., Manzuk L.V., et al. Evaluation of effectiveness of Forticare enteral mixture in patients with oncological diseases during beam therapy and chemoradiotherapy. Vestn. Intensiv. Ter. = Intensive Care Herald 2009;(4):77–83. (In Russ.)].
- Решетов И.В., Егоров Г.Н. Предоперационная нутритивная терапия пациентов с опухолями головы и шеи. Голова и шея 2013;2:27– 34. [Reshetov I.V., Egorov G.N. Preoperative nutritional therapy in patients with head and neck tumors. Head and Neck. 2013;(2):27–34. (In Russ.)].
- Elia M., Van Bokhorst-de van der Schueren M.A., Garvey J., et al. Enteral (oral or tube administration) nutritional support and eicosapentaenoic acid in patients with cancer: a systematic review. Int. J. Oncol.2006;28(1):5–23. PMID: 16327975.
- Pauloski B.R. Rehabilitation of dysphagia following head and neck cancer. Phys. Med. Rehabil. Clin. N. Am. 2008;9:889–928. doi: 10.1016/j. pmr.2008.05.010. PMID: 18940647.
- Weimann A., et al. ESPEN guideline: Clinical nutrition in surgery. Clin. Nutr. 2017;36:623–50.
- Руководство по клиническому питанию. Под ред. В.М. Луфта СПб., 2016. 484 с. [Manual of clinical nutrition. Еd. by V.M. Luft SPb., 2016. 484 p. (In Russ.)].
- Arends J., et al. ESPEN guidelines on nutrition in cancer patients. Clin. Nutr. 2017;36:11–48.
- Spotten L.E., et al. Subjective and objective taste and smell changes in cancer. Ann. Oncol. 2017;28(5):969–84.
- De Haan J.J., Moshage Y., Kluifhooft D., et al. Impact of taste alterations during systemic anti-tumour therapy on the liking of oral nutritional supplements with adapted flavours. Ann. Oncol. 2018;29(Suppl. 8): viii603–40.
Поступила 11.01.20 Принята в печать 25.03.20 Received 11.01.20 Accepted 25.03.20
Информация об авторах:
И.В. Решетов – д.м.н., профессор, академик РАН, директор НОКЦ пластической хирургии, заведующий кафедрой онкологии, радиотерапии и пластической хирургии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава РФ (Сеченовский университет), Академия постдипломного образования ФГБУ ФНКЦ ФМБА России, Москва; e-mail: reshetoviv@mail.ru; https://orcid.org/0000-0002-0909-6278
Н.С. Сукорцева – зав. онкологическим хирургическим отделением комбинированных методов лечения УКБ №1 , доцент кафедры онкологии, радиотерапии и пластической хирургии лечебного факультета Первого МГМУ им. И.М. Сеченова (Сеченовский университет), Москва, Россия.
Ю.С. Агакина – врач-онколог онкологического хирургического отделения комбинированных методов лечения УКБ №1 , Первого МГМУ им. И.М. Сеченова (Сеченовский университет), Москва, Россия.
А.А. Шевалгин – врач-онколог онкологического хирургического отделения комбинированных методов лечения УКБ №1 , Первого МГМУ им. И.М. Сеченова (Сеченовский университет), Москва, Россия; https:// orcid.org/0000-0002-7045-5540. И.И. Быков – врач-онколог онкологического хирургического отделения комбинированных методов лечения УКБ №1 , Первого МГМУ им. И.М. Сеченова (Сеченовский университет), Москва, Россия; ORCID. org/0000-0001-8391-8885.
About the authors:
I.V. Reshetov – Doctor of Medicine, Professor, Academician of the Russian Academy of Sciences, Director of the Scientific and Educational Clinical Center for Plastic Surgery, Head of the Department of Oncology, Radiotherapy and Plastic Surgery, FSAEI HE First Moscow State Medical University n.a. I.M. Sechenov of the Ministry of Health of the Russian Federation (Sechenov University), Academy of Postgraduate Education FSBI FSCC FMBA of Russia, Moscow; e-mail: reshetoviv@mail.ru. https://orcid.org/0000-0002- 0909-6278
N.S. Sukortseva – MD, Head of Oncological Surgery Department of CombinedMethods of Treatment, Clinical Hospital No. 1, Associate Professor of the Department of Oncology, Radiotherapy and Plastic Surgery at the Medical Faculty of the First MSMU named after I.M. Sechenov (Sechenov University), Moscow, Russia.
Yu.S.Agakina – MD, oncologist of Oncological Surgery Department of Combined Methods of Treatment, Clinical Hospital No. 1, the First MSMU named after I.M. Sechenov (Sechenov University), Moscow, Russia.
A.A. Shevalgin — MD, oncologist of Oncological Surgery Department of Combined Methods of Treatment, Clinical Hospital No. 1, the First MSMU named after I.M. Sechenov (Sechenov University), Moscow, Russia, https://orcid.org/0000- 0002-7045-5540.
I.I. Bykov — MD, oncologist of Oncological Surgery Department of Combined Methods of Treatment, Clinical Hospital No. 1, the First MSMU named after I.M. Sechenov (Sechenov University), Moscow, Russia; ORCID.org/0000-0001- 8391-8885.