Для цитирования: Рехвиашвили М.Г., Денис А.Г., Кузнецова Ю.А., Томина В.О., Таранова Ю.А., Полуэктов Д.С., Базина И.Г., Шалатонин М.П., Каражова Э.Ф., Стародубова А.А., Абушкин И.А. Нейробластома шеи у младенца, симулирующая гемангиому и мышечную кривошею. Голова и шея. Российский журнал Head and neck Russian Journal. 2019;7(3):41–46.
For citation: Rekhviashvili M.G., Denis A.G., Kuznecova J.A., Tomina V.O., Taranova J.A., Polujektov D.S., Bazina I.G., Shalatonin M.P., Karazhova J.F., Starodubova A.A., Abushkin I.A. Нейробластома шеи у младенца, симулирующаягемангиому и мышечную кривошею. Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2019;7(3):41–46 (in Russian).
Doi: 10.25792/HN.2019.7.3.41–46
В последнее время наблюдается увеличение числа новообразований, в т.ч. и злокачественного характера у детей в области головы и шеи. Зачастую – это врожденные образования, которые сложны в диагностике. Нейробластома – эмбриональная злокачественная опухоль, происходящая из симпатогониев – незрелых клеток-предшественников симпатической нервной системы. В структуре общей онкологической заболеваемости у детей нейробластома занимает 4-е место, в области головы и шеи встречается в 1–2% случаев. Первоначально симптомы нейробластомы не имеют специфичности и могут имитировать различные педиатрические заболевания, что зачастую составляет сложность ее диагностики. В статье представлен клинический случай расположения нейробластомы у новорожденного ребенка в области шеи. Проведено диагностическое обследование, хирургическое лечение и патогистологическая верификация опухоли. Заживление прошло первичным натяжением без особенностей.
Ключевые слова: нейробластома, перинатальная диагностика, ультразвуковое исследование, компьютерная томография, иммуногистохимический анализ
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Рехвиашвили М.Г., Денис А.Г., Кузнецова Ю.А., Томина В.О., Таранова Ю.А., Полуэктов Д.С., Базина И.Г., Шалатонин М.П., Каражова Э.Ф., Стародубова А.А., Абушкин И.А. Нейробластома шеи у младенца, симулирующая гемангиому и мышечную кривошею. Голова и шея. Российский журнал Head and neck Russian Journal. 2019;7(3):41–46.
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Recently, an increase in malignancies’s incidence had been detected, including malignant head and neck tumors in children, which are often congenital and difficult for diagnostics. Neuroblastoma is an embryonic malignant tumor originating from sympathogonia — immature precursors of the sympathetic nervous system. Neuroblastoma takes the 4th place among the other malignancies in children, with 1–2% of them localized in the head and neck region. Initially, the symptoms of neuroblastoma do not have specificity and can imitate various pediatric diseases; this often makes the diagnostics difficult. The article presents a clinical case of neuroblastoma in a newborn child localized on the neck. Diagnostic examination, surgical treatment followed by histopathological verification of the tumor were carried out; the healing went primarily without complications.
Key words: neuroblastoma, perinatal diagnosis, ultrasound, computed tomography, immunohistochemical analysis
The authors declare no conflict of interest.
Source of financing: not specified.
For citation: Rekhviashvili M.G., Denis A.G., Kuznecova J.A., Tomina V.O., Taranova J.A., Polujektov D.S., Bazina I.G., Shalatonin M.P., Karazhova J.F., Starodubova A.A., Abushkin I.A. Нейробластома шеи у младенца, симулирующаягемангиому и мышечную кривошею. Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2019;7(3):41–46 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of pub-lishing illustrative material – tables, figures, photographs of patients.
摘要
最近,已经发现恶性肿瘤的发病率有所上升,包括儿童恶性的头颈部肿瘤,这些恶性肿瘤通常是先天性的,难以 诊断。 神经母细胞瘤是一种起源于交感神经-交感神经系统的不成熟前体的胚胎恶性肿瘤。 在儿童的其他恶性肿 瘤中,神经母细胞瘤排名第四,其中1-2%位于头颈部区域。 最初,神经母细胞瘤的症状没有特异性,可以模仿 各种儿科疾病。 这通常使诊断变得困难。这篇文章介绍了一个位于颈部的新生儿神经母细胞瘤的临床病例。 进 行诊断检查,手术治疗,然后对肿瘤进行组织病理学证实; 愈合基本上没有 并发症。
进关键词
神经母细胞瘤,围产期诊断,超声,计算机断层扫描,免疫组化分析
作者声明没有利益冲突。
资金来源:未指定。
引用:Rekhviashvili M.G., Denis A.G., Kuznecova J.A., Tomina V.O., Taranova J.A., Polujektov D.S., Bazina I.G., Shalatonin M.P., Karazhova J.F., Starodubova A.A., Abushkin I.A. Нейробластома шеи у младенца, симулирующая гемангиому и мышечную кривошею. Golova i sheya. Rossijskij zhurnal = Head and neck. Russian Journal. 2019;7(3):41–46 (in Russian).
作者对所提供数据的独创性以及发布说明性材料(表格,数字,患者照片)负责。
Введение
Нейробластома – эмбриональная злокачественная опухоль, происходящая из симпатогониев (незрелых клеток-предшественников симпатической нервной системы). Впервые нейробластому описал в 1865 г. немецкий ученый Рудольф Вирхов. Опухоль развивается из симпатических ганглиев и встречается только у детей. Различают 3 типа опухолей, отличающихся друг от друга степенью дифференциации: ганглионеврому, ганглионейробластому и нейробластому.
Среди онкологической заболеваемости у детей нейробластома занимает 4-е место. У 90% пациентов нейробластома диагностируется в возрасте до 6 лет. Среди детей до 1 года заболеваемость нейробластомой составляет около 40% всех опухолей. У мальчиков встречается чаще, чем у девочек. Частыми локализациями нейробластомы являются надпочечники (35%), забрюшинное пространство (30–35%), реже – заднее средостение (20%), область малого таза (3%), область шеи (1–2%). В 70% случаев уже при установлении первичного диагноза выявляются отдаленные метастазы.
Клинический случай
Мальчик, 29 дней поступил в отделение неонатологии и неонатальной хирургии Морозовской городской клинической больницы с диагнозом: «образование шеи неясной этиологии: младенческая гемангиома? Мышечная кривошея?» Из анамнеза: ребенок от 3-й беременности (две предыдущие беременности без патологии), протекавшей с токсикозом в I триместре, во II триместре, по данным УЗ-скрининга, заподозрена генетическая патология, для уточнения диагноза проведен амниоцентез, патологии выявлено не было. Роды на 39–40-й неделе, раннее излитие околоплодных вод, безводный промежуток около 5 часов, масса тела 3090 г, рост 52 см.
Со слов матери, с рождения заметили образование в области шеи справа, однако из роддома выписаны на 4-е сутки жизни под наблюдение педиатра по месту жительства. Образование не увеличивалось в размере, не было клинически значимой симптоматики компрессии близлежащих анатомических структур. В возрасте 25 суток жизни при плановом обращении в районную поликлинику выполнено ультразвуковое исследование (УЗИ) мягких тканей, при котором выявлено образование неясной этиологии, ребенок направлен в широкопрофильный стационар.
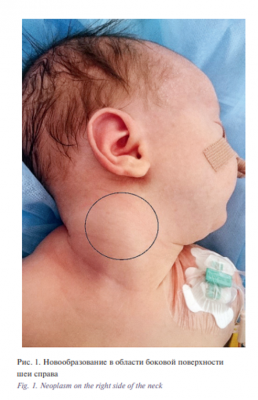
При первичном осмотре в отделении неонатологии Морозовской ДГКБ в проекции средней трети m. sternocleidomastoideus справа пальпировалось объемное образование размером 4×3 см, плотноэластичной консистенции, безболезненное при пальпации, умеренно подвижное. Кожа над образованием не изменена. Структура правой m. sternocleidomastoideus отчетливо пальпировалась только в нижней трети. Вынужденного положения головы не было. Явлений дисфагии, нарушения дыхания не было (рис. 1)
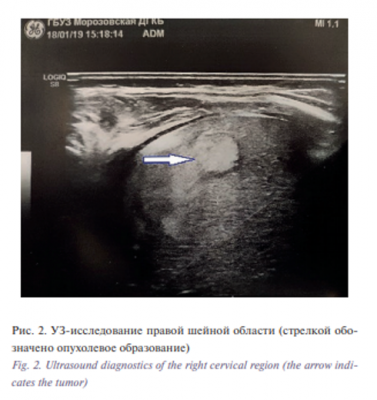
С целью дифференциальной диагностики с мышечной кривошеей и сосудистым образованием выполнено УЗИ мягких тканей: при сканировании в проекции боковой поверхности шеи под правой m. sternocleidomastoideus определялось объемное образование размерами 41×20 мм, представленное солидным компонентом, неоднородное по структуре за счет участков пониженной эхогенности, при цветовом допплеровском картировании обильно васкуляризировано. Окружающие мягкие ткани, включая регионарные лимфоузлы, без особенностей (рис. 2).
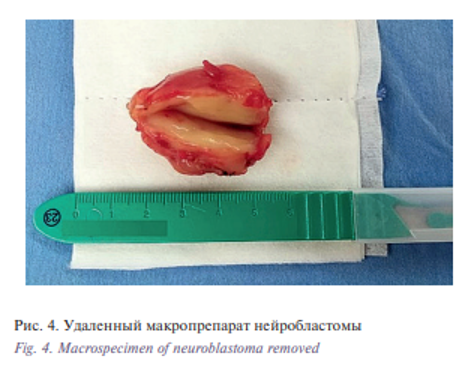
С учетом полученных данных ребенку было показано проведение компьютерной томографии (КТ) с внутривенным болюсным контрастным усилением. Использовался рентгеноконтрастный препарат Ultravist 370 мг/мл в объеме 9 мл. На серии КТ срезов справа и кпереди от позвоночного столба от уровня С3 до Th2, определялось объемное образование, до 56 едН, полуовальной формы, с четкими. неровными контурами, размерами: 40×26×28 мм (В×Ш×Г), активно накапливающее контрастный препарат в артериальную фазу до 89 едН, в венозную фазу – до 103 едН, неоднородное по структуре, содержащее множество сосудов, отходящих от правой подключичной артерии. Вышеописанное образование оттесняло грудино-ключично-сосцевидную мышцу кпереди, трахею и общую сонную артерию кпереди и левее. Значимых сужений сосудов и органов, окружающих образование, не отмечалось. Достоверных данных за инвазию в окружающие ткани и органы получено не было. Левый околоушный лимфатический узел овальной формы, с ненарушенной архитектоникой, размерами: 7×5 мм. Мышцы дна ротовой полости симметричны и развиты нормально. Клетчаточные пространства шеи отчетливо контурировались. Околоушные и поднижнечелюстные слюнные железы симметричны, нормально расположены, без патологических изменений. Глотка и гортань обычной формы и размеров. Стенки их четко визуализировались, не утолщены. Щитовидная железа обычной плотности и структуры, симметрично развита, в размерах не увеличена. Заключение: КТ-картина объемного паравертебрального образования мягких тканей шеи справа без достоверных данных за инвазию в окружающие структуры (рис. 3).
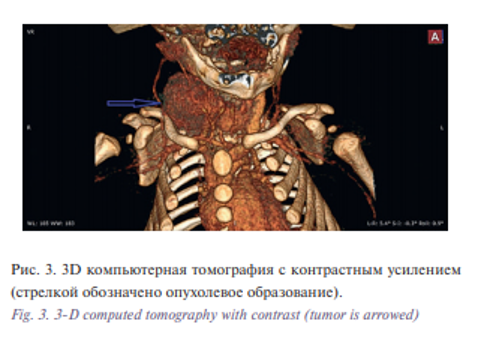
В проведенном лабораторном мониторинге онкомаркеры на момент поступления в стационар: AFP/Альфафетопротеин 1970,75 МЕ/мл, b-ХГЧ 2,00 мМЕ/мл. Ребенок консультирован онкологом, говорить о природе образования без морфологической верификации не представлялось возможным. С учетом всех полученных данных и консультаций смежных специалистов принято решение о проведении радикального удаления новообразования шеи. Оперативное лечение протекало без особенностей, образование локализовалось межфасциально в carotid triangle, без инвазии в окружающие ткани и органы, крупные сосуды и нервы в новообразование не прорастали. Выделение прошло без технических трудностей. После удаления макропрепарат представлял собой узловое образование размерами 4×3×2 см, мягкоэластичной консистенции, при рассечении на срезе – однородное по своей структуре (рис. 4).
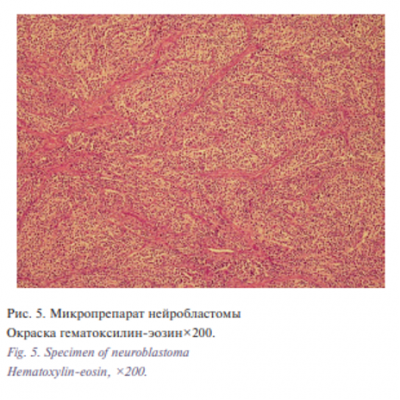
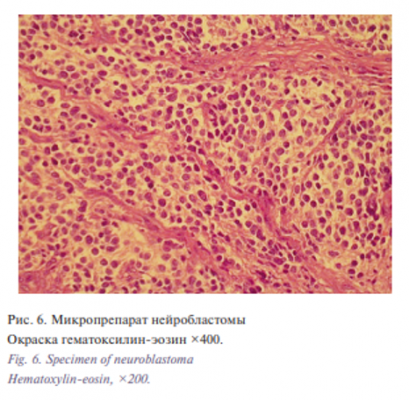
При проведении гистологического и иммуногистохимического анализа удаленного материала использовались реакции и окраски: HE, IHС CD56, Chromographin A, Ki-67, S-100, Sinaptophysin, Vimentin. При микроскопическом анализе определялись участки опухоли со`лидного строения, состоящие из клеточных элементов среднего размера, округлой или овальной формы, с округлым гиперхромным ядром и узким ободком цитоплазмы в окружении сети нейропиля. Также имелось большое количество расширенных полнокровных сосудов и очаговые кровоизлияния. Строма не выражена. Во всех полях зрения наблюдались очаги некроза с очаговым грубоволокнистым фиброзом со скоплениями гистиоцитов и гемосидерофагов. Митотическая активность низкая, апоптотические тельца единичны (рис. 5, 6).
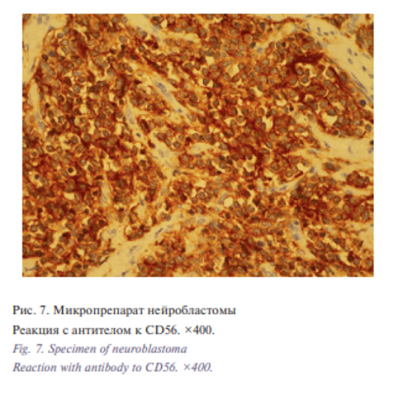
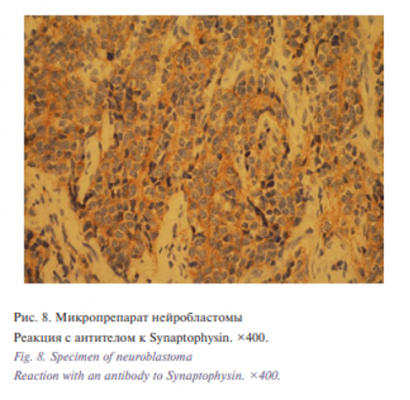
При реакции с CD56 отмечалась выраженная мембранная реакция во всех опухолевых клетках, при реакции с anti-synaptophosin видна в сети нейропиля, NSE и Vimentin –фокально, Сhromogranin A – отрицательно (рис. 7, 8). Ядерноцитоплазматическая реакция с S-100 протеином встречалась в немногочисленных клетках стромы и фрагменте нервного волокна. Ki-67 – около 35%. Заключение: низкодифференцированная нейробластома с низким МКИ (митотический клеточный индекс). Послеоперационной период протекал без особенностей. Швы сняты на 10-е сутки, ребенок в состоянии средней степени тяжести. Ребенок повторно был консультирован онкологом, находится на этапном лечении и наблюдении в отделении онкологии.
Выводы
Таким образом, нейробластома может встречаться уже с рождения, в т.ч. и при более редкой ее локализации на шее.
Необходима ранняя, перинатальная диагностика для исключения наследственной предрасположенности и составления специализированной тактики лечения.
Для установления диагноза показано проведение иммуногистохимического исследования, которое имеет определенное сочетание экспрессии антител [7–8]. Процесс диагностики и лечения нейробластомы требует привлечения различных смежных специалистов, поэтому должен проводиться в многопрофильном специализированном лечебном учреждении.
ЛИТЕРАТУРА/REFERENCES
- Avanzini S., Pio L., Erminio G., et al. Image-defined risk factors in unresectable neuroblastoma: SIOPEN study on incidence, chemotherapyinduced variation, and impact on surgical outcomes. Pediatr. Blood Cancer. 2017;64:11.
- Fritsch P., Kerbl R., Lackner H., et al. “Wait and see” strategy in localized neuroblastoma in infants: an option not only for cases detected by mass screening. Pediatr. Blood Cancer. 2004;43(6):679–82.
- Goto S., Umehara S., Gerbing R.B., et al. Histopathology (International Neuroblastoma Pathology Classification) and MYCN status in patients with peripheral neuroblastic tumors: a report from the Children’s Cancer Group. Cancer. 2001;92(10): 2699–708.
- Hiyama E., Reynolds C.P. Telomerase as a biological and prognostic marker in neuroblastoma. In: Brodeur GM, Sawada T, Tsuchida Y: Neuroblastoma. New York, NY: Elsevier Science, 2000. Р. 159–74.
- Okamatsu C., London W.B., Naranjo A., et al. Clinicopathological characteristics of ganglioneuroma and ganglioneuroblastoma: a report from the CCG and COG. Pediatr. Blood Cancer. 2009;53(4):563–69.
- Shimada H., Umehara S., Monobe Y., et al. International neuroblastoma pathology classification for prognostic evaluation of patients with peripheral neuroblastic tumors: a report from the Children’s Cancer Group. Cancer. 2001;92(9):2451–61.
- Алиев М.Д., Поляков В.Г. Злокачественные опухоли у детей. Онкология. Национальное руководство. Под ред. В.М. Чиссова, М.М. Давыдова. М., 2008. С. 956–962. (In Russ.). Aliev M.D., Polyakov V.G. Malignant tumors in children. Oncology. National guidelines. Ed. V.M. Chissova, M.M. Davydova. M., 2008. Р. 956–962. (In Russ.).
- Исаков Ю.Ф. Хирургия детского возраста. Т. 2. Под ред. Ю.Ф. Исакова. М., 2004. 584 с. (In Russ.). Isakov Yu.F. Pediatric Surgery. T. 2. Ed. Yu.F. Isakova. M., 2004.584 s. (In Russ.).
- Шориков Е.В., Попова Т.П., Лемешева О.В. и др. Ретроспективный анализ эффективности программного лечения пациентов с нейробластомой. Детская онкология. 2008;2:83–8. (In Russ.). Shorikov E.V., Popova T.P., Lemesheva O.V., et al. Retrospective analysis of the effectiveness of program treatment of patients with neuroblastoma. Pediatric oncology. 2008; 2: 83–8. (In Russ.).
Поступила 01.06.19 Принята в печать 01.08.19
Received 01.06.19 Accepted 01.08.19
Информация об авторах:
М.Г. Рехвиашвили – детский хирург неонатального отделения Морозовской ДГКБ ДЗМ, Москва; e-mail: dr.rekhviashvili@yandex.ru. ORCID 0000 – 0003 – 2256 – 6198
А.Г. Денис – челюстно-лицевой хирург отделения челюстно-лицевой хирургии Морозовской ДГКБ ДЗМ, Москва; e-mail: anna.denis@mail.ru. ORCID 0000- 0003-1348-430X
Ю.А. Кузнецова – неонатолог неонатального отделения Морозовской ДГКБ ДЗМ, Москва. ORCID 0000 – 0001 – 7952 – 9203
О.В. Томина – анестезиолог-реаниматолог отделения реанимации и интенсивной терапии для хирургических больных Морозовской ДГКБ ДЗМ, Москва. ORCID 0000 – 0002 – 3785 – 3838
Ю.А. Таранова – анестезиолог-реаниматолог отделения анестезиологии Морозовской ДГКБ ДЗМ, Москва. ORCID 0000 – 002 – 2329 – 0253
Д.С. Полуэктов – челюстно-лицевой хирург отделения челюстно-лицевой хирургии Морозовской ДГКБ ДЗМ, Москва
И.Г. Базина – к.м.н., челюстно-лицевой хирург, заведующая отделением челюстно-лицевой хирургии Морозовской ДГКБ ДЗМ, Москва
М.П. Шалатонин – врач-патологоанатом отделения патологической анатомии Морозовской ДГКБ ДЗМ, ассистент кафедры патологической анатомии и клинической патологической анатомии РНИМУ, Москва. ORCID 0000 – 0002 – 9768 – 9646
Э.Ф. Каражова – врач-рентгенолог отделения экстренной и неотложной лучевой диагностики Морозовской ДГКБ ДЗМ, Москва. ORCID 0000 – 0001 – 9101 – 3322
А.А. Стародубова – врач ультразвуковой диагностики отделения ультразвуковой и функциональной диагностики Морозовской ДГКБ ДЗМ, Москва
И.А. Абушкин – д.м.н., детский хирург, директор центра медицинских лазерных технологий, Челябинск
About the authors:
M.G. Rekhviashvili – MD, pediatric surgeon of the neonatal department of the Morozov Children’s State Clinical Hospital DHM, Moscow. ORCID 0000 – 0003 – 2256 – 6198
A.G. Denis – MD, Oral and Maxillofacial Surgeon, Department of Oral and Maxillofacial Surgery, Morozov Children’s State Clinical Hospital DHM, Moscow. ORCID 0000-0003-1348-430X
Yu.A. Kuznetsova – MD, neonatologist of the neonatal department of the Morozov Children’s State Clinical Hospital DHM, Moscow. ORCID 0000 – 0001 – 7952 – 9203
O.V. Tomina – MD, anesthesiologist-resuscitator of the intensive care unit and intensive care unit for surgical patients of the Morozov Children’s State Clinical Hospital DHM, Moscow. ORCID 0000 – 0002 – 3785 – 3838
Yu.A. Taranova – MD, anesthesiologist-resuscitator of the anesthesiology department of the Morozov Children’s State Clinical Hospital DHM, Moscow. ORCID 0000 – 002 – 2329 – 0253
D.S. Poluektov – MD, Oral and Maxillofacial Surgeon of the Department of Oral and Maxillofacial Surgery, Morozov Children’s State Clinical Hospital DHM, Moscow
I.G. Bazina – MD, Ph.D, maxillofacial surgeon, head of the department of maxillofacial surgery at the Morozov Children’s State Clinical Hospital DHM, Moscow.
M.P. Shalatonin – MD, pathologist at the Department of Pathological Anatomy of the Morozov Children’s State Clinical Hospital DHM, an assistant at the Department of Pathological Anatomy and Clinical Pathological Anatomy of the Russian National Research Medical University, Moscow. ORCID 0000 – 0002 – 9768 – 9646
E.F. Karazhova – MD, Radiologist, Department of Emergency and Urgent Radiation Diagnostics, Morozov Children’s State Clinical Hospital DHM, Moscow. ORCID 0000 – 0001 – 9101 – 3322
A.A. Starodubova – MD, radiologist, Department of Ultrasound and Functional Diagnostics, Morozov Children’s State Clinical Hospital DHM, Moscow
I.A. Abushkin — MD, Ph.D, pediatric surgeon, director of the center for medical laser technology, Chelyabinsk