Для цитирования: Бекяшев А.Х., Голанов А.В., Тушев А.А., Молдованов В.А., Банов С.М. Адьювантная химиотерапия впервые выявленных глиом низкой степени злокачеcтвенности. Голова и шея. Российский журнал Head and neck Russian Journal. 2019;7(3):49–57.
For citation: Bekyashev A.Kh., Golanov A.V., Tushev A.A., Moldovanov V.A., Banov S.M.. Adjuvant chemotherapy of newly diagnozed low grade gliomas. Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2019;7(3):49–57 (in Russian).
Глиомы низкой степени злокачественности (ГНСЗ, WHO – World Health Organization Grade II) представляют собой опухоли нейроэпителиального происхождения, составляя, от 15 до 45% всех первичных опухолей головного мозга. По данным H. Ohgaki и P. Kleihues (2005), среднее время прогрессии глиомы до глиобластомы составляет 5,3 года, а от WHO Gr III до глиобластомы – 1,4 года. Медиана общей выживаемости (ОВ) при ГНСЗ составляет 186 месяцев, 5-летняя ОВ – от 54,6 до 88,4%, 5-летняя беспрогрессивная выживаемость (ВБП) – от 37 до 55%; 8-летняя ВБП – 37%, а 10-летняя ОВ – 67,1%. Продолжительность жизни пациентов с впервые выявленными глиомами составляет в среднем от 6 до 8 лет, но может достигать, по данным некоторых исследований, и 20 лет. Факторами прогноза продолженного роста после хирургического лечения являются возраст пациента, исходный неврологический статус, радикальность хирургического удаления и локализация опухоли. Несмотря на то что, по данным нейрохирургов, все пациенты перенесли тотальное удаление опухоли, у 58 (59%) из 98 пациентов имелась остаточная ткань опухоли в объеме 1 см и менее во всех направлениях, что выявилось на Т2 последовательностях магнитно-резонансной томографии, у 31 (32%) пациента наблюдалась остаточная ткань в объеме 1–2 смво всех направлениях относительно границы зоны резекции, а у 9 (9%) – 2 см и более. В настоящее время нет завершившихся рандомизированных исследований по применению химиотерапии у пациентов с ГНСЗ после хирургического лечения, все исследования относятся к 3-му классу доказательности. Необходимость адъювантной терапии ГНСЗ базируется на факторах прогноза риска рецидива в каждом конкретном случае.
Ключевые слова: глиомы низкой степени злокачественности, диффузные астроцитомы, глиомы WHO Grade 2, химиотерапия глиом низкой степени злокачественности, химиотерапия глиом WHO Grade 2, химиотерапия диффузных астроцитом
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Бекяшев А.Х., Голанов А.В., Тушев А.А., Молдованов В.А., Банов С.М. Адьювантная химиотерапия впервые выявленных глиом низкой степени злокачеcтвенности. Голова и шея. Российский журнал Head and neck Russian Journal. 2019;7(3):49–57.
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Low-grade gliomas (LGG, WHO – World Health Organization Grade II) are the tumors of neuroepithelial origin, accounting for 15-45% of all primary brain lesions. According to H. Ohgaki and P. Kleihues (2005), the average time for progression of glioma to glioblastoma is about 5.3 years, and from WHO Grade III glioma to glioblastoma is 1.4 years. The median overall survival (OS) for LGG is 186 months; the 5-year OS varies from 54.6 to 88.4%, the 5-year progression-free survival (PFS) is about 37% to 55%; 8-year PFS — 37%, and 10-year OS – 67.1%. The life expectancy of patients with newly diagnosed gliomas is about 6 to 8 years in average, but it can reach 20 years, according to some studies. The factors for predicting continued growth after surgical treatment are _the patient’s age, initial neurological status, radical surgical removal, and tumor localization. Despite the fact that, according to neurosurgeons, all patients underwent total tumor removal, 58 (59%) of 98 patients had residual tumor (≤1 cm resection margin in all directions), which was revealed on T2-weighted MRI images. In 31 (32%) patients, residual tumor was observed within 1–2 cm in all directions from resection margin, and in 9 patients (9%) – within 2 cm or even more. Currently, there are no completed randomized trials on the use of chemotherapy in patients with LGG after surgical treatment; all studies belong to the 3rd evidence level. The need for adjuvant therapy for LGG is based on the risk factors for relapse in each individual case.
Key words: low-grade gliomas, diffuse astrocytomas, WHO Grade 2 gliomas, chemotherapy for low-grade gliomas, chemotherapy for WHO Grade 2 gliomas, diffuse astrocytoma chemotherapy
The authors declare no conflict of interest.
Source of financing: not specified.
For citation: Bekyashev A.Kh., Golanov A.V., Tushev A.A., Moldovanov V.A., Banov S.M.. Adjuvant chemotherapy of newly diagnozed low grade gliomas. Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2019;7(3):49–57 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of pub-lishing illustrative material – tables, figures, photographs of patients.
摘要
低度神经胶质瘤(LGG,WHO-世界卫生组织II级)是神经上皮起源的肿瘤,占所有原发性脑部病变的15-45%
根据H. Ohgaki和P. Kleihues(2005)的研究,神经胶质瘤发展为胶质母细胞瘤的平均时间约为5.3年,而从 WHO III级神经胶质瘤发展为胶质母细胞瘤的平均时间为1.4年。 LGG的中位总生存期(OS)为186个月; 5年OS 从54.6%到88.4%不等,5年无进展生存期(PFS)约为37%至55%; 8年PFS-37%,10年OS-67.1%。
根据一些研究,新诊断出的神经胶质瘤患者的平均寿命约为6至8年,但可以达到20年。预测手术治疗后持续增长 的因素是患者的年龄,初始神经系统状况,彻底的手术切除和肿瘤的位置。尽管根据神经外科医师的事实,所有 患者均进行了全部肿瘤切除,但98例患者中有58例(59%)残留肿瘤(在各个方向上≤1 cm切除切缘),这在T2 加权MRI图像上可以看出。在31例(32%)患者中,从切除边缘到各个方向的1-2 cm内均观察到残留肿瘤,而9 例(9%)在2 cm甚至更大范围内观察到残留肿瘤。目前,尚无关于LGG患者手术治疗后使用化学疗法的完整随 机试验。所有研究均属于第三证据级别。 LGG辅助治疗的需要是基于每个病例复发的危险因素。
关键词:低度神经胶质瘤,弥漫性星形细胞瘤,WHO 2级神经胶质瘤,低度神经胶质瘤化疗,WHO 2级神经胶质 瘤化学疗法,弥漫性星形细胞瘤化疗。
作者声明没有利益冲突。
资金来源:未指定。
引用:Bekyashev A.Kh., Golanov A.V., Tushev A.A., Moldovanov V.A., Banov S.M.. Adjuvant chemotherapy of newly diagnozed low grade gliomas. Golova i sheya. Rossijskij zhurnal = Head and neck. Russian Journal. 2019;7(3):49–57 (in Russian).
作者对所提供数据的独创性以及发布说明性材料(表格,数字,患者照片)负责。
Глиомы низкой степени злокачественности (ГНСЗ, WHO Grade 2) представляют собой гетерогенную группу опухолей нейроэпителиального происхождения и являются самыми частыми новообразованиями головного мозга, составляя, по данным различных источников, от 15 до 45% всех первичных опухолей головного мозга [1–9].
В классификации опухолей центральной нервной системы 2016 г. диффузные астроцитомы делятся не только по фенотипическим, но и по генотипическим особенностям: мутации в генах IDH1 и IDH2. Если при иммуногистохимиотипировании не выявлен мутантный белок R132H IDH1 и при секвенировании генов IDH1 (кодон 132) и IDH2 (кодон 172) не обнаружены мутации, или при секвенировании негативны только мутации генов IDH1 (кодон 132) и IDH2 (кодон 172), такой тип повреждения можно считать как IDH-дикого типа. В случае, когда невозможно провести полноценное исследование, тип диффузной астроцитомы указывается как неуточненный – NOS [10–13].
Медиана общей выживаемости (ОВ) при ГНСЗ составляет 186 месяцев, 5-летняя ОВ – от 54,6 до 88,4%, 5-летняя ВБП – от 37 до 55%; 8-летняя ВБП – 37%, а 10-летняя ОВ – 67,1%. Продолжительность жизни пациентов составляет от 6 до 8 лет, но может достигать и 20 лет. По данным некоторых авторов, в 50% случаев продолженного роста диффузной астроцитомы после хирургического лечения отмечается злокачественная трансформация клеток, при этом медиана сроков озлокачествления составляет от 32 до 32,5 месяца. По данным H. Ohgaki и P. Kleihues (2005), среднее время прогрессии глиомы WHO Gr II до глиобластомы составляет 5,3 года, а от WHO Gr III до глиобластомы – 1,4 года [5, 14–31].
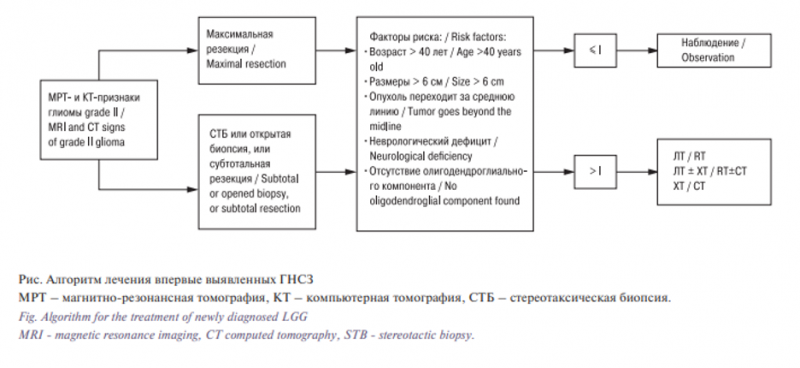
Согласно практическим рекомендациям Ассоциации нейрохирургов России (АНР), Российского общества клинической онкологии RUSSCO, Ассоциации онкологов России (АОР), определены подходы к лечению глиом WHO Grade 1–2: хирургическое лечение с последующим проведением лучевой терапии – (ЛТ, 50–54 Гр) и/или химиотерапии (ХТ) в зависимости от факторов риска продолженного роста (см. рисунок) [15].
Роль ХТ при лечении ГНСЗ до сих пор не определена, в настоящее время вновь вернулись к вопросу проведения как моно- (темозоломид), так и полихимиотерапии (PCV – прокарбазин, ломустин и винкристин) [32, 33]. Большинство российских и международных рекомендаций не содержат сведений о необходимости проведения ХТ при лечении первичной ГНСЗ (АНР, 2015; Кобяков и др., 2015; АОР, 2015; Soffietti и соавт., 2011; Stupp и соавт., 2014). Однако в рекомендациях NCCN (National Comprehensive Cancer Network) сообщается о том, что пациентам в неблагоприятной группе на 3-м этапе комплексного лечения необходимо проведение ХТ по схеме PCV (6 курсов), а при наличии противопоказаний рекомендуется применение темозоломида (TMZ) как радиомодификатора на фоне проведения радиотерапии и в качестве монотерапии (12 курсов) (National Comprehensive Cancer Network Guidelines, 2015) [16].
Необходимость адъювантной терапии ГНСЗ базируется на факторах прогноза риска рецидива в каждом конкретном случае. Многие клинические исследования оценивают адьювантную терапию с разбивкой по группам риска. Факторами прогноза продолженного роста ГНСЗ, по данным EANO (European Association of Neuro-Oncology), ESMO (European Society for Medical Oncology), АНР, Российского общества клинической онкологии RUSSCO, АОР являются: возраст пациентов >40 лет на момент морфологической верификации диагноза, гистологический диагноз – диффузная астроцитома, умеренные или грубые неврологические нарушения, максимальный линейный размер опухоли 6 см и больше, наличие смещения срединных структур головного мозга до хирургического вмешательства. Сочетание трех и более неблагоприятных прогностических факторов свидетельствует о принадлежности к неблагоприятной группе прогноза. Степень хирургической резекции опухоли учитывается отдельно от вышеперечисленных факторов прогноза, более неблагоприятным является недостаточная радикальность при удалении опухоли. В рекомендациях АНР, RUSSCO и АОР к неблагоприятной прогностической группе относят пациентов с двумя и более выявленными неблагоприятными факторами прогноза. В рекомендациях NCCN 2015 г. неблагоприятную группу прогноза составляют все пациенты в возрасте> 40 лет и все пациенты, у которых не было радикального удаления опухоли [16, 23, 27, 29, 31, 34]. В настоящее время нет завершившихся рандомизированных исследований по применению ХТ у пациентов с ГНСЗ, все исследования относятся к 3-му классу доказательности.
Целесообразна ли ХТ в качестве адъювантной терапии при лечении пациентов с впервые выявленными ГНСЗ?
В нескольких исследованиях описана ХТ непосредственно после хирургического лечения либо TMZ, либо PCV. У части пациентов при применении TMZ отмечалось улучшение качества жизни, лучший контроль приступов судорог и улучшение ВБП. Была исследована и доказана возможность применения непрерывных схем TMZ [36–42].
J.D. Olson и соавт. [3] провели ретроспективный анализ данных 106 пациентов. Проведены различные методы лечения: 20 – ЛТ, 12 – ХТ (14 PCV, 1 кармустин и 1 цисплатин), 6 прошли ХТ и ЛТ и 68 пациентам адъювантная терапия не проводилась. В среднем спустя 6 лет у 72 пациентов был диагностирован рецидив. Медиана времени до прогрессирования опухоли равнялась 3,9 года у пациентов, находящихся под наблюдением, 5,7 года у пациентов, прошедших ЛТ, 5,5 года у пациентов, прошедших ХТ и 8,6 года у пациентов, проходивших ЛТ и ХТ. Ученые пришли к выводу, что сроки и методы лечения достоверно не влияют ни на опухолевую прогрессию, ни на продолжительность жизни. Был предложен целесообразный подход к лечению данных пациентов при необходимости. Исследователи выступили за то, что ХТ может быть предпочтительной в качестве начальной терапии. ХТ остро токсична, но в целом ее отрицательные эффекты обратимы в отличие от ЛТ, токсичность которой имеет необратимый характер.
- Iwadate и соавт. [43] провели ретроспективный анализ данных 36 пациентов. Пациентам, перенесшим общее тотальное удаление опухоли (n=15), не проводилась адъювантная терапия до прогрессии. Пациенты с субтотальным удалением опухоли в течение двух лет получали лечение PVA (нидран, винкристин, прокарбазин). ХТ начиналась в течение 12 недель после операции. Пяти- и 10-летняя ВБП опухоли равнялась 75 и 46,9% соответственно. Авторы работы сделали вывод, что лучший способ лечения ГНСЗ заключается в проведении максимально возможной хирургической резекции, не приводящей к неврологическому дефициту, с последующим наблюдением. Кроме того, пациентам, у которых опухоль была удалена не полностью, ХТ должна быть проведена в течение 12 недель после операции.
- Nakamura и соавт. [25] провели ретроспективный анализ данных 88 пациентов. Режим ХТ – применение нимустина (нидран) и винкристина. Радикальная резекция была проведена 43 пациентам и 45 – субтотальная. После операции 52 пациента прошли только ЛТ, 14 – ХТ и ЛТ и 22 не проводили ни ЛТ, ни ХТ. Средняя продолжительность жизни без прогрессирования опухоли у всех пациентов равнялась 5,9 года, 5- и 10-летняя ВБП была 45 и 7% соответственно. Средняя продолжительность жизни составила 8,5 года у пациентов, перенесших послеоперационную ЛТ, и 7,6 года у 14 пациентов, которые прошли ХТ в сочетании с ЛТ. У пациентов, перенесших радикальную резекцию без адъювантной терапии, средняя продолжительность жизни составила 5,1 года. Исследователи не нашли четких доказательств того, что проведение ХТ совместно с ЛТ может оказать положительное воздействие при лечении ГНСЗ.
E.M. Stege и соавт. [36] провели ретроспективный анализ данных 21 пациента. ХТ по схеме PCV проведена 16 впервые диагностированным пациентам и 5 с рецидивом олигодендроглиом. Медиана времени до прогрессии не была достигнута за 24 месяца наблюдения. Авторы пришли к выводу, что ХТ эффективна у пациентов с большими олигодендроглиомами или смешанными олигоастроцитомами. Однако в этом ретроспективном исследовании не уточняются сроки начала ХТ после хирургического вмешательства или установления диагноза. Y. Higuchi и соавт. [44] провели проспективное нерандомизированное исследование с участием 18 в пациентов с ГНСЗ. Пять пациентов с практически полностью удаленными опухолями наблюдались в динамике по данным МРТ; 12 пациентам, которым опухоль была удалена субтотально или выполнена биопсия, ХТ (нимустин, винкристин, прокарбазин) назначена сразу после хирургии, 1 пациент отказался от лечения. Ответ опухоли на ХТ оценивали при помощи МРТ, пациентов классифицировали на реагирующих, когда уменьшение объема опухоли отмечалось более чем на 50%, не реагирующих, если отмечалось увеличение размеров опухоли более чем на 25%, и стабильных во всех других ситуациях. Авторы сообщают, что у 94% пациентов с глиомами WHO Gr II контроль размеров опухоли может быть без ЛТ с медианой наблюдения 4,7 года. ХТ может безопасно использоваться для контроля ВБП и ОВ у пациентов с частичной/субтотальной хирургической резекцией или только с биопсией. Кроме того, хирургическое удаление и ХТ при наличии остаточной опухоли является адекватным начальным лечением олигодендроглиом низкой степени злокачественности, что позволяет отсрочить ЛТ до прогрессирования опухоли [45].
Обновленный отчет Американского рандомизированного исследования (RTOG 9802), основанный на результатах лечения 251 пациента с первично диагностированными ГНСЗ WHO Gr II с относительно неблагоприятным прогностическим профилем показал, что адьювантная PCV ХТ улучшила показатели как беспрогрессивной продолжительности жизни, так и ОВ. Умерли 55% пациентов; средняя продолжительность жизни составила 7,8 года после проведенной только ЛТ и 13,3 года после ЛТ с последующей PCV ХТ (отношение рисков – ОР=0,59; p=0,002). На основании этого можно сделать вывод, что ЛТ с последующей адьювантной ХТ необходимо рассматривать как стандарт терапии ГНСЗ с высоким риском продолженного роста [46].
У кого из пациентов с впервые выявленными ГНСЗ ХТ будет наиболее эффективной?
E.G. Shaw и соавт. [47] опубликовали результаты проспективного рандомизированного исследования RTOG 9802. Пациенты были распределены в две группы риска в зависимости от возраста и установленной степени радикальности резекции. В группу благоприятных к лечению пациентов входили все пациенты моложе 40 лет, которым было проведено радикальное удаление глиомы, а неблагоприятная группа включала в себя пациентов старше 40 лет, которым были проведены повторные операции по удалению опухоли, и пациентов старше 40 лет, которым не было выполнено радикального удаления опухоли. После хирургического лечения 111 пациентам в благоприятной группе проводились МРТ в динамике. Несмотря на то что распределение пациентов на две группы базировалось на объеме резекции опухоли, определенном нейрохирургом, результаты и заключения были сообщены после рентгенологического определения остаточной опухоли во время послеоперационной МРТ. В среднем наблюдение продолжалось 4,4 года: 8 летальных исходов, случившихся в результате прогрессирования заболевания, у 49 пациентов была прогрессия опухоли. ОВ: 2 года – 99%, 5 лет – 93%. ВБП опухоли: 2 года – 82%, 5 лет – 48%. Что касается остальных 253 пациентов, отнесенных к неблагоприятной группе больных ГНСЗ, ОВ составила 2 года у 87% и 5 лет /у 66% (p=0,0001); ВБП опухоли: 73 и 50% (p=0,13). Пациенты из неблагоприятной группы в случайном порядке отбирались для прохождения только ЛТ либо ЛТ с PCV-ХТ. Средняя ВБП опухоли составила 4,9 года в благоприятной группе (находящейся под наблюдением) и 5,5 года в неблагоприятной. Послеоперационное исследование для оценки объема остаточной опухоли было проведено 98 из 111 пациентов благоприятной группы. Несмотря на то что, согласно нейрохирургическому отчету, все эти пациенты перенесли тотальное удаление опухоли, послеоперационная томография показала, что у 58 (59%) из 98 пациентов имелась остаточная ткань опухоли в объеме 1 см и менее во всех направлениях, что выявилось на Т2 последовательности МРТ, у 31 (32%) пациента наблюдалась остаточная ткань в объеме 1–2 см во всех направлениях относительно границы зоны резекции, а у 9 (9%) – 2 см и более. Авторы исследования выделили 3 фактора, прогнозирующих низкий уровень ОВ: диаметр предоперационной опухоли размером более 4 см, гистологический диагноз «астроцитома» или «смешанная олигоастроцитома» и послеоперационный остаточный объем опухоли более 1 см. Степень удаления опухоли, выявленная рентгенологически, коррелировала с частотой прогрессии опухоли; частота рецидивов составила 26% у пациентов, имевших 1 см послеоперационной остаточной опухоли, 68% при наличии 1–2 см послеоперационной остаточной опухолевой ткани и 89% у тех, чья остаточная опухоль составляла 2 см и более. Авторы данного исследования пришли к выводу, что пациенты в благоприятной группе с послеоперационным остаточным объемом опухоли в 1 см, по данным нейровизуализации, с предоперационным диаметром до 4 см и гистологическим диагнозом «олигодендроглиома» могут наблюдаться после первичной операции. Во всех других подгруппах пациентов должно быть рассмотрено дополнительное лечение как пациентам высокой степени риска. В данной исследовательской работе не изучалась роль только ХТ при лечении глиом WHO Gr II, также подчеркнуто, что нейрохирургическое определение степени резекции должно быть подтверждено послеоперационной МРТ, прежде чем направлять больного на последующее лечение [44].
Какие химиотерапевтические препараты следует использовать для лечения впервые выявленной ГНСЗ?
Нерешенным остается вопрос преимущества применения TMZ, его влияния на общую и ВБП по сравнению с PCV-ХТ.
Исследования, которые непосредственно сравнивают разные режимы приема препаратов, выступающих в качестве стартовой терапии впервые выявленных ГНСЗ, еще не проводилось. В большинстве исследований проводилась PCV-ХТ, лишь в немногих из них применяли TMZ, в некоторых других исследованиях использовали схему применения нидрана, винкристина и прокарбазина [45].
По данным G. Kaloshi и соавт. (2007), олигодендроглиомы и смешанные астроцитомы лучше реагируют на метилирующий агент – TMZ [50]. Неконтролируемые исследования по использованию TMZ и PCV-ХТ показывают более высокую скорость ответа при опухолях с утратой гетерозиготности 1p/19q [54].
По данным E.M. Stege и соавт. (2005), результат терапии TMZ 149 пациентов с глиомой WHO Gr II показал, что среднее время ВБП составило 28 месяцев, значительно лучший результат был в случае выявленной коделеции 1p/19q [41]. Аналогичные результаты были и при использовании схемы PCV [55].
Первое и единственное исследование Европейской организации по исследованию и лечению рака (EORTC), представленное в 2013 г. на заседании ASCO (Американское общество клинической онкологии) показало, что беспрогрессивная продолжительность жизни не отличалась у пациентов с потерей 1p, получавших TMZ, и у пациентов, которым проводилась ЛТ. У пациентов без утраты 1p при проведении ЛТ была лучшая беспрогрессивная продолжительность жизни. Средняя общая продолжительность жизни в этом исследовании не изучена [56].
В исследовании RTOG 9802 с 1998 по 2002 г. принял участие 251 пациент, окончание в 2012 г., медиана наблюдения – 11,9 года [47]. В выборку вошли пациенты в возрасте старше 40 лет либо с субтотальным удалением опухоли, или биопсией опухоли в независимости от возраста. Пациенты были разделены на две группы: первая – только ЛТ, вторая – ЛТ и ХТ. ЛТ – суммарной очаговой дозой – СОД (54 Гр, 30 фракций по 1,8 Гр в течение 6 недель). ХТ после завершения ЛТ 6 курсов прокарбазина (60 мг/м2 перорально с 8 по 21 день каждого цикла), ломустина – CCNU – 110 мг/м2 перорально в 1 день каждого цикла, винкристина (1,4–2,0 мг/м2 внутривенно на 8 и 29 дни каждого цикла), продолжительность цикла 8 недель. По результатам исследования: относительно ВБП до двух лет разницы между группами не было, ОВ была без различий до четырех лет. В группе пациентов, перенесших ЛТ: 5-летняя ВБП – 44% (95% доверительный интервал – ДИ 35–53), 10-летняя ВБП – 21% (95% ДИ 14–28), медиана ВБП – 4,0 года (95% ДИ 3,1– 5,5, ОР для прогрессирования заболевания или смерти 0,50; р<0,001), 5-летняя ОВ – 63% (95% ДИ 55–72), 10-летняя ОВ – 40% (95% ДИ 31–49), медиана ОВ – 7,8 ода (95% ДИ 6,1–9,8). В группе пациентов, перенесших ЛТ и ХТ: 5-летняя ВБП – 61% (95% ДИ 53–70), 10-летняя ВБП – 51% (95% ДИ 42–59), медиана ВБП – 10,4 года (95% ДИ 6,1 – не достигнуто), 5-летняя ОВ – 72% (95% ДИ 64–80), 10-летняя ОВ – 60% (95% ДИ 51–69), медиана ОВ – 13,3 года (95% ДИ 10,6 – не достигнуто).
В исследовании RTOG 0424 с 2005 по 2009 г. приняли участие 129 пациентов, медиана наблюдения – 4,1 года [60]. После оперативного вмешательства проведена дистанционная ЛТ, СОД (54 Гр, 30 фракций по 1,8 Гр в течение 6 недель). ХТ – TMZ 75 мг/м2 в сутки во время ЛТ и до 12 курсов адьювантной ХТ 150–200 мг/м2 с 1 по 5 дни каждые 28 дней, с профилактикой пневмоцистной пневмонии. ХТ прекращалась в случае прогрессирования опухоли либо в случае критической токсичности (на основании показателей крови). По данным исследования, 3-летняя ОВ составила 73,1% (95% ДИ 65,3–80,8%), 5-летняя ОВ 57,1% (95% ДИ 47,7–66,5%), 3-летняя ВБП 59,2% (95% ДИ 50,7–67,8%), медиана – 4,5 года (95% ДИ 3,5–NA).
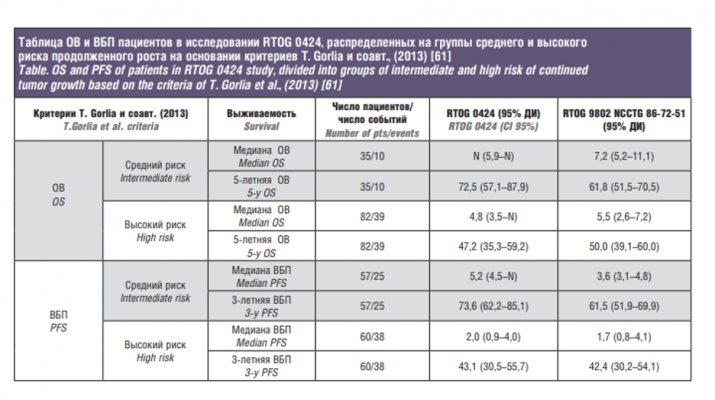
B.J. Fisher и соавт. (2014) представили сравнительный анализ рандомизированных исследований пациентов с впервые выявленными ГНСЗ [60] на основании критериев T. Gorlia и соавт. (2013) [61].
К критериям высокого риска продолженного роста (T. Gorlia и соавт., 2013) относятся:
- гистологический тип опухоли (астроцитома);
- сроки появления первых симптомов (30 недель и более);
- наличие неврологического дефицита (умеренный/выраженный);
- размеры опухоли (5 см и более);
- проведенная ЛТ (отсроченная).
Проведена оценка Каплана–Майера: к группе среднего риска отнесли пациентов с 2 факторами риска; к группе высокого риска с 3 и более (см. таблицу). Полученные результаты показывают лучшую выживаемость для группы пациентов среднего риска в RTOG 0424, однако результаты можно считать предварительными в связи с небольшой медианой наблюдения (4,1 года).
Существуют ли опухолевые маркеры, которые подскажут, каким пациентам первичное химиотерапевтическое лечение окажет наилучшее воздействие?
К сожалению, молекулярные данные (мутации гена ТР53, генные мутации изоцитратдегидрогеназы 1 (IDH1) и 2 (IDH2), трисомии 7 хромосомы, метилирование промотора О6-метилгуанинметилтрансферазы (МГМТ) RTOG 9802 пока не доступны и неясно все ли молекулярные подгруппы будут в равной степени реагировать на комбинированное лечение. По данным H.J. Dubbink и соавт. (2009), имеется прямая связь между мутацией IDH1 и положительным прогнозом относительно ОВ пациентов с ГНСЗ, независимо от коделеции 1p19q хромосомы [44], но в то же время отсутствует прямая связь мутации IDH1 и ответом на терапию TMZ [49].
- Ricard и соавт. [50] проанализировали влияние TMZ на естественное увеличение диаметра ГНСЗ. Обнаружилось, что препарат TMZ изменяет структуру роста ГНСЗ. Кроме того, указано, что эффективность препарата TMZ была незначительной в опухолях с мутацией p53 и коделецией 1p/19q.
- Iwadate и соавт. [43] занимались проспективным анализом данных 36 взрослых пациентов с диагнозом «глиома низкой степени злокачественности»: у 23 пациентов отмечалась коделеция 1p/19q, 21 пациенту, которому была выполнена субтотальная и частичная резекции, проведена первичная адъювантная ХТ, и 15 пациентов с общим тотальным удалением опухоли находились под наблюдением, ХТ проводилась только в период прогрессии опухоли (5 пациентов). Продолжительность жизни без прогрессирования опухоли составила 121 месяц у пациентов с коделецией 1p/19q, но она существенно не отличалась от таковой у тех, у кого была опухоль без коделеции 1p/19q (101 месяц). Авторы пришли к выводу, что результаты лечения всех пациентов с глиомой WHO Gr II в целом были положительными, независимо от статуса 1p/19q.
В ходе ретроспективного исследования Y. Okita и соавт. [51] оценивалось значение мутации IDH1 и IDH2 у пациентов с ГНСЗ, получавших адъювантную ХТ. Хирургическое удаление опухоли и биопсия для подтверждения диагноза были проведены 72 взрослым пациентам, а затем 58 пациентов подверглись ЛТ, 46 из которых также была назначена ХТ. Ни один из этих пациентов не получал только ХТ. Оказалось, что у пациентов с опухолями с мутацией IDH, половина из которых получали ХТ и ЛТ, период ВБП опухоли был больше (9,3 года), чем у тех, кому проводилась лишь ЛТ (3,1 года) (p=0,01). Однако у пациентов с IDH мутацией дикого типа, вне зависимости от того проходили они химиолучевую терапию или нет, продолжительность жизни без прогрессирования опухоли была примерно одинакова.
Таким образом, использование данных о коделеции 1p/19q для определения тактики лечения оказались неубедительными. Однако Y. Okita и соавт. [51] получили любопытные данные третьего класса относительно прогностического значения IDH мутаций, но они требуют дополнительных исследований и проверки [45]
В какие сроки должна начаться ХТ после того, как подтвердится диагноз «глиома низкой степени злокачественности»?
Сроки начала ХТ после операции в различных исследованиях достаточно разнообразны. E.G. Shaw и соавт. [47] в исследовании RTOG 9802 сообщили о начале ХТ в течение 12 недель после хирургического удаления у пациентов, которые также проходили ЛТ. Те же временны`е рамки обозначили и Y. Iwadate и соавт. [43], и J.C. Buckner и соавт. (3–12 недель). M.P. Frenay и соавт. [52] начали адъювантную терапию на 8–16-й неделях после биопсии опухоли. C. Lebrun и соавт. [53] сообщили о том, что адъювантная терапия была начата в среднем через 2 месяца после хирургической операции (0,5–9,0 месяцев). Поскольку ни в одном из данных исследований непосредственно не решался вопрос выбора времени начала адъювантной ХТ при лечении ГНСЗ, то нельзя дать однозначных рекомендаций. Однако поскольку в большинстве исследований сообщено о начале ХТ в течение 12 недель после операции, целесообразно сделать это время максимальным периодом для начала адъювантной ХТ у пациентов с верифицированной глиомой WHO Gr II [47].
Какие оптимальные режимы ХТ необходимо использовать в качестве стартовой терапии при лечении ГНСЗ?
Исследования, в которых сравниваются различные режимы или действующие агенты при первичной терапии ГНСЗ, отсутствуют. Чаще применялась PCV-ХТ, в части исследований – TMZ. В небольшом числе исследований использовались нимустин (ACNU), винкристин и прокарбазин.
- Ricard и соавт. [50] оценивали естественное развитие ГНСЗ и влияние TMZ на изменение диаметра опухоли. С помощью МРТ оценивали изменение среднего диаметра опухоли у 146 пациентов с глиомой WHO Gr II до, во время и после лечения TMZ. Они включили взрослых пациентов с подтвержденным диагнозом ГНСЗ. В первой группе данные 39 пациентов были оценены до, во время и после лечения TMZ. Эти 39 пациентов имели не менее 4 последовательных контрольных МРТ с медианой наблюдения 3,6 года (от 1 до 9,2 года) до начала лечения TMZ, данные 107 пациентов, включенных во вторую группу, оценивались только во время и после лечения TMZ. Применялась стандартная доза TMZ: 200 мг/м2 перорально на 1–5 дни 28-дневного цикла в среднем в течение 17 циклов (2–30 циклов). До лечения TMZ средний диаметр опухоли линейно возрастал во времени. Рост был медленнее в опухолях с 1p/19q коделецией (3,4 против 5,9 мм/год) и в тех, которые не экспрессировали p53 (4,2 против 6,3 мм/год; р=0,05). После начала терапии TMZ авторы сообщили, что произошло уменьшение среднего диаметра опухоли у 38 из 39 пациентов первой группы и у 98 из 107 второй группы. Эти изменения были рассчитаны не менее чем в ходе 4 последовательных МРТ. В группе, демонстрирующей снижение среднего диаметра опухоли, снижение было линейным и наполовину меньше темпов роста до лечения (9,2 против 4,7 мм/год). Авторы определили полный радиологический ответ как исчезновение всей опухоли на T2W МРТ или на FLAIR последовательностях через 8 недель. Частичный ответ был определен как сокращение более чем на 50% от размера (по площади поперечного сечения), малый ответ был определен как уменьшение размера на 25–50% и прогрессирующее заболевание определялось как увеличение размера опухоли более чем на 25%. У 20 пациентов достигнут частичный радиологический ответ, у 45 достигнут незначительный ответ, у 35 отмечена стабилизация опухоли, в то время как у 7 выявлена прогрессия опухоли. Клиническое улучшение наблюдалось у 68 (63,5%) пациентов, в то время как 34 (31,8%) были клинически стабильными, а 5 ухудшились. Уменьшение среднего диаметра опухоли после начала лечения TMZ было быстрым у 77 больных и с задержкой в среднем на 116 дней (48–206) у 21 пациента. После медианы в 367 дней (95% ДИ 290–403, диапазон 98–756 дней), у 36 из 98 пациентов был замечен продолженный рост. Риск продолженного роста был значительно выше у пациентов без коделеции 1p/19q (60,6 против 16,6%; р=0,0004). Применение TMZ было прекращено у 25 пациентов по решению врача, у большинства этих пациентов рост опухоли возобновился в течение 1 года. Авторы пришли к выводу, что нелеченные ГНСЗ почти предсказуемым образом непрерывно растут и это зависит от их генетических изменений. TMZ в начале изменяет эту картину, но эффект от терапии недлительный, большинство опухолей возобновляет свой рост, когда лечение прекращено.
- Lebrun и соавт. [53] ретроспективно проанализировали свой опыт лечения 33 пациентов с олигодендроглиомами низкой степени злокачественности, которые подверглись частичной резекции и ХТ. Ни одному из этих пациентов не проводилась ЛТ. PCV-ХТ была начата в среднем через 2 месяца после хирургического лечения. Авторы сообщили о ВБП заболевания более 30 месяцев. Выживаемость на 2-й и 5-й год составила 85 и 75% соответственно. ВБП на 1-м году составила 90%. Клинический ответ (определялся как уменьшение частоты приступов) наблюдался у 81% пациентов. Авторы пришли к выводу, что адьювантная ХТ по схеме PCV может быть использована для симптомных пациентов с олигодендроглиомами низкой степени злокачественности, которым не может быть проведено макроскопически тотальное удаление для того, чтобы отсрочить ЛТ и продлить ВБП.
- Pouratian и соавт. [57] ретроспективно изучили токсичность продолжительного курса приема небольшой дозы TMZ согласно графику, рассчитанному на 28 дней, в 21 из которых следует принимать 75 мг/м2 /сут, что отличается от стандартной дозы и графика приема TMZ, рассчитанного на 5 дней (200 мг/м2 /сут). В исследование были включены 25 пациентов (15 с впервые выявленными и 10 с рецидивом) с гистологически подтвержденным диагнозом «глиома низкой степени злокачественности» (у 11 была проведена биопсия, и 14 – субтотальное удаление). Три пациента перешли на стандартное дозирование TMZ вследствие недопустимых побочных эффектов, и 3 пациента раньше срока прекратили ХТ из-за прогрессирования опухоли. Объективный ответ был отмечен у 52% пациентов, а частота контроля опухолевого процесса составила 84%. Продолжительность жизни без прогрессирования опухоли: 6 месяцев у 92% пациентов и 12 месяцев у 74%. В группе с впервые выявленными опухолями ни у одного из пациентов не было полного ответа; у 3 пациентов наблюдался частичный ответ, минимальный ответ был у 6 пациентов, стабилизация заболевание у 3 и прогрессия у 3 пациентов. Токсичность проявлялась в повышенной утомляемости, лимфо- и лейкопении, запорах, тошноте, электролитных нарушениях, рвоте, артралгиях, возникновении опоясывающего герпеса, развитии злокачественной опухоли (диффузная крупноклеточная В-клеточная лимфома), когнитивных расстройствах. Исследователи пришли к выводу, что длительный прием небольшой дозы TMZ положителен, поскольку препарат оказывает повышенное кумулятивное действие, но в то же время является более токсичным. Было предложено допустить пациентов к продолжительному приему небольшой дозы TMZ, а затем вернуться к стандартной дозе, когда прежний режим перестанет подходить пациенту. Поскольку данное исследование представляет собой не сравнительный анализ, то для того, чтобы рекомендовать препарат к лечению, необходимо провести рандомизированное исследование для подтверждения эффективности продолжительного курса приема данного режима ХТ. Кроме того, как отмечают исследователи, с таким режимом приема лекарства увеличится стоимость лечения.
Следует ли пациентам с впервые выявленной ГНСЗ проводить ХТ наряду с другими адъювантными терапиями?
E.G. Shaw и соавт. [58] в ходе исследования RTOG 9802 проводили анализ результатов ЛТ по сравнению с одновременным применении ЛТ и ХТ у пациентов с впервые выявленной ГНСЗ. Согласно результатам исследования, пациенты, прожившие 2 года, имели более полное хирургическое удаление, подтвержденное рентгенологически, а опухоль была олигодендроглиальной природы. Авторы исследования высказали предположение о возможности именно этой подгруппе пациентов получить положительный эффект от комбинации ЛТ и ХТ.
J.D. Olson и соавт. [3] продемонстрировали, что у пациентов, находящихся под наблюдением, медиана времени до прогрессирования равнялась 3,9 года, у пациентов, прошедших ЛТ – 5,7 года, у пациентов, прошедших ХТ – 5,5 года, и 8,6 года у пациентов, перенесших ХТ и ЛТ. Авторы считают, что нет таких схем лечения, которые бы были статистически лучше других. Было сделано заключение о том, что тип адъювантной терапии не оказывает влияния ни на медиану времени до прогрессирования опухоли, ни на ОВ.
По данным M. Nakamura и соавт. [25], занимавшимися ретроспективным исследованием 88 взрослых пациентов с глиомой WHO Gr II, у больных, прошедших курс ХТ в комбинации с ЛТ, ОВ не была лучше, чем у пациентов, прошедших только ЛТ.
- Okita и соавт. [51] представили данные о том, что адъювантная ХТ, проведенная совместно с ЛТ, оказала положительное влияние на продолжительность жизни без прогрессирования опухоли и на ОВ больных ГНСЗ с мутацией IDH по сравнению с пациентами, которым была проведена только ЛТ. Однако у больных с мутацией IDH дикого типа добавление ХТ к ЛТ никак не повлияло ни на продолжительность жизни без прогрессирования заболевания, ни на ОВ больных.
В исследовании J.C. Buckner J. C. и соавт. [59] 28 взрослым пациентам была проведена ХТ в течение 12 недель после операции, а через 10 недель после завершения ХТ была проведена ЛТ. У 8 пациентов был зафиксирован рентгенологический ответ, у 17 – стабилизация процесса, у 3 – быстрое прогрессирование [45].
Заключение
Таким образом, несмотря на большое число рассмотренных публикаций о роли ХТ в лечении пациентов с впервые выявленными ГНСЗ, нет ни одного, относящегося к 1-му классу доказательности
ЛИТЕРАТУРА/REFERENCES
- Okamoto Y., Schler D., Probst-Hensch N.M., Yasargil M.G., Yonekawa Y., Ltolf U.M., Kleihues P., Ohgaki H. Population-based study on incidence, survival rates, and genetic alterations of low-grade diffuse astrocytomas and oligodendrogliomas. Acta Neuropathol. 2004;108(1):49–56.
- Van Veelen M.L.C., et al. Supratentorial low grade astrocytoma: prognostic factors, dedifferentiation, and the issue of early versus late surgery. J. Neurol. Neurosurg. Psychiatry. 1998;64(5):581–7.
- Olson J.D., Riedel E., DeAngelis L.M. Long-term outcome of low-grade oligodendroglioma and mixed glioma. Neurol. 2000;54(7):1442–8.
- Hinsdale I.L. CBTRUS, Statistic report; primary brain tumors in United States, 1998–2002. Central Brain Tumor Registry of the United States. 2005.
- Ohgaki H., Kleihues P. Population-based studies on incidence, survival rates, and genetic alterations in astrocytic and oligodendroglial gliomas. J. Neuropathol. Exper. Neurol. 2005;64(6):479–89.
- Johannesen T.B., et al. Trends in incidence of brain and central nervous system tumors in Norway, 1970–1999. Neuroepidemiol. 2004;23(3):101–9.
- Lönn S., et al. Incidence trends of adult primary intracerebral tumors in four Nordic countries. Int. J. Cancer. 2004;108(3):450–5.
- Hoffman S., Propp J. M., McCarthy B.J. Temporal trends in incidence of primary brain tumors in the United States, 1985–1999. J. Neuro-oncol. 2006;8(1):27–37.
- Hess K.R., Broglio K.R., Bondy M.L. Adult glioma incidence trends in the United States, 1977–2000. Cancer. 2004;101(10):2293–9.
- Janny P., et al. Low grade supratentorial astrocytomas. Management and prognostic factors. Cancer. 1994;73(7):1937–45.
- Louis D.N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. 2016;131(6):803–20.
- Kobyakov G.L., et al. The 2016 WHO classification of primary central nervous system tumors: a clinician’s view. Zhurnal voprosy neirokhirurgii imeni N.N. Burdenko. 2018;82(3):88–96.
- Мацко Д.Е., Мацко М.В. Классификация опухолей центральной нервной системы ВОЗ (2016). Рос. нейрохирургический журнал им. профессора А.Л. Поленова. 2016;8(4):5–11.
- Claus E.B., Black P.M. Survival rates and patterns of care for patients diagnosed with supratentorial low-grade gliomas. Cancer. 2006;106(6):1358–63.
- Кобяков Г.Л., Бекяшев А.Х., Голанов А.В., Коновалов А.Н., Насхлеташвили Д.Р., Потапов А.А. и др. Практические рекомендации по лекарственному лечению первичных опухолей центральной нервной системы. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2. 2018;8:83–99
- Милюков С.М. Диагностика и лечение первичных инфильтративных глиом низкой степени злокачественности. Вестн. Рос. научного центра рентгенорадиологии Минздрава России. 2016;16(2).
- Okamoto Y., et al. Population-based study on incidence, survival rates, and genetic alterations of low-grade diffuse astrocytomas and oligodendrogliomas. Acta Neuropathol. 2004;108(1):49–56.
- Walker D.G., Kaye A.H. Low grade glial neoplasms. J. Clin. Neurosci. 2003;10(1):1–13.
- Becker K., et al. DNA repair protein MGMT protects against N-methyl-Nnitrosourea-induced conversion of benign into malignant tumors. Carcinogenesis. 2003;24(3):541–6.
- Nakasu S., et al. Prognostic significance of loss of O 6-methylguanine-DNA methyltransferase expression in supratentorial diffuse low-grade astrocytoma. Surg. Neurol. 2007;68(6):603–8.
- Leighton C., et al. Supratentorial low-grade glioma in adults: an analysis of prognostic factors and timing of radiation. J. Clin. Oncol. 1997;15(4): 1294–301.
- Sanai N., Chang S., Berger M.S. Low-grade gliomas in adults: a review. J. Neurosurg. 2011;115(5):948–65.
- Lunsford L.D., et al. Survival after stereotactic biopsy and irradiation of cerebral nonanaplastic, nonpilocytic astrocytoma. J. Neurosurg. 1995;82(4):523–9.
- McCormack B.M., et al. Treatment and survival of low-grade astrocytoma in adults –1977–1988. J. Neurosurg. 1992;31(4):636–42.
- Nakamura M., et al. Analysis of prognostic and survival factors related to treatment of low-grade astrocytomas in adults. Oncol. 2000;58(2):108–6.
- North C.A., et al. Low-grade cerebral astrocytomas. Cancer. 1990;66:6–14.
- Philippon J.H., et al. Supratentorial low-grade astrocytomas in adults. J. Neurosurg. 1993;32(4):554–9.
- Chaichana K.L., et al. Recurrence and malignant degeneration after resection of adult hemispheric low-grade gliomas. J. Neurosurg. 2010;112(1):10–7.
- Pignatti F., et al. Prognostic factors for survival in adult patients with cerebral low-grade glioma. J. Clin. Oncol. 2002;20(8):2076–84.
- Lee S.M., et al. Inter-and intracellular heterogeneity of O 6-alkylguanineDNA alkyltransferase expression in human brain tumours: possible significance in nitrosourea therapy. 1996.
- Piepmeier J., et al. Variations in the History and Survival of Patients with, Supratentorial Low-grade Astrocytomas. J. Neurosurg. 1996;38(5):872–9.
- Raizer J. Chemotherapy for low-grade gliomas: lessons and questions. Oncol. (Williston Park, NY). 2014;28(12):1043–4, 1051.
- van den Bent M.J. Chemotherapy for low-grade glioma: when, for whom, which regimen? Curr. Opin. Neurol. 2015;28(6):633–8.
- Hoang-Xuan K., et al. Temozolomide as initial treatment for adults with lowgrade oligodendrogliomas or oligoastrocytomas and correlation with chromosome 1p deletions. J. Clin. Oncol. 2004;22(15):3133–8.
- Baumert B.G., Stupp R. Low-grade glioma: a challenge in therapeutic options: the role of radiotherapy. Ann. Oncol. 2008;19(Suppl. 7):vii217-vii222.
- Stege E.M., et al. Successful treatment of low-grade oligodendroglial tumors with a chemotherapy regimen of procarbazine, lomustine, and vincristine. Cancer. 2005;103(4):802–9.
- Pace A., et al. Temozolomide chemotherapy for progressive low-grade glioma: clinical benefits and radiological response. Ann. Oncol. 200;14(12):1722–6.
- Quinn J.A., et al. Phase II trial of temozolomide in patients with progressive lowgrade glioma. J. Clin. Oncol. 2003;21(4):646–51.
- Brock C.S., et al. Phase I trial of temozolomide using an extended continuous oral schedule. Cancer Res. 1998;58(19):4363–7.
- Khan R.B., et al. A phase II study of extended low-dose temozolomide in recurrent malignant gliomas. J. Neuro-oncol. 2002;4(1):39–43.
- Tosoni A., et al. Temozolomide three weeks on and one week off as first line therapy for patients with recurrent or progressive low grade gliomas. J. Neurooncol. 2008;89(2):179–85.
- Kaloshi G., et al. Temozolomide for low-grade gliomas Predictive impact of 1p/19q loss on response and outcome. Neurol. 2007;68(21):1831–6.
- Iwadate Y., et al. Favorable long-term outcome of low-grade oligodendrogliomas irrespective of 1p/19q status when treated without radiotherapy. J. Neuro-oncol. 2011;102(3):443–9.
- Higuchi Y., Iwadate Y., Yamaura A. Treatment of low-grade oligodendroglial tumors without radiotherapy. Neurol. 2004;63(12):2384–6.
- Ziu M., et al. The role of initial chemotherapy for the treatment of adults with diffuse low grade glioma. J. Neuro-oncol. 2015;125(3):585–607.
- Karim A.B.M.F., et al. Randomized trial on the efficacy of radiotherapy for cerebral low-grade glioma in the adult: European Organization for Research and Treatment of Cancer Study 22845 with the Medical Research Council study BRO4: an interim analysis. Int. J. Radiat. Oncol. Biol. Phys. 1996; 36:549–56.
- Shaw E.G., et al. Randomized trial of radiation therapy plus procarbazine, lomustine, and vincristine chemotherapy for supratentorial adult lowgrade glioma: initial results of RTOG 9802. J. Clin. Oncol. 2012;30(25): 3065–70.
- Dubbink H.J., et al. IDH1 mutations in low-grade astrocytomas predict survival but not response to temozolomide. Neurol. 2009;73(21):1792–5.
- Baumert B.G., Stupp R. Is there a place for radiotherapy in low-grade gliomas? Low-Grade Gliomas. 2010. С. 159–82.
- Ricard D., et al. Dynamic history of low-grade gliomas before and after temozolomide treatment. Ann. Neurol. 2007;61(5):484–90.
- Okita Y., et al. IDH1/2 mutation is a prognostic marker for survival and predicts response to chemotherapy for grade II gliomas concomitantly treated with radiation therapy. Int. J. Oncol. 2012;41(4):1325–36.
- Frenay M.P., et al. First-line nitrosourea-based chemotherapy in symptomatic non-resectable supratentorial pure low-grade astrocytomas. Eur. J. Neurol. 200;12(9):685–90.
- Lebrun C., et al. Treatment of newly diagnosed symptomatic pure lowgrade oligodendrogliomas with PCV chemotherapy. Eur. J. Neurol. 2007; 14(4):391–8.
- van den Bent M.J. Practice changing mature results of RTOG study 9802: another positive PCV trial makes adjuvant chemotherapy part of standard of care in lowgrade glioma. J. Neuro-oncol. 2014;16(12):1570–4.
- Douw L., et al. Cognitive and radiological effects of radiotherapy in patients with low-grade glioma: long-term follow-up. Lancet. Neurol. 2009;8(9):810–8.
- Habets E.J.J., et al. Health-related quality of life and cognitive functioning in long-term anaplastic oligodendroglioma and oligoastrocytoma survivors. J. Neuro-oncol. 2014;116(1):161–8.
- Pouratian N., et al. Low-grade gliomas in older patients: a retrospective analysis of prognostic factors. J. Neuro-oncol. 2008;90(3):341.
- Shaw E.G., et al. Recurrence following neurosurgeon-determined gross-total resection of adult supratentorial low-grade glioma: results of a prospective clinical trial. 2008.
- Buckner J.C., et al. Phase II trial of procarbazine, lomustine, and vincristine as initial therapy for patients with low-grade oligodendroglioma or oligoastrocytoma: efficacy and associations with chromosomal abnormalities. J. Clin. Oncol. 2003;21(2):251–5.
- Fisher B.J., et al. Phase 2 study of temozolomide-based chemoradiation therapy for high-risk low-grade gliomas: preliminary results of Radiation Therapy Oncology Group 0424. Int. J. Radiat. Oncol. Biol. Phys. 2015;91(3):497–504.
- Gorlia T., et al. New validated prognostic models and prognostic calculators in patients with low-grade gliomas diagnosed by central Neuro pathology review: a pooled analysis of EORTC/RTOG/NCCTG phase III clinical trials. J. Neurooncol. 2013;15(11):1568–79.
Поступила 11.06.19 Принята в печать 01.08.19
Received 11.06.19 Accepted 01.08.19
Информация об авторах:
А.Х. Бекяшев – д.м.н., профессор кафедры нейрохирургии ФГБОУ ДПО РМАНПО Минздрава РФ, заведующий Нейрохирургическим отделением в ФГБУ Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина МЗ РФ, Москва; e-mail: abekyashev@gmail.com
А.В. Голанов – д.м.н., профессор кафедры Радиологии ФГБОУ ДПО РМАНПО Минздрава РФ, член-корреспондент РАН, заведующий отделением радиологии и радиохирургии в ФГАУ НМИЦ нейрохирургии им. акад. Н.Н. Бурденко МЗ РФ, Москва; e-mail: golanovav@gmail.com
С.М. Банов – к.м.н., врач-радиотерапевт, заведующий отделением радиохирургии и радиотерапии Центра «Гамма-нож» ФГАУ НМИЦ нейрохирургии им. акад. Н.Н. Бурденко МЗ РФ, Москва; e-mail: smbanov@ gmail.com
В.А. Молдованов – к.м.н., врач-нейрохирург ФГБОУ ВО Ростовский государственный медицинский университет МЗ РФ, Ростов-на-Дону; e-mail: v.moldovanov@yandex.ru
А.А. Тушев – врач-нейрохирург ФГБОУ ВО Ростовский государственный медицинский университет МЗ РФ, Ростов-на-Дону; e-mail: Dr.tushev@ mail.ru
About the authors:
A.Kh. Bekyashev – MD, professor of the Department of Neurosurgery, FSBEI RMACPE of the Ministry of Health of the Russian Federation, head of the Neurosurgery Department at the FSBI National Medical Research Center for Oncology named after N.N. Blokhin, Ministry of Health of the Russian Federation, Moscow; e-mail: abekyashev@gmail.com
A.V. Golanov – MD, Professor, Department of Radiology, FSBEI RMACPE of the Ministry of Health of the Russian Federation, Corresponding Member of the Russian Academy of Sciences, Head of the Department of Radiology and Radiosurgery at the FSAI NMRC of Neurosurgery named after Acad. N.N. Burdenko, Ministry of Health of the Russian Federation, Moscow; e-mail: golanovav@gmail.com
- Banov – MD, PhD, Head of the Department of Radiosurgery and Radiotherapy at the Gamma Knife Center, FSAI NMRC for Neurosurgery named after Acad. N.N. Burdenko, Ministry of Health of the Russian Federation, Moscow; e-mail: smbanov@gmail.com
V.A. Moldovanov – MD, neurosurgeon, FSBEI HE Rostov State Medical University of the Ministry of Health of the Russian Federation, Rostov-on-Don; e-mail: v.moldovanov@yandex.ru
A.A. Tushev – MD, neurosurgeon at the FSBEI HE, Rostov State Medical University, Ministry of Health of the Russian Federation, Rostov-on-Don; e-mail: Dr.tushev@mail.ru