Для цитирования:
Диаб Х.М., Дайхес Н.А., Рязанов В.Б., Каибов А.А., Пащинина О.А., Михалевич А.Е. Кохлеарная имплантация под местной анестезией с применением Дексдор. Голова и шея. Российский журнал Head and neck Russian Journal. 2019;7(4):53–60.
For citation:
Diab Kh.M., Daikhes N.A., Ryazanov V.B., Kaibov A.A., Pashchinina O.A., Mikhalevich A.E. Cochlear implantation under local anesthesia with the use of Dexdor. Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2019;7(4):53–60 (in Russian).
Doi: 10.25792/HN.2019.7.4.53–60
В статье представлен материал, посвященный актуальной проблеме – реабилитации пациентов с сенсоневральной тугоухостью IV степени и глухотой с сопутствующими заболеваниями. Представлен собственный опыт проведения операции кохлеарной имплантации (КИ) у пациентов с сопутствующей соматической патологией в условиях местной инфильтрационной анестезии с внутривенной седацией препаратом дексмедетомидин. Дексмедетомидин является относительно новым препаратом, используемым для седации в практике анестезиологии и реанимации.
Материал и методы. На базе НКЦ оториноларингологии в отделении заболеваний уха выполнена КИ 10 пациентам с сопутствующими заболеваниями, что было препятствием для общего наркоза, с применением местной инфильтрационной анестезии с внутривенной седацией препаратом дексмедетомидин (Дексдор). В предоперационном периоде пациенты тщательно были подготовлены, ознакомлены с каждым этапом операции, с таблицами для диалога интраоперационно. Выполнялась КИ классическим методом: антромастоидотомия, задняя тимпанотомия, вскрытие вторичной мембраны, введение электрода, интраоперационные измерения и проверка импланта, ушивание раны послойно. Также после операции проводили опрос по всем параметрам во время операции и в раннем послеоперационном периоде.
Результаты.
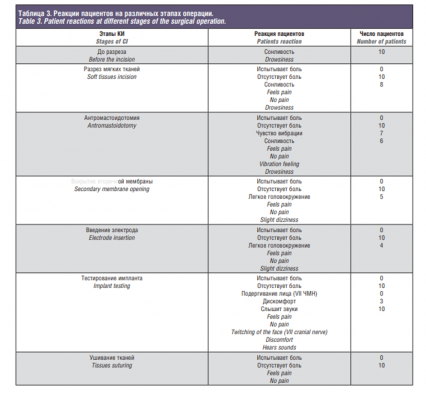
Во всех 10 случаях пациентам с сопутствующими заболеваниями была выполнена КИ под местной анестезией sol. Ultracaini – 8,0 с применением дексмедетомидина, что позволило избежать введения миорелаксантов. Операцию проводили стандартно под контролем операционного микроскопа OMPI Sensera S7 Karl Zeiss. После парентерального введения препарата эффект достигался достаточно быстро, на фоне введения препарата артериальное давление не достигало высоких цифр, усугубления сопутствующих заболеваний не отмечалось, пациенты чувствовали себя удовлетворительно, реагировали на все знаки, отвечали на вопросы, читая с таблиц. Ни в одном из случаев пациенты не чувствовали боль при разрезе, отсепаровке мягких тканей, работе бор-машиной, введении электродной решетки кохлеарного импланта и его последующем тестировании. С помощью таблиц для беседы все пациенты получали информацию о каждом этапе операции и последующих действиях хирургической бригады и аудиологов. На всех этапах операции все пациенты не испытывали каких-либо болевых ощущений, за исключением только незначительного головокружения и дискомфорта во время вскрытия вторичной мембраны окна улитки, введения электродной решетки в тимпанальную лестницу и тестирования импланта. Большинство пациентов при этом находились в состоянии неглубокого сна, периодически просыпаясь только при необходимости информирования их о ходе операции. Проведение КИ под местной анестезией позволило получить четкие пороги регистрации акустических рефлексов (исключено действие миорелаксантов) сухожилия стременной мышцы. Время операции в среднем занимало 18±5,2 минут с учетом времени анестезии, что на 15±5,3 минуты меньше, чем в случаях интубации трахеи с применением миорелаксантов.
Выводы. К преимуществам местной анестезии с применением дексмедетомидина можно отнести меньшую инвазивность процедуры, возможность не использовать миорелаксанты, экономить средства, сохранять сознание пациента (не требуется интубации трахеи), что дает возможность интраоперационно проводить диагностику импланта и оценивать ощущения слухового восприятия пациента при подаче сигналов, определять наличие или отсутствие патологической стимуляции лицевого нерва, сократить время операции, перевести пациента в палату (режим общий); при этом отсутствуют тошнота и рвота в раннем послеоперационном периоде, пациент может самостоятельно продолжить назначения (при сопутствующих заболеваниях) по схеме, быстро восстанавливается общее состояние больного и сокращается срок послеоперационного периода, а самое главное, отсутствуют интра- и послеоперационные осложнения, связанные с анестезией. Ключевые слова: кохлеарная имплантация, седация, местная анестезия, наркоз, реабилитация.
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Диаб Х.М., Дайхес Н.А., Рязанов В.Б., Каибов А.А., Пащинина О.А., Михалевич А.Е. Кохлеарная имплантация под местной анестезией с применением Дексдор. Голова и шея. Российский журнал Head and neck Russian Journal. 2019;7(4):53–60.
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
The article presents material devoted to an urgent problem — rehabilitation of patients with sensorineural hearing loss of the IV degree and deafness with concomitant diseases. The authors present their own experience of cochlear implantation (CI) surgery in patients with concomitant somatic pathology under local infiltration anesthesia with intravenous sedation with dexmedetomidine. Dexmedetomidine is a relatively new drug used for sedation in anesthesiology and intensive care.
Material and Methods: In the Department of Ear Diseases of the SCC of Otorhinolaryngology, CI was performed in 10 patients with concomitant diseases, contraindicative for general anesthesia application, using local infiltration anesthesia with intravenous sedation by dexmedetomidine (Dexdor). In the preoperative period, all the patients were carefully prepared, each stage of the operation discussed, including the tables for intraoperative dialogue. CI was performed by the classical method: antromastoidotomy, posterior tympanotomy, opening of the secondary membrane, insertion of an electrode, intraoperative measurements and implant testing, wound closure layer by layer. Also, after the operation, a survey was conducted concerning all the parameters during the operation and in the early postoperative period.
Results. In all 10 cases, patients with concomitant diseases underwent CI under local anesthesia sol. Ultracaini – 8.0 with the use of dexmedetomidine, which helped to avoid the administration of myorelaxants. The surgery was performed in standard way under the control of an OMPI Sensera S7 Karl Zeiss microscope. After parenteral administration of the drug, the effect was achieved quickly enough, blood pressure during the administration did not reach high levels, no concomitant diseases were aggravated, patients felt satisfactory, responded to all signs, and answered questions reading from the tables. None of the patients felt pain during incision, soft tissue separation, boron machine working, insertion of the cochlear implant electrode array and its subsequent testing. Using tables for conversation, all patients received information about each stage of the operation and the subsequent actions of the surgical team and audiologists. At all stages of the operation, all patients did not experience any pain, only slight dizziness and discomfort during opening of the secondary membrane of the round window, insertion of the electrode array into the tympanum ladder and testing of the implant. Most patients were not in a deep sleep state, periodically waking up only in cases when it was necessary to inform them of the progress of the operation. Performing CI under local anesthesia allows to get clear thresholds for recording the acoustic reflexes (due to the myorelaxants effect exclusion) from stapedius muscle tendon. The operation time took 18±5.2 minutes on average, taking into account the time of anesthesia, which was 15±5.3 minutes less than in cases of tracheal intubation using myorelaxants.
Conclusions. The advantages of local anesthesia with the use of dexmedetomidine include less invasiveness of the procedure, the ability to not use myorelaxants, cost saving, the patient staying conscious (tracheal intubation is not required), which makes it possible to perform intraoperative testing of the implant and evaluate the patient’s auditory perception when signals are given, determining the presence or absence of pathological stimulation of the facial nerve, reduction of operation time, transfer to the ward (general regimen); the absence of nausea and vomiting in the early postoperative period, ability of patient (with concomitant diseases) to continue implementation of prescriptions by himself according to the scheme, a quick recovery of the general condition of the organism and a reduction in the postoperative period terms, and most importantly, the absence of intra- and postoperative complications associated with anesthesia.
Keywords: cochlear implantation, sedation, local anesthesia, anesthesia, rehabilitation
The authors declare no conflict of interest.
Source of financing: not specified.
For citation: Diab Kh.M., Daikhes N.A., Ryazanov V.B., Kaibov A.A., Pashchinina O.A., Mikhalevich A.E. Cochlear implantation under local anesthesia with the use of Dexdor. Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2019;7(4):53–60 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of pub-lishing illustrative material – tables, figures, photographs of patients.
Введение
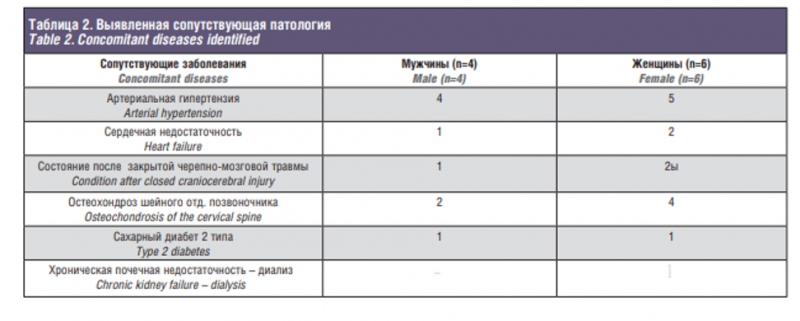
Кохлеарная имплантация (КИ) в настоящее время является наиболее эффективным способом реабилитации пациентов при глубокой двусторонней сенсоневральной тугоухости и глухоте, обеспечивает улучшение качества жизни пациентов в различных аспектах, таких как самообеспеченность и социализация [1]. КИ включает комплекс мероприятий – отбор кандидатов для проведения КИ, хирургический этап и слухоречевую реабилитацию. Эта операция характеризуется восстановлением слуховой афферентации путем непосредственной электростимуляции волокон слухового нерва с помощью введенных в улитку электродных систем [2, 3]. Хирургические аспекты и осложнения операции относительно тщательно изучены [4]. В последние годы число выполняемых КИ неуклонно растет, т.к. кохлеарный имплант является хорошей заменой при потере слуха. Тем не менее остаются некоторые проблемы при проведении анестезии из-за сопутствующих заболеваний у пациентов, которые увеличивают риск интраоперационных осложнений [5]. Противопоказания к общему обезболиванию возникают из-за сопутствующих заболеваний со стороны сердечно-сосудистой, нервной, дыхательной систем, почечной и печеночной недостаточности, сахарного диабета и т.д., а также у пациентов с анатомически короткой шеей, когда возникают трудности с интубацией. Под осложнениями следует понимать потерю управляемости анестезией, создающую потенциальную угрозу для жизни больного (больше вероятность сердечной аритмии и др.), которая может также усилить кровотечение во время операции под общей анестезией. Осложнения происходят чаще всего при вводном наркозе и во время пробуждения больного, а тошнота и рвота в первые часы после анестезии требуют применения противорвотных препаратов. Кроме того, общая анестезия несет бóльшую себестоимость и увеличивает срок пребывания пациентов после КИ из-за усугубления сопутствующих заболеваний. Также в ходе хирургического этапа КИ необходимо учитывать ряд нюансов, которые зависят от анестезии. Одно из требований, предъявляемых хирургом к анестезии в ходе КИ, – это отсутствие нейромышечного блока в момент тестирования импланта после его установки [6]. Интраоперационно проводится телеметрия импланта – оценка сопротивления каждого электрода и сопротивления референтного электрода, а также регистрация акустических рефлексов сухожилия стременной мышцы и определение пороговых значений. В дальнейшем полученные данные используются при настройках кохлеарного импланта. Электрофизиологические интраоперационные данные позволяют незамедлительно убедиться в корректной работе импланта и стимуляции проводящих путей слухового анализатора. Эти объективные измерения также помогают в определении потенциально сложных случаев, как, например низкая чувствительность к электрической стимуляции или возможная стимуляция лицевого нерва. Исследования показали, что интраоперационные измерения играют значимую роль в первичной настройке речевого процессора [6]. По сравнению с телеметрией нервного ответа регистрация электрически вызванного мышечного рефлекса более изменчива, удобна, точна, обладая при этом объективным преимуществом и в послеоперационном периоде [6]. Существует 3 способа достижения отсутствия нейромышечного блока в момент регистрации стапедиального рефлекса: 1) дождаться окончания действия миорелаксантов; 2) ввести антидот; 3) не использовать миорелаксанты вообще. В клинической практике чаще всего применяют рокурония бромид (Эсмерон) – быстродействующий, средней продолжительности действия не деполяризующий миорелаксант, который не подвержен элиминации Хоффмана. Продолжительность эффективной блокады Эсмероном составляет 20 минут и дождаться окончания действия миорелаксантов не всегда представляется возможным ввиду короткого времени операции (30 минут от разреза до ушивания) и высокой встречаемости холинэстеразной недостаточности у наших пациентов. Для реверсии нейромышечной блокады необходимо ввести сугаммадекс натрия (Брайдан) или провести декураризацию прозерином. Брайдан есть не во всех клиниках, и рутинное использование этого препарата существенно повышает стоимость анестезии. Про побочные эффекты прозерина сказано достаточно [7], чтобы не использовать его без острой необходимости. Принимая решение о проведении больному местной или общей анестезии, обычно ориентируются на возраст, способность пациента контактировать с врачом, адекватно выполнять инструкции, а также на предполагаемую длительность и возможные осложнения при проведении оперативного вмешательства [8]. Среди преимуществ местной анестезии, кроме значимого снижения стоимости лечения и сохранения возможности контактировать с больным, необходимо отметить, что опросы самих пациентов свидетельствуют о существенном преобладании среди них тех, кто предпочитает проведение оперативных вмешательств в области среднего уха под местной анестезией (73 и 89%). Наш опыт свидетельствует и о возможности расширить показания для КИ при использовании местной анестезии у пациентов с высоким анестезиологическим риском проведения общей анестезии (пожилой возраст с тяжелым течением сопутствующих заболеваний).
Несмотря на перечисленные преимущества, местная анестезия без адекватной седации пациента может сопровождаться непреднамеренными движениями, что наиболее опасно во время микрохирургического этапа оперативного вмешательства. Выбор седативного препарата (или сочетание нескольких) и его доза крайне важны, учитывая необходимость сохранения спонтанного дыхания и контролируемые параметры гемодинамики у пациента. Среди современных лекарственных препаратов данные фармакологические свойства присущи дексмедетомидину – высокоселективному агонисту α2-адренорецепторов, область применения которого в основном связана с седацией больных в отделениях интенсивной терапии [9]. Обладая дозозависимыми седативным и симпатолитическим действиями, а также способностью проявлять обезболивающие и анксиолитические свойства, данный препарат нашел свое применение среди специфических подгрупп хирургических больных и в анестезиологии. M.A. Ramsay, D.L. Luterman (2004) продемонстрировали обезболивающий эффект дексмедетомидина (монотерапия) у нескольких пациентов с нарушениями дыхания различной этиологии. Для проведения витреоретинальных операций, интубации, краниотомии у пациентов с сохраненным сознанием также используют данный препарат [10]. В исследовании M. Durmus и соавт. парентеральное применение дексмедетомидина в качестве адъювантной терапии способствовало стабилизации гемодинамики, снижению интраоперационных кровотечений и потребности в обезболивании в послеоперационном периоде у пациентов после рино-, септо-, тимпанопластики [11].
Дексмедетомидин является относительно новым из препаратов, используемых для седации в практике анестезиологии и реанимации. Впервые он был зарегистрирован в США под маркой Precedex (“HospiraInc”, США) еще в 1999 г., в 2012 г. на отечественном рынке появился под маркой Дексдор® (OrionPharma, Финляндия) [12]. Действующее вещество Дексдора – дексмедетомидин – препарат из группы α2–адреномиметиков, которые давно заняли особое место в арсенале анестезиологов-реаниматологов. Данная группа препаратов обладает комплексным действием, изменяя параметры функционирования множества органов и систем. Дексмедетомидин обладает значительно большей селективностью по отношению к α2-адренорецепторам, с соотношением сродства α2:α1 равным 1600:1. Его фармакокинетика характеризуется сравнительно быстрым распределением (t1/2α=6 минут) и периодом полувыведения (t1/2 примерно 2 часа против 9–12 часов у клонидина) [13].
Влияние на центральную нервную систему дексмедетомидина, как уже отмечалось выше, в первую очередь связано со стимуляцией α2-адренорецепторов. Исследователи подчеркивают, что воздействие дексмедетомидина максимально точно соответствует естественному механизму сна человека, что определяет своеобразную, отличную от прочих анестетиков картину вызываемой этим препаратом седации. Гемодинамический эффект дексмедетомидина носит двухфазный характер. Использование дексмедетомидина в терапевтических дозах (в форме инфузии) приводит к снижению систолического и диастолического артериального давления (АД) [14], при этом показатели центрального венозного давления и расчетное сосудистое сопротивление не изменяются. Однако при резком увеличении концентрации дексмедетомидина в крови (например, в результате болюсного введения) или при инфузии с высокой скоростью, напротив, наблюдается повышение АД, объясняемое преимущественным воздействием препарата не на центральные, а на периферические адренорецепторы в сосудах. При этом дексмедетомидин вызывает развитие дозозависимой брадикардии. Следует, однако, подчеркнуть, что в терапевтических дозах при отсутствии тяжелой сопутствующей сердечно-сосудистой патологии снижение АД не превышает 10–15%, а брадикардия не достигает клинически значимых значений ниже 50 ударов в 1 минуту. В связи с этим большинство специалистов характеризуют гемодинамические эффекты дексмедетомидина скорее как стабилизацию гемодинамики, связанную с подавлением активности симпатической системы. Можно даже говорить о потенциальном кардиопротекторном эффекте дексмедетомидина для пациентов с сердечно-сосудистой патологией, учитывая, что периоперационный стресс и связанные с ним тахикардия и гипертензия представляют большую опасность для больных данной категории [15]. Большинство современных анестезиологических препаратов приводит к дозозависимому подавлению дыхания. Принципиально иной механизм седативного действия дексмедетомидина, ассоциированный с адренергическим путем активации коры, объясняет отсутствие такого эффекта при его введении [15].
Цель работы: определить эффективность применения малоинвазивной анестезиологической тактики при проведении КИ.
Материал и методы
В период с января по сентябрь 2019 г. на базе ФМБА НКЦ оториноларингологии были прооперированы 10 пациентов под местной анестезией в возрасте от 30 до 58 лет с применением дексмедетомидина (табл. 1). Критерием отбора было отсутствие кохлеовестибулярной патологии (аномалии развития внутреннего уха и оссификации лабиринта). Также особенностью отбора больных на КИ являлось то, что пациенты имели те или иные сопутствующие заболевания (табл. 2).
В предоперационном периоде проводилась беседа с пациентами для ознакомления с каждым этапом операции, возможными осложнениями. Предоперационная подготовка была проведена в соответствии с сопутствующими заболеваниями.
Были имплантированы устройства 4 фирм-производителей, доступные в России, с прямым или перимодиолярным типом активного электрода.
Операции во всех случаях были проведены по классической методике КИ, включающей заушный С-образный разрез, подготовку ложа для имплантата, антромастоидотомию, заднюю тимпанотомию. Введение активного электрода производили через окно улитки. После установки импланта выполняли телеметрию и визуальную регистрацию порогов акустических рефлексов сухожилия стременной мышцы. В нашей практике в качестве анестезиологического пособия проводилась местная анестезия дексмедетомидином, который за 15 минут до начала КИ вводили парентерально в дозе 0,6–0,7 мкг/кг/час. В процессе оперативного вмешательства для адекватного потенцирования местной анестезии дозировка составляла 0,9–1,0 мкг/кг/час. Для контакта с пациентом и информирования его о ходе операции мы использовали заранее заготовленные таблички с надписями, обозначающими либо вопросы, либо предупреждение пациента о тех или иных действиях хирурга. Для удобства пациенту во время операции нужно было лишь читать информацию с табличек, а в случаях вопросов аккуратно кивать головой или произносить «Да» или «Нет». Для примера надписи на табличках: «Сейчас Вам сделают несколько уколов в заушную область», «Вам больно?», «Сейчас будете ощущать вибрацию от работы бор-машины, больно не будет, сохраняйте спокойствие» и т.д.
Результаты исследования и их обсуждение
Во всех 10 случаях пациентам с сопутствующими заболеваниями была выполнена КИ под местной анестезией sol. Ultracaini – 8,0 с применением дексмедетомидина, что позволило избежать введения миорелаксантов. Операцию проводили стандартно под контролем операционного микроскопа OMPI Sensera S7 Karl Zeiss. После парентерального введения препарата эффект достигался достаточно быстро, на фоне введения препарата АД не достигало высоких цифр, усугубления сопутствующих заболеваний не отмечалось, пациенты чувствовали себя удовлетворительно, реагировали на все знаки, отвечали на вопросы, читая с таблиц. Ни в одном из случаев пациенты не чувствовали боли при разрезе, отсепаровке мягких тканей, работе бор-машиной, введении электродной решетки кохлеарного импланта и его последующем тестировании. С помощью таблиц для беседы все пациенты получали информацию о каждом этапе операции и последующих действиях хирургической бригады и аудиологов.
Как видно из табл. 3, на всех этапах операции пациенты не испытывали каких-либо болевых ощущений за исключением незначительного головокружения и дискомфорта во время вскрытия вторичной мембраны окна улитки, введения электродной решетки в тимпанальную лестницу и тестирования импланта. Большинство пациентов при этом находились в состоянии неглубокого сна, периодически просыпаясь только при необходимости информирования их о ходе операции.
Проведение КИ под местной анестезией позволяет получить четкие пороги регистрации акустических рефлексов (исключено действие миорелаксантов) сухожилия стременной мышцы и в среднем занимает 18±5,2 минуты с учетом времени анестезии, что на 15±5,3 минуты меньше, чем в случаях интубации трахеи с применением миорелаксантов.
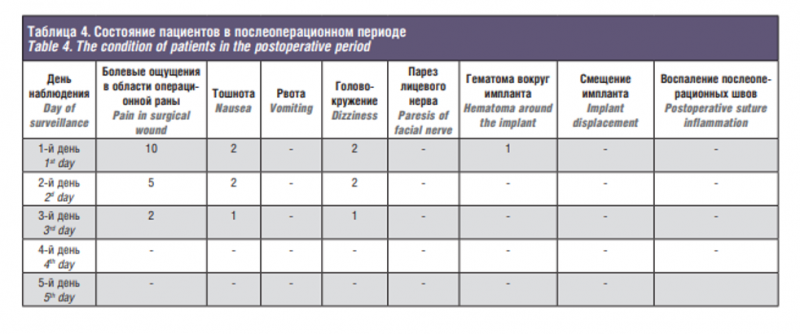
К преимуществам местной анестезии с применением дексмедетомидина можно отнести меньшую инвазивность процедуры, возможность не использовать миорелаксанты, экономить средства, сохранять сознание пациента (не требуется интубации трахеи), что дает возможность интраоперационно проводить диагностику импланта и оценивать ощущения слухового восприятия пациента при подаче сигналов; определять наличие или отсутствие патологической стимуляции лицевого нерва; сократить время операции, перевести пациента в палату (режим общий); кроме того, в раннем послеоперационном периоде отсутствуют тошнота и рвота, больной может самостоятельно продолжить применение (при сопутствующих заболеваниях) препаратов по схеме; быстро восстанавливается общее состояние больного и сокращается срок послеоперационного периода, а, самое главное, отсутствуют интра- и послеоперационныех осложнения, связанные с анестезией. В остальном (заживление раны, результаты слухоречевой реабилитации) в послеоперационном периоде у пациентов по сравнению с пациентами с другими видами анестезии различий не было. Любой метод анестезии имеет свои преимущества и недостатки, показания и противопоказания. Местная анестезия не является исключением. Как видно из табл. 4, состояние пациентов после проведенного хирургического лечения под местной анестезией с применением препарата Дексдор не отличался от такового у пациентов, прооперированных в условиях общей анестезии. Болевой синдром в области послеоперационной раны имел умеренный характер, чаще всего в первые сутки после операции и купировался при применении стандартных анальгетиков до полной отмены на 3-и сутки. Всего 2 пациентов беспокоили незначительная тошнота и головокружение, которые прошли самостоятельно без медикаментозной терапии на 3-и сутки. Во всех случаях отсутствовали какие-либо нарушения функции лицевого нерва и признаки смещения тела импланта и образования поднадкостничной гематомы вокруг импланта.
Также следует отметить, что ни в одном из случаев после проведенной КИ под местной анестезией с применением препарата Дексдор в послеоперационном периоде не было осложнений сопутствующей соматической патологии. По данным анкетирования, проводимого после операции, ни у одного из оперированных пациентов не возникало каких-либо сложностей в послеоперационном периоде.
Заключение
Применение малоинвазивной анестезиологической тактики (при отсутствии патологии кохлеовестибулярной системы) позволяет исключить интра- и послеоперационные осложнения, сократить время проведения КИ, снизить объем вводимых анестезиологических препаратов, обеспечить качественное интраоперационное тестирование импланта, сократить сроки послеоперационного пребывания пациента. Использование Дексдора при местной анестезии является методом выбора при наличии у пациентов противопоказаний к общему наркозу и интубации трахеи.
ЛИТЕРАТУРА
- Дайхес Н.А., Диаб Х.М., Пащинина О.А., Кондратчиков Д.С., Юсифов К.Д., Умаров П.У., Сираева А.Р. Сложные случаи кохлеарной имплантации. Альманах клин. Медицины. 2016;44(7):821–27.
- Marshall A.H., Fanning N., Symons S., Shipp D., Chen J.M., Nedzelski J.M. Cochlear implantation in cochlear otosclerosis. Laryngoscope. 2005;115:1728–33.
- Hamerschmidt R., Mocellin M., Gasperin A., Faria J., Trevizan G., Wiemes G. Local anesthesia for cochlear implant surgery: a possible alternative. Braz. J. Otorhinolaryngol. 2010;76 (5):561–4.
- Диаб Х.М., Дайхес Н.А., Юсифов К.Д., Пащинина О.А. Случаи осложнений кохлеарной имплантации. Рос. оториноларингология. 2017;6 (91):21–27.
- Hamerschmidt R., Mocellin M., Gasperin A., Faria J., Trevizan G., Wiemes G. Local anesthesia for cochlear implant surgery: a possible alternative. Braz. J. Otorhinolaryngol. 2010;76 (5):561–64.
- Рязанов В.Б., Диаб Х.М., Дайхес Н.А., Вайнштейн Д.П., Вайнштейн А.И., Кондратчиков Д.С., Сираева А.Р., Пащинина О.А. Особенности анестезиологического пособия при операции кохлеарной имплантации впедиатрии. Анестезиология и реаниматология. 2016;61(4):272–74.
- Hermite L., Louvier N., Hilaire P., Orry D., Seltzer S., Collet E. Neostigmine induced anaphylaxis in the wake of surgery. Anaesth. Care Pain Med. 2015;34(2):109–11.
- Liang S., Irwin M.G. Review of anesthesia for middle ear surgery. Anesthesiol. Clin. 2010;28:519–28.
- Keating G.M. Dexmedetomidine: A Review of Its Use for Sedation in the Intensive Care Setting. Drugs. 2015;75(10):1119–30.
- Davy A., Fessler J., Fischler M., Guen M. Dexmedetomidine and general anesthesia: a narrative literature review of its major indications for use in adults undergoing non-cardiac surgery. Minerva Anestesiol. 2017;83(12):1294–308.
- Durmus M., But A.K., Dogan Z., et al. Effect of dexmedetomidine on bleeding during tympanoplasty or Septorhinoplasty. Eur. J. Anaesthesiol. 2007;24(5):447–53.
- Дексдор: Инструкция по применению. Orion Pharma. 2012.
- Miller R.D. Miller’s anesthesia. Philadelphia, PA: Churchill Livingstone. El. sevier. 2010.
- Frol ich M.A., Arabshahi A., Katholi C., et al. Hemodynamic characteristics of midazolam, propofol, and dexmedetomidine in healthy volunteers. J. Clin. Anesth. 2011;23:218–23.
- Ebert T., Maze M. Dexmedetomidine: another arrow for the clinicians quiver.
Anesthesiol. 2004;101:568–70. Поступила 04.09.19 Принята в печать 29.11.19
REFERENCES
- Daikhes N.A., Diab H.M., Pashchinina O.A., Kondratchikov D.S., Yusifov K.D., Umarov P.U., Siraeva A.R. Complex cases of cochlear implantation. Almanach clinicheskoi mediciniy. 2016; 44 (7): 821–7 (In Russ.).
- Marshall A.H., Fanning N., Symons S., Shipp D., Chen J.M., Nedzelski J.M. Cochlear implantation in cochlear otosclerosis. Laryngoscope. 2005;115:1728– 33.
- Hamerschmidt R., Mocellin M., Gasperin A., Faria J., Trevizan G., Wiemes G. Local anesthesia for cochlear implant surgery: a possible alternative. Braz. J. Otorhinolaryngol. 2010;76 (5):561–4.
- Diab H.M., Daikhes N.A., Yusifov K.D., Pashchinina O.A. Cases of complications of cochlear implantation. Rossijskaya otorhinolaryngologya. 2017; 6 (91): 21–7 (In Russ.).
- Hamerschmidt R., Mocellin M., Gasperin A., Faria J., Trevizan G., Wiemes G. Local anesthesia for cochlear implant surgery: a possible alternative. Braz. J. Otorhinolaryngol. 2010;76 (5):561–4.
- Ryazanov V.B., Diab H.M., Daikhes N.A., Weinstein D.P., Weinstein A.I., Kondratchikov D.S., Siraeva A.R., Pashchinina O.A. Features of anesthesia application in cochlear implant surgery in pediatrics. Anesthesiologya i reanimatologya. 2016;61(4):272–4 (In Russ.).
- Hermite L., Louvier N., Hilaire P., Orry D., Seltzer S., Collet E. Neostigmine induced anaphylaxis in the wake of surgery. Anaesth. Care Pain Med. 2015;34(2):109–11.
- Liang S., Irwin M.G. Review of anesthesia for middle ear surgery. Anesthesiol. Clin. 2010;28:519–28.
- Keating G.M. Dexmedetomidine: A Review of Its Use for Sedation in the Intensive Care Setting. Drugs. 2015;75(10):1119–30.
- Davy A., Fessler J., Fischler M., Guen M. Dexmedetomidine and general anesthesia: a narrative literature review of its major indications for use in adults undergoing non-cardiac surgery. Minerva Anestesiol. 2017;83(12):1294–308.
- Durmus M., But A.K., Dogan Z., et al. Effect of dexmedetomidine on bleeding during tympanoplasty or Septorhinoplasty. Eur. J. Anaesthesiol. 2007;24(5):447–53.
- Dexdor: Instructions for use. Orion Pharma. 2012 (In Russ.).
- Miller R.D. Miller’s anesthesia. Philadelphia, PA: Churchill Livingstone. El. sevier. 2010.
- Frol ich M.A., Arabshahi A., Katholi C., et al. Hemodynamic characteristics of midazolam, propofol, and dexmedetomidine in healthy volunteers. J. Clin. Anesth. 2011;23:218–23
. 15. Ebert T., Maze M. Dexmedetomidine: another arrow for the clinicians quiver. Anesthesiol. 2004;101:568–70. Received 04.09.19 Accepted 29.11.19
Информация об авторах:
Х.М.А. Диаб – д.м.н., гл. научный сотрудник, руководитель научноклинического отдела заболеваний уха ФГБУ НКЦО ФМБА России, Москва, Россия; e-mail: Hasandiab@mail.ru. https://orcid.org/0000-0001- 5337-3239
Н.А. Дайхес – член-корр. РАН, д.м.н., профессор, директор Научноклинического центра оториноларингологии Федерального медикобиологического агентства России, Москва, Россия; e-mail: admin@otolar.ru В.Б. Рязанов – руководитель научно-клинического отдела нестезиологии и реанимации ФГБУ НКЦО ФМБА России, Москва, Россия; e-mail: Ryazanov@mail.ru
А.А. Каибов – соискатель отдела заболеваний уха ФГБУ НКЦО ФМБА России, Москва, Россия; e-mail: Kaibov2989@mail.ru
О.А. Пащинина – к.м.н., заведующая отделением научно-клинического отдела заболеваний уха ФГБУ НКЦО ФМБА России, Москва, Россия; e-mail: Olga83@mail.ru
А.Е. Михалевич – младший научный сотрудник научно-клинического отдела заболеваний уха ФГБУ НКЦ оториноларингологии ФМБА России, Москва, Россия; e-mail: MikhalevichAE@mail.ru
Information about the authors:
Kh.M.A. Diab – Doctor of Medicine, Chief Researcher, Head of the Scientific and Clinical Department of Ear Diseases, FSBI SCCO FMBA of Russia, Moscow, Russia; e-mail: Hasandiab@mail.ru. https://orcid.org/0000-0001- 5337-3239
N.A. Daikhes – Corresponding Member RAS, Doctor of Medicine, professor, director of the Scientific and Clinical Center of Otorhinolaryngology, Federal Medical and Biological Agency of Russia, Moscow, Russia; e-mail: admin@ otolar.ru
V.B. Ryazanov – Head of the Scientific and Clinical Department of Anesthesiology and Intensive Care, FSBI NCCO FMBA Russia, Moscow, Russia e-mail: Ryazanov@mail.ru
A.A. Kaibov – applicant in the Department of Ear Diseases, FSBI NCCO FMBA of Russia, Moscow, Russia; e-mail: Kaibov2989@mail.ru
O.A. Pashchinina – PhD in Medicine, Head of the Department of the Scientific and Clinical Department of Ear Diseases FSBI NCCO FMBA of Russia, Moscow, Russia; e-mail: Olga83@mail.ru
A.E. Mikhalevich – Junior Researcher, Scientific and Clinical Department of Ear Diseases, FSBI NCC of Otorhinolaryngology, FMBA of Russia, Moscow, Russia; e-mail: MikhalevichAE@mail.ru