Для цитирования: Вербо Е.В., Крайтор А.С. Концепция патогенеза остеорадионекроза челюстей. Голова и шея Head and neck Russian Journal. 2018;6(1):65–70
For citations: Verbo E.V., Kraitor A.S. Osteoradionecrosis of jaws: pathogenesis conception. Golova I Sheya Head and neck. Russian Journal. 2018;6(1):65–70 (in Russian).
Представлен детальный анализ мировых литературных данных, охватывающих почти столетнюю историю изучения остеорадионекроза челюстей. Собраны и систематизированы стадии развития этого коварного процесса, а также определены этапы более глубокого понимания его патогенеза. Согласно теории радиационно-индуцированного фиброза, ключевым событием в прогрессии остеорадионекроза является активация и дисрегуляция фибробластической активности, что приводит к атрофическим явлениям в тканях в ранее облученной области. Разрушение эндотелиальных клеток в сочетании с тромбозом сосудов является причиной некроза микрососудов, местной ишемии и потери ткани. Разрушение естественного клеточного барьера приводит к просачиванию различных цитокинов, которые превращают фибробласты в миофибробласты. Опосредованное активными формами кислорода высвобождение цитокинов приводит к нерегулируемой фибробластической активации и разрастанию миофибробластического фенотипа. В конечном счете, миофибробласты подвергаются апоптозу, и даже через десятилетия после лучевой терапии кость остается с небольшим числом костных клеток, плохо васкуляризированной и фиброзной. Таким образом, только привнесение нового источника адекватного кровоснабжения из отдаленных участков к ранее облученной области способно остановить патологический процесс и создать условия для оптимальной социальной адаптации.
Ключевые слова: остеорадионекроз, этапы развития, микрохирургическая аутотрансплантация тканей.
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Вербо Е.В., Крайтор А.С. Концепция патогенеза остеорадионекроза челюстей. Голова и шея Head and neck Russian Journal. 2018;6(1):65–70
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
A detailed analysis of the world literature data, covering almost a hundred-year history of studying the osteoradionecrosis of the jaws, is presented in the article. The stages of this insidious process development are described and systematized for deeper understanding of its pathogenesis. According to the theory of radiationinduced fibrosis, the key event in the progression of osteoradionecrosis is the activation and dysregulation of fibroblastic activity, which leads to tissue atrophy in the previously irradiated region. The destruction of endothelial cells in combination with vascular thrombosis causes necrosis of microvessels, local ischemia and tissue loss. Destruction of the natural cell barrier leads to various cytokines leakage that turn fibroblasts into myofibroblasts. The release of cytokines mediated by active oxygen forms leads to unregulated fibroblastic activation and the myofibroblastic proliferation. Ultimately, myofibroblasts undergo apoptosis, and even decades after radiotherapy only a small number of bone cells remain poorly vascularized and fibrotic. Thus, only a new source of adequate blood supply from remote areas to the previously irradiated area can stop the pathological process and create conditions for optimal social adaptation.
Key words: osteoradionecrosis, stages of development, microsurgical autotransplantation of tissues.
Authors declare no conflict of interests for this article.
Source of financing. Unspecified.
For citations: Verbo E.V., Kraitor A.S. Osteoradionecrosis of jaws: pathogenesis conception. Golova I Sheya Head and neck. Russian Journal. 2018;6(1):65–70 (in Russian).
The authors are responsible for the originality of the presented data and the possibility of publishing illustrative material – tables, drawings, photographs of patients.
Злокачественные опухоли челюстно-лицевой области занимают третье место в структуре всех онкологических заболеваний, причем частота их неуклонно растет [1]. Наряду с хирургией, неотъемлемой частью комбинированного лечения злокачественных новообразований челюстно-лицевой области является лучевая терапия. Остеорадионкроз (ОРН) нижней челюсти (НЧ) является серьезным осложнением, возникающим после лучевой терапии как с хирургическим вмешательством, так и без него [22].
Частота распространенности ОРН варьируется в широких пределах: от <1 до 30%, более часто встречается в интервале 5–15%. В НЧ вероятность его локализации составляет от 2 до 22%, чаще поражается тело НЧ [25]. Верхняя челюсть или какие-либо другие кости головы и шеи поражаются остеорадионекротическим процессом гораздо реже [24]. ОРН лицевого скелета вызывают тяжелые страдания больных и сопровождаются нарушением жизненно важных функций, таких как жевание, глотание, артикуляция, мимика, что приводит к быстрой социальной дезадаптации. С. Regaud в 1922 г. впервые отметил высокую склонность НЧ к развитию некроза и инфекционных осложнений при облучении злокачественных опухолей внутриротовой локализации [11]. Он также отметил, что ОРН челюстей отличается от обычного остеомиелита тем, что при радионекрозе отсутствует демаркационная линия между распадающейся и здоровой костной тканью
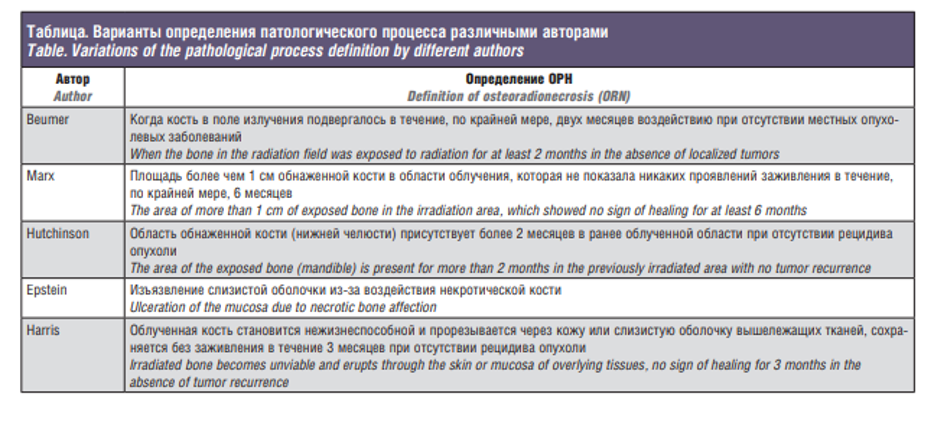
За 95-летний период изучения ОРН понятно, что он является сложной клинической проблемой, требующей многогранных исследований. В начале этапа исследований различные авторы (Beumer, Marx, Hutchinson, Epstein, Harris) давали определения остеонекроза, базирующегося на описании клинических симптомов, не принимая во внимание патогенетические основы данного процесса (см. таблицу). В одной из своих многочисленных работ, посвященных исследованиям онкологической патологии, J. Ewing высказал предположение, что ионизирующее облучение напрямую убивает костные клетки. Высокочувствительная к радиации надкостница при этом утолщается. Развиваются расстройства микроциркуляции, что приводит к затуханию клеточной активности (как остеобластов, так и остеокластов). начительный вклад в изучение проблемы ОРН внес W.D. McCrorie в 1950 г., предположивший, что пострадиационный остеопороз является следствием того, что функция более чувствительных к облучению остеобластов подавляется в большей степени, нежели функция остеокластов.
Факторы, которые определяют или повышают риск развития ОРН, включают размер и место опухоли, дозы радиации и тип нижнечелюстной резекции, травмы или удаления зубов, инфекции, иммунодефициты, недостаточное питание. У многих пациентов с раком ротовой полости есть и другие серьезные заболевания, также они часто злоупотребляют алкоголем _ и табакокурением, что в сочетании с плохим питанием и неудовлетворительной гигиеной полости рта является высоким риском развития ОРН [17].
В результате поражения мягких тканей нередко возникает сквозной дефект с формированием оростомы. Это состояние причиняет страдания больным, поскольку резко изменяет конфигурацию лица вплоть до тяжелых уродств, нарушает жизненно важные функции, такие как глотание, жевание, артикуляцию [4]. Однако зона поражения тканей гораздо шире, чем размеры самого дефекта, поскольку смежные с ним ткани находятся в состоянии ишемии и нарушения метаболизма. В этом заключается сложность диагностики, поскольку клинические проявления возникают только на поздних и терминальных стадиях заболевания.
Данная проблема не утеряла своей актуальности во всем мире, поскольку до сих пор остаются открытыми вопросы патогенеза, диагностики и лечения этой сложной и многокомпонентной патологии.
Цель исследования: определение современного понимания патогенетических механизмов, лежащих в основе ОРН челюстей.
Материал и методы
Были изучены литературные данные по всем вопросам, освещающим ОРН костей лицевого скелета, его патофизиологию и патогенез, охватывающие период с 1922 г. по настоящее время.
Результаты исследования и их обсуждение
В течение последних 95 лет было предложено несколько теорий, объясняющих причину возникновения ОРН, включая высвобождение гистамина, теорию излучения, травмы и инфекции [6], наиболее широко распространенную теорию гипоксии, гиповаскуляризации и гипоклеллюлярности [8]. Как только ОРН распознается, он необратим и трудно поддается лечению.
Радиационно-индуцированный фиброз [16] представляет собой неизбежное и необратимое повреждение костной и мягких тканей, которое может длиться годами после радиотерапии. Это динамический процесс с участием различных цитокинов, взаимодействующих с их рецепторами и внеклеточным матриксом (ECM) [18– 20]. Радиационно-индуцированные морфологические изменения классифицировались в зависимости от сроков их возникновения при остром и хроническом токсическом поражении, включая неспецифическое воспаление и поздний фиброз [21].
В результате радиоиндуцированного повреждения в ткани возникает метаболический дефицит и нехватка факторов гомеостаза [9]. Изначально ОРН НЧ определяли как обнажение облученной костной ткани, незаживающее в течение 3 месяцев и более при отсутствии местнораспространенной опухоли (Marx R.). J.M. Balogh в 1989 г. предположил следующую последовательность патологических процессов, протекающих в ткани под воздействием радиации: облучение – гипоцеллюлярнаягиповаскулярная ткань, тканевая гипоксия – распад ткани – хроническая незаживающая рана [9].
Большинство авторов соглашаются с тем, что ОРН – полиэтиологическое заболевание, в развитии которого играет роль не только высокоинтенсивное ионизирующее излучение, но также травматическое повреждение нижней челюсти и инфекционные агенты. Из-за своей изогнутой формы, компактного строения и наличия лишь одной питающей артерии с каждой стороны, НЧ в большей степени подвержена отрицательным эффектам радиотерапии, чем любая другая кость черепнолицевой области [50]. Чаще всего ОРН НЧ развивается после облучения опухолей, локализующихся в ротовой полости, верхних отделах дыхательного и пищеварительного трактов, а также карцином самой челюсти, при которых эффективная доза облучения вызывает деструкцию костной ткани [1].
- I. Meyer в 1970 г. предложил свою радиационную, травматическую и инфекционную теорию [6]. Другие авторы согласились и называют ОРН вторичной инфекцией после травмы нежизнеспособной кости и даже радиационно-индуцированным остеомиелитом. Теория Meyer развивалась в течение десяти лет и стала основой для популяризации использования антибиотиков при хирургических операциях для лечения ОРН.
После углубленного исследования гипотезы Meyer Marx в 1983 г. предложил гипоксическо-гипоцеллюлярно-гиповаскулярную теорию как новый путь понимания патофизиологии ОРН. Он отметил, что не было никаких травм перед началом ОРН в 35% случаев, и обнаружил, что микробиологический профиль ОРН отличался от остеонекроза трубчатых костей. Микробиологическое исследование пострадавших от ОРН лицевых костей показало наличие разнообразных микробов на их поверхности, которые, возможно, были причиной инфицирования. Это резко контрастирует с данными, полученными при изучении остеомиелита трубчатых костей, при котором определяли один патогенный микроб, обычно это был стафилококк. Он также обнаружил, что структура облученных тканей была более гипоксическая, чем тех костей, которые не были облучены. Патофизиологическая последовательность, предложенная Marx: облучение – формирование гипоксическогипоцеллюлярно-гиповаскулярной ткани – разрушение ткани (клеточная смерть и распад коллагена, который превышает клеточную репликацию и синтез) на основании постоянной гипоксии, что может обусловить развитие хронически незаживающей раны (в которой метаболические требования превышают поставку). Эти объяснения сформировали краеугольный камень для использования гипербарической оксигенации в лечении ОРН [7, 49, 51, 52].
По своему строению кости лицевого скелета являются компактными, содержание в них минеральных веществ выше, чем в губчатых, поэтому выше и поглощенная доза ионизирующего излучения при лучевой терапии [13]. Ветви и мыщелковые отростки НЧ относительно устойчивы к развитию лучевых повреждений, тогда как тело и подбородочный отдел, кровоснабжаемые, главным образом, нижней альвеолярной артерией, более восприимчивы к лучевой ишемии, нежели другие кости лицевого скелета (J.M. Balogh, R.E. Marx). У пациентов с внутриротовой локализацией злокачественной опухоли обычно страдает гигиена полости рта, а также снижается неспецифическая резистентность к инфекциям. Все эти факторы делают НЧ восприимчивой к развитию ОРН после лучевой терапии (E. Santamaria, S.P. Hao). Предшествующее лучевой терапии хирургическое вмешательство на НЧ – дополнительный фактор риска для развития ОРН (Naci Celik). Сама по себе костная ткань является маловосприимчивой к лучевым поражениям, поэтому этиологическим фактором развития ОРН является лучевое поражение питающих кость сосудов. В результате лучевого воздействия происходит денатурация белка сосудистой стенки, возникает набухание, вакуолизация, а затем разрушение эндотелиальных клеток.
Различные компоненты кости имеют разные степени чувствительности к облучению. Минеральная кость, минерализованные компоненты кости не считаются радиочувствительными. Неминерализованные элементы, такие как хрящевая пластинка в растущих костях, клетки костного мозга и остеогенные клетки, являются радиочувствительными [28]. При высоких дозах облучения большинство хрящевых клеток разрушается, а пластинка заменяется твердым образованием, неспособным к росту. Кроме того, при значительной способности к регенерации клеток, костный мозг обладает высокой радиочувствительностью. Опубликованы сообщения о раннем депрессивном воздействии локального внешнего излучения на костный мозг [29], которое уменьшает число гемопоэтических стволовых клеток [30] и индуцирует апоптоз в этих линиях. Это необратимо влияет на местные микрососуды, а затем приводит к ишемии в очагах поражения.
Наиболее чувствительны к радиационным поражениям сосуды микроциркуляторного русла, в которых быстро наступает тромбоз и кровоизлияния в сосудистую стенку. На поздних стадиях (после 60 суток) развивается гиперплазия клеток внутренней оболочки сосудов, гиалиноз ее коллагеновой части. В артериолах и мелких артериях такие нарушения сопровождаются резким сужением просвета и даже полной облитерацией сосуда [2].
Оставшаяся без кровоснабжения кость претерпевает изменения, характерные для ишемического костного некроза. В первую очередь поражаются костные балки, между которыми расположены пустые лакуны, окруженные некротизированными жировыми клетками. Корковый слой обычно не страдает, поскольку используются возможности коллатерального кровотока [3]. Особенностью радиационного поражения кости является невозможность неоостеогенеза, связанная с облитерацией сосудов.
Сложность ОРН лица обусловлена поражением не только кости, но и мягких тканей как наружной, так и внутренней выстилки. Поражение мягких тканей протекает по тем же законам. На клеточном уровне это выглядит следующим образом. После облучения тканей наблюдается раздвоение базальной мембраны капилляров; их просвет эктатически расширяется, в эндотелиальных клетках увеличивается содержание цитоплазмы и микропиноцитом. Часто становится видимым промежуток между эндотелиальными клетками и перицитами. В адипоцитах наблюдается скопление лизосом и групп митохондрий.
В соединительной ткани происходит накопление коллагена и «клеточного мусора», состоящего из обрывков клеточных мембран с фрагментами наружной цитоплазматической клеточной оболочки, предположительно принадлежавшей разрушенным адипоцитам. Все это позволяет говорить об ишемической природе лучевых повреждений, похожих по своему механизму на склеродермию [5]. Несмотря на то что изменения могут обнаруживаться в цитоплазме, основной мишенью является ядро клетки. При высокой дозе облучения ядро набухает, а хроматин агригируется, затем оно приобретает причудливые формы и в итоге наступает кариопикноз и кариорексис. Происходит гибель клетки. Таким образом, ОРН можно охарактеризовать как процесс деваскуляризации и гибели костной ткани вместе с окружающими тканями лица в результате облучения.
Радиация индуцирует изменения не только в остеогенном, но и в воспалительном процессе. Обычная воспалительная реакция в процессе заживления индуцирует дифференцировку фибробластов в миофибробласты, которые имеют сократительные, секреторные и макрофагальные свойства [28, 33]. Во время нормального заживления ран миофибробластический фенотип является временным. После облучения миофибробласты появляются к начальной воспалительной фазе и сохраняются до фиброзной фазы. Они увеличивают секрецию внеклеточного матрикса и накопление антиколлагеназы, а также снижают экскрецию металлопротеиназы [32].
Радиационный фиброз является новой теорией, которая объясняет повреждение нормальных тканей, в т.ч. кости, после лучевой терапии. Она была введена в 2004 г., когда последние достижения в области клеточной и молекулярной биологии объяснили прогрессирование микроскопических нарушений при ОРН. Гистопатологические фазы развития ОРН точно отражают изменения, определяемые при хроническом заживлении травматических ран. Различают три различных фазы:
- начальная префибротическая фаза, в которой изменения наблюдаются преимущественно в эндотелиальных клетках, вместе с острой воспалительной реакцией;
- организационная фаза, в которой преобладает ненормальная фибробластическая активность и есть явления дезорганизации внеклеточного матрикса;
- поздняя фиброатрофическая фаза, когда попытки ремоделирования ткани происходят с образованием хрупких излеченных тканей, которые несут серьезный и неотъемлемый риск поздней реактивировации воспаления в случае локальной травмы.
Интересно отметить, что Marx пришел к аналогичным выводам, но считал, что движущей силой последовательности событий является стойкая гипоксия тканей.
Теория радиационно-индуцированного фиброза утверждает, что ключевым событием в прогрессии ОРН является активация и дисрегуляция фибробластической активности, что приводит к атрофическим явлениям в тканях ранее облученной области. После лучевой терапии эндотелиальные клетки получают травму как в результате прямого повреждения излучением, так и от косвенного ущерба, причиняемого радиационно генерированными активными формами кислорода или свободными радикалами. Поврежденные эндотелиальные клетки производят хемотаксические цитокины, которые вызывают острую воспалительную реакцию, а затем обусловливают дальнейшее высвобождение активных форм кислорода из полиморфов и других фагоцитов. Разрушение эндотелиальных клеток в сочетании с тромбозом сосудов приводит к некрозу микрососудов, местной ишемии и потере ткани. Потеря естественного клеточного барьера приводит к просачиванию различных цитокинов, которые превращают фибробласты в миофибробласты.
Опосредованное активными формами кислорода высвобождение цитокинов, таких как фактор некроза опухоли a (TNF-a), тромбоцитарный фактор роста, фактор роста фибробластов, интерлейкины 1 (IL-1), IL-4 и IL-6, трансформирующий фактор роста 1 (TGF-1) и фактор роста соединительной ткани, приводит к нерегулируемой фибробластической активации и разрастанию миофибробластического фенотипа. Эти миофибробласты характеризуются необычно высоким уровнем пролиферации, секреции аномальных продуктов внеклеточного матрикса, а также пониженной способностью разрушать такие компоненты. Дисрегуляция пролиферации фибробластов и обмена веществ аналогичны тем, которые описаны при фиброзе легких и циррозе печени после попадании вирусов, алкоголя и двуокиси кремния. Этот процесс регулируется на нескольких уровнях, включая хемотаксис и пролиферацию фибробластов, секрецию и регуляцию метаболизма компонентов внеклеточного матрикса [34]. На молекулярном уровне S.R. Basavaraju и соавт. в 2002 г. сообщили о некоторых цитокинах и факторах роста, таких как TGF-b1 и IL-1b, которые могут стимулировать индуцированную радиацией эндотелиальную пролиферацию, пролиферацию фибробластов, осаждение коллагена и фиброз [36]. Трансформирующий фактор роста β (TGF-β) является прототипическим многофункциональным цитокином. Рецепторы к нему можно найти почти в каждой клетке тела, подверженной травме и участвующей в восстановлении тканей [37]. TGF-β взаимодействует с тремя рецепторами, а, именно, рецепторами TGF-β (TBR) I (50 кДа), II (80 кДа) и III (280 кДа), которые присутствуют на мембранах почти всех типов клеток. Сигнализация протекает по пути Smad3 [31, 38], что приводит к развитию и постоянному поддержанию фиброза, а также контролирует дифференцировку гладких клеток мышц и субэпителиальных миофибробластов, экспрессию CTGF (Connective tissue growth factor и синтез ECM – extracellular matrix) [21]. TGF-β1 индуцирует пролиферацию фибробластов путем расширения пула фибробластов-предшественников, а также преждевременную дифференциацию фибробластов – предшественников в постмитотические фиброциты, которые способны к синтезу ECM в гораздо большем количестве, чем фибробласты-предшественники [39]. TGF-β1 может увеличить и саму радиочувствительность, что когда-то описано для фибробластов, находящихся в легких [40, 41], что доказано в испытаниях на трансгенных мышах [42]. Фиброгенный потенциал TGF-β делает его главным кандидатом в качестве медиатора в развитии фиброза [43, 44]. Многие исследования показали, что некоторые лекарственные средства, например галофугинон, могут препятствовать сигнальному пути TGF-β1, таким образом, могут уменьшить индуцированный радиацией фиброз [45, 46]. Более того, A. Maeda и соавт. в 1996 г. показали, что IL-1β, высвобождаемый из макрофагов, может оказаться одним из важнейших элементов на ранней стадии воспалительных реакций [47].
НЧ, как полагают, предрасположена к развитию ОРН [26]. Это, главным образом, является результатом фиброза, что приводит к облитерации нижнеальвеолярной артерии вместе с недостаточностью лицевой артерии. Дисбаланс между синтезом и деградацией в облученной ткани особенно опасен в кости. Сочетание гибели остеобластов после облучения, выход из строя процессов остеобластообразования и чрезмерное распространение миофибробластов приводит к уменьшению костной матрицы и ее замены волокнистой тканью. Микрорадиографический анализ при ОРН предлагает 4 возможных механизма разрушения кости:
- прогрессивная резорбция остеокластов, опосредованная макрофагами, несопровождаемая остеогенезом;
- периостеоцитолиз, патогномоничный при ОРН;
- обширная деминерализация, которая является вторичной по отношению к внешним факторам, таким как слюна и бактериальные продукты;
- ускоренное старение кости.
В конечном счете, миофибробласты подвергаются апоптозу и даже через десятилетия после лучевой терапии, кость остается с небольшим числом костных клеток, плохо васкуляризированной и фиброзной. Облученные области, процесс некроза в которых прекратился, остаются хрупкими и могут быть подвергнуты резкой реактивировации воспаления после любой физико-радиохимической травмы, так что они имеют тенденцию к развитию ОРН.
Заключение
Таким образом, индуцированный излучением фиброз играет важную роль в развитии ОРН, а по мере увеличения дозы облучения влияние радиационного фиброза на ОРН увеличивается в прямо пропорциональной зависимости. Изучение этой зависимости улучшает понимание патогенеза ОРН челюстей. Применение аваскулярных трансплантатов, а также имплантатов из различных материалов считаем патогенетически противоправными методами лечения. Только привнесение тканей с полноценным кровоснабжением способно остановить некротический процесс. Регулирование и контроль патогенетических процессов может позволить управлять ОРН более эффективно, чем общепринятые методики лечения, и даже может помочь обеспечить защиту от возникновения осложнений после лучевой терапии.
ЛИТЕРАТУРА/REFERENCES
- Paches A.Yu. Tumors of the head and neck. Clinical guidelines. 2013. Пачес А.Ю. Опухоли головы и шеи. Клиническое руководство. 2013. (in Russ.).
- Paltsov M. Anatomical pathology and molecular diagnosis. Archive of pathology. 2006; 68 (4): 3–7. Пальцев М.А. Анатомическая патология и молекулярный диагноз. Архив патологии. 2006;68(4):3–7 (in Russ.).
- Lavrischeva G.I., Onoprelyenko G.A. Morphological and clinical aspects of reparative tissue regeneration. M.: Medicine, 1996. Лаврищева Г.И., Онопреленко Г.А. Морфологические и клинические аспекты репаративной регенерации тканей. М.:Медицина, 1996 (in Russ.).
- Verbo E.V. Plastic elimination of combined defects in the lower zone of the face with revascularized autografts. Diss. Cand. honey. sciences. M., 1999. P. 219. Вербо Е.В. Пластическое устранение комбинированных дефектов нижней зоны лица реваскуляризированными аутотрансплантатами. Дисс. канд. мед. наук. М., 1999. С. 219 (in Russ.).
- Rigotti G., et al. Adipose-derived mesenchymal stem cells: past, present, and future. Aesthetic. Plast. Surg. 2009;33(3):271–73. doi: 10.1007/s00266-009- 9339-7. 2009.
- Meyer I. Infectious diseases of the jaws. J. Oral. Surg. 1970;28:17–26.
- Mainous E.G., Heart G.B. Osteoradionecrosis of the mandible – treatment with hyperbaric oxygen. Arch. Otolaryng. 1975;101:173.
- Marx R.E. A new concept in the treatment of osteoradionecrosis. J. Oral. Maxillofac. Surg. 1983;41:351.
- Balogh J.M., Sutherland S.E. Osteoradionecrosis of the mandible: A review. J. Otolaryngol. 1989;18: 245.
- Marx R.E. Osteoradionecrosis: a new concept of its pathophysiology. J. Oral. Maxillofac. Surg. 1983;41:283–288.
- Regaud C. Sur la necrose des os attente par un processus cancereux et traites par les radiaions. Compt. Rend. Soc. Biol. 1922;87:629.
- Naci Celik, Fu-chan Wei, Hung-chi Chen, Ming-huei Cheng, Wei-chao Huang, Feng-chau Tsai, and Yi-chieh Chen. Osteoradionecrosis of the Mandible after Oromandibular Cancer Surgery. Plast. Reconstr. Surg. 2002;109:1875.
- Baker D.G. The radiobiological basis for tissue reactions in the oral cavity following therapeutic x-irradiation: A review. Arch. Otolaryngol. 1982;108:21.
- Harris M. The conservative management of osteoradionecrosis of the mandible with ultrasound therapy. Br. J. Oral Maxillofac. Surg. 1992;30:313.
- Delanian S., Lefaix J.L. Mature bone necrosis: from recent pathophysiological knowledge to an innovative therapeutic action [in French]. Cancer Radiother. 2002;6:1–9.
- Lyons A., Ghazali N. Osteoradionecrosis of the jaws: current understanding of its pathophysiology and treatment. Br. J. Oral. Maxillofac. Surg. 2008;46:653–660.
- Lee I.J., Koom W.S., Lee C.G., et al. Risk factors and dose – effect relationship for mandibular osteoradionecrosis in oral and oropharyngeal cancer patients. Int. J. Radiat. Oncol. Biol. Phys. 2009;75(4):1084–1091.
- Strup-Perrot C., Mathé D., Linard C., et al. Global gene expression profiles reveal an increase in mRNA levels of collagens, MMPs, and TIMPs in late radiation enteritis. Am. J. Physiol. Gastrointest. Liver Physiol. 2004;287(4):G875–885.
- Haydont V., Vozenin-Brotons M.C. Maintenance of radiation-induced intestinal fibrosis: cellular and molecular features. World J. Gastroenterol. 2007;13(19): 2675–2683.
- O’Sullivan B., Levin W. Late radiation-related fibrosis: pathogenesis, manifestations, and current management. Semin. Radiat. Oncol. 2003;13(3): 274–289.
- Gervaz P., Morel P., Vozenin-Brotons M.C. Molecular aspects of intestinal radiation-induced fibrosis. Curr. Mol. Med. 2009;9(3):273–280.
- Thorn J.J., Hansen H.S., Specht L., et al. Osteoradionecrosis of the jaws: clinical characteristics and relation to the field of irradiation. J. Oral. Maxillofac. Surg. 2000;58:1088–1093.
- Harris M. The conservative management of osteoradionecrosis of the mandible with ultrasound therapy. Br. J. Oral. Maxillofac. Surg. 1992;30(5):313–318.
- Schwartz H.C., Kagan A.R. Osteoradionecrosis of the mandible: scientific basis for clinical staging. Am. J. Clin. Oncol. 2002;25(2):168–171.
- Støre G., Boysen M. Mandibular osteoradionecrosis: clinical behavior and diagnostic aspects. Clin. Otolaryngol. Allied. Sci. 2000;25(5):378–384.
- Oh H.K., Chambers M.S., Martin J.W., et al. Osteoradionecrosis of the mandible: treatment outcomes and factors influencing the progress of osteoradionecrosis. J. Oral. Maxillofac. Surg. 2009; 67(7):1378–1386.
- Marx R.E., Stern D. Oral and maxillofacial pathology: a rationale for diagnosis and treatment. Chicago: Quintessence Publishing Co. Ltd. 2003:388–390.
- Jegoux F., Malard O., Goyenvalle E., et al. Radiation effects on bone healing and reconstruction: interpretation of the literature. Oral. Surg. Oral. Med. Oral. Pathol. Oral. Radiol. Endod. 2010;109(2):173–184.
- Knospe W.H., Blom J., Crosby W.H. Regeneration of locally irradiated bone marrow. I. Dose dependent, long-term changes in the rat, with particular emphasis upon vascular and stromal reaction. Blood. 1966;28: 398–415.
- van Os R., Thames H.D., Konings A.W., et al. Radiation dose-fractionation and dose-rate relationships for long-term re-populating hemopoietic stem cells in a murine bone marrow transplant model. Radiat. Res. 1993;136:118–125.
- Barcellos-Hoff M.H. How do tissues respond to damage at the cellular level? The role of cytokines in irradiated tissues. Radiat. Res. 1998;150(5 Suppl.):S109–120.
- Delanian S., Lefaix J.L.T. He radiation-induced fibroatrophic process: therapeutic perspective via the antioxidant pathway. Radiother. Oncol. 2004;73:119–131.
- Gabbiani G. Modulation of fibroblastic cytoskeletal features during wound healing and fibrosis. Pathol. Res. Pract. 1994;190(9–10):851–853.
- Delanian S., Lefaix J.L. Current management for late normal tissue injury: radiation-induced fibrosis and necrosis. Semin. Radiat. Oncol. 2007;17:99–107.
- Delanian S., Martin M., Housset M. Iatrogenic fibrosis in oncology (part I): descriptive and pathophysiological aspects. Bull. Cancer. 1993;80:192–201.
- Basavaraju S.R., Easterly C.E. Pathophysiological effects of radiation on atherosclerosis development and progression, and the incidence of cardiovascular complications. Med. Phys. 2002;29:2391–2403.
- Shukla A., Meisler N., Cutroneo K.R. Perspective article: transforming growth factor-beta: crossroad of glucocorticoid and bleomycin regulation of collagen synthesis in lung fibroblasts. Wound Repair Regen. 1999;7:133–40.
- Furukawa F., Matsuzaki K., Mori S., et al. p38 MAPK mediates fibrogenic signal through Smad3 phosphorylation in rat myofibroblasts. Hepatology. 2003; 38:879–889.
- Burger A., Löffler H., Bamberg M., et al. Molecular and cellular basis of radiation fibrosis. Int. J. Radiat. Biol. 1998;73:401–408.
- Von Pfeil A., Hakenjos L., Herskind C., et al. Irradiated homozygous TGF-beta1 knockout fibroblasts show enhanced clonogenic survival as compared with TGFbeta1 wild-type fibroblasts. Int. J. Radiat. Biol. 2002;78:331–339.
- Vujaskovic Z., Anscher M.S., Feng Q.F., et al. Radiation-induced hypoxia may perpetuate late normal tissue injury. Int. J. Radiat. Oncol. Biol. Phys. 2001;50:851–855.
- Vodovotz Y., Lucia M.S., DeLucca A.M., et al. Reduced hematopoietic function and enhanced radiosensitivity of transforming growth factor-beta1 transgenic mice. Int. J. Cancer. 2000;90:13–21.
- Canney P., Dean S. Transforming growth factor beta: a promoter of late connective tissue injury following radiotherapy? Br. J. Radiol 1990;63:620–623.
- Border W.A., Noble N.A. Transforming growth factor-b in tissue fibrosis. N. Engl. J. Med. 1994;331:1286–1292.
- Xavier S., Piek E., Fujii M., et al. Amelioration of radiation-induced fibrosis: inhibition of transforming growth factor-beta signaling by halofuginone. J. Biol. Chem. 2004;279:15167–176.
- McGaha T.L., Phelps R.G., Spiera H., et al. Halofuginone, an inhibitor of type-I collagen synthesis and skin sclerosis, blocks transforming growth-factorbeta- mediated Smad3 activation in fibroblasts. J. Invest. Dermatol. 2002; 118:461–470.
- Maeda A., Hiyama K., Yamakido H., et al. Increased expression of platelet derived growth factor A and insulin like growth factor-1 in BAL cells during the development of bleomycin induced pulmonary fibrosis in mice. Chest. 1996;109:780–786.
- Ewing J. Radiation osteitis. Acta Radio1. 1926;6:339.
- Hart G.B., Mainous E.G. The treatment of radiation necrosis with hyperbaric oxygen. Cancer. 1976;37:2580.
- Rankow R.M., Weissman B. Osteoradionecrosis of the mandible. Ann. Otol. Rhino1. Laryngol. 1971;80:603.
- Bump R.L., Young J.M., David J.C., Heimbach R.D. Hyperbaric oxygen: Treatment of osteoradionecrosis and osteomyelitis. Med. Serv. Digest. 1976;26:17.
- Stevens M.R., Marx R.E. Complete resolution of osteoradionecrosis with a new protocol combining hyper-baric oxygen and resection. Scientific Abstracts Session, 63rd Annual AAOMS Meeting, San Francisco, 1981.
Поступила 15.11.17 Принята в печать 20.02.18
Received 15.11.17 Accepted 20.02.18
Сведения об авторах:
Е.В. Вербо – д.м.н., профессор, ФГБУ «ЦНИИС и ЧЛХ» Минздравсоцразвития России, Москва, Россия; e-mail: everbo@mail.ru
А.С. Крайтор – ФГБУ «ЦНИИС и ЧЛХ» Минздравсоцразвития России, Москва, Россия
About the authors:
E.V. Verbo – MD, professor, FSBI “CSRID and MFS” of the Ministry of Healthcare and Social Development of Russia, Moscow, Russia; e-mail: everbo@ mail.ru
A.S. Kraitor – FSBI “CSRID and MFS” of the Ministry of Health and Social Development of Russia, Moscow, Russia