Для цитирования: Габоян А.Н., Сукорцева Н.С., Сидоренков Д.А., АганесовГ.А., Синельников М.Е. Экспериментальное моделирование реконструкции ушного хряща на подложке. Голова и шея Head and neck Russian Journal. 2019;7(2):33–37
For citation: Gaboyan A.N., Sukorceva N.S., Sidorenkov D.A., Aganesov G.A., Sinelnikov M.Y. Experimental modeling of auricular cartilage reconstruction using exogenous material. Head and neck Russian Journal. 2019;7(2):33–37 (in Russian).
Doi: 10.25792/HN.2019.7.2.33–37
Реконструктивная пластика хрящевой ткани остается актуальной проблемой в пластической хирургии ввиду частой потребности в восстановлении хрящевых структур как в эстетической, так и в реконструктивной хирургии. Проведена экспериментальная разработка метода создания гибридной конструкции хрящевой ткани заданной формы и конфигурации при помощи прототипирования и микрографтинга хрящевой ткани на подложке. Операция выполнена на ушном хряще кролика. По результатам выполненной работы отмечается стабилизация формы аутотрансплантата при дополнительной фиксации на подложке. Таким образом, создана экспериментальная модель биоинженерного хряща требуемой трехмерной формы с подложкой из Реперена.
Ключевые слова: хрящевая аутотрансплантация, реперен, моделирования хряща, реконструкция хряща, репарация тканей
Авторы заявляют об отсутствии конфликта интересов. Источник финансирования. Статья выполнена в рамках гранта РФФИ №15-29-04819 “Гибридные конструкции из искусственных материалов созданные при помощи 3D принтинга с включением мезенхимальных стволовых клеток для реконструкции хрящевой ткани”.
Для цитирования: Габоян А.Н., Сукорцева Н.С., Сидоренков Д.А., АганесовГ.А., Синельников М.Е. Экспериментальное моделирование реконструкции ушного хряща на подложке. Голова и шея Head and neck Russian Journal. 2019;7(2):33–37
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Reconstructive plastics of cartilage remains an urgent problem in plastic surgery due to the frequent need to restore cartilage structures in both aesthetic and reconstructive surgery. An experimental method of creating a hybrid cartilage of a certain shape and configuration using prototyping and micrografting on a substrate has been developed. The operation was performed on rabbit ear cartilage. According to the results obtained, the stabilization of the autograft shape was noted with additional fixation on the substrate. Thus, an experimental bioengineered cartilage model of the required three-dimensional shape with a substrate of reperen has been created.
Key words: cartilage autotransplantation, reperen, cartilage modeling, cartilage reconstruction, tissue repair
The authors declare no conflict of interest.
Source of financing: The article was written within the framework of the RFFR grant No. 15-29-04819 “Hybrid constructions made of artificial materials created using 3D printing with the inclusion of mesenchymal stem cells for the reconstruction of cartilage tissue”.
For citation: Gaboyan A.N., Sukorceva N.S., Sidorenkov D.A., Aganesov G.A., Sinelnikov M.Y. Experimental modeling of auricular cartilage reconstruction using exogenous material. Head and neck Russian Journal. 2019;7(2):33–37 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients.
Введение
Основной областью применения хрящевой ткани в пластической и реконструктивной хирургии является восстановительная хирургия эстетических и функциональных дефектов различных анатомических областей, аугментация утраченных объемов и коррекция покровных дефектов. Чаще всего хирурги имеют дело с дефектами и деформациями хрящей ушных раковин и носовой перегородки.
Начало истории развития реконструктивной хирургии хрящей тела человека можно связать с первой попыткой воссоздать ушные раковины хирургом Gillies в 1920 г. Gillies выполнял ряд восстановительных операций при микротии, для коррекции которой он использовал аллотрансплантат реберного хряща [1]. В дальнейшем хирург Converse установил, что аллохрящ в отдаленном послеоперационном периоде подвергается резорбции [2]. Авторы Young (1944) и Peer (1948) проводили измельчение аутологичного реберного хряща кубиками («дайсинг») и помещали его в металлическую форму в виде ушной раковины. Данная конструкция имплантировалась под кожу передней брюшной стенки на 5 месяцев. Далее фрагменты хряща, спаянные соединительной тканью, извлекали через отверстия в форме и имплантировали в реципиентную зону. При данной методике контракция рубца деформировала воссозданное наружное ухо [3]. Высокая частота осложнений и неуспешные результаты полностью исключили использование трупного аллогенного хряща в реконструктивных целях.
В 1959 г. хирург Tanzer сформировал хрящевую основу уха из единого блока хрящевой ткани. Это привело к устойчивым, длительным результатам восстановительной операции [4, 5]. Данная операция, несмотря на успешные результаты, была очень длительной, с высоким риском неудовлетворительных результатов. С целью сокращения времени операции были предприняты попытки использования силиконовых протезов [6]. Впоследствии было установлено, что существует проблема экструзии в связи с изъязвлением кожи над протезом и последующим нагноением [7]. При этом импланты не выдерживали даже малейшей травмы, их приходилось часто извлекать, даже спустя длительное время после оперативного вмешательства [8].
С развитием современных медицинских технологий исследователи предприняли попытки реконструкции каркаса наружного уха с помощью неорганических имплантатов [9]. К плюсам данной методики относятся доступность и хирургическая легкость применения данной методики. Как альтернатива операционным техникам восстановления наружного уха выступает применение протезов из искусственных материалов, в частности изготовленных из силикона при помощи 3D-принтера [10]. В реципиентной зоне протез фиксируется к специальным креплениям из титанового сплава, которые в свою очередь прикрепляются к кости [11].
Не менее сложным вопросом является проблема дефектов и деформаций хрящевой части носовой перегородки. В ходе риносептопластики нередко возникает необходимость забора хрящевого аутотрансплантата. Современные методы забора, консервации и моделирования хряща позволяют применять аутологичную хрящевую трансплантацию в качестве «золотого стандарта» при реконструкции хрящевой пластины. Наиболее перспективным подходом к решению проблемы дефектов и деформаций хрящей является биоинжинерный метод, в основе которого лежит моделирование хряща и поддержание его жизнеспособности и структурной целостности [12]. При этом актуален поиск оптимального материала, наиболее подходящего для этих целей.
Основанная цель нашей работы – это создание метода формирования конструкции хрящевой ткани с предварительным использованием технологии 3D-моделирования для придания конструкции заданных параметров формы и размера, с дальнейшей имплантацией под кожу экспериментального объекта, с последующей оценкой стабильности, инертности данной конструкции, сохранности формы и конфигурации.
Материал и методы
В качестве материала экзогенного происхождения для формирования биоинженерной конструкции использовался Реперен. Он применяется в медицине и биологии еще с 1996 г. Это полимер из олигомеров метакрилового ряда. В отличие от других материалов Реперен обладает нулевой электропроводностью и низкой теплопроводностью, что позволяет снизить погрешности электрофизиологических исследований; имеет такое свойство, как «память формы», что позволяет сохранять форму моделированного имплантата, которая не меняется под длительным механическим и химическим воздействием тканей организма. При нагреве Реперена до 80 градусов он способен к изменению формы, что позволяет выполнять моделирование имплантата. Производство Реперена на территории России обусловливает экономическую целесообразность его использования. Пластины из Реперена широко используются в нейрохирургии, офтальмологии, абдоминальной хирургии.
В эксперименте участвовали 2 группы кроликов, по 10 особей в каждой группе. Группа I (контрольная) включала 10 особей, которым была выполнена имплантация немоделированного хряща. Группа II (экспериментальная) включала 10 особей, которым была выполнена имплантация моделированного хряща с помощью Реперена. В каждой группе 3 кроликам выполнена имплантация в наружную поверхность ушной раковины, 7 кроликам – под кожу внутренней поверхности ушной раковины. Пластины перед имплантацией дополнительно обрабатывались полипотентными стволовыми клетками.
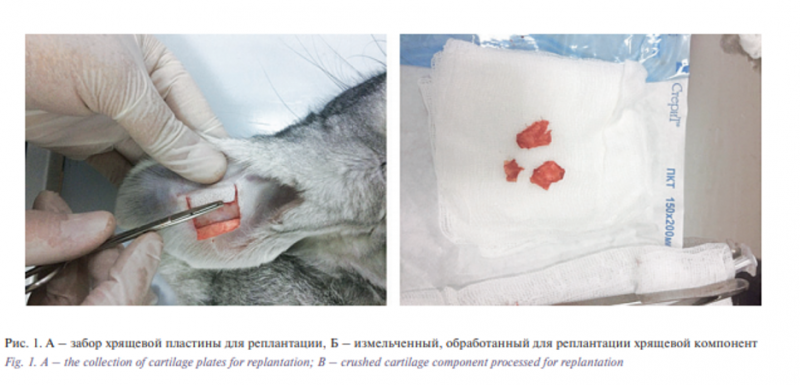
Для создания микрографтов использовали запатентованную методику «Способы реконструкции тканей и органов» [13]. Из правого уха кроликов группы I был забран ушной хрящ, измельчен до размеров примерно 0,1×0,1 см и имплантирован субперихондриально в левое ухо в форме валика, диаметром 0,5 см, размерами 0,5×3,0 см (рис. 1).
У кроликов группы II аналогичным образом был забран и измельчен ушной хрящ, укрыт пластиной Реперена размерами 0,5×3,0 см, которой предварительно была задана форма арки (в теплом стерильном растворе пластине Реперена предана форма арки, в дальнейшем после охлаждения форма арки сохранилась и приобрела первоначальную жесткость). Хрящ с Репереном были имплантированы субперихондриально в правое ухо (рис. 2). Экстракция материала проводилась на 45-е сутки. В каждом случае выполнено гистологическое исследование.
Результаты
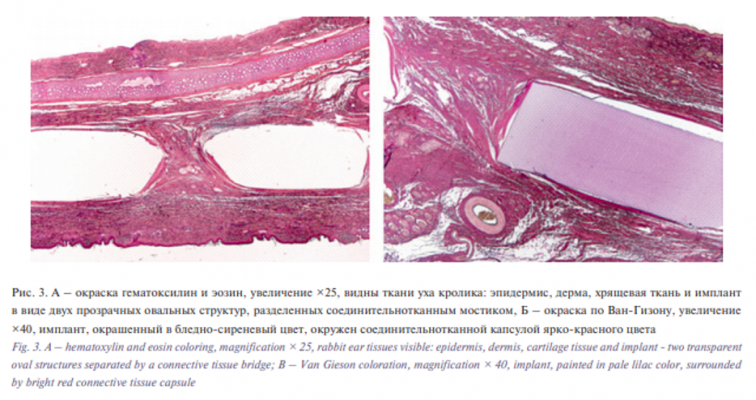
У кроликов с пластинами на передней поверхности уха произошло прорезывание пластины во всех случаях в связи с поверхностным расположением имплантата. У кроликов с пластинами на задней поверхности уха пластина была стабильна. Ни в одной из групп не было гнойно-септических осложнений. У кроликов группы I в левом ухе, где был сформирован валик из рубленного хряща без Реперена, хрящ потерял валикообразную форму, приобрел плоский вид. У кроликов группы II имплантат сохранил валикообразную форму (хрящевая ткань, покрытая Репереном). Выполнено морфологическое исследование уха кролика на 7-е, 14 и 21-е сутки. Препараты окрашивали гематоксилин-эозином и по Ван-Гизону. Во всех микропрепаратах определялся прозрачный бесцветный имплантат, окруженный соединительнотканной капсулой. Воспалительная реакция отсутствовала. Данные гистологических исследований свидетельствуют о биоинертности и биосовместимости выбранной основы для создания гибридной конструкции (рис. 3).
Таким образом, доказана эффективность и безопасность для пациента, целесообразность применения эндопротезов из Реперена для реконструкции хрящевых структур.
Обсуждение
В результате проведенного эксперимента, был выполнен анализ биосовместимости и биоинтеграции биоинженерной конструкции на основе Реперена. Ранее на основании эксперементальных морфологических исследований была доказана биохимическая совместимость имплантатов из Реперена [14]. Показано течение репаративного процесса при расположении пластинки Реперена на месте ранее существующего хряща, укрытого только кожным покровом, продемонстрировано клиническое состояние покровных тканей над пластиной. Полученные экспериментальные данные, касающиеся патогенетических механизмов клеточного уровня при имплантации пластин Реперена, позволили по-новому оценить хирургическую тактику и ведение послеоперационного периода, уверенно применить разработанные методы оперативной техники в клинической практике. Изучение репаративного процесса сделало возможным четко определить особенности нового материала, сравнить его с другими материалами, используемыми для реконструкции хрящевых дефектов [15, 16]. Современные достижения в реконструкции хрящевых структур связаны с инновациями в сфере биоинженерии [17]. Новым и многообещающим направлением является пересадка децеллюляризированных трансплантатов [18, 19]. Однако даже децеллюляризированные аллотрансплантаты требуют должной фиксации в реципиентной зоне, что может быть обеспеченно такими биокомпозитными матриксами, как Реперен [20].
Заключение
В результате проведенного эксперимента с систематическим анализом литературных данных Реперен показал себя как биосовместимый, биоинертный, биоинженерный материал, который может использоваться в реконструктивных целях для моделирования и фиксации хрящевых структур. Биофункциональные характеристики Реперена обусловливают безопасность его применения ввиду отсутствия реакции со стороны иммунной системы реципиентного организма. Значительный научный задел [21–23] о клиническом применении Реперена свидетельствует о безопасности и целесообразности применения данного материала в лечебных целях. Реперен не вызывает гнойно-септических осложнений, что свидетельствует о низком контаминационном потенциале данного материала. Данный материал не подвергается сокращению в размерах. Таким образом, создана экспериментальная модель биоинженерного хряща требуемой трехмерной формы с подложкой из Реперена.
ЛИТЕРАТУРА
- Gillies H. Plastic Surgery of the face. London: Н. Frowde, Hodder & Stоughtоn, 1920.
- Converse J.M. LXXII Corrective Surgery of the Nasal Tip. Ann. Otol. Rhinol. Laryngol. 1940;49(4):895–911.
- Young F. Cast and precast cartilage grafts. Surg.1944;15(1):735.
- Tanzer R.C. Total reconstruction of the auricle: a 10-year report. Plast. Reconstr. Surg. 1967;40(6):547–50.
- Tanzer R.C. Microtia. Clinics in plastic surgery. 1978;5(3):317–36.
- Cronin T.D. Use of a silastic frame for total and subtotal reconstruction of the external ear: preliminary report. Plast. Reconstr. Surg. 1966;37(5):399–405.
- Cronin T.D., Greenberg R.L., Brauer R.O. Follow-up study of silastic frame for reconstruction of external ear. Plast. Reconstr. Surg. 1968;42(6):522–9.
- Monroe C.W. Our experiences with the silicone ear framework: A report of 17 ears in 15 patients. Plast. Reconstr. Surg. 1972;49(4):428–32.
- Водяницкий В.Б. Коррекция и профилактика осложнений при хирургическом лечении микротии у детей. Анналы пластической, реконструктивной и эстетической хирургии. 2008;1(1):39.
- Водяницкий В.Б. Реконструкция ушных раковин у детей (желаемое и возможности). Анналы пластической, реконструктивной и эстетической хирургии. 2006;1(4):60.
- Кручинский Г.В., Неробеев А.И. Устранение дефектов ушной раковины. Восстановительная хирургия мягких тканей челюстно-лицевой области. Руководство для врачей. Под ред. А.И. Неробеева, Н.А. Плотникова. М., 1997;136–55.
- Сао Y., Vacanti J.Р., Paige K.T. Transplantation of chondrocytes utilizing а polymer-cell construct to produce tissue-engineered cartilage in the shape of human ear. Plast. Reconstr. Surg. 1997;100(2):297–302.
- Решетов И.В. Патент РФ №2016137499/20 (059160) «Способ реконструкции тканей и органов». Официальный бюллетень Федеральной службы по интеллектуальной собственности (Роспатент) «Изобретения. Полезные модели» №9-2018, 21.03.2018–27.03.2018.
- Тихомиров С.Е., Цыбусов С.Н., Кравец Л.Я. Изучение реакции мягких тканей на имплантацию полимера «Реперен». Нейрохирургия. 2012;1(3):45–52.
- Треушников В.М., Викторова Е.А. Основы создания биосовместимых и биостойких полимерных имплантатов (обзор). Современные технологии в медицине. 2015;7(3):149–71.
- Tikhomirov S.Е. Application of reperen miniplate for minor calvarium defect plasty in intracerebral hematoma removal. Mod. Technol. Med. 2015;7(2).
- Faust H.J., Guo Q., Elisseeff J.H. Cartilage Tissue Engineering. Princ. Regener. Med. 2019;937–52. Academic Press.
- Nayyer L., Jell G., Esmaeili A., Birchall M., SeifalianA.M. A biodesigned nanocomposite biomaterial for auricular cartilage reconstruction. Adv. Healthcare Material. 2016;5(10):1203–12.
- Chen Y.C., Chen R.N., Jhan H.J., Liu D.Z., Ho H.O., Mao Y., Sheu M.T. Development and characterization of acellular extracellular matrix scaffolds from porcine menisci for use in cartilage tissue engineering. Tissue Engineering Part C: Methods. 2015;21(9):971–86.
- Rowland C.R., Colucci L.A., Guilak F. Fabrication of anatomically-shaped cartilage constructs using decellularized cartilage-derived matrix scaffolds. Biomaterials. 2016;91:57–72.
- Danilova D.A., Gorbunova L.I., Tsybusov S.N., Uspensky I.V., Kravets L.Y. Materials for Plastic Surgery of the Dura Mater: History and Current State of the Problem. Mod. Technol. Med. 2018;10(3).
- Ryabova D.A., Orlinskaya N.Y., Tsybusov S.N., Homutinnikova N.E., Lapshin R.D., DurnovoE.A. Application of Polymer Phospholipid Matrix for Closing Open Wounds on Oral Mucosa. Mod. Technol. Med. 2016;8(1).
- Словиков С.В. Механические свойства сетчатых имплантатов, используемых при пластике грыжевых дефектов передней брюшной стенки. Материалы X Всероссийской конференции по механике деформируемого твердого тела. 2017;198–201.
Поступила 20.02.19
Принята в печать 01.04.19
REFERENCES
- Gillies H. Plastic Surgery of the face. London: Н. Frowde, Hodder & Stоughtоn, 1920.
- Converse J.M. LXXII Corrective Surgery of the Nasal Tip. Ann. Otol. Rhinol. Laryngol. 1940;49(4):895–911.
- Young F. Cast and precast cartilage grafts. Surgery.1944;15(1):735.
- Tanzer R.C. Total reconstruction of the auricle: a 10-year report. Plast. Reconstr. Surg. 1967;40(6):547–50.
- Tanzer R.C. Microtia. Clinics in plastic surgery. 1978;5(3):317–36.
- Cronin T.D. Use of a silastic frame for total and subtotal reconstruction of the external ear: preliminary report. Plast. Reconstr. Surg. 1966;37(5): 399–405.
- Cronin T.D., Greenberg R.L., Brauer R.O. Follow-up study of silastic frame for reconstruction of external ear. Plast. Reconstr. Surg. 1968;42(6):522–9.
- Monroe C.W. Our experiences with the silicone ear framework: A report of 17 ears in 15 patients. Plast. Reconstr. Surg. 1972;49(4):428–32.
- Vodyanitsky V.B. Correction and prevention of complications in the surgical treatment of microtia in children. Ann. Рlast. Reconstr. Anesthet. Surg. 2008;1 (1): 39. (In Russ.).
- Vodyanitsky V.B. Reconstruction of auricles in children (desired and possibilities). Annals of plastic, reconstructive and aesthetic surgery. 2006;1(4):60. (In Russ.).
- Kruchinsky G.V., Nerobeev A.I. Elimination of auricle defects. Reconstructive surgery of the soft tissues of the maxillofacial area. Guide for doctors. Еdit. A.I. Nerobeev, N.A. Plotnikov. M ., 1997. Р. 136–55. (In Russ.).
- Сао Y., Vacanti J.Р., Paige K.T. Transplantation of chondrocytes utilizing а polymer-cell construct to produce tissue-engineered cartilage in the shape of human ear. Plast. Reconstr. Surg. 1997;100(2):297–302.
- Reshetov I.V. RF patent №2016137499 / 20 (059160) “Method for the reconstruction of tissues and organs”. Official bulletin of the Federal Service for Intellectual Property (Rospatent) “Inventions. Utility models ”№9-2018, 03/21/2018–27.03.2018. (In Russ.).
- Tikhomirov S.E., Tsybusov S.N., Kravets L.Ya. The study of the reaction of soft tissue to the implantation of the Reperen polymer. Neurosurgery. 2012;1(3): 45–52. (In Russ.).
- Treushnikov V.M., Viktorova E.A. Basics of creating biocompatible and biostable polymer implants (review). Modern technology in medicine. 2015;7 (3):149–71. (In Russ.).
- Tikhomirov S.Е. Application of reperen miniplate for minor calvarium defect plasty in intracerebral hematoma removal. Mod. Technol. Med. 2015;7(2).
- Faust H.J., Guo Q., Elisseeff J.H. Cartilage Tissue Engineering. Principles of Regenerative Medicine. 2019;937–52. Academic Press.
- Nayyer L., Jell G., Esmaeili A., Birchall M., SeifalianA.M. A biodesigned nanocomposite biomaterial for auricular cartilage reconstruction. Advanced healthcare materials. 2016;5(10):1203–12.
- Chen Y.C., Chen R.N., Jhan H.J., Liu D.Z., Ho H.O., Mao Y., Sheu M.T. Development and characterization of acellular extracellular matrix scaffolds from porcine menisci for use in cartilage tissue engineering. Tissue Engineering Part C: Methods. 2015;21(9):971–86.
- Rowland C.R., Colucci L.A., Guilak F. Fabrication of anatomically-shaped cartilage constructs using decellularized cartilage-derived matrix scaffolds. Biomaterials. 2016;91:57–72.
- Danilova D.A., Gorbunova L.I., Tsybusov S.N., Uspensky I.V., Kravets L.Y. Materials for Plastic Surgery of the Dura Mater: History and Current State of the Problem. Mod. Technol. Med. 2018;10(3).
- Ryabova D.A., Orlinskaya N.Y., Tsybusov S.N., Homutinnikova N.E., Lapshin R.D., DurnovoE.A. Application of Polymer Phospholipid Matrix for Closing Open Wounds on Oral Mucosa. Mod. Technol. Med. 2016;8(1).
- Slovikov S.V. Mechanical properties of mesh implants used in plastic repair of hernial defects of the anterior abdominal wall. Proceedings of the X All-Russian Conference on the Mechanics of a Deformable Solid. 2017; 198–201. (In Russ.).
Received 20.02.19 Accepted 01.04.18
Информация об авторах:
А.Н. Габоян – кафедра онкологии, радиотерапии и реконструктивной хирургии Сеченовского Университета, главный внештатный специалист по пластической хирургии МЗ РФ по Астраханской Области, e-mail: dr_ gaboyan@mail.ru
Н.С. Сукорцева – к.м.н., заведующая отделением онкологии, Университетская клиническая ольница №1, Сеченовский университет.
Д.А. Сидоренков – д.м.н., заведующий отделение пластической хирургии, Университетская клиническая больница №1, Сеченовский университет, профессор кафедры онкологии, радиотерапии и реконструктивной хирургии.
Г.А. Аганесов – к.м.н., ассистент кафедры онкологии, радиотерапии и реконструктивной хирургии Сеченовского университета.
М.Е. Синельников – кафедра онкологии, радиотерапии и реконструктивной хирургии Сеченовского университета.
About the authors:
A.N. Gaboyan – MD, department of oncology, radiotherapy and reconstructive surgery, Sechenov University, head plastic surgery specialist of ministry of health in Astrakhan, e-mail: dr_gaboyan@mail.ru.
N.S. Sukorceva – MD, PhD., head of oncology department at University Clinical Hospital #1, Sechenov University.
D.A. Sidorenkov – MD, PhD, head of plastic surgery department at University Clinical Hospital #1, Sechenov University, professor of department of oncology, radiotherapy and reconstructive surgery
. G.A. Aganesov – MD, PhD., assistant at department of oncology, radiotherapy and reconstructive surgery at Sechenov University.
M.Y. Sinelnikov – MD., department of oncology, radiotherapy and reconstructive surgery, Sechenov University.