Для цитирования: Першин Б.С., Смирнова А.Б., Масчан А.А., Махмутов В.Ю., Ступакова Н.А., Петухова А.Б. Цитомегаловирусный ретинит после трансплантации гемопоэтических стволовых клеток. Пилотная фаза проспективного исследования (24 клинических случая). Голова и шея Head and neck Russian Journal. 2018;6(3):28–33
For citations: Pershin B.S., Smirnova A.B., Maschan A.A., Makhmutov V.Yu., Stupakova N.A., Petukhova A.B. Cytomegalovirus retinitis after hematopoietic stem cell transplantation. Pilot phase of a prospective study (24 clinical cases). Golova I Sheya Head and neck Russian Journal. 2018;6(3):28–33 (in Russian).
Doi: 10.25792/HN.2018.6.3.28–33
Цитомегаловирусный ретинит – заболевание заднего отрезка глаза, развивающееся при нарушениях функций иммунной системы, которое может стать причиной необратимой слепоты. Залогом благоприятного исхода цитомегаловирусного ретинита является его своевременная диагностика. В НМИЦ ДГОИ им Д. Рогачева разработан протокол ранней диагностики и лечения данного заболевания у детей, перенесших трансплантацию стволовых клеток. Описаны закономерности развития, офтальмоскопические особенности и методы ранней диагностики цитомегаловирусного ретинита, в т.ч. его доклинического выявления.
Ключевые слова: диагностика и лечение цитомегаловирусного ретинита, острый ретинонекроз
Авторы заявляют об отсутствии конфликта интересов. Источник финансирования. Не указан.
Для цитирования: Першин Б.С., Смирнова А.Б., Масчан А.А., Махмутов В.Ю., Ступакова Н.А., Петухова А.Б. Цитомегаловирусный ретинит после трансплантации гемопоэтических стволовых клеток. Пилотная фаза проспективного исследования (24 клинических случая). Голова и шея Head and neck Russian Journal. 2018;6(3):28–33
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Cytomegalovirus retinitis is a disease of the posterior segment of the eye developed due to the immune system disorders; it can become a cause of irreversible blindness. The key to a favorable outcome of cytomegalovirus retinitis is its timely diagnosis. The protocol of its early diagnosis and treatment for children who have undergone stem cell transplantation has been developed in D.Rogachyov’s Center of pediatric hematology, oncology and immunology. The patterns of development, ophthalmoscopic features and methods of early diagnosis of cytomegalovirus retinitis, including its preclinical detection, were described in the following article.
Key words: diagnosis and treatment of cytomegalovirus retinitis, acute retinonecrosis. Author declare no conflict of interests for this article. Source of financing. Unspecified.
For citations: Pershin B.S., Smirnova A.B., Maschan A.A., Makhmutov V.Yu., Stupakova N.A., Petukhova A.B. Cytomegalovirus retinitis after hematopoietic stem cell transplantation. Pilot phase of a prospective study (24 clinical cases). Golova I Sheya Head and neck Russian Journal. 2018;6(3):28–33 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material such as tables, figures, photographs of patients.
Актуальность
Цитомегаловирусный ретинит (ЦМВР) может стать причиной необратимой слепоты и морфологически представляет собой ретинонекроз [1–3]. Данное заболевание чаще всего поражает людей с иммунодефицитами: первичными [4, 5], приобретенными [6], а также связанными с трансплантацией солидных органов или костного мозга [7]. Для благоприятного исхода ЦМВР необходима его ранняя диагностика и своевременное начало лечения.
Материал и методы
В НМИЦ ДГОИ им. Д. Рогачева разработан и внедрен в практику протокол диагностики и лечения ЦМВР у детей, перенесших трансплантацию гемопоэтических стволовых клеток (ТГСК), включающий еженедельное проведение количественной полимеразной цепной реакции (ПЦР) на цитомегаловирус (ЦМВ).
Скрининг, который включает в себя биомикроскопию переднего отрезка глаза, офтальмоскопию глазного дна, а также флуоресцентную ангиографию глазного дна (ФАГ), проводится до ТГСК на 30-е, 60, 90, 120-е сутки после ТГСК. При выявлении в периферической крови более 500 коп/мл ЦМВ офтальмоскопию глазного дна с мидриазом повторяют еженедельно до достижения иммунореконституции.
При обнаружении белых ретинальных очагов неправильной формы проводят забор влаги передней камеры и ее ПЦР на ЦМВ.
Интравитреальные введения (ИВВ) противовирусных препаратов фоскарнета (используют готовый раствор 24 мг/мл) или ганцикловира (дозу определяют в зависимости от результата ПЦР внутриглазной жидкости – ВГЖ: по 2,0 мг препарата на каждые 50 000 копий вируса в 1 мл водянистой влаги). ИВВ противовирусных препаратов проводится до регресса воспалительных изменений и полной элиминации вирусов из внутриглазной жидкости по согласованию с решением локального этического комитета и экспертной комиссии в соответствии с Приказом МЗ РФ №499. Родители или законные представители пациентов подписывают информированное согласие на проведение диагностических и лечебных манипуляций.
Системная противовирусная терапия проводится всем пациентам с ЦМВ-ассоциированными осложнениями ТГСК и включает в себя внутривенные инфузии препаратов ганцикловир, фоскавир или цидофовир в зависимости от длительности и резистентности ЦМВ-инфекции. При серопозитивности донора проводится клеточная терапия донорскими CD45RA деплетированными лимфоцитами.
В НМИЦ ДГОИ им Д. Рогачева проведена пилотная фаза проспективного исследования, направленного на изучение закономерностей развития ЦМВР у детей после ТГСК с сентября 2015 по июль 2017 г. Критериями включения стали: заболевание крови или иммунной системы, требующее ТГСК, и прозрачность глазных оптических сред. Критериями исключения стали: смерть или перевод пациента на паллиативное лечение в течении года после ТГСК, развитие ЦМВР в ходе летального сепсиса, а также помутнение оптических сред глазного яблока, за исключением стекловидного тела, т.к. помутнение стекловидного тела может являться частью клинической картины ЦМВР.
Результаты исследования
В исследование вошли 195 пациентов, среди которых было выявлено 24 (12,3%) клинических случая ЦМВР. У 19 (79,2%) детей поражение имело билатеральный, а у 5 (20,8%) – монолатеральный характер. ЦМВР выявлен у 16 (67%) мальчиков и 8 (33%) девочек.
Для изучения закономерностей развития ЦМВР в посттрансплантационном периоде проводили оценку динамики ЦМВвиремии (ЦМВВ) каждого пациента по двум параметрам: длительность и максимальное значение. Пациенты, страдающие острым лимфобластным лейкозом (ОЛЛ), острым миелобластным лейкозом (ОМЛ) и синдромом Вискотта-Олдрича были вынесены в отдельные категории, т.к. их число было достаточным для достоверного селективного определения степени риска развития ЦМВР. Результаты анализа заболеваемости ЦМВР в зависимости от максимального значения ЦМВВ представлены в табл. 1, а от длительности ЦМВВ – в табл. 2. Ни одного случая ЦМВР не было выявлено среди пациентов без ЦМВВ в посттрансплантационном периоде (n=61).
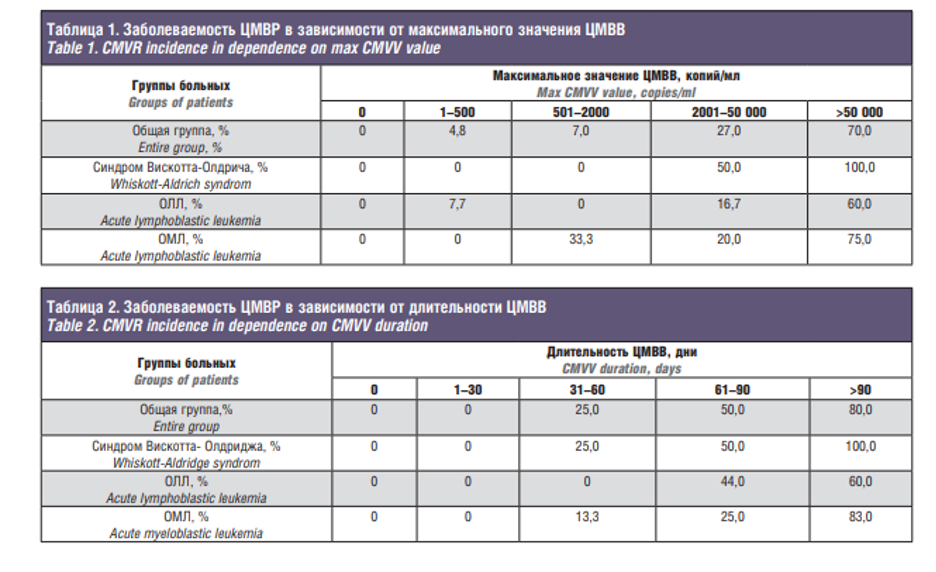
Установлено, что длительность и выраженность ЦМВВ прямо пропорциональны вероятности развития ЦМВР. Вероятность развития ЦМВР в посттрансплантационном периоде в зависимости от основного заболевания представлена в табл. 3. Из-за высокой заболеваемости ЦМВР помимо пациентов, страдающих синдромом Вискотта-Олдрича, ОМЛ и ОЛЛ, в отдельные категории вынесены дети, страдающие тяжелой комбинированной иммунной недостаточностью (ТКИН) и апластической анемией.
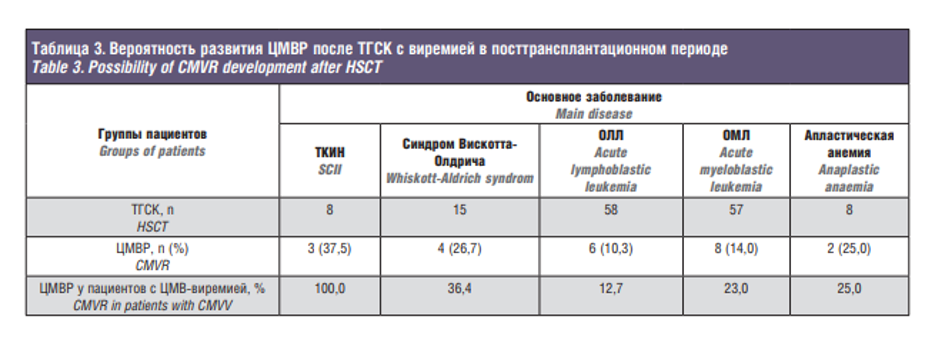
Среди детей, страдающих более редкими заболеваниями, посттрансплантационный период осложнился ЦМВР у одного ребенка, страдающего бета-талассемией. При анализе общей выборки пациентов, было отмечено, что среди 7 пациентов с синдромом Нейминген, 7 детей с хронической гранулематозной болезнью и 5 с Х-сцепленным лимфопролиферативным синдромом не было выявлено ни одного случая ЦМВР.
Офтальмологическая служба НМИЦ ДГОИ им Д. Рогачева разрабатывает новую классификацию ЦМВР, прототип которой представлен ниже.
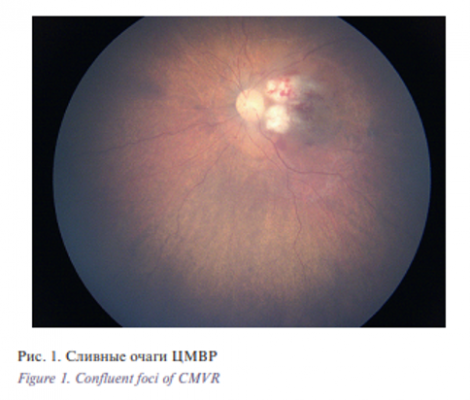
- Cливные очаги (рис. 1), занимающие площадь не менее 0,3 мм2 , отличаются медленным ростом и имеют тенденцию к заживлению с развитием фиброза и грубой дисперсии пигментного эпителия. Вероятность появления этой формы заболевания находится в прямой зависимости от длительности посттрансплантационной ЦМВВ.
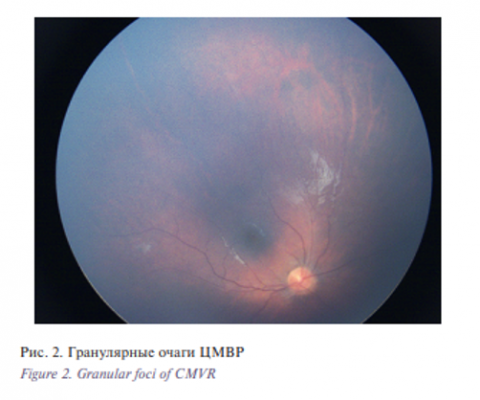
- Гранулярные очаги (рис. 2) – точечные изменения белого цвета до 0,3 мм2 , которые могут появляться как в малом, так и в большом количестве, образуя рисунок в виде дроби. При данной форме заболевания очаги не увеличивают свою площадь, однако при прогрессии ЦМВР появляются новые очаги в виде дроби. Гранулярные очаги отличаются более мягким заживлением, с менее выраженной дисперсией пигментного эпителия и изменением цвета сетчатки. Вероятность появления этой формы заболевания находится в прямой зависимости от длительности посттрансплантационной ЦМВВ.
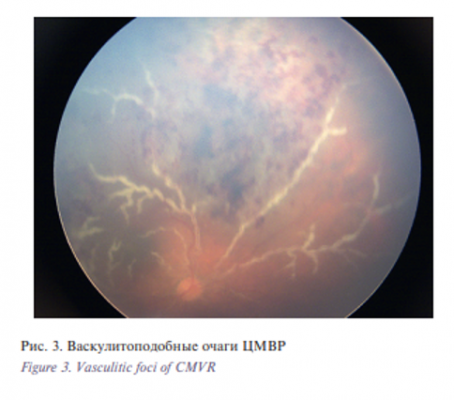
- Васкулитоподобные очаги (рис. 3) повторяют форму ретинального сосуда и имеют тенденцию к быстрому распространению, но при ИВВ противовирусных препаратов превращаются в сливные или гранулярные. Вероятность их развития находится в прямой зависимости от максимального значения ЦМВ-виремии, предшествующей ЦМВР. Необходимо отметить, что все очаги, кроме макулярных и локализованных около зубчатой линии, располагались по ходу ретинальных сосудов. Корреляционный анализ динамики площади воспалительных очагов и динамики количества копий ЦМВ в водянистой влаге показал, что эти показатели находятся в прямой зависимости друг от друга, а количество копий ЦМВ, определяемое при помощи ПЦР внутриглазной жидкости, уменьшается параллельно регрессии воспалительного процесса. Это явление позволяет оценивать результат лечения в реальном времени.
Среди выявляемых при помощи ФАГ изменений были выделены имеющие наибольшее клиническое значение:
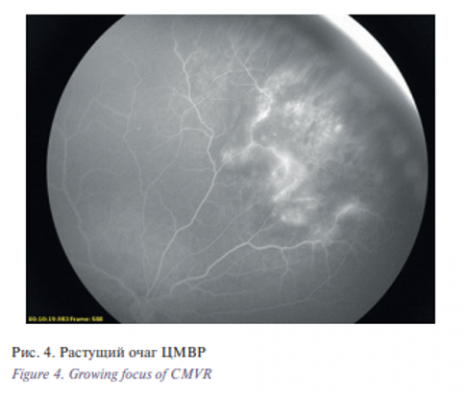
- Гиперфлуоресценция в зоне очага с зоной гипофлуоресценции (рис. 4). Для данного изменения характерно начало свечения в капиллярную фазу и его усиление во время рециркуляции. По периметру очага выявляется зона дисперфузии крови. В результате анализа ФАГ в динамике было установлено, что данный вид изменений встречается при увеличении площади очага. Площадь фиброзных изменений сетчатки после завершения активной фазы ЦМВР находится в прямой зависимости от площади ретинальной дисперфузии во время острого процесса.
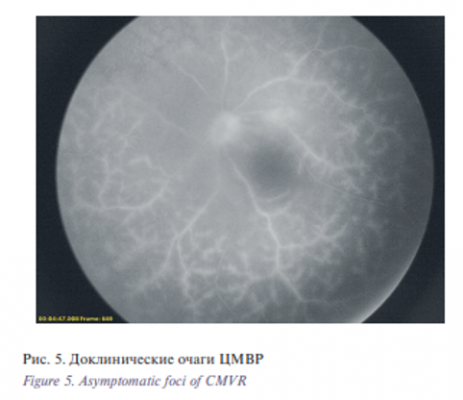
- Гиперфлуоресценция сосудов, усиливающаяся при рециркуляции (рис. 5). Обычно данному изменению подвержены артериолы 2-го и 3-го порядков и все их дочерние сосуды. Как правило, данный вид изменений на момент ФАГ не находит своего отражения при офтальмоскопии, однако является предшественником новых очагов ЦМВР. Данный вид изменений, выявляемых при ФАГ, имеет наибольшее клиническое значение, потому что позволяет диагностировать ЦМВР до развития офтальмоскопически видимых патологических изменений.
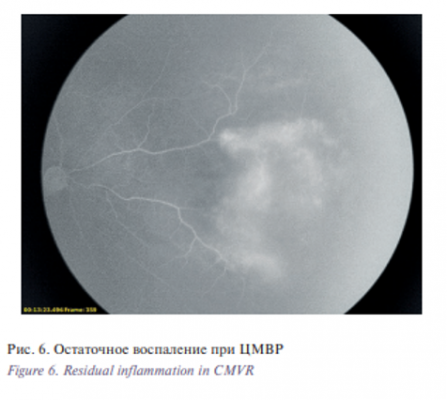
- Гиперфлуоресценция очага, выявляемая в позднюю фазу (рис. 6). При регрессии очагов ЦМВР, сложно дифференцировать поствоспалительный фиброз и остаточные воспалительные явления. При корреляционном анализе изменений, выявляемых при ФАГ, и результатов ПЦР внутриглазной жидкости в динамике выявлена взаимозависимость гиперфлуоресценции очага в позднюю фазу с наличием в камерной влаге копий ЦМВ.
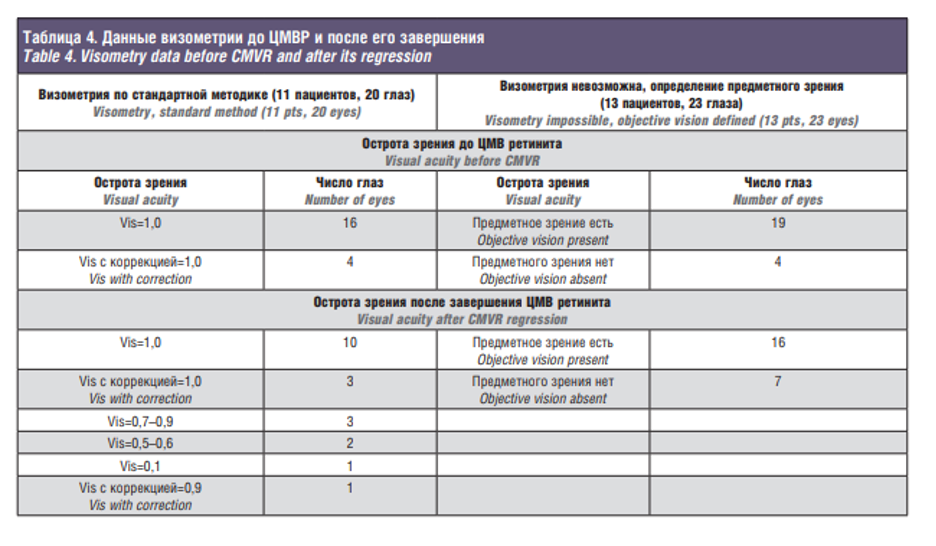
Для определения степени снижения зрения при ЦМВР, дети были разделены на две группы. В первой (11 пациентов, 20 глаз) остроту зрения проверяли по стандартной методике, во второй группе (13 пациентов, 23 глаза) в связи с возрастными и психофизиологическими особенностями, проводили определение предметного зрения с 5 метров. Данные визометрии до ЦМВР и после его завершения представлены в табл. 4.
Обсуждение
Согласно полученным нами данным, у детей ЦМВР осложняет 12,3% ТГСК. Процесс, как правил, носит билатеральный характер и встречается у мальчиков в два раза чаще, чем у девочек. Принимая во внимание то, что среди пациентов, чей посттрансплантационный период не был осложнен ЦМВВ, не было выявлено ни одного клинического случая ЦМВР, можно сделать предположение о том, что наличие копий вируса в кровотоке является звеном патогенеза ЦМВ инфекции, необходимым для развития ретинита. По данным настоящего исследования, абсолютное большинство очагов ЦМВ ретинита располагалось по ходу сосудов сетчатки, что дает возможность предполагать гематогенный путь распространения ЦМВ инфекции внутрь глазного яблока. Это позволяет трактовать выявляемые при помощи ФАГ доклинические изменения в виде гиперфлуоресценции ретинальных сосудов, проявляющиеся при рециркуляции, как ЦМВ-ассоциированное интравазальное воспаление, которое является этапом прохождения инфекции сквозь гематоретинальный барьер.
Анализ длительности и интенсивности ЦМВВ продемонстрировал их прямую взаимосвязь с вероятностью развития поражения сетчатки, что подтверждает наше предположение о важности гематогенного распространения в развитии ЦМВР. Анализ заболеваемости ЦМВР после ТГСК в зависимости от основного заболевания продемонстрировал, что при наличии ЦМВ-виремии, дети с ТКИН имеют 100% заболеваемость. Помимо этого такие заболевания, как синдром ВискоттаОлдрича, апластическая анемия, ОМЛ и ОЛЛ также являются факторами риска развития ЦМВР. Это демонстрирует важность верификации различных видов иммуносупрессии среди пациентов, страдающих ЦМВР, о чем будет изложено в следующих публикациях.
Согласно данным настоящего исследования и мировой литературы [8], ИВВ противовирусных препаратов продемонстрировало свою эффективность в лечении ЦМВР. По нашему протоколу, интравитреальная терапия проводилась под контролем ПЦР в реальном времени и на данный момент в большинстве клинических случаев удалось сохранить высокие зрительные показатели.
Заключение
Абсолютное большинство опубликованных исследований, посвященных изучению развития ЦМВР после ТГСК, были ретроспективными, а частота возникновения данного осложнения, согласно данным литературы, колеблется от 0,17 до 5,0% [2, 9–12]. В настоящем исследовании, клинические случаи ЦМВР осложнили 12,3% ТГСК, что может быть связано со сложностью диагностики данного заболевания. Создание протокола своевременной диагностики и лечения ЦМВР после ТГСК является очень актуальной задачей, решение которой позволит значительно уменьшить число случаев необратимой слепоты у детей при лечении первичных иммунодефицитов, злокачественных заболеваний системы крови и тяжелых форм анемий. Описанный протокол внедрен в клиническую практику НМИЦ ДГОИ им Д. Рогачева. На момент публикации этой статьи продолжается сбор и анализ данных, позволяющих детализировать статистические и клинические особенности ЦМВР у детей, перенесших ТГСК.
ЛИТЕРАТУРА/REFERENCES
1 Agarwal A., Kumari N., Trehan A., Khadwal A., Dogra M.R., Gupta V., Sharma A., Gupta A., Singh R. Outcome of cytomegalovirus retinitis in immunocompromised patients without Human Immunodeficiency Virus treated with intravitreal ganciclovir injection. Graefes Arch Clin. Exp. Ophthalmol. 2014;252(9):1393–401.
2 Crippa F., Corey L., Chuang E.L., Sale G., Boeckh M. Virological. Clinical, and Ophthalmologic Features of Cytomegalovirus Retinitis after Hematopoietic Stem Cell Transplantation. Clin. Infect. Dis. 2001;32(2):214–9.
3 Eid A.J., Bakri S.J., Kijpittayarit S., Razonable R.R. Clinical features and outcomes of cytomegalovirus retinitis after transplantation. Transplant Infectious Disease. 2008;10(1):13–8.
4 Baumal C.R, Levin A.V., Read S.E. Cytomegalovirus retinitis in immunosuppressed children. Am. J. Ophthal. 1999;127(5):550–8.
5 Ozcan P.Y., Celik H.T., Sonmez K., Celik M. Necrotizing Retinitis Secondary to Congenital Cytomegalovirus Infection Associated with Severe Combined Immunodeficiency Case. Rep. Ophthalmol. Med. 2016;2016:495639.
6 Jabs D.A., Van Natta M.L., Kempen J.H., Reed P.P., Lim J.I., Murphy R.L., Hubbard L.D. Characteristics of patients with cytomegalovirus retinitis in the era of highly active antiretroviral therapy. Am. J. Ophthalmol. 2002;133(1):48–61.
7 Kim T., Lee Y.-M., Lee S.-O., Choi S.-H., Kim Y.S., Woo J.H. Differences of cytomegalovirus diseases between kidney and hematopoietic stem cell transplant recipients during preemptive therapy. Korean J. Intern. Med. 2016; 31(5):961–70.
8 Peyman G.A., Lad E.M., Moshfeghi D.M. Intravitreal injection of therapeutic agents. Retina. 2009;29(7):875–912.
9 Larochelle M.B., Phan R., Craddock J., Abzug M.J., Curtis D., Robinson C.C., Giller R.H., Cosgrove S., Siringo F., McCourt E., Palestine A.G. Cytomegalovirus retinitis in pediatric stem cell transplants: report of a recent cluster and the development of a screening protocol. Am. J. Ophthalmol. 2017;175:8–15.
10 Hiwarkar P., Gajdosova E., Qasim W., Worth A., Breuer J., Chiesa R., Ridout D., Edelsten C., Moore A., Amrolia P., Veys P., Rao K. Frequent Occurrence of Cytomegalovirus Retinitis During Immune Reconstitution Warrants Regular Ophthalmic Screening in High-Risk Pediatric Allogeneic Hematopoietic Stem Cell Transplant Recipients. Clin. Infect. Dis. 2014;58(12):1700–6.
11 Jeon S., Lee W.K., Lee Y., Lee D.G., Lee J.W., Risk Factors for Cytomegalovirus Retinitis in Patients with Cytomegalovirus Viremia after Hematopoietic Stem Cell Transplantation. Am. Acad. Ophthal. 2012;119(9):1892–8.
12 Yoo Y.S., Na K.S., Shin J.A., Park Y.H., Lee J.W. Posterior eye segment complicatons related to allogeneic hematopoietic stem cell transplantation. Retina. 2017;37(1):135–43.
Поступила 20.05.18 Принята в печать 23.08.18
Received 20.05.18 Accepted 23.08.18
Сведения об авторах:
Б.С. Першин – к.м.н., врач-офтальмохирург, руководитель офтальмологической службы Национального медицинского исследовательского центра детской гематологии, онкологии и иммунологии им Д. Рогачева, Москва, Россия; e-mail: pershin1984@gmail.com.
А.А. Масчан – д.м.н., профессор, член-корреспондент РАН, заместитель генерального директора Института гематологии, иммунологии и клеточных технологий ГБУ Национального медицинского исследовательского центра детской гематологии, онкологии и иммунологии им. Д. Рогачева Минздрава России, Москва, Россия
В.Ю. Махмутов – д.м.н., профессор, врач-офтальмохирург Центра эндохирургии и литотрипсии, Москва, Россия
А.Б. Смирнова – врач-офтальмолог Национального медицинского исследовательского центра детской гематологии, онкологии и иммунологии им Д. Рогачева, Москва, Россия
Н.А. Ступакова – врач-офтальмолог Национального медицинского исследовательского центра детской гематологии, онкологии и иммунологии им Д. Рогачева, Москва, Россия
А.Б. Петухова – врач-офтальмолог Национального медицинского исследовательского центра детской гематологии, онкологии и иммунологии им Д. Рогачева, Москва, Россия
About the authors:
B.S. Pershin – MD, PhD, ophthalmic surgeon, head of the ophthalmological service of the National Medical Research Center of Pediatric Hematology, Oncology and Immunology named after D. Rogachev, Moscow, Russia
A.A. Maschan – MD, PhD, Professor, Corresponding Member of the Russian Academy of Sciences, Deputy General Director of the Institute of Hematology, Immunology and Cell Technologies of the SBIH National Medical Research Center of Pediatric Hematology, Oncology and Immunology named after Dmitry Rogachev, Ministry of Health of Russia, Moscow, Russia
V.Y. Makhmutov – MD, PhD, professor, ophthalmic surgeon at the Center for Endosurgery and Lithotripsy, Moscow, Russia
A.B Smirnova — ophthalmologist, D. Rogachev’s National Medical Research Center for Pediatric Hematology, Oncology and Immunology, Moscow
N.A. Stupakova – ophthalmologist, D. Rogachev’s National Medical Research Center for Pediatric Hematology, Oncology and Immunology, Moscow,
A.B.Petukhova — ophthalmologist, D. Rogachev’s National Medical Research Center for Pediatric Hematology, Oncology and Immunology, Moscow