Для цитирования: Решетов И.В., Макаров В.Н. Радиочастотная аблация опухолей головы и шеи без контакта с электродами. Голова и шея Head and neck Russian Journal. 2018;6(3):20–27
Doi: 10.25792/HN.2018.6.3.20–27
Рассмотрены основные факторы, препятствующие увеличению объема радиочастотной аблации при нагреве опухолей токами высокой частоты до температуры коагуляции. Показано, что увеличить подводимую энергию, а, следовательно, и объем коагуляции можно только за счет увеличения числа электродов, вводимых в опухоль. Проведен анализ современного состояния установок и показано, что наиболее близкими характеристиками к желаемым обладает отечественный комплекс «МЕТАТОМ». Приведены результаты экспериментальных исследований и клинической апробации, которые свидетельствуют о возможности бесконтактной аблации опухолей с объемом, превышающим 100 см3.
Ключевые слова: опухоль, аблация, генератор, электроды, область абластики
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Решетов И.В., Макаров В.Н. Радиочастотная аблация опухолей головы и шеи без контакта с электродами. Голова и шея Head and neck Russian Journal. 2018;6(3):20–27
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Octreotide is a synthetic analogue of somatostatin hormone which is widely used for the treatment of acromegaly, for benign and malignant tumors of hypothalamus and gastro-intestinal (GI) tract therapy, and for prophylaxis of postoperative GI complications as well as for lymphorrhea elimination and fistulous defects clearing. Surgery on major salivary glands presumes the development of various postoperative complications such as salivary fistulas, seromas, lymphorrhea, hematomas and contaminated wound, especially in patients who underwent head and neck radiotherapy.
Bearing in mind all the positive effects of Octreotide as well as some data concerning its advantageous influence on salivary fistulas management as a component of complex treatment, the authors initiated a clinical study with expertise on the base of the department of plastic surgery of the 1st I.M. Sechenov Moscow state medical university. Positive results have been obtained with Octreotide use for prophylaxis of complications after salivary glands surgery. Thus, the authors consider the further clinical trials with Octreotide reasonable.
Key words: Оctreotide, salivary glands, postoperative complications prophylaxis, salivary glands cancer, salivary gland adenoma, somatostatin analogue
The main factors preventing the enhancement of radiofrequency ablation due to the thermal heating of tumors are reviewed. The authors showed that it was possible to increase the input energy, and, therefore, the coagulation volume only by increasing the number of electrodes inserted into the tumor. The analysis of current situation with the apparatus is carried out and it is shown that the domestic METATOM complex has the closest characteristics to the desired ones. The results of experimental studies and clinical testing, which indicate the possibility of contactless ablation of tumors with a volume exceeding 100 cm3 , are presented in the article.
Keywords: tumor, ablation, generator, electrodes, ablastic area
Author declare no conflict of interests for this article. Source of financing. Unspecified.
For citations: Reshetov I.V., Makarov V.N. Radiofrequency ablation of head and neck tumors without contacting electrodes. Golova I Sheya = Head and neck. Russian Journal. 2018;6(3):20–27 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material such as tables, figures, photographs of patients.
Введение
В конце прошлого века в онкологии возникло направление локального объемного разрушения опухолей за счет их нагрева токами высокой частоты до температуры коагуляции. Способ радиочастотной аблации (РЧА) оказался самым простым и дешевым. После нагрева опухоли полученный коагулят впоследствии замещается соединительной тканью [1]. Метод РЧА тканей прочно занял одно из лидирующих положений среди малоинвазивных технологий локальной деструкции. Возрастающий интерес к этому способу теплового разрушения тканей связан, наряду с относительной дешевизной и доступностью, главным образом, с реальным клиническим эффектом, который демонстрируется в многочисленных публикациях. Наибольшие успехи РЧА достигнуты при опухолях печени, однако метод применяется также при новообразованиях почек, легких и других органов [1–2]. Основные преимущества теплового разрушения опухоли по сравнению с хирургическим вмешательством: малые кровопотери при проведении, сокращение времени операции, техническая простота процедуры, сокращение расходов на анестезиологическое и хирургическое обеспечение оперативного вмешательства, снижение время пребывания в стационаре до 1–2 дней.
Однако, несмотря на очевидные достоинства, метод остается вспомогательным средством, к которому прибегают лишь в случае невозможности применения резекции опухоли. Причиной являются рецидивы вторичного рака [3], причем 3-летняя выживаемость без опухолей составляет всего 20–40%. Основной проблемой при разрушении раковых опухолей путем нагрева является неудовлетворительный нагрев в монополярном режиме периферийной части опухоли, что через какой-то период времени приводит к возвратным опухолям. Попытки увеличения объема зоны нагрева за счет увеличения подводимой мощности блокируются ухудшением проводимости ткани в месте контакта электрода с тканью и уменьшением плотности выделяемой мощности по мере удаления от электрода. На протяжении последних 3 лет за рубежом интенсивно развивается новый подход к тепловому нагреву, основанный на нагреве опухоли с периферии к центру без ввода электродов в саму опухоль [4–8]. В соответствии с хирургическим принципом футлярности удаления опухоли, вокруг опухоли создается слой нагретой ткани с помощью трехэлектродной системы, не контактирующей с опухолью. Экспериментальные исследования показали, что по сравнению с обычным методом введения электродов в ткань многоэлектродная аблация без контакта с опухолью улучшает аблацию опухоли с последующей более низкой частотой локального рецидива опухоли (выживаемость 91,0% на третий год).
В задачу данной работы входило рассмотрение факторов, ограничивающих объем нагреваемой ткани при РЧА, анализ современного состояния радиочастотных установок, использующих многоэлектродные системы, и клиническая апробация возможностей отечественного комплекса «МЕТАТОМ» при работе с однорядными и двухрядными системами.
Анализ факторов, ограничивающих объем нагреваемой ткани при РЧА
Одним из основных показателей эффективности РЧА является частота полных некрозов опухоли (т.е. полного отсутствия жизнеспособных опухолевых клеток в зоне воздействия). По данным разных авторов, этот показатель варьируется в пределах 30–100%, что свидетельствует о недостаточности достигнутых размеров теплового поля и необходимости его увеличения как минимум в 2 раза. Если для небольших опухолей удается достигнуть удовлетворительного некроза на периферии опухоли, то при диаметрах опухолей, превышающих 3 см, периферия опухоли прогревается слабо.
Для полной коагуляции опухоли требуется создание теплового поля, конфигурация которого должна быть аналогичной конфигурации опухоли (шаровидной или эллипсовидной), а размеры должны перекрывать размеры опухоли на 0,5–1,0 см, как и в случае классической хирургической резекции опухоли. Как показывают расчеты, объем, который должен быть нагрет, с учетом дополнительного объема переходной зоны возрастает в 2–3 раза по сравнению с исходным объемом опухоли.
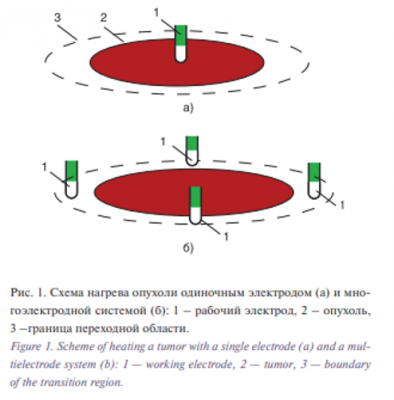
Большинство выпускаемых установок для РЧА характеризуются одним общим признаком – нагрев опухоли проводится от центра опухоли к периферии, т.к. источник тепла (рабочий электрод) вводится в центре опухоли (рис. 1а).
При нагреве одиночным электродом (1) необходимо, чтобы тепловое поле с запасом в 0,5–1,0 см перекрывало поперечное сечение опухоли (2), а температура на границе области (3) была не меньше 60 o С. Это условие выполняется только для опухолей небольшого размера из-за особенностей нагрева, присущих такому виду нагрева.
Первая особенность применения одиночных электродов при РЧА связана с уменьшением плотности высокочастотного тока по мере удаления от источника тепла пропорционально 1/r2 , где r – текущее расстояние от поверхности электрода. Аналогичным образом спадает и температура ткани по мере удаления от одиночного электрода. Из-за резкого уменьшения температуры наблюдается неполный некроз ткани на периферии опухоли и в переходной зоне между опухолевой и здоровой тканью (зоне абластики).
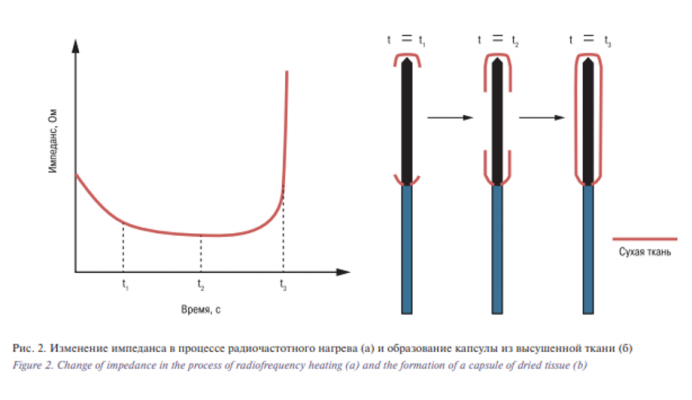
Вторая особенность связана с физическими процессами, происходящими в области контакта электрода с тканью. Проведенные экспериментальные исследования показали, что импеданс в процессе нагрева ткани вначале уменьшается и достаточно долго не меняется, а затем резко увеличивается из-за высушивания ткани в области ее контакта с электродом (рис. 2а). Картина образования капсулы схематично показана на рис. 2б. Как известно, объем нагреваемой ткани зависит от подводимой энергии. Увеличение уровня подводимой мощности к одиночному электроду приводит к быстрому сокращению временного диапазона работы генератора t1 –t3 .В результате попытки увеличения уровня подводимой мощности блокируются ускорением процесса высыхания ткани.
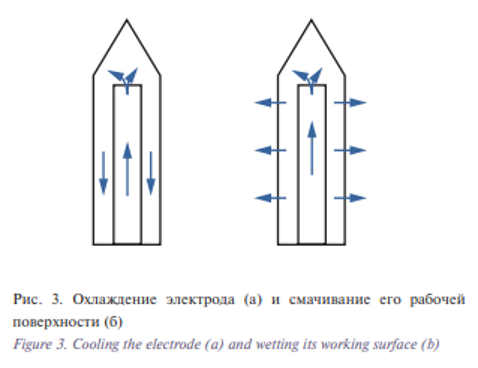
С целью замедления процесса высушивания были предложены способы снижения температуры на поверхности электрода с помощью внутреннего охлаждения электрода (рис. 3а) или введения в зону нагрева через отверстия в электроде физиологического раствора для поддержания постоянного импеданса в области контакта (рис. 3б) [1].
Эффективному отводу тепла от поверхности электрода препятствует очень маленькое сечение теплоотводящего канала, обусловленное маленьким внешним диаметром электрода (не более 1,8 мм). Поэтому при повышении подводимой мощности охлаждение не справляется с высушиванием ткани в месте ее контакта с рабочей поверхностью.
Поддержание влажной поверхности ткани также не является панацеей, т.к. жидкость растекается неравномерно и появляются области высушенной ткани. К тому же растекающаяся жидкость может служить источником опухолевых клеток. Поэтому достигнутый к настоящему времени объем разрушения одиночными электродами не превышает 40–50 см3 , что при шаровидной опухоли с учетом зоны абластики соответствует диаметрам опухоли не более 2,5 см. К тому же возникающая неравномерность нагрева по объему, обусловленная положением и формой теплового источника, не способствует выполнению условия абластичности процедуры на периферии опухоли. Таким образом, одиночные электроды не смогли обеспечить требуемые объемы разрушения тканей (≥2,5–3,0 см) из-за ограничений, связанных с разрывом электрической цепи в месте подведения ВЧ энергии к опухоли и отсутствием возможности достижения полного некроза ткани на периферии опухоли.
Понятно, что можно избежать целого ряда нежелательных последствий, присущих одиночному электроду, если исключить выделение большой энергии в одном месте. Для этого можно одиночный электрод «расщепить» на несколько электродов (см. рис. 1б), которые можно ввести на периферии опухоли. При использовании «расщепленных» электродов нагрев опухолей осуществляется из центра к периферии и неравномерность нагрева, присущая одиночным электродам, здесь намного меньше. Существенное улучшение нагрева опухоли на периферии достигается за счет перемещения группы электродов (1), осуществляющих нагрев, в область перехода от опухолевой ткани к нормальной (см. рис. 1б), причем максимум температуры нагрева сдвигается с центра опухоли на 5–50 мм в зависимости от выбранного способа доступа к опухоли. В результате температура в пограничной области (зона абластики) увеличивается, что приводит к более интенсивной гибели клеток. Контроль температуры в этой области осуществляется самими электродами, имеющими внутренние термодатчики. Суммарное увеличение рабочей поверхности электродов сопровождается снижением плотности тока с них и временным удлинением процесса высушивания тканей по сравнению с одиночным электродом.
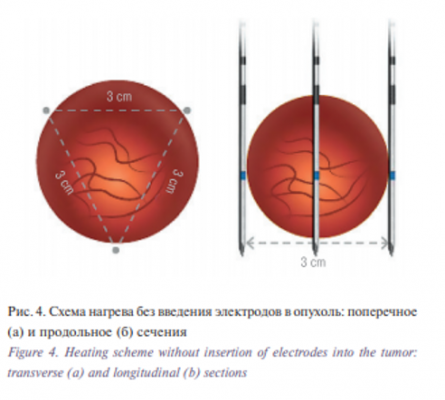
При фиксированном времени процедуры такое пространственное распределение излучателей позволяет подвести к опухоли больше энергии, что и дает возможность увеличить объем разрушения ткани при уменьшении неравномерности нагрева [9]. Первые конструкции установок, применяющих 3 электрода, объединенных в единый кластер, были выпущены на рынок фирмами США [10]. Кластер с расстоянием между электродами 0,5–1,0 см позволяет довести диаметр нагрева до 2,5 см, дальнейшее увеличение возможно при увеличении расстояния между электродами до 1,5–2,0 см. Для разрушения опухолей с диаметром, превышающим 3 см, было предложено использовать системы, в которых 3 электрода кластера вводятся на периферии опухоли и не имеют контакта с нею. В этом случае, как показано на рис. 4, электроды не должны касаться опухоли и находиться на некотором расстоянии от наружной поверхности (рис. 4а), а длина рабочей части должна превышать размер опухоли по вертикали (рис. 4б). Естественно, что при наличии только трех электродов неравномерность нагрева, нарастающая с увеличением диаметра, будет являться ограничивающим фактором.
Наблюдаемое на практике изменение импеданса таких систем в зависимости от числа электродов привело к необходимости введения коммутирующего устройства, последовательно подключающего к выходным каналам генератора в зависимости от режима работы один или два электрода в соответствии с заданной программой [11–14]. При этом генератор установки должен иметь 3 выходных канала, независимых друг от друга. Наличие последовательных переключений каналов равноценно уменьшению подводимой мощности и может быть скомпенсировано только увеличением времени процедуры.
В настоящее время усилия разработчиков установок РЧА направлены на решение задач по увеличению диаметра (до 4,5–6,0 см) и объема разрушаемых опухолей (больше 100 см3 ) при максимальном сокращении времени процедуры (не более 15–20 минут). Такие параметры могут быть достигнуты только при применении однорядных и двухрядных многоэлектродных систем с числом электродов от 4 до 12, охватывающих опухоль и нагревающих ее от периферии к центру [15]. В таких конструкциях тепловые источники распределены симметрично вокруг опухоли, нагрев осуществляется от периферии к центру опухоли без резкого перепада температуры. В зоне абластики достигается полный некроз ткани, а уровень подводимой мощности может быть увеличен без риска образования капсул вокруг электродов.
Радиочастотные установки с многоэлектродными системами
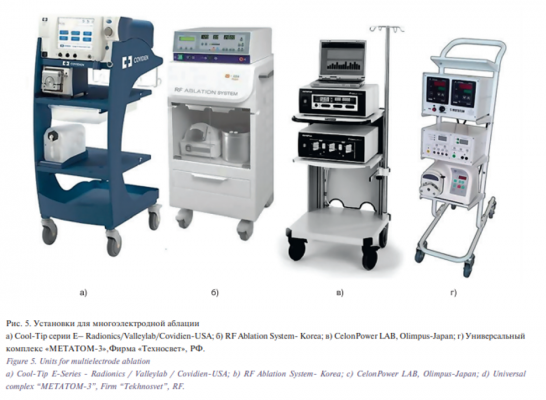
На рис. 5 показан внешний вид установок с многоэлектродными системами, выпускаемых сейчас, а в таблице приведены основные технические характеристики, взятые из официальных источников.
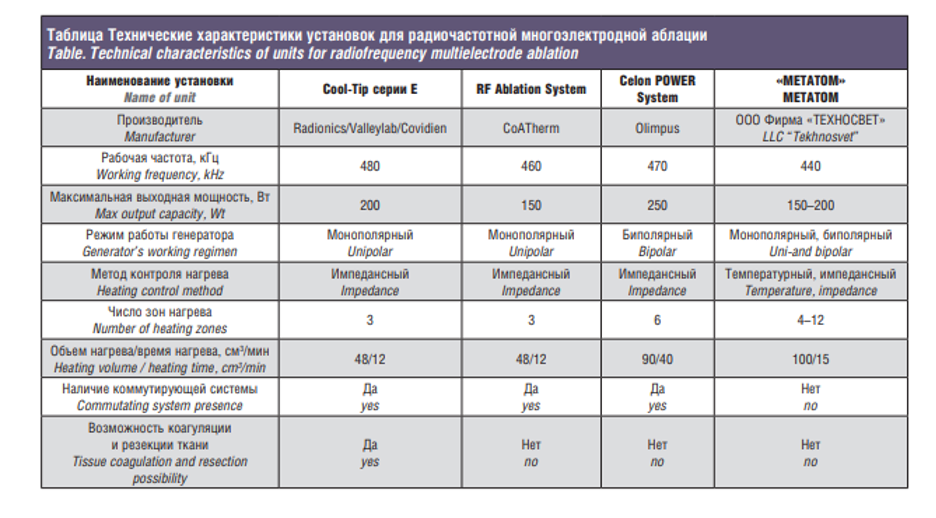
По основным параметрам (мощность, рабочая частота) все установки схожи. Различия касаются режимов работы, охлаждения электродов, метода контроля нагрева и возможностей нагрева снаружи опухоли.
Большинство рассмотренных выше зарубежных установок, имеющих охлаждаемые электроды, управляются по импедансу. Конструктивно это проще, т.к. не требует введения температурных датчиков в электроды и системы обработки получаемых сигналов. Однако связь величины импеданса с состоянием нагреваемой ткани не является очевидной, а сам импеданс не может являться критерием, т.к. он сильно зависит от размеров рабочей зоны электрода, числа электродов и вида нагреваемой ткани. Использование переключателей сильно удлиняет время нагрева, что также является нежелательным в данных процедурах из-за необходимости применения наркоза.
В установке Cool-Tip (рис. 5а) используется электрод с внутренним охлаждением. Внутри электрода циркулирует дистиллированная вода или физиологический раствор с температурой от 4 до 12 °С для предотвращения карбонизации активной части электрода. Самые большие размеры зоны нагрева были достигнуты на кластере из 3 электродов (диаметр 4,4 см, объем 48,3 см3 ) при нагреве за 12 минут.
К этому же типу следует отнести установку, выпускаемую в Корее (рис. 5б). Установка имеет 3 выходных канала, к которым можно подключить 3 электрода, работающих в монополярном и биполярном режимах.
В отличие от вышерассмотренных установок в установке Celon Power System (рис. 5в) используются одиночные электроды с двумя рабочими зонами, используемые в биполярном режиме. Активная часть такого электрода разделена на две рабочие области, к каждой из которых подведен разнополярный потенциал. В этой установке существует возможность подключения кластера из трех электродов, образующего двухэтажную систему, работающую в многоэлектродном режиме, т.к. к каждой из рабочих частей будут подводиться разные потенциалы по сложному алгоритму. Максимальный объем некрозируемой ткани может достигать 95 см3 при использовании многоэлектродной биполярной системы с длиной рабочей части 4 см. При применении кластеров использовалась система переключений, обеспечивающая постоянную нагрузку генератора за счет последовательно включенных пар электродов В зависимости от размеров получаемого объема время процедуры менялось от 28 до 40 минут.
Эта установка наиболее близка к идеологии распределенного нагрева, т.к. в ней реализуется введение в область нагрева сразу шести тепловых источников. Дальнейшее развитие — это направление получило при создании отечественного комплекса «МЕТАТОМ (рис. 5г), в котором число тепловых источников можно было увеличить до 12 [15]. Четырехканальная установка для аблации опухолей «МЕТАТОМ» дает возможность подключать к генератору от 4 до 12 электродов с термопарами и управлять их температурой, задавая предварительно тот или иной профиль изменения температуры во времени. Поддержание заданной температуры на электродах программным способом позволяет отказаться от их искусственного охлаждения и упростить конструкцию установки, исключив насосы и системы охлаждения. Дополнительной опцией новой установки является возможность работы с электрохирургическими инструментами для коагуляции и резекции тканей.
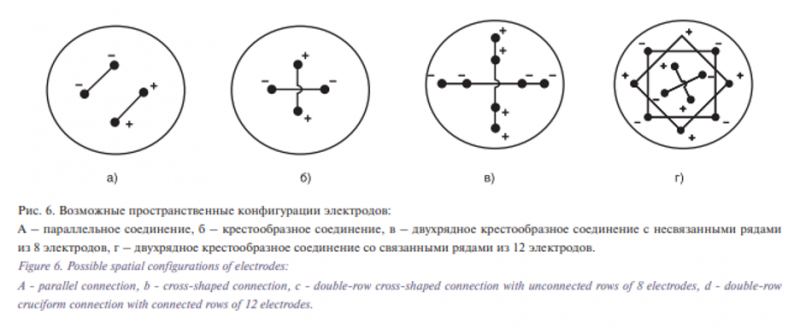
Конструкция из 4 электродов, в которой однополярные электроды соединены между собой, образуя в пространстве параллельную или крестообразную конструкции (рис. 6а,б), является базовой.
Такие системы при биполярном режиме работы генератора создают электрические поля разной конфигурации. Так, в первом случае будет создаваться поперечное поле между однополярными электродами, во втором случае поле будет азимутальным. Базовая система может быть дополнена такой же системой электродов, где диаметр расположения электродов будет больше или меньше диаметра первичной системы. В этом случае вместо однорядной системы образуется двухрядная система, в которой однополярные электроды соединены между собой, образуя либо систему с несвязанными рядами (рис. 6в), либо систему со связанными рядами (рис. 6г). При совместном одновременном или последовательном использовании разных соединений можно получать различные конфигурации теплового поля. Следует заметить, что азимутальное смещение рядов может также менять картину полей между рядами. Причем ряды электродов могут размещаться как в самой опухоли, так и за ее пределами, например, в зоне абластики. Суммарное тепловое поле окажется размазанным по большому пространству, а его однородность будет зависеть от числа электродов и числа рядов. При совместном одновременном или последовательном использовании разных соединений можно получать различные конфигурации теплового поля.
Конкретные конструкции однорядных и двухрядных систем разрабатывались для трех видов доступа к опухоли: открытого, лапороскопического и чрескожного. Системы для открытого доступа, показанные на рис. 7, позволяют нагревать цилиндрические области диаметром до 4,5–5,5 см. и высотой до 5,0–6,0 см с гарантией обеспечения высокой температуры в переходной области между здоровой и опухолевой тканями. Для фиксации поверхности ввода электродов часть систем снабжена цилиндрическим фиксатором из фторопласта, который может перемещаться и регулировать глубину ввода электродов в ткань (рис. 7а). Двухрядные системы могут вводиться в ткань поочередно, сначала внешняя система, а затем внутренняя, как показано на рис. 7б. Системы отличаются диаметром (от 1 до 4 см) и различной длиной рабочей части, которая может устанавливаться передвижением фторопластового ограничителя.
Экспериментальные исследования многоэлектродных систем
Разработанные наборы однорядных и двухрядных систем с различным числом электродов (от 4 до 12) позволяют перераспределять подводимую радиочастотную мощность между ними со снижением тепловой нагрузки на отдельные электроды системы. Применение соединения однополюсных электродов увеличивает число одновременно работающих электродов и сокращает число переключений, тем самым уменьшая время процедуры аблации.
Результаты нагрева имитатора при последовательном включении двух крестообразно включенных систем на одном диаметре приведены на рис. 8. Выводы двух структур подключались к двум биполярным каналам генератора так, что вначале работала первая пара крестообразно соединенных электродов, а вторая пара была отключена от генератора и работала как два термодатчика. При достижении режима увеличения импеданса эта пара переключалась в режим измерения температуры и включалась вторая пара электродов.
Видно, что последовательное подключение пар крестообразно соединенных электродов позволяет на диаметре 4,5 см получить температуру, превышающую 60 o С в течении 10 минут. Картина нагрева на имитаторе, приведенная на рис. 7 б,в, свидетельствует об образовании в объеме имитатора области нагрева в виде цилиндра, высота которого превышает длину рабочей части электродов на 0,5 см, а диаметр имеет четко очерченную границу, отстоящую от электродов тоже на 0,5–0,6 см. Общий объем нагрева достигает 63 см3 , причем на периферии области температура превышает 60 o С через 5–6 минут.
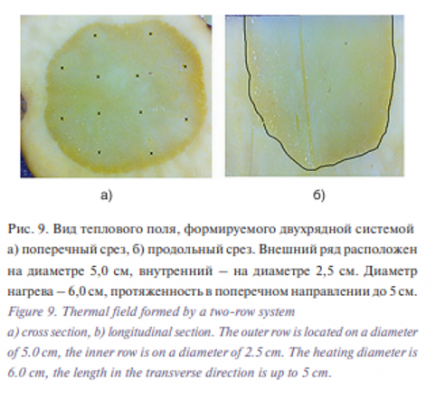
На рис. 9 показано тепловое поле, сформированное 12 электродами двухрядной системы.
За счет использования многоэлектродных систем удается увеличить подводимую энергию без увеличения времени нагрева и довести на имитаторах объемы нагреваемых тканей до 100 см3 и выше за время, не превышающее 15–20 минут [15]. В ходе полугодичной эксплуатации комплекса в онкологическом отделении хирургических методов лечения опухолей головы и шеи, молочных желез, кожи и мягких тканей (Первый МГМУ им. И.М. Сеченова) было проведено лечение 27 пациентов. Проводилась РЧА метастазов полости рта и шеи с размерами от 1 до 6 см. У всех пациентов диагноз был верифицирован гистологически. Для планирования вмешательства и оценки технической эффективности РЧА всем пациентам до и после процедуры выполняли УЗИ и КТ. Этап прицеливания и мониторирования процесса РЧА у всех больных осуществлялся при помощи УЗИ. Успешно проведенная аблация опухоли проявлялась на спиральной КТ как низкоплотная неконтрастируемая зона на изображениях в артериальную и венозную (портальную) фазы исследования. Разработанные электроды были использованы в самых разнообразных операциях. Например, при раке дна полости рта, меланоме слизистой оболочки носа, раке слюнной железы, злокачественной шванноме и т.д.
Заключение
Таким образом, проведенная работа свидетельствует о технической возможности существенного увеличения объема разрушаемой ткани за счет увеличения числа электродов и размещения электродов по объему опухоли, а также вне ее. Увеличение числа тепловых источников позволяет не только снизить нагрузки на электроды, но и сократить время процедуры.
Отечественная четырехканальная установка для аблации опухолей «МЕТАТОМ» дает возможность подключать к генератору от 4 до 12 электродов с термопарами и управлять их температурой, задавая предварительно тот или иной профиль изменения температуры во времени. Поддержание заданной температуры на электродах программным способом позволяет отказаться от их искусственного охлаждения и упростить конструкцию установки, исключив насосы и системы охлаждения. Дополнительной опцией новой установки является возможность работы с электрохирургическими инструментами для коагуляции и резекции тканей.
Впервые разработанные наборы однорядных и двухрядных систем с различным количеством электродов (от 4 до 12) позволяют перераспределить подводимую радиочастотную мощность между ними со снижением тепловой нагрузки на отдельные электроды системы. Примененное сдваивание однополюсных электродов увеличивает число одновременно работающих электродов и сокращает число переключений, тем самым уменьшая время процедуры аблации.
За счет использования многоэлектродных систем удается увеличить подводимую энергию без увеличения времени нагрева и довести на имитаторах объемы нагреваемых тканей до 100 см3 и выше за время, не превышающее 15–20 минут [13].
Достоинством комплекса является также возможность непрерывного контроля температуры нагрева в 4 точках с помощью компьютера, подключаемого к установке.
Клиническая апробация установки подтвердила результаты экспериментальных исследований, полученные на имитаторах биообъектов.
ЛИТЕРАТУРА
- Долгушин Б.И., Косырев В.Ю. Радиочастотная термоабляция опухолей. Под ред. М.И. Давыдова. М. 2015;192 с.
- Решетов И.В. Опухоли органов головы и шеи: технологии лечения и реабилитации пациентов: реконструкция тканей. М. 2016;520 с.
- Hirooka M. No-touch radiofrequency ablation is an ideal method to prevent intrahepatic metastasis of hepatocellular carcinoma. AASLD LiverLearning. 2017;194949.
- Hocquelet A., Aubé C., Rode A., Cartier V., Sutter O., Manichon A.F., Boursier J., N’kontchou G., Merle P., Blanc J.F., Trillaud H., Seror O. Comparison of no-touch multi-bipolar vs.monopolar radiofrequency ablation for small HCC. J. Hepatol. 2017;66:67–74.
- Chang W., Lee J.M., Lee S.M., Han J.K. No-Touch Radiofrequency Ablation: A Comparison of Switching Bipolar and Switching Monopolar Ablation in Ex Vivo Bovine Liver. Kor. J. Radiol. 2017;18(2): 279–88.
- Seror O., N’Kontchou G., Van Nhieu J.T., Rabahi Y., Nahon P., Laurent A., Trinchet J.C., Cherqui D., Vicaut E., Beaugrand M., Sellier N. Histopathologic comparison of monopolar versus no-touch multipolar radiofrequency ablation to treat hepatocellular carcinoma within Milan criteria. J. Vasc. Interv. Radiol. 2014;25:599–607
7.Seror O., N’Kontchou G., Nault J.C., Rabahi Y., Nahon P., Ganne-Carrié N., Grando V., Zentar N., Beaugrand M., Trinchet J.C., Diallo A., Sellier N. Hepatocellular carcinoma within Milan criteria: no-touch multibipolar radiofrequency ablation for treatment-long-term results. Radiology. 2016;280:611–21.
- Wu L.W., Chen C.Y., Liu C.J., et al. Multipolar radiofrequency ablation with non-touch technique for hepatocellular carcinoma≤3 cm: a preliminary report. Adv. Dig. Med. 2014;1:80–5.
- Макаров В.Н., Махов М.А, Мирошник В.И. Применение многоэлектродных систем в радиочастотных устройствах для абляции тканей. Биомедицинская радиоэлектроника. 2017;4:55–62
- Zhang B., Moser M.A., Zhang E.M., Luo Y., Liu C., Zhang W. A review of radiofrequency ablation: Large target tissue necrosis and mathematical modeling. Phys. Med. 2016;32:961–71.
- Choi T.W., Lee J.M., Lee D.H., Lee J.H., Yu S.J., Kim Y.J., Yoon J.H., Han J.K. Percutaneous Dual-Switching Monopolar Radiofrequency Ablation Using a Separable Clustered Electrode: A Preliminary Study. Kor. J. Radiol. 2017;18(5):799–808.
- Cartier V., Boursier J., Lebigot J., Oberti F., Fouchard-Hubert I., Aubé C. Radiofrequency ablation of hepatocellular carcinoma: Mono or multipolar? J. Gastroenterol. Hepatol. 2016;31(3):654–60.
- Макаров В.Н. Аппаратное и электродное обеспечение зарубежных и отечественных установок для радиочастотной абляции. 19-я научнотехническая конференция «Медико-технические технологии на страже здоровья» МЕДТЕХ-2017.Сборник трудов. НИИ РЛ им. Н.Э. Баумана. М. 2017;91–100
- Zhang T.Q., Zhang Y.Y., Gu Y.K., Gao F., Huang Z.M., Huang J.H. Clinical application of multi-electrode synchronous radiofrequency ablation via switching controller for treating large hepatocellular carcinoma. Zhonghua Yi Xue Za Zhi. 2016; 96(35):2777–80.
- Макаров В.Н., Махов М.А, Мирошник В.И. Исследование многоэлектродной радиочастотной абляции в биполярном режиме при температурном управлении процессом нагрева. Биомедицинская радиоэлектроника. 2017;12:50–9.
Поступила 30.01.18
Принята в печать 20.03.18
REFERENCES
- DolgushinBI, KosyrevV.Yu. Radiofrequencythermoablationoftumors. Ed. M.I. Davydov. M. 2015; 192 p. (In Russ.).
- Reshetov I.V. Tumors of the head and neck organs: technologies for treating and rehabilitating patients: tissue reconstruction. M. 2016; 520 s.
- Hirooka M. No-touch radiofrequency ablation is an ideal method to prevent intrahepatic metastasis of hepatocellular carcinoma. AASLD LiverLearning. 2017;194949.
- Hocquelet A., Aubé C., Rode A., Cartier V., Sutter O., Manichon A.F., Boursier J., N’kontchou G., Merle P., Blanc J.F., Trillaud H., Seror O. Comparison of no-touch multi-bipolar vs.monopolar radiofrequency ablation for small HCC. J. Hepatol. 2017;66:67–74.
- Chang W., Lee J.M., Lee S.M., Han J.K. No-Touch Radiofrequency Ablation: A Comparison of Switching Bipolar and Switching Monopolar Ablation in Ex Vivo Bovine Liver. Kor. J. Radiol. 2017;18(2):279–88.
- Seror O., N’Kontchou G., Van Nhieu J.T., Rabahi Y., Nahon P., Laurent A., Trinchet J.C., Cherqui D., Vicaut E., Beaugrand M., Sellier N. Histopathologic comparison of monopolar versus no-touch multipolar radiofrequency ablation to treat hepatocellular carcinoma within Milan criteria. J. Vasc. Interv. Radiol. 2014;25:599–607.
- Seror O., N’Kontchou G., Nault J.C., Rabahi Y., Nahon P., Ganne-Carrié N., Grando V., Zentar N., Beaugrand M., Trinchet J.C., Diallo A., Sellier N. Hepatocellular carcinoma within Milan criteria: no-touch multibipolar radiofrequency ablation for treatment-long-term results. Radiology. 2016;280:611–21.
- Wu L.W., Chen C.Y., Liu C.J., et al. Multipolar radiofrequency ablation with non-touch technique for hepatocellular carcinoma≤3 cm: a preliminary report. Adv. Dig. Med. 2014;1:80–5.
- Makarov V.N., Makhov M.A., Miroshnik V.I. The use of multi-electrode systems in radio frequency devices for tissue ablation. Biomedicinskaya radioehlektronika. 2017;4: 55–62 (In Russ.).
- Zhang B., Moser M.A., Zhang E.M., Luo Y., Liu C., Zhang W. A review of radiofrequency ablation: Large target tissue necrosis and mathematical modeling. Phys. Med. 2016;32:961–71.
- Choi T.W., Lee J.M., Lee D.H., Lee J.H., Yu S.J., Kim Y.J., Yoon J.H., Han J.K. Percutaneous Dual-Switching Monopolar Radiofrequency Ablation Using a Separable Clustered Electrode: A Preliminary Study. Kor. J. Radiol. 2017;18(5):799–808.
- Cartier V., Boursier J., Lebigot J., Oberti F., Fouchard-Hubert I., Aubé C. Radiofrequency ablation of hepatocellular carcinoma: Mono or multipolar? J. Gastroenterol. Hepatol. 2016;31(3):654–60.
- Makarov V.N. Hardware and electrode support of foreign and domestic installations for radiofrequency ablation. The 19th scientific and technical conference “Medical-technical technologies on the guard of health” MEDTECH-2017. Collection of papers. SRI RL them. N.E. Bauman. M. 2017; 91–100 (In Russ.).
- Zhang T.Q., Zhang Y.Y., Gu Y.K., Gao F., Huang Z.M., Huang J.H. Clinical application of multi-electrode synchronous radiofrequency ablation via switching controller for treating large hepatocellular carcinoma. Zhonghua Yi Xue Za Zhi. 2016; 96(35):2777–80.
- Makarov V.N., Makhov M.A., Miroshnik V.I. Investigation of multielectrode radiofrequency ablation in bipolar mode with temperature control of the heating process. Biomedicinskaya radioehlektronika. 2017; 12: 50–9 (In Russ.).
Received 30.01.18
Accepted 20.03.18
Сведения об авторах:
И.В. Решетов – д.м.н., профессор, академик РАН, заведующий кафедрой пластической хирургии ПервогоМГМУ им. И.М. Сеченова (Сеченовский университет), заведующий кафедрой онкологии и пластической хирургии Института повышения квалификации Федерального медико-биологического агентства; e-mail: reshetoviv@mail.ru, orcid.org/0000-0002-0580-7052.
В.Н. Макаров – д.физ.-мат.н., профессор кафедры Биокибернетические системы и технологии Московского технологического университета (МИРЭА), науч. руководитель фирмы «Техносвет», Москва, Россия: e-mail: makarov_vn@bk.ru.
About the authors:
I.V. Reshetov – MD, PhD, Professor, Academician of the Russian Academy of Sciences, Head of the Department of Plastic Surgery of the First Moscow State Medical University named after I.M. Sechenov (Sechenov University), Head of the Department of Oncology and Plastic Surgery of the Institute for Advanced Studies of the Federal Medical-Biological Agency; e-mail: reshetoviv@mail.ru, orcid. org/0000-0002-0580-7052.
V.N. Makarov – Doctor of Physics and Mathematics, Professor, Department of Biocybernetic Systems and Technologies, Moscow Technological University, supervisor of Technosvet, Moscow, Russia: e-mail: makarov_vn@bk.ru