Для цитирования: Дустов Ш.Х., Решетов И.В. Бесшовные методы микрососудистого анастомоза в реконструктивно-востановительной хирургии. Голова и шея. Российский журнал Head and neck Russian Journal. 2019;7(3):64–68.
For citation: Dustov SH. KH., Reshetov I.V. Sutureless microvascular anastomoses in reconstructive surgery. Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2019;7(3):1: 64–68 (in Russian).
Doi: 10.25792/HN.2019.7.3.64–68
В различных литературных данных описаны множественные методы соединения мелких сосудов, основную часть которых сшивают вручную под операционным микроскопом. Был описан широкий спектр методов зашивания вручную, и они все еще развиваются рутинно. Кроме того, в последние годы бесшовные методы анастомозирования мелких сосудов широко внедряются благодаря многочисленным экстра и интравазальным методам. В этой статье рассмотрена техника микрохирургического шва для соединения мелких сосудов и представлены аргументы в пользу бесшовных методов для анастомозирования в качестве альтернативы стандартному наложению швов.
Ключевые слова: анастомоз, микрохирургия, микрососуды, бесшовные методы
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Дустов Ш.Х., Решетов И.В. Бесшовные методы микрососудистого анастомоза в реконструктивно-востановительной хирургии. Голова и шея. Российский журнал Head and neck Russian Journal. 2019;7(3):64–68.
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
A plethora of methods has been proposed for microvessels ligation, with the mainstay being hand suturing under an operating microscope. A broad range of hand-sutured techniques has been described, and they are still routinely evolving today. In addition, in recent years, sutureless methods of ligation of small vessels have been widely introduced due to numerous extra and intravasal methods. This article discusses the microsurgical suture technique for connecting small vessels and presents arguments in favor of sutureless methods for anastomosing proposed as an alternative to standard suturing.
Key words: anastomosis, microsurgery, microvessels, seamless.
The authors declare no conflict of interest.
Source of financing: not specified.
For citation: Dustov SH. KH., Reshetov I.V. Sutureless microvascular anastomoses in reconstructive surgery. Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2019;7(3):1: 64–68 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of pub-lishing illustrative material – tables, figures, photographs of patients.
Микрососудистые анастомозы
Микрохирургическая процедура как метод был бы невозможным без помощи оптического увеличения. Хотя соединение (анастомозирование) кровеносных сосудов было выполнено в конце девятнадцатого века, только в середине ХХ века с использованием оптического микроскопа аностомозирование мелких кровеносных сосудов стало доступным. С того времени было предложено много методов для соединения микрососудов, которые все еще совершенствуются. В этой статье рассматриваются различные техники микрохирургического наложения швов для микрососудистых анастомозов и представлен целый ряд бесшовных методов для анастомозирования в качестве альтернативы стандартному наложению швов.
Бесшовные анастомозы
Благодаря современным микрохирургическим инструментам и применению интраоперационного оптического увеличения достигнуты успешные результаты наложения микрососудистого анастомоза по сравнению с простым ушиванием, что предполагает определенный метод обработки сосуда и, следовательно, возможность избежать повреждения интимы. Кроме того, сам шовный материал (либо полипропилен, либо нейлон) остается в просвете сосудов. Эти факторы, среди прочего, способствуют отторжению ушиваемых анастомозов, примерно в 2–6% случаев [3–4], и вторичному тромбообразованию. Даже для опытного микрохирурга микрососудистый анастомоз остается сложным, отнимающим много времени процессом. В связи с этим в последние десятилетия изучались альтернативные методы наложения швов [2, 5–7]. _ Эти методики без наложения швов можно разделить на зажимы, скобки, клеи, лазерные анастомозы, стенты, магниты, гели и устройства с кольцевыми штырями [1, 8].
Клипсы/Скобы
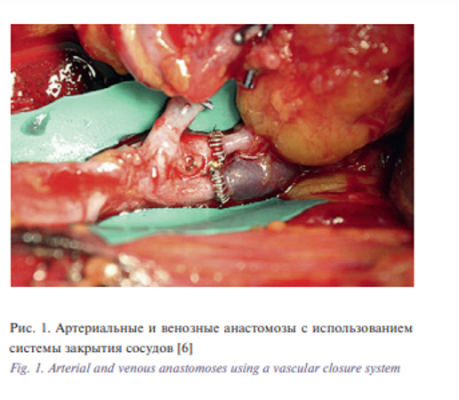
Первые клипсы в своей практике использовал для соединения сосудов A. Bikfalvi, , а также S. Dubecz в 1953 г. [8]. Несколько изменений в этой сфере произошли в последующие годы в работах W.M. Kirsch и соавт., которые провели большую работу [9]. Эти ученые модифицировали предыдущие устройства, чтобы применить серию непроникающих клипс, которые могут быть индивидуально размещены вокруг анастомоза. Эта работа в конечном итоге привела к разработке коммерчески доступной системы закрытия сосудов, которая в настоящее время используется в клинической практике. Эта система требует позиционирования серии наложения швов, использования специальных инструментов для выворачивания сосудистых концов. В последующем непроникающие клипсы вставляют между швами, которые затем удаляются (рис. 1). Произведено несколько исследований, демонстрирующих эффективность этой техники с эквивалентной проходимостью соединенных анастомозов [6, 7, 10–12].
Другая система клипс, разработанная для сосудистого анастомоза, называется U-Clip. Преимущество перед ушитым анастомозом заключается в том, что нет необходимости завязывать микрохирургические узлы. Следовательно, процедура проводится с меньшей затратой времени, но в отличие от непроникающих клипс при использовании этого метода в просвете сосуда остается посторонний материал. Этот метод используется не так широко, как непроникающие клипсы, и имеет немного доказательств, подтверждающих его клиническое использование [13–15].
Клеи
В последние годы наблюдается тенденция к росту числа случаев использования клеев и адгезивов в хирургии [16]. Широкий ассортимент клеящих веществ можно разделить на две категории: «цианоакрилаты» и «фибриновые клеи», в основе которых лежит тромбин. Фибриновые клеи содержат компоненты, имитирующие конечный этап свертывания крови [1], и часто используются _ в качестве дополнения к системному шву с целью уменьшения числа швов, необходимых при наложении анастомоза, что и продемонстрировано в работах A.B. Cho и других когортных исследованиях [17]. Были проведены клинические исследования, изучавшие использование фибриновых клеев для анастомоза у пациентов при реконструкции груди без каких-либо данных о недостаточности анастомоза [18]. Тем не менее, учитывая состав самого клея, многие хирурги предпочитают использовать вещества, которые могут вызвать свертывание в микрососудистых анастомозах [19]. Клеи с цианакрилатной основой впервые были экспериментально использованы для сосудистого анастомоза в 1960-х гг. [20]. Однако в течение относительно короткого промежутка времени несколько проблем с этим методом были идентифицированы в рамках работы A.R. Green и соавт. [21], которые экспериментально продемонстрировали раннюю реакцию на инородное тело с образованием гигантских клеток, а затем чрезмерное истончение стенки сосуда. По этим причинам среди прочего, в т.ч. из-за сильного тепловыделения во время полимеризации [1], цианоакрилаты обычно не используются для анастомозирования микрососудов. Важно отметить, что некоторые из цианоакрилатов нового поколения не вызывают той же тканевой реакции, которая наблюдалась в этих исследованиях, и, действительно, демонстрируют меньшую реакцию, чем шовный анастомоз [22, 23].
Магниты
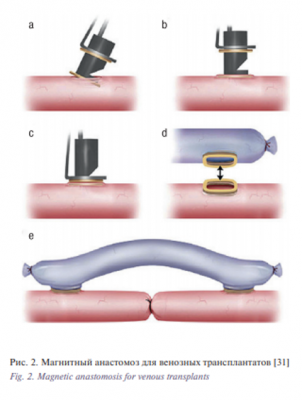
Аностомозирование сосудов с помощью магнитов было впервые проведено еще в 1978 г. Y. Oborа и соавт. [29], после чего 2 года спустя та же группа опубликовала научную статью [30]. Этот метод включает проведение концов сосуда через полный магнит и закрепление вывернутых краев на штифты. Магниты обеспечили необходимую силу для соединения двух просветов сосуда. Результаты, представленные этой группой, показали степень проходимости в 90% в сосудах с максимальным диаметром 1 мм, со средним временем формирования анастомоза 8 минут. Несмотря на эти положительные результаты, магнитное анастомозирование микрососудов не нашло широкого применения в обычной практике. Были проведены отдельные исследования, аргументирующие использование магнитов для анастомозов в венозных трансплантатах [31] (рис. 2), а также для анастомозов без швов на модели собаки с использованием намагниченных шпилек [32].
Гели
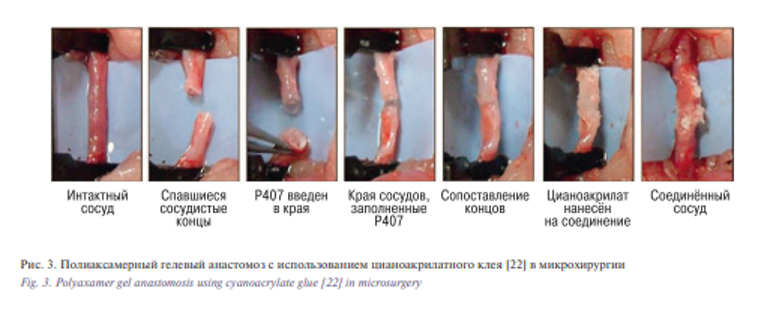
Гели для анастомозирования микрососудов преимущественно используются для получения временного «закупоривания» сосуда с двумя целями, во-первых, чтобы свести на нет использование сосудистых зажимов и, во-вторых, чтобы держать конец сосуда открытым, дабы облегчить требуемый метод анастомозирования. Сами гели состоят из ряда веществ, которые растворяются при воздействии высоких [22, 23] или низких [33, 34] температур. Гель не формирует анастомоз должным образом, скорее всего, он помогает анастомозированию при наложении швов или анастомозированию при нанесении клея. Клинические данные о переносе свободных трансплантатов с использованием клея недавно сообщили G.A. Giessler и др. [33]. В этой ситуации гель использовался для облегчения наложения анастомоза, а затем растворялся с использованием местного холодного физиологического раствора. Они доказали состоятельность анастомоза и предположили, что гель – достойная альтернатива микрозажимам, особенно для атеросклеротических артерий и поврежденных участков анастомоза [33]. В исследовании E.I. Chang и др. был использован уникальный состав геля полоаксамера [22] для создания клеевого анастомоза с использованием цианоакрилатного клея без швов (рис. 3). Впоследствии гель был растворен с использованием внешнего источника тепла. Q. Qassemyar и G. Michel [23] использовали коммерчески доступный гель LeGoo для выполнения почти идентичной процедуры, однако LeGoo не требует добавления внешнего источника тепла для растворения, поэтому процедура является более простой. Важным дополнением к этому является то, что обе группы нашли значимо меньше реакций на инородное тело в цианоакрилатном анастомозе, чем в ушитых в исследовании, проведенном в 1980-х гг. [22].
Стенты
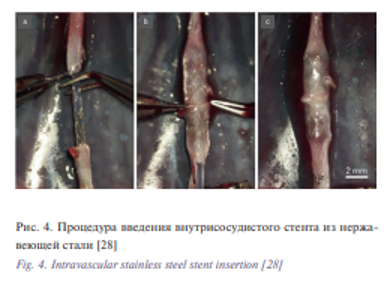
В то время как внутрисосудистые стенты были использованы с конца ХIХ века в той или иной форме, первый капиллярный анастомоз, выполненный с использованием стента, произведен в 1979 г. S. Yamagata [24]. В его исследовании сравнивались 3 типа растворимого трубчатого стента из поливинилового спирта, используемого для анастомоза сонных артерий у крыс с местным применением цианоакрилатного клея. Их двухслойные стенты демонстрировали проходимость от 92 до 98% в течение максимум шести месяцев. Дальнейшие экспериментальные исследования проводились с использованием абсорбируемых стентов в сосудах диаметром 0,35 мм путем наложения анастомоза, с использованием адгезивов, которые продемонстрировали непосредственно лучшие показатели проходимости по сравнению с методами при которых использовались только адгезивы [25]. C. Mikaelsson и E. Arnbjörnsson в своих работах [26] использовали внутрисосудистые цилиндрические стенты для анастомозирования аорты крысы без помощи клея. Совсем недавно существующие металлические кардиологические стенты были использованы для выполнения микроанастомозов в диагностическом исследовании [27] с многообещающими начальными результатами. Этот стент опирается на баллон, который необходим для дилатации стенок до нужного размера и, следовательно, в данном случае необходим прокол стенки сосуда в отдаленном месте от анастомоза, что может быть неидеальным во многих пластических, хирургических операциях, например для переноса свободных тканей. Аналогичное исследование было проведено под руководством F. Bauer [28] с использованием стентов из нержавеющей стали при наложении анастомоза аорты у девяти крыс (рис. 4).
Из девяти наложенных анастомозаов в одном проценте случаев отмечался тромбоз, а в четырех требовалась дополнительная герметизация анастомоза фибриновым клеем. Эти исследования наглядно демонстрируют возможности микрососудистого анастомоза с использованием стента.
Последняя информация о бесшовном методе микрососудистого анастомоза с использованием микростента опубликованы в журнале “PLOSone” в 2017 г. Авторы использовали бесшовный метод соединения сосудов малого диаметра, с использованием микростента NiTi (Microstent) 45 лабораторным крысам и доказали, что выполнение сосудистого анастомоза этим методом заняло меньше времени, чем при ручном методе шва. Кроме того, достигнуты аналогичные или лучшие результаты в отношении образования тромба, степени проходимости просвета и прочности кровеносных сосудов по сравнению с методом ручного сшивания [35].
Заключение
Таким образом, при сшивании сосудов малого диаметра из-за их особенностей, упруго-эластических свойств создаются технические трудности и предпосылки для травматизации, но в то же время эти свойства служат и основой, облегчающей выполнение микроанастомозов. Поэтому актуальной остается разработка новых методов бесшовного соединения сосудов малого диаметра. Бесшовный микроанастамоз по сравнению с шовными методами включает не только более щадящие, но и простые в исполнении приемы и обеспечивает высокий процент проходимости сосудов малого диаметра. Разрабатывается несколько новых методов восстановления микрососудов для сокращения времени процедуры, таких как лазер, клей, внутрисосудистый стент, магнит, микрососудистая анастомотическая система и т.д. Основными причинами разработки этих альтернативных методов являются сокращение времени, необходимого для выполнения анастомоза, снижение травматичности и вероятности тромбообразования. Кроме того, устранение несоответствия размеров, снижение затрат и разработка техники, которую относительно легко освоить и выполнять, являются важными факторами, способствующими разработке этих альтернативных методов.
ЛИТЕРАТУРА/REFERENCES
- Zeebregts C.J., Heijmen R.H., van den Dungen J.J., van Schilfgaarde R. Nonsuture methods of vascular anastomosis. Br. J. Surg. 2003;90(3):261–71.
- Jandali S., Wu L.C., Vega S.J., Kovach S.J., Serletti J.M. 1000 consecutive venous anastomoses using the microvascular anastomotic coupler in breast reconstruction. Plast. Reconstruct. Surg. 2010;125(3):792–8.
- Disa J.J., Cordeiro P.G., Hidalgo D.A. Efficacy of conventional monitoring techniques in free tissue transfer: An 11-year experience in 750 consecutive cases. Plast. Reconstruct. Surg. 1999;104(1):97–101. 4. Kroll S.S., Schusterman M.A., Reece G.P., Miller M.J., Evans G.R., Robb G.L., et al. Choice of flap and incidence of free flap success. Plast. Reconstruct. Surg. 1996;98(3):459–63.
- Ardehali B., Morritt A.N., Jain A. Systematic review: Anastomotic microvascular device. J. Plast. Reconstruct. Aesthet. Surg. JPRAS. 2014;67(6):752–5.
- Reddy C., Pennington D., Stern H. Microvascular anastomosis using the vascular closure device in free flap reconstructive surgery: A 13-year experience. J. Plast. Reconstruct. Aesthet. Surg. JPRAS. 2012;65(2):195–200.
- Zeebregts C., Acosta R., Bölander L., van Schilfgaarde R., Jakobsson O. Clinical experience with non-penetrating vascular clips in free-flap reconstructions. Br. J. Plast. Surg. 2002;55(2):105–10.
- Bikfalvi A., Dubecz S. Observations in animal experiments with mechanised vessel suture. J. Int. De Chirurgie. 1953;13(5):481–96.
- Kirsch W.M., Zhu Y.H., Hardesty R.A., Chapolini R. A new method for microvascular anastomosis: Report of experimental and clinical research. Am. Surg. 1992;58(12):722–7.
- Zeebregts C.J., Kirsch W.M., van den Dungen J.J., Zhu Y.H., van Schilfgaarde R. Five years’ world experience with nonpenetrating clips for vascular anastomoses. Am. J. Surg. 2004;187(6):751–60.
- Cope C., Lee K., Stern H., Pennington D. Use of the vascular closure staple clip applier for microvascular anastomosis in free-flap surgery. Plast. Reconstr. Surg. 2000;106(1):107–10.
- Rozen W.M., Whitaker I.S., Acosta R. Venous coupler for free-flap anastomosis: Outcomes of 1,000 cases. Anticancer Res. 2010;30(4):1293–4.
- Taylor J., Katz R., Singh N. Use of the U-clip for microvascular anastomosis. J. Microsurg. 2006;26(8):550–1. 14. Baynosa R.C., Stutman R., Mahabir R.C., Zamboni W.A., Khiabani K.T. Use of a novel penetrating, sutureless anastomotic device in arterial microvascular anastomoses. J. Reconstr. Microsurg. 2008;24(1):39–42.
- Maher J.L., Roehl K.R., Mahabir R.C. A prospective evaluation of U-clips for arterial microvascular anastomoses. J. Reconstr. Microsurg. 2012;28(8):543–8.
- Lee M.G.M., & Jones, D. Applications of fibrin sealant in surgery. Surgical Innovation, 2005; 12(3): 203–213.
- Cho A.B., Wei T.H., Torres L.R., Júnior R.M., Rugiero G.M., Aita M.A. Fibrin glue application in microvascular anastomosis: Comparative study of two free flaps series. J. Microsurg. 2009;29(1):24–8.
- Andree C., Munder B.I.J., Behrendt P., Hellmann S., Audretsch W., Voigt M., et al. Improved safety of autologous breast reconstruction surgery by stabilisation of microsurgical vessel anastomoses using fibrin sealant in 349 free DIEP or fascia-muscle-sparing (fms)-TRAM flaps: A two-centre study. Breast (Edinburgh, Scotland). 2008;17(5):492–8.
- Marek C.A., Amiss L.R., Morgan R.F., Spotnitz W.D., Drake D.B. Acute thrombogenic effects of fibrin sealant on microvascular anastomoses in a rat model. Ann. Plast. Surg. 1998;41(4):415–9.
- Gottlob R., Blümel G. Anastomoses of small arteries and veins by means of bushings and adhesive. J. Cardiovasc. Surg. 1968;9(4):337–41.
- Green A.R., Milling M.A., Green A.R. Butylcyanoacrylate adhesives in microvascular surgery: An experimental pilot study. J. Reconstr. Microsurg. 1986;2(2):103–5.
- Chang E.I., Galvez M.G., Glotzbach J.P., Hamou C.D., El-ftesi S., Rappleye C.T., et al. Vascular anastomosis using controlled phase transitions in poloxamer gels. Nat. Med. 2011;17(9):1147–52.
- Qassemyar Q., Michel G. A new method of sutureless microvascular anastomoses using a thermosensitive poloxamer and cyanoacrylate: An experimental study. J. Microsurg. 2015;35(4):315–9.
- Yamagata S., Handa H., Taki W., Yonekawa Y., Ikada Y., Iwata H. Experimental nonsuture microvascular anastomosis using a soluble PVA tube and plastic adhesive. J. Microsurg. 1979; 1(3):208–15.
- Moskovitz M.J., Bass L., Zhang L., Siebert J.W. Microvascular anastomoses utilizing new intravascular stents. Anna. Plastic Surg. 1994;32(6):612–8.
- Mikaelsson C., Arnbjörnsson E. Nonsuture end-to-end microvascular anastomosis using intravascular stents. Ann.s Chirurg. Et Gynaecol. 1996;85(1):36–9.
- Prabhu I.S., Homer-Vanniasinkam S. A proof-of-principle study on animals for a new method of anastomosing vessels using intraluminal stents. J. CranioMaxillo-Facial Surg. Official Publication of the European Association for Cranio-Maxillo-Facial Surgery. 2013;41(4):327–30.
- Bauer F., Fichter A.M., Loeffelbein D.J., Wolff K.-D., Schütz K., Mücke T. Microvascular anastomosis using modified micro-stents: A pilot in vivo study. J. Cranio-Maxillo-Facial Surg. 2015;43(2):204–7.
- Obora Y., Tamaki N., Matsumoto S. Nonsuture microvascular anastomosis using magnet rings: Preliminary report. Surg. Neurol. 1978;9(2):117–20.
- Obora Y., Tamaki N., Matsumoto S. Nonsuture microvascular anastomosis using magnet rings. Neurol. Medico-Chirurgica. 1980;20(5):497–505.
- Heitmann C., Khan F.N., Erdmann D., Olbrich K.C., Sharkawy A.A., Klitzman B. Vein graft anastomoses with magnets. J. Plastic Reconstr. Aesthet. Surg: JPRAS. 2007;60(12):1296–301.
- Liu S.-Q., Lei P., Cao Z.-P., Lv Y., Li J.-H., Cui X.-H. Nonsuture anastomosis of arteries and veins using the magnetic pinned-ring device: A histologic and scanning electron microscopic study. Ann. Vascular. Surg. 2012;26(7):985–95.
- Giessler G.A., Fischborn G.T., Schmidt A.B. Clampless anastomosis with an intraluminal thermosensitive gel: First application in reconstructive microsurgery and literature review. J. Plastic Reconstr. Aesthet. Surg. 2012;65(1):100–5.
- Manchio J.V., Litchfield C.R., Zeheb R., Bryan D.J. Evaluation of a novel reverse thermosensitive polymer for use in microvascular surgery. J. Reconstr. Microsurg. 2009;25(1):69–76.
- Saegusa N., Sarukawa S., Ohta K., Takamatsu K., Watanabe M., Sugino T., Nakagawa M., Akiyama Y., Kusuhara M., Kishi K., Inoue K. Sutureless microvascular anastomosis assisted by an expandable shape-memory alloy stent. PLOS ONE. 2017;12(7): e0181520. doi:10/1371journal.pone.
Поступила 04.05.19 Принята в печать 01.08.19
Received 04.05.19 Accepted 01.08.19
Информация об авторах:
Ш.Х Дустов – заместитель директора по лечебным вопросам Бухарского филиала Республиканского специализированного научно практического медицинского центра онкологии и радиологии, Бухара, Узбекистан; e-mail: sherali_doc@mail.ru
И.В. Решетов – академик РАН, д.м.н., профессор, директор НОКЦ пластической хирургии, ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава РФ (Сеченовский Университет), Академия постдипломного образования ФГБУ ФНКЦ ФМБА России, Москва; e-mail: reshetoviv@ mail.ru
About the authors:
Sh. Kh. Dustov – Deputy Director for Medical Issues, Bukhara Branch of the Republican Specialized Scientific Practical Medical Center of Oncology and Radiology, Bukhara, Uzbekistan; e-mail: sherali_doc@mail.ru
I.V. Reshetov – academician of the Russian Academy of Sciences, MD, professor, director of the Scientific and Practical Center for Plastic Surgery, Federal State Autonomous Educational Institution of Higher Education First Moscow State Medical University named after I.M. Sechenov, Ministry of Health of the Russian Federation (Sechenovskiy University), Moscow, Academy of Postgraduate Education FSBI FSCC FMBA of Russia, Moscow