Для цитирования: Поляков К.А., Иванюшко Т.П., Аразашвили Л.Д., Медведев Ю.А., Трофимов Д.Ю., Абрамов Д.Д., Коршунова А.В., Образцова Т.А. Значение условно-патогенной микрофлоры в развитии остеонекрозов челюстей. Голова и шея Head and neck Russian Journal. 2018;6(2):15–19 Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
For citations: Polyakov K.A., Ivanyushko Т.P., Arazashvili L.D., Medvedev Yu.A., Trofimov D.Yu., Abramov D.D., Korshunova A.V., Obraztsova Т.А. The importance of an opportunistic microflora in the development of jaws osteonecrosses. Golova I Sheya Head and neck Russian Journal. 2018;6(2):15–19 (in Russian).
Doi: 10.25792/HN.2018.6.2.15–19
Цель: определение значения условно-патогенной микрофлоры полости рта в течении остеонекрозов челюстей (ОНЧ) различной этиологии.
Материал и методы. Оценку микрофлоры проводили у 15 больных остеонекрозом нижней челюсти (ОННЧ), из них 6 больных были с бисфосфонатным остеонекрозом, 4 больных – после лучевой терапии и 5 – с дезоморфиновой зависимостью. Была проведена количественная оценка содержания в образцах 12 групп факультативно- и облигатно-анаэробных микроорганизмов, грибов Candida spp., а также 5 пародонтопатогенов методом полимеразной цепной реакции в реальном времени.
Результаты и обсуждение. Представлены показатели состава аэробно-анаэробной микрофлоры у пациентов с ОНЧ в ротовой жидкости и костной ткани. В ротовой жидкости отмечен высокий показатель анаэробных патогенов, превышающий таковой у здоровых лиц на 1–3 порядка. В костной ткани показатель всех анаэробных микроорганизмов был выше, чем в ротовой жидкости на 2–4 порядка. На фоне частого применения антибиотикотерапии в костной ткани и ротовой жидкости отмечен высокий показатель содержания грибов рода Candida spp. и четырех пародонтопатогенов.
Выводы.
У больных ОНЧ различного происхождения выявлен высокий уровень анаэробных патогенов в ротовой жидкости и костной ткани. Костная ткань в наибольшей степени подвержена воздействию сообщества микроорганизмов. Хирургическое лечение приводит к эффективной санации в течение длительного периода. Курсы подобранной антибиотикотерапии свидетельствуют о положительной динамике в отношении уровня обсемененности ротовой жидкости у пациентов данной группы.
Ключевые слова: остеонекроз челюстей, условно-патогенные микроорганизмы, полимеразная цепная реакция в реальном времени.
Авторы заявляют об отсутствии конфликта интересов. Источник финансирования. Не указан.
Для цитирования: Поляков К.А., Иванюшко Т.П., Аразашвили Л.Д., Медведев Ю.А., Трофимов Д.Ю., Абрамов Д.Д., Коршунова А.В., Образцова Т.А. Значение условно-патогенной микрофлоры в развитии остеонекрозов челюстей. Голова и шея Head and neck Russian Journal. 2018;6(2):15–19 Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Aim. To define the significance of oral opportunistic microflora for the development of jaws osteonecrosis of various etiology.
Materials and methods. Microflora was assessed in 15 patients with mandibular osteonecrosis (MON), 6 patients with bisphosphonate osteonecrosis, 4 patients after radiation therapy and 5 desomorphine addicts. A quantitative assessment was performed on 12 groups of facultative and obligate anaerobic microorganisms, Candida spp. Fungi, and 5 parodontium pathogens by real-time polymerase chain reaction.
Results. The parameters of aerobic and anaerobic microflora content in the oral fluid and bone tissue are presented for patients with ON. In the oral fluid, a high index of anaerobic pathogens was detected, which is 1–3 orders of magnitude higher than in healthy individuals. In bone tissue, the rate of all anaerobic microorganisms was higher than in the oral fluid by 2–4 orders. The frequent use of antibiotics led to the increase of fungi Candida spp. and four periodontium pathogens in bone tissue and in the oral fluid.
Conclusion. In patients with MON of various origin, a high level of anaerobic pathogens was detected in the oral fluid and bone tissue. Bone tissue is most susceptible to the effects of microorganisms’ community. Surgical treatment leads to an effective sanitation for a long period. The courses of adequately selected antibiotic therapy contribute to the positive dynamics with respect to the level of dissemination of oral fluid in such category of patients.
Key words: osteonecrosis of jaws, conditionally pathogenic microorganisms, polymerase chain reaction in real time.
Authors declare no conflict of interests for this article.
Source of financing. Unspecified.
For citations: Polyakov K.A., Ivanyushko Т.P., Arazashvili L.D., Medvedev Yu.A., Trofimov D.Yu., Abramov D.D., Korshunova A.V., Obraztsova Т.А. The importance of an opportunistic microflora in the development of jaws osteonecrosses. Golova I Sheya Head and neck Russian Journal. 2018;6(2):15–19 (in Russian).
The authors are responsible for the originality of the presented data and the possibility of publishing illustrative material – tables, drawings, photographs of patients.
Введение
Остеонекрозы челюстей (ОНЧ) являются тяжелым осложнением на фоне общесоматических заболеваний [1–6]. К факторам риска развития остеонекроза (ОН) относятся медикаментозные средства (бисфосфонаты), комбинированное лечение онкологических больных с применением лучевой терапии, наркотическая зависимость. Из костей лицевого скелета наиболее часто поражается нижняя челюсть вследствие ряда особенностей, в т.ч. анатомических. Воздействие на организм медикаментозных средств приводит к изменениям в костной ткани, влияя на ангиогенез и остеогенез.
Долгосрочное лечение онкологических больных бисфосфонатами для лечения метастазов в костной ткани, а также применение наркотических препаратов – первитина и дезоморфина, содержащих фосфор, наркозависимыми лицами способны вызывать ОНЧ. Вторичное присоединение микрофлоры отрицательно влияет на процесс заживления костной раны [2–8].
Неудовлетворительные гигиена или санация полости рта, а также различные инвазивные вмешательства, такие как удаление зубов или размещение имплантатов, увеличивают риск инфицирования ОН костей лицевого скелета вследствие агрессивности анаэробных патогенов биопленки.
Применение при данной патологии антибиотикотерапии как основного метода лечения малоэффективно, т.к. применяется нерационально. Эффективным методом лечения на сегодняшний день остается хирургическое вмешательство, которое является сложной задачей и нередко неудовлетворительно по последствиям, что приводит к низкому качеству жизни данных пациентов.
Целью исследования было определение значения условнопатогенной микрофлоры полости рта в течении ОНЧ различной этиологии.
Материал и методы
Оценку микрофлоры проводили у 15 больных остеонекрозом нижней челюсти (ОННЧ), из них 6 больных были с бисфосфонатным ОН, 4 больных – после лучевой терапии и 5 – с дезоморфиновой зависимостью.
ОННЧ у 6 больных стал следствием приема препарата Зомета (золедроновая кислота) в инъекциях в течение длительного времени (от 1,5 до 3 лет). В анамнезе больных имелось онкологическое заболевание (рак молочной железы, рак предстательной железы) с метастазами в костную ткань. Им были проведены оперативное вмешательство и курсы химиотерапии в связи с наличием костных метастазов. Четырем пациентам с онкологическими заболеваниями (рак молочной железы, рак предстательной железы) в анамнезе было проведено комбинированное лечение – оперативное, химиотерапия, лучевая терапия по установленным схемам.
У 5 больных, на фоне длительного приема синтетических наркотических препаратов (дезоморфин, первитин), развился токсический фосфорный остеонекроз нижней челюсти. У данных больных имелись ряд сопутствующих заболеваний инфекционной и вирусной природы (гепатит С). При госпитализации в клинику челюстно-лицевой хирургии Первого МГМУ им. И.М. Сеченова больные предъявляли жалобы на боли в области нижней челюсти и наличие в полости рта свищей с гнойным отделяемым. Боли возникли после удаления зубов, постановки имплантатов, а у одной больной – после пользования съемным протезом.
При осмотре больных ОННЧ выявлено изменение конфигурации лица за счет отека поднижнечелюстной области. При пальпации определялся болезненный инфильтрат плотной консистенции. Имелись свищевые ходы со стороны кожных покровов. Открывание рта было болезненным.
В полости рта у всех больных наблюдались следующие клинические проявления: слизистая оболочка полости рта некротизирована, оголена костная ткань альвеолярного отростка челюсти, имелось упорное гнойное отделяемое из свищевых ходов с ихорозным запахом, неудовлетворительное состояние гигиены и санации полости рта. На компьютерной томограмме (КТ) имелись участки демаркации, свободно лежащие секвестры, множественные очаги деструкции, остеопороз, резорбция костной ткани нижней челюсти разных размеров.
Была проведена количественная оценка содержания в образцах 12 групп факультативно- и облигатно-анаэробных микроорганизмов и грибов Candida spp., а также 5 пародонтопатогенов методом полимеразной цепной реакции (ПЦР) в реальном времени. Показателем общей обсемененности исследуемого образца служила общая бактериальная масса (ОБМ).
Образцы костной ткани были взяты во время проведения оперативного лечения в виде блоковой или полной резекции челюсти. Взятие ротовой жидкости проводили с помощью стерильного одноразового зонда. Зонд погружали в ротовую жидкость в подъязычной области на 1–2 секунды и опускали в транспортную среду.
ДНК микроорганизмов выделяли при помощи набора реагентов «ПРОБА-ГС-ПЛЮС» (производства ООО «НПО ДНКТехнология»), согласно прилагаемой инструкции производителя. Методика выделения основана на лизисе биоматериала с последующими сорбцией ДНК на носителе, отмывкой примесей, элюцией ДНК с сорбента. ПЦР проводили с помощью детектирующего амплификатора «ДТ-96» (производства ООО «НПО ДНК-Технология», Россия). Учет результатов вели с помощью программного обеспечения, прилагающегося к детектирующему амплификатору «ДТ-96».
Статистическая обработка данных проводилась с помощью статистического пакета SPSS Statistics версии 17.0 (Inc., Chicago, USA). В качестве меры центральной тенденции количественных признаков выбрана медиана, а в качестве интервальной оценки – верхний и нижний квартили, т.к. исследуемые выборки не подчиняются закону нормального распределения.
Результаты и обсуждение
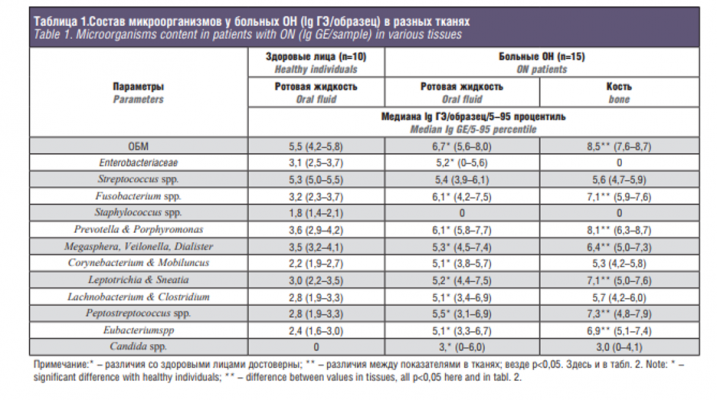
Полученные результаты исследования состава микрофлоры у больных ОННЧ представлены в табл. 1.
Показатель ОБМ в ротовой жидкости у больных ОН был выше на 1–3 порядка, чем у здоровых лиц. В костной ткани у больных ОН показатель ОБМ преобладал на 2–2,5 порядка выше, чем в ротовой жидкости. Различий между показателями у больных разных групп не выявлено, поэтому они объединены в одну группу. В табл. 1 представлены показатели состава аэробноанаэробной микрофлоры у больных ОН (Lg ГЭ/образец) в разных тканях. Состав микрофлоры в ротовой жидкости у данных больных резко отличались от показателей у здоровых лиц. У больных ОН в ротовой жидкости отмечен высокий показатель анаэробных патогенов, превышающий таковой у здоровых лиц на 1–3 порядка. В костной ткани показатель всех анаэробных микроорганизмов был выше, чем в ротовой жидкости на 2–4 порядка. При этом аэробные микроорганизмы в этих средах отсутствовали. У больных ОН на фоне частого применения антибиотикотерапии в костной ткани и в ротовой жидкости отмечен высокий показатель содержания грибов рода Candida spp.
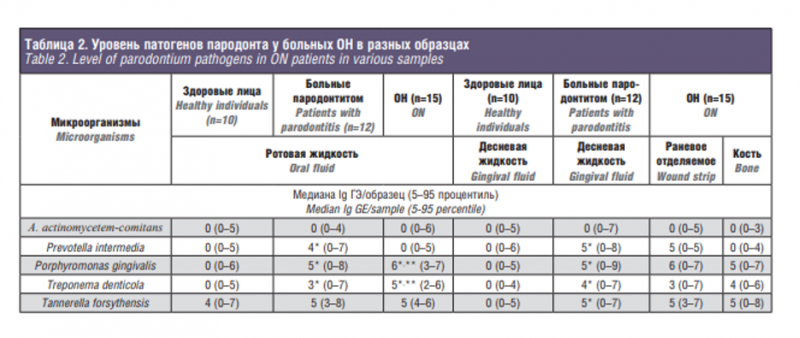
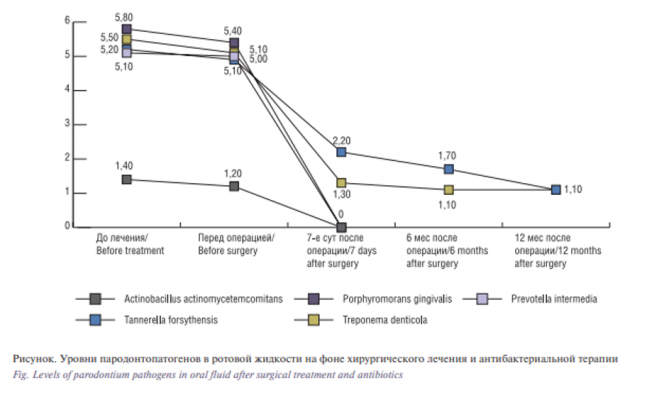
Показатели патогенов пародонта представлены в табл. 2. У здоровых лиц в исследуемых средах, таких как слюна и десневая жидкость, изучаемые патогенные микроорганизмы обнаруживались в единичных случаях. У больных пародонтитом отмечалось повышение числа всех пародонтопатогенов. Микроорганизм Aggregatibacter actinomycetemcomitans выявлялся в единичных случаях. У больных ОН в слюне, раневом отделяемом и в костной ткани были выявлены высокие показатели 4 микроорганизмов, кроме A. actinomycetemcomitans. До оперативного вмешательства всем пациентам был проведен курс антибактериальной терапии в течение 7 дней, затем 7 дней после операции. Антибактериальная терапия подбиралась с учетом чувствительности микрофлоры раневого отделяемого к данному виду антибактериального препарата по результатам бактериологического посева. В результате проведенного курса антибактериальной терапии количество пародонтопатогенов снизилось, но преобладающими видами остались T. denticola и T. forsythensis.После хирургического лечения на 7-е сутки, через 6–12 месяцев наблюдения A. actinomycetemcomitans, P. gingivalis и P. intermedia не были обнаружены, отмечалась регрессия видов T. forsythensis и T. denticola (см. рисунок).
Заключение
У больных с ОН нижней челюсти различного происхождения выявлен высокий уровень анаэробных патогенов в ротовой жидкости и костной ткани. Костная ткань в наибольшей степени была подвержена воздействию сообщества микроорганизмов. Достоверных различий по показателям уровня анаэробных патогенов у разных групп больных с ОН не выявлено. Внедрению микрофлоры в некротизированную костную ткань челюсти предшествовали лечебные мероприятия (удаление зубов), ношение полного съемного протеза, постановка зубных имплантатов, а также плохая гигиена и санация полости рта.
Важным условием профилактики развития ОН является сроки отмены медикаментозных средств у онкологических больных для возможности проведения хирургической санации полости рта. Удаление зубов рекомендуется проводить через 2–6 мес. после окончания курса химиотерапии. В связи с нарушением процессов регенерации кости не следует проводить имплантацию зубов. Съемное протезирование может привести к травме слизистой оболочки и внедрению микроорганизмов в костную ткань. Курсы подобранной антибиотикотерапии (цефазолин в инъекциях в течение 7 дней до операции и 7 дней после операции) свидетельствуют о положительной динамике в отношении уровня обсемененности ротовой жидкости у данной группы пациентов.
ЛИТЕРАТУРА
- Басин Е.М., Медведев Ю.А. Токсические фосфорные остеонекрозы лицевого черепа у лиц с наркотической зависимостью от дезоморфина и первитина. Стоматология. 2015;94(2):53–57. doi: 10.17116/stomat201594253-57.
- Иванюшко Т.П., Поляков К.А., Медведев Ю.А., Шаманаев С.В., Трофимов Д.Ю., Абрамов Д.Д., Балыкин Р.А. Исследование условно-патогенных микроорганизмов у больных с бисфосфонатным остеонекрозом челюстей. Стоматология. 2016;95(1):44–48. doi: 10.17116/stomat201695144-48.
- Медведев Ю.А., Басин Е.М., Коршунова А.В. Хирургическое лечение пациентов с наркотической зависимостью и остеонекрозом нижней челюсти. Стоматология. 2014;93(5):40–42.
- Поляков К.А., Медведев Ю.А., Омельченко А.С. Бисфосфонатные остеонекрозы челюстей: аспекты патогенеза и клинические проявления. Голова и шея. Российское издание. Журнал Общероссийской общественной организации «Федерация специалистов по лечению заболеваний головы и шеи». 2013;2:20–23.
- Almazrooa S.A., Woo S.B. Bisphosphonate and nonbisphosphonate-associated osteonecrosis of the jaw: a review. J. Am. Dent. Assoc. 2009;140(7):864–875.
- Boff R.C., Salum F.G., Figueiredo M.A., Cherubini K. Important aspects regarding the role of microorganisms in bisphosphonate-related osteonecrosis of the jaws. Arch. Oral. Biol. 2014;59(8):790–799. doi: 10.1016/j.archoralbio.2014.05.002.
- Wei X., Pushalkar S., Estilo C., Wong C., Farooki A., Fornier M., Bohle G., Huryn J., Li Y., Doty S., Saxena D. Molecular profiling of oral microbiota in jawbone samples of bisphosphonate-related osteonecrosis of the jaw. Oral. Dis. 2012;18(6):602–12. doi: 10.1111/j.1601-0825.2012.01916.x.
- Kumar S.K., Gorur A., Schaudinn C., Shuler C.F., Costerton J.W., Sedghizadeh P.P. The role of microbial biofilms in osteonecrosis of the jaw associated with bisphosphonate therapy. Curr. Osteoporos Rep. 2010;8(1):40–48. doi: 10.1007/ s11914-010-0008-1.
REFERENCES
- Basin E.M., Medvedev Yu.A. Toxic phosphoric osteonecrosis of the facial skull in persons with a drug dependence on desomorphine and pervitin. Stomatologiya. 2015; 94 (2): 53–57. [In Russ.] doi: 10.17116 / stomat201594253-57.
- Ivanyushko T.P., Polyakov K.A., Medvedev Yu.A., Shamanaev S.V., Trofimov D.Yu., Abramov D.D., Balykin R.A. Investigation of opportunistic microorganisms in patients with bisphosphonate osteonecrosis of the jaws. Stomatologiya. 2016;95 (1): 44–48 [In Russ.]. doi: 10.17116 / stomat 201695144-48.
- Medvedev Yu.A., Basin E.M., Korshunova A.V. Surgical treatment of patients with drug dependence and osteonecrosis of mandible. Stomatologiya. 2014; 93 (5): 40–42 [In Russ.].
- Polyakov K.A., Medvedev Yu.A., Omelchenko A.S. Bisphosphonate osteonecrosis of the jaws: aspects of pathogenesis and clinical manifestations. Head and neck. The Russian edition. Journal of the All-Russian Public Organization Federation of Specialists in the Treatment of Head and Neck Diseases. 2013; 2: 20–23 [In Russ.].
- Almazrooa S.A., Woo S.B. Bisphosphonate and nonbisphosphonate-associated osteonecrosis of the jaw: a review. J. Am. Dent. Assoc. 2009;140(7):864–875.
- Boff R.C., Salum F.G., Figueiredo M.A., Cherubini K. Important aspects regarding the role of microorganisms in bisphosphonate-related osteonecrosis of the jaws. Arch. Oral. Biol. 2014;59(8):790–799. doi: 10.1016/j.archoralbio.2014.05.002.
- Wei X., Pushalkar S., Estilo C., Wong C., Farooki A., Fornier M., Bohle G., Huryn J., Li Y., Doty S., Saxena D. Molecular profiling of oral microbiota in jawbone samples of bisphosphonate-related osteonecrosis of the jaw. Oral. Dis. 2012;18(6):602–12. doi: 10.1111/j.1601-0825.2012.01916.x.
- Kumar S.K., Gorur A., Schaudinn C., Shuler C.F., Costerton J.W., Sedghizadeh P.P. The role of microbial biofilms in osteonecrosis of the jaw associated with bisphosphonate therapy. Curr. Osteoporos Rep. 2010;8(1):40–48. doi: 10.1007/ s11914-010-0008-1.
Поступила 15.01.18 Принята в печать 20.03.18 Received 15.01.18 Accepted 20.03.18
Сведения об авторах:
К.А. Поляков – к.м.н., доцент кафедры ЧЛХ ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский университет), Москва, Россия Т.П. Иванюшко– д.м.н., доцент кафедры ЧЛХ ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский университет), Москва, Россия; e-mail: Ivanushko-Tatyana@yandex.ru
Ю.А. Медведев– д.м.н., профессор, заведующий кафедрой ЧЛХ ФПКВ МГМСУ им. А.И. Евдокимова, Москва, Россия Д.Ю. Трофимов– д.б.н., заведующий лабораторией НПФ ДНК-Технология, Москва, Россия
Д.Д. Абрамов – к.б.н., с.н.с. ГНЦИ иммунологии ФМБА России, Москва, Россия Л.Д. Аразашвили– к.м.н., доцент кафедры ЧЛХ ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский университет), Москва, Россия
Т.А. Образцова – ассистент кафедры ЧЛХ ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский университет), Москва, Россия
А.В. Коршунова – аспирант кафедры ЧЛХ ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовскийуниверситет), Москва, Россия
About the authors:
K.A. Polyakov – MD, Ph.D., associate professor of the department of MFS, FSAEI First Moscow State Medical University named after I.M. Sechenov (Sechenov University), Moscow, Russia
T.P. Ivanyushko – MD, Ph.D., associate professor of the department of MFS, FSAEI First Moscow State Medical University named after I.M. Sechenov (Sechenov University), Moscow, Russia
Yu.A. Medvedev – MD, professor, head of the department of MFS, MSMSU named after A.I. Evdokimov, Moscow, Russia
D.Yu. Trofimov – doctor of biological sciences, head of the laboratory SPF DNATechnology, Moscow, Russia D.D. Abramov – Candidate of biological sciences, senior researcher SNCI of Immunology, FMBA Russia, Moscow, Russia
L.D. Arazashvili – MD, Ph.D., associate professor, department of MFS, FSAEI First Moscow State Medical University named after I.M. Sechenov (Sechenov University), Moscow, Russia
T.A. Obraztsova – associate professor, department of MFS, FSAEI First Moscow State Medical University named after I.M. Sechenov (Sechenov University), Moscow, Russia
A.V. Korshunova – post-graduate, department of MFS, FSAEI First Moscow State Medical University named after I.M. Sechenov (Sechenov University), Moscow, Russia
Рецензия на статью
«ЗНАЧЕНИЕ УСЛОВНО-ПАТОГЕННОЙ МИКРОФЛОРЫ В РАЗВИТИИ ОСТЕОНЕКРОЗОВ ЧЕЛЮСТЕЙ». К.А. Поляков, Т.П. Иванюшко, Л.Д. Аразашвили, Ю.А. Медведев, Д.Ю. Трофимов, Д.Д. Абрамов, А.В. Коршунова, Т.А. Образцова
Актуальность данной статьи не вызывает сомнения, поскольку с увеличением средней продолжительности жизни больных онкологического профиля, распространенность остеонекрозов челюстей возрастает. И поиск новых высокоэффективных методов профилактики и лечения остеонекрозов челюстей сегодня является актуальной исследовательской задачей.
Автором проведена работа по определению 12 групп условно-патогенных микроорганизмов рта с помощью современного метода диагностики (ПЦР). Проведен сравнительный анализ с показателями у здоровых лиц. Данное направление способно определить новый подход к лечению остеонекрозов челюстей.
Review on the article
THE IMPORTANCE OF AN OPPORTUNISTIC MICROFLORA IN THE DEVELOPMENT OF JAWS OSTEONECROSSES K.A. Polyakov, Т.П. Ivanyushko, LD Arazashvili, Yu.A. Medvedev, D.Yu. Trofimov, D.D. Abramov, A.V. Korshunova, Т.А. Obraztsova
The relevance of this article is beyond doubt, since with the increase in the average life expectancy of cancer patients increases, as well as the incidence of osteonecrosis of the jaws. The search for new highly effective methods of osteonecrosis prevention and treatment is of high importance today.
The author defined 12 groups of opportunistic microorganisms in oral cavity with the modern diagnostic method use (PCR). A comparative analysis was carried out with definite indicators in healthy individuals. This direction can determine a new approach to the successful osteonecrosis treatment..