Для цитирования:
Саакян С.В., Тадевосян С.С., Цыганков А.Ю., Иванова О.А. Вторые опухоли у больных ретинобластомой в отдаленном периоде наблюдения (серия клинических случаев). Голова и шея. Российский журнал=Head and neck. Russian Journal. 2021;9(1):83–90
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллю- стративного материала – таблиц, рисунков, фотографий пациентов.
Doi: 10.25792/HN.2021.9.1.83–90
Материал и методы. С января 1986 по декабрь 2008 г. в отделе офтальмоонкологии и радиологии ФГБУ НМИЦ ГБ им. Гельмгольца Минздрава РФ обследовали и пролечили 903 ребенка с ретинобластомой. Из них в исследование вошли 140 больных ретинобластомой (70 мужчин, 70 женщин), получавших лечение в возра- сте от 1,5 до 108 месяцев (средний возраст на момент начала лечения составил 21,5±19,0 месяцев, медиана 16 месяцев), у которых удалось оценить полные сведения о состоянии здоровья. Средний возраст пациентов при оценке витального статуса составил 244,6±78,4 месяца (медиана 228 месяцев, макс. – 420, мин. – 120 ме- сяцев). Медиана срока наблюдения составила 228 месяцев. (интерквартильный размах от 168 до 288 месяцев). Монокулярную форму заболевания диагностировали в 87 (62,1%) случаях, бинокулярную форму – в 53 (37,9%). Результаты. При ретроспективном изучении сведений о 140 больных ВЗО выявлены в 9 (6,4%) случаях: остеосаркома бедренной кости – в 4, аденокарцинома околоушной слюнной железы – в 1, лейомиосарко- ма бедра – в 1, лимфосаркома мочевого пузыря – в 1, рак шейки матки – в 1, гистиоцитома – в 1 случае. В 1 случае после остеосаркомы бедренной кости метахронно развились третья и четвертая опухоли в ви- де рака щитовидной железы и саркомы мягких тканей плеча соответственно. Медиана от начала лечения до появления ВЗО составила 216 месяцев. Выживаемость в общей группе составила 98,6% (138 из 140 паци- ентов). Среди 9 больных ВЗО летальный исход наступил в 2 случаях. Риск развития ВЗО при бинокулярной форме заболевания (15,1%, 8 из 53) был значимо выше, чем при монокулярной (1,1%, 1 из 87; p=0,00186). Среди пациентов, получивших дистанционную лучевую терапию (ДЛТ) (41/29,3%), ВЗО выявлены в 4 (9,8%) случаев, среди 99 (70,7%) пациентов, не получавших ДЛТ, ВЗО отмечены в 2 раза реже – в 5 (5,0%) случаев. Однако при оценке ассоциаций между риском развития ВЗО и ДЛТ достоверных взаимосвязей не выявлено (p=0,44846). Среди пациентов с ВЗО только в 4 случаях удалось провести молекулярно-генетическое иссле- дование. У пациентки с лимфосаркомой мочевого пузыря и у ее матери выявлены гомозиготные мутации в локусе Q433P гена RB1, которые свидетельствуют о наличии семейной формы ретинобластомы, передаю- щейся по наследству. Мутации в этом локусе ассоциированы с развитием ВЗО у пациентов с ретинобластомой, локализованных в мочеполовой системе. У 3 пациентов гомозиготные мутации в гене RB1 отсутствовали. Заключение. Полученные данные свидетельствуют о необходимости регулярного наблюдения пациентов в течение всей жизни из-за высокого риска развития ВЗО. Пациентам необходимо проводить молекулярно- генетические исследования для определения риска развития ВЗО в соответствии с литературными данными и базой данных OMIM.
Ключевые слова: ретинобластома, вторые опухоли, отдаленный период наблюдения
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена без спонсорской поддержки.
Aim. To determine the incidence and the time of the occurrence of second nonocular malignant tumors (SMT) among survivors of retinoblastoma.
Materal and methods. 903 children with retinoblastoma were examined and treated in the ocular oncology and radiology department of Helmholtz National Medical Research Center of Eye Diseases from January 1986 to December 2008. The study included 140 patients with retinoblastoma (70 men, 70 women) who received treatment from the age of 1.5 months to 108 months (average age at the start of treatment was 21.5±19.0 months, median 16 months), in whom it was possible to evaluate complete information about the health condition. When assessing vital status, the average age of patients was 244.6±78.4 months (median 228 months, max. 420 months, min. 120 months). The median of follow-up period was 228 months. (interquartile range from 168 to 288 months). The monolateral disease was diagnosed in 62.1% of cases (n=87), the bilateral – in 37.9% (n=53).
Results. In a retrospective study of 140 patients, the SMT were detected in 9 cases (6.4%): osteosarcoma of femoral bone (n=4), parotid adenocarcinoma (n=1), femoral leiomyosarcoma (n=1), bladder lymphosarcoma (n=1), cervical cancer (n=1), histiocytoma (n=1). In 1 case, after osteosarcoma of the femoral bone, the third and fourth tumors in the form of thyroid cancer and soft tissue sarcoma of the shoulder metachronously developed. The median from the start of treatment to the appearance of the SMT was 216 months. Survival in the general group was 98.6% (n=138 out of 140). Among 9 patients with SMT 2 cases were fatal. The risk of developing SMT with bilateral disease (15.1%, n=8 out of 53) was significantly higher than with monolateral disease (1.1%, n=1 out of 87; p=0.00186). Among patients who received radiation therapy (RT) (29.3%, n=41), SMT were detected in 9.8% of cases (n=4), among patients who did not receive RT (70.7%, n=99), SMT detected 2 times less often — in 5.0% of cases (n=5). However, no reliable relationships between the risk of developing of SMT and RT were found (p=0.44846). Among patients with SMT, only 4 cases were able to conduct a genetic study. In a patient with bladder lymphosarcoma and her mother, homozygous mutations were detected at the Q433P locus of the RB1 gene in both of them, indicating hereditary RB. Mutations in this locus are associated with the development of SMT in patients with retinoblastoma localized in the urogenital system. Homozygous mutations in the RB1 gene were absent in 3 patients.
Conclusions. The findings suggest the need for regular life-long follow-up of patients due to the high risk of developing SMT. Patients need to conduct molecular genetic studies to determine the risk of a SMT in accordance with literature data and the OMIM database.
Key words: retinoblastoma, second nonocular malignant tumors, long-term follow-up
Conflicts of interest.
Funding. There was no funding for this study.
Введение
Ретинобластома является самой распространенной злокачественной внутриглазной опухолью у детей. Показатели выживаемости в развитых странах в настоящее время составляют до 95% при бинокулярной форме и 98% при монокулярной форме [1, 2].
Увеличение продолжительности жизни пациентов, получавших в детстве лечение по поводу злокачественных новообразований, позволяет оценить показатели их здоровья и определить отдаленные последствия проведенного лечения [3]. Одним из наиболее грозных отдаленных последствий терапии является развитие вторых злокачественных опухолей (ВЗО) [4]. Наиболее распространенные ВЗО при наличии ретинобластомы в анамнезе – саркомы костей и мягких тканей [5–7], включая рабдомиосаркому [8] и лейомиосаркому [5, 9], пинеобластому [10] и меланому кожи [5].
В нескольких крупных мультицентровых и популяционных исследованиях показано, что у лиц с наследственной формой ретинобластомы риск развития ВЗО превышает общепопуляционный, что, вероятно, обусловлено наличием генетически детерминированной предрасположенности к развитию опухолевых заболеваний и применением отдельных групп цитостатических препаратов и дистанционную лучевую терапию (ДЛТ) [5, 9, 11–13]. Лидирующей причиной смерти больных наследственной ретинобластомой в отдаленном периоде наблюдения является развитие ВЗО [14–18].
В литературе достаточно много работ, посвященных вопросу развития ВЗО. В работах A. MacCarthy и соавт. [5], R.A. Kleinerman и соавт. [13], T. Marees и соавт. [14] представ- лены большие выборки больных и анализ результатов эффек- тивности лечения и отдаленного наблюдения. В вышеперечисленных работах отмечены высокие показатели смертности по причине ВЗО среди больных наследственной ретинобластомой [5, 13, 14]. Однако многие вопросы остаются спорными, включая роль тех или иных причин развития опухолей, в связи с чем изучение данного вопроса является актуальным в практической офтальмоонкологии.
Цель исследования – определить сроки и характер развития ВЗО у больных ретинобластомой в отдаленном периоде наблюдения.
Материал и методы
В дизайне ретроспективного исследования проанализированы данные 903 детей с ретинобластомой, обследованных и пролеченных в отделе офтальмоонкологии и радиологии ФГБУ НМИЦ ГБ им. Гельмгольца Минздрава РФ с января 1986 по декабрь 2008 г. Из них в исследование вошли 140 больных ретинобластомой (70 мужчин, 70 женщин), которые получали лечение в возрасте от 1,5 до 108 месяцев (средний возраст на момент начала лечения составил 21,5±19,0 месяцев, меди- ана 16 месяцев), у которых удалось оценить полные сведения о состоянии здоровья. Средний возраст пациентов при оцен- ке витального статуса составил 244,6±78,4 месяца (медиана 228 месяцев, макс. – 420 месяцев, мин. – 120 месяцев). Медиана срока наблюдения за пациентами составила 228 месяцев (интер- квартильный размах от 168 до 288 месяцев). Монокулярную форму заболевания диагностировали в 87 (62,1%) случаев, бинокулярную форму – в 53 (37,9%).
Диспансерное наблюдение осуществляли в соответствии с приказом No135 Минздрава РФ от 19.04.1999 в детском и взрослом консультативно-диагностических отделениях ФГБУ НМИЦ ГБ им. Гельмгольца Минздрава РФ. Пациенты, которые по различным причинам не могли приехать на осмотр, сообщали о себе по телефону, факсу и через родственников. При необходимости больные предоставили выписки из амбулаторных карт с заключениями врачей-специалистов для подтверждения факта наличия ВЗО. Часть данных получена путем запросов в департаменты здравоохранения по месту жительства пациентов. Данные о проведенном лечении больных по поводу ретинобластомы получены ретроспективно. Пациенты с вторичными опухолями, развивающимися в зоне облучения, были исключены из исследования.
Статистическая обработка результатов исследования выполнена с использованием приложения Microsoft Excel 2010 и статистической программы Statistica 10 (Statsoft, США). Проведен расчет среднего арифметического значения (M), стандартного отклонения от среднего арифметического значения (SD), минимальных (min) и максимальных (max) значений, размаха вариаций Rv (разность max – min), интерквартильного размаха (25-й и 75-й процентили). Для исследования выживаемости пациентов после лечения использовался статистический метод множительных оценок Каплана–Мейера. Для оценки достоверности полученных результатов при сравнении средних показателей использовался t-критерий Стьюдента, при сравнении частот встречаемости признака – точный критерий Фишера. Различия между выборками считали достоверными при p<0,05, доверительный интервал (ДИ) 95%
Результаты
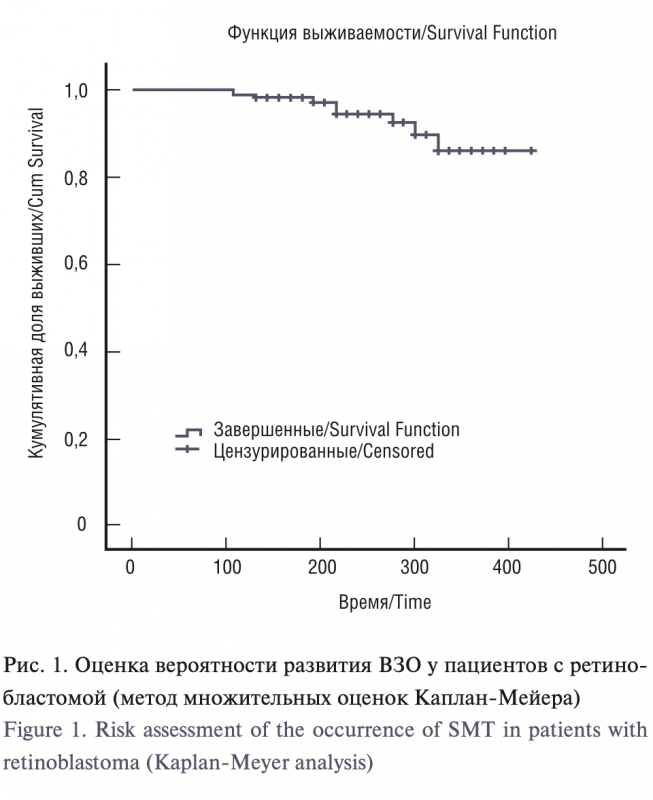
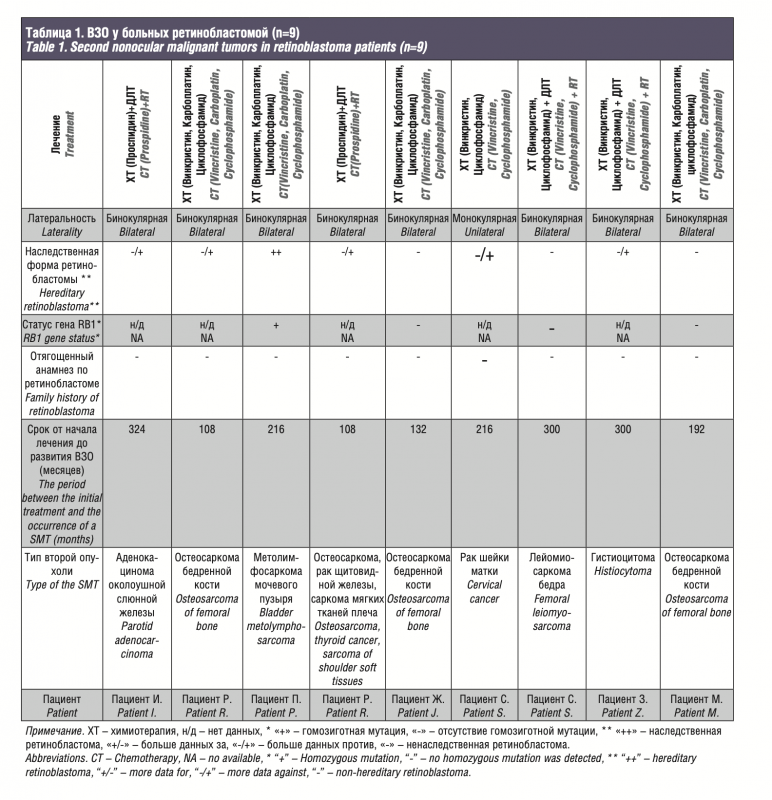
ВЗО выявлены у 9 (6,4%) из 140 пациентов, получавших лече- ние с 1986 по 2008 г. Медиана периода от начала лечения до раз- вития второй опухоли составила 216 месяцев (мин. 108 месяцев, макс. 300 месяцев) (рис. 1). Общая характеристика данных пациентов представлена в табл. 1.
Выживаемость в общей группе составила 98,6% (138 из 140 пациентов). Среди 9 больных ВЗО летальный исход наступил в 2 случаях.
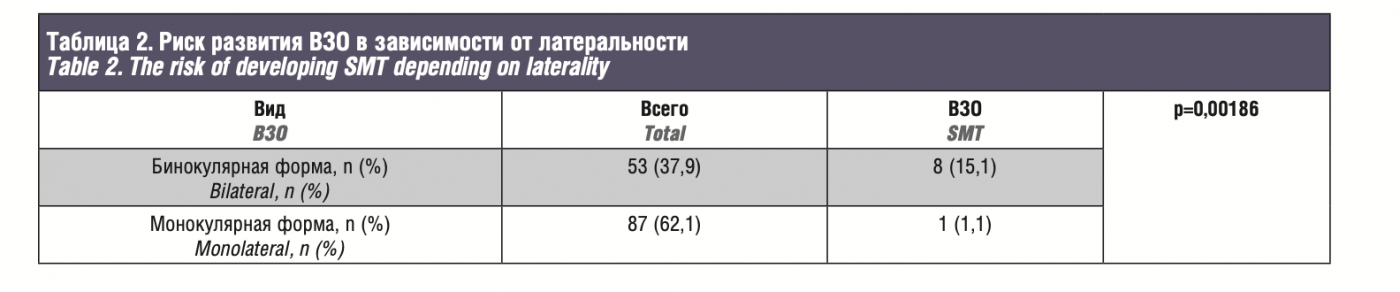
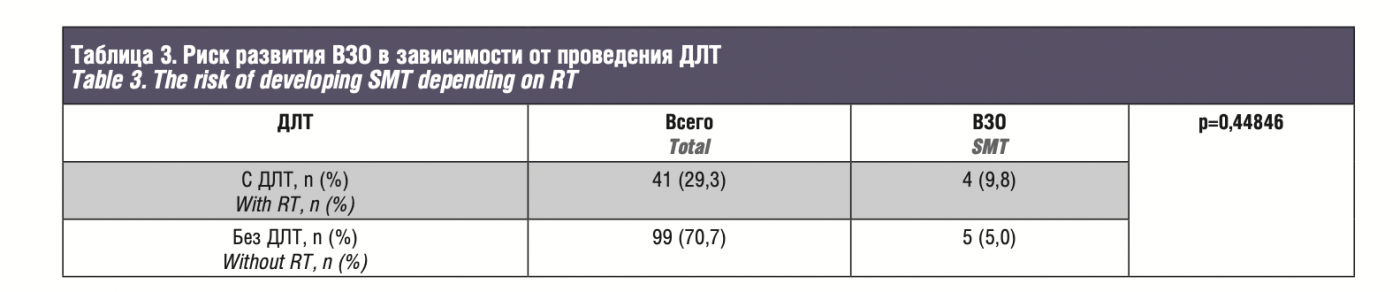
Риск развития ВЗО при бинокулярной форме заболевания (15,1%, 8 из 53 пациентов) был значимо выше, чем при монокулярной (1,1%, 1 из 87 пациентов; p=0,00186; табл. 2). Среди 41 (29,3%) пациента, получившего ДЛТ, ВЗО выявлены в 4 (9,8%) случаев, среди 99 (70,7%) пациентов, не получав- ших ДЛТ, ВЗО отмечены в 2 раза реже – в 5 (5,0%) случаев. Однако при оценке ассоциаций между риском развития ВЗО и ДЛТ достоверных взаимосвязей не выявлено (p=0,44846; табл. 3).
Клинические наблюдения
У больного И. через 27 лет от начала лечения развилась аде- нокарцинома околоушной железы. Он погиб от метастатической болезни через 28 лет после начала лечения.
Пациентка Р. с бинокулярной формой ретинобластомы умерла от остеосаркомы в августе 2017 г. через 9 лет после начала лечения. По данным регионального департамента здравоохранения, посмертный диагноз следующий: легочная эмболия без упоминания об остром легочном сердце, злокачественное новообразование длинных костей нижней конечности.
У пациентки П. 22 лет с бинокулярной формы ретинобластомы через 18 лет после проведенного лечения диагностировали лимфосаркому мочевого пузыря. Больная получала лечение у онкологов, на данный момент жива, выявлен синдром гиперактивного мочевого пузыря. При молекулярно-генетиче- ском исследовании, как у матери, так и у пациентки выявлены гомозиготные мутации в локусе Q433P гена RB1, которые сви- детельствуют о наличии семейной формы ретинобластомы, передающейся по наследству. Мутации в указанном локусе ассоциированы с развитием ВЗО у пациентов с ретинобластомой, локализованных в пределах мочеполовой системы. Полученные данные свидетельствуют о наличии наследственного ракового синдрома и необходимости регулярного пожизненного наблюдения за пациенткой П. в связи с высоким риском развития ВЗО.
У пациентки Р. 29 лет с бинокулярной формой ретинобластомы в возрасте 9 лет развилась остеосаркома нижней конечности, по поводу чего больная получала системную ХТ. В возрасте 24 лет у пациентки развился рак щитовидной железы, по поводу чего была проведена радиойодтерапия и тиреоидэктомия. Затем у больной развилась саркома мягких тканей плеча. На данный момент пациентка жива, преподает в музыкальной школе.
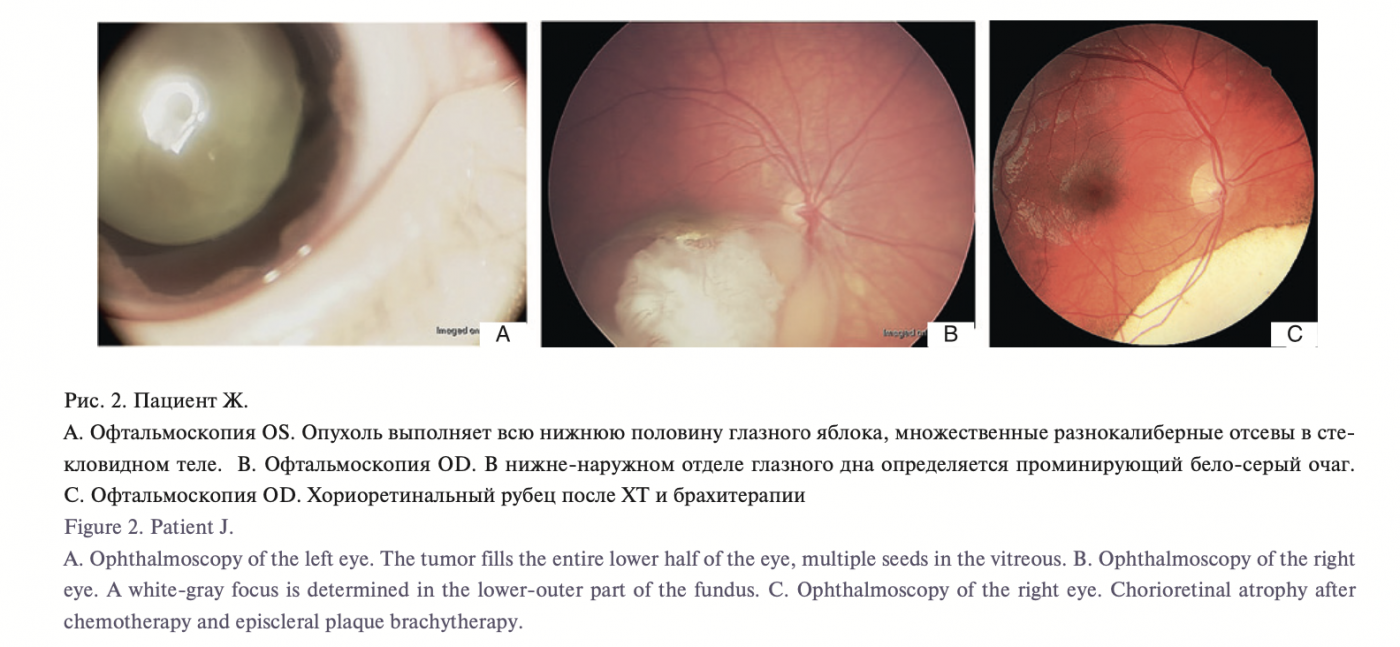
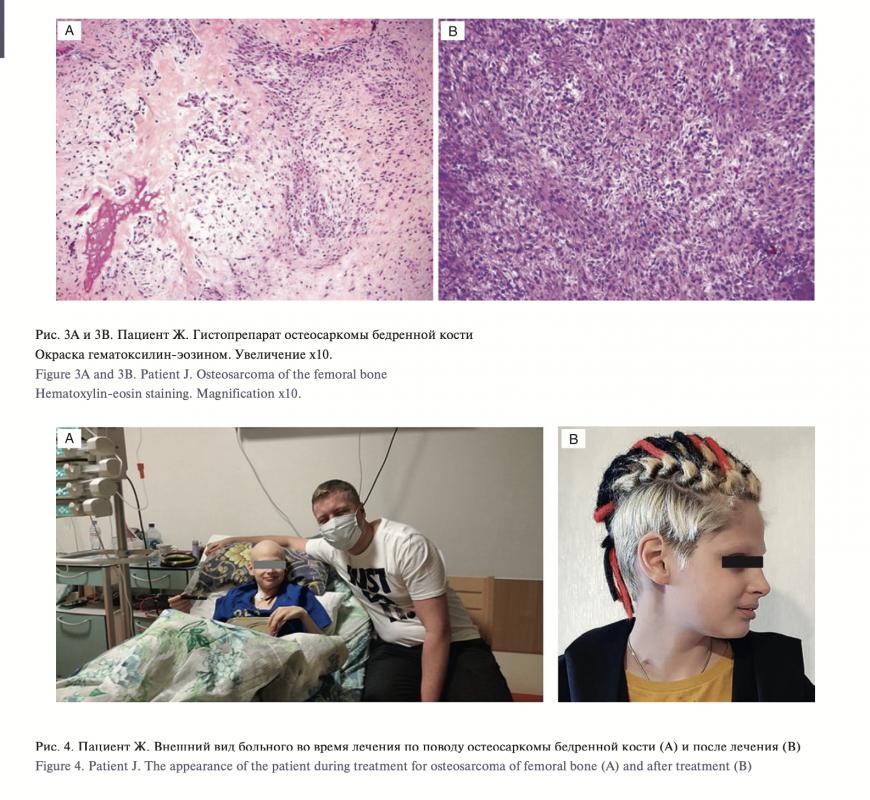
У пациента Ж. 14 лет через 11 лет после проведенного лечения появилась припухлость в области левого бедра. После двух биопсий установлен диагноз: остеосаркома левой бедренной кости. Через три месяца обнаружены метастазы в легких. На данный момент проведена полихимиотерапия в условиях онкологического стационара с положительной динамикой. При проведении молекулярно-генетического исследования гомозиготные мутации в гене RB1отсутствовали.
У больной С. 22 лет монокулярной ретинобластомой через 18 лет после начала комбинированного лечения развился рак шейки матки. Пациентка жива, наблюдается в онкогинекологическом центре.
У пациентки С. 25 лет с бинокулярной ретинобластомой через 25 лет после начала лечения выявлена лейомиосаркома бедра. При молекулярно-генетическом исследовании пациентки выявлена гетерозиготная мутация в локусе del1539insC, которая свидетельствует о несемейном характере заболевания.
У пациентки З. 26 лет с бинокулярной формой ретинобластомы спустя 25 лет после лечения выявили гистиоцитому.
У пациентки М. 16 лет через 15 лет после начала лечения по поводу бинокулярной ретинобластомы выявлена остеосаркома бедренной кости. При проведении молекулярно-генетического исследования гомозиготные мутации в гене RB1 отсутствовали.
Обсуждение
Несмотря на значимый прогресс в лечении ретинобластомы, пациенты, выжившие с наследственной формой ретинобластомы после терапии, преждевременно погибают от последующих злокачественных новообразований. В своих работах R.A. Kleinerman и соавт. указывают, что показатели смертности у больных бинокулярной ретинобластомой и/или с выявленным дефектом в гене RB1, которым ранее проводилась ДЛТ, несколько выше, чем у пациентов, которые не получали ДЛТ (p>0,05). Данные авторы не уточняют, наступили летальные исходы из-за вторичных радиационно-индуцированных опухолей или ВЗО вне зоны облучения. По данным P. Temming и соавт., еще одним фактором риска для развития ВЗО является проведение ХТ, что согласуется с нашими данными [12].
По данным литературы, самые высокие показатели смертно- сти по причине развития ВЗО отмечали спустя 15–29 лет после начала лечения, но риск возникновения ВЗО остается высоким после 50–60 лет [13, 14, 19]. В нашем исследовании медиана срока наблюдения до появления ВЗО составила 18 лет (от 9 до 25 лет), что совпадает с данными других авторов.
Т.В. Горбунова и соавт. описали 5 метахронно-синхронных опухолей у ребенка, излеченного от первой опухоли в дошколь ном возрасте с помощью химиолучевой терапии. По мнению авторов, данное наблюдение подтверждает канцерогенное влияние химиопрепаратов и лучевой терапии на возникновение последующих опухолей, а именно неходжкинской лимфомы через 5 лет, остеосаркомы ключицы через 7 лет, рабдомиосаркомы на шее и остеосаркомы крестца и лопаток через 13 лет после завершения лечения по поводу первой опухоли [19]. В нашем исследовании описан 1 пациент с метахронно развившимися третьим и четвертым новообразованиями. Случаев с синхронным развитием опухолей не выявлено.
По данным K. Turaka и соавт., среди 245 пациентов с ретинобластомой, получавших ХТ (винкристин, карбоплатин, +/-это- позид), у 4% пациентов с наследственной ретинобластомой развилась ВЗО в среднем через 11 лет, среди пациентов со спорадической формой ВЗО не выявлены. У 1 пациента с наследственной двусторонней ретинобластомой после ДЛТ развилась рабдомиосаркома мягких тканей верхнего века в височной ямке [20]. J. Moon и соавт. в своей работе описали пациента с односторонней спорадической ретинобластомой, у которого развилась рабдомиосаркома через 7 лет после адъювантной ХТ без ДЛТ [21]. Y. Araki и соавт. также выявили умеренную ассоциацию между ХТ и развитием ВЗО, но достоверно не подтвердили данную связь (p=0,200) [22]. C.F. Suttie и соавт., сравнив период до возникновения саркомы после ДЛТ и после комбинирован- ной терапии, включающей ДЛТ и ХТ, подчеркивают, что ХТ сокращает сроки возникновения радиационно-индуцированной саркомы [23]. По данным В.М. Козловой и соавт., ВЗО у больных ретинобластомой выявлены в 13 случаях (9 детей и 4 родственников с ретинобластомой); у 8 из 13 пациентов выявлены опухоли головы и шеи. Все пациенты получали ДЛТ по поводу ретинобластомы [24]. По нашим данным, ДЛТ достоверно не влияет на развитие ВЗО, а наличие бинокулярной формы ретинобластомы достоверно увеличивает риск ВЗО.
Заключение
Представлен собственный опыт наблюдения 9 клинических случаев ВЗО у лиц, получавших лечение по поводу ретинобластомы в детском возрасте. Медиана периода от начала лечения до появления второй опухоли составила 216 месяцев. Данная серия клинических случаев демонстрирует необходимость пожизненного регулярного наблюдения больных ретинобластомой по причине высокого риска развития у них ВЗО, а также необходимость не только генетического консультирования, но и молекулярно-генетического обследования таких пациентов с определением риска развития ВЗО в соответствии с литературой и базой данных OMIM и своевременного выявления опухоли.