Для цитирования:
Карпюк В.Б., Перова М.Д., Порханов В.А., Решетов И.В., Гилевич И.В., Севостьянов И.А. Применение стромально-васкулярной фракции жировой ткани в регенеративной хирургии челюстного альвеолярного гребня. Голова и шея. Российский журнал Head and neck Russian Journal. 2019;7(4):18–26.
For citation:
Karpyuk V.B., Perova M.D., Porkhanov V.A., Reshetov I.V., Gilevich I.V., Sevostyanov I.A. The use of the stromal-vascular fraction of adipose tissue in regenerative surgery of the alveolar ridge. Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2019;7(4):18–26 (in Russian).
В современной стоматологии и челюстно-лицевой хирургии активно апробируются регенеративные технологии восстановления кости с применением как минимально манипулированных клеток, так и стромальных/стволовых клеточных линий из разных тканевых источников, включая жировую ткань.
Цель работы: оценить возможности применения стромально-васкулярной фракции жировой ткани (СВФ-ЖТ) для совершенствования методов реконструктивной хирургии челюстного альвеолярного гребня.
Материал и методы. В исследование вошел 141 пациент с вторичной адентией и сопутствующей регрессионной трансформацией альвеолярного гребня челюстей, в т.ч. мужчин – 61 (43,3%), женщин – 80 (56,7%). Возраст исследуемых колебался от 45 до 78 лет, составляя в среднем 57 (52–63) лет. Операции открытого синуслифтинга (ОСЛ), горизонтальной, вертикальной и трехмерной аугментации альвеолярного отростка верхней челюсти (ААОВЧ) и альвеолярной части нижней челюсти (ААЧНЧ) в тестовой группе (ТГ, 68 пациентов; 55, 26 и 31 ОСЛ, ААОВЧ и ААЧНЧ соответственно) проводились с использованием костных аутотрансплантатов и остеозамещающих материалов в комбинации с аутологичной СВФ-ЖТ. В контрольной группе (КГ, 73 пациента; 52, 28 и 37 ОСЛ, ААОВЧ и ААЧНЧ соответственно) операции проводились по аналогичным методикам с использованием таких же материалов, но без клеточного компонента. В ТГ установлено 302, а в КГ 318 дентальных имплантатов (ДИ). Средний срок от остеопластики до имплантации составил 176±28 и 215±35 дней в ТГ и КГ соответственно (р=0,385). Наблюдение продолжалось до завершения всех этапов зубопротезирования, включая оценку параметров реконструированного альвеолярного гребня и состояния ДИ в отдаленные сроки. Использовались клинические, рентгенологические и морфологические методы исследования. Статистический анализ проводился с использованием программы IBM SPSS Statistics 23.
Результаты и обсуждение. Общая частота осложнений с полной или частичной утратой трансплантата составила 0,9 и 13,7% в ТГ и КГ соответственно (р<0,001). В результате операции в обеих группах получен достаточный объем кости для проведения дентальной имплантации. Высота доступной кости в ТГ группе на 20,3% превысила показатель КГ (р<0,001), ширина – на 7,6% (р<0,001). В гистоморфометрическом исследовании установлено, что СВФ-ЖТ, добавленная к гранулам остеозамещающего материала на основе депротеинизированной бычьей кости, значительно увеличивает его ремоделинг in vivo: площадь витальной минерализованной ткани составила 40,14±3,36% и 24,23±2,63%; остаточных гранул остеокондуктора 13,31±1,59 и 24,98±1,97% в ТГ и КГ соответственно (р≤0,001). СВФ-ЖТ в составе костнопластического материала создает условия для его более активной неоваскуляризации после имплантации в зону дефекта: плотность микрососудов на срезах субантрального остеорегенерата составила 63,1±8,1 и 36,7±7,8 единиц на 1 мм2 в ТГ и КГ соответственно (р=0,033). Низкий уровень периимплантатной маргинальной костной потери в процессе функционирования завершенных ортопедических конструкций свидетельствует о функциональных преимуществах опорной кости, восстановленной с применением СВФ-ЖТ: во все контрольные сроки потеря костной ткани значимо меньше в ТГ по сравнению с КГ (р<0,001). Пятилетняя выживаемость ДИ в ТГ составила 99,7%, в КГ – 96,5% (р=0,006). Заключение. Применение аутологичной СВФ-ЖТ в качестве источника регенеративных клеток и стимулов в комбинации с остеокондуктивными биоматериалами улучшает клинические, рентгенологические и гистоморфологические результаты остеозамещения при реконструкции атрофированного челюстного альвеолярного гребня. Реализация представленного регенеративного подхода позволяет значительно повысить эффективность лечения и качество реабилитации наиболее сложной категории пациентов с вторичной адентией и выраженным дефицитом опорной кости.
Ключевые слова: стромально-васкулярная фракция жировой ткани, регенерация костной ткани челюстей, реконструкция альвеолярного гребня, дентальная имплантация при атрофии.
Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Не указан.
Для цитирования: Карпюк В.Б., Перова М.Д., Порханов В.А., Решетов И.В., Гилевич И.В., Севостьянов И.А. Применение стромально-васкулярной фракции жировой ткани в регенеративной хирургии челюстного альвеолярного гребня. Голова и шея. Российский журнал Head and neck Russian Journal. 2019;7(4):18–26.
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
In modern dentistry and maxillofacial surgery, regenerative technologies for bone restoration using both minimally manipulated cells and stromal/stem cell lines from various tissue sources, including adipose tissue, are being actively tested.
Objective: to assess the possibilities of using the stromal-vascular fraction of adipose tissue (SVF-AT) to improve the methods of reconstructive surgery of the alveolar ridge.
Material and methods. The study included 141 patients with secondary adentia and concomitant regression transformation of the alveolar ridge of the jaws, among them were 61 (43.3%) men and 80 (56.7%) women. The age of the patients ranged from 45 to 78 years, with median of 57 (52–63) years. Open sinus lift (OSL), horizontal, vertical, and three-dimensional augmentation of the alveolar ridge of the maxilla (ARM) and the alveolar part of the mandible (APM) in the test group (TG, 68 patients; 55, 26 and 31 of the OSL, ARM and APM, respectively) were performed using bone autografts and bone replacement materials in combination with autologous SVF-AT. In the control group (CG, 73 patients; 52, 28, and 37 OSL, ARM, and APM, respectively), operations were performed using similar methods and materials, but without the cellular component. In TG were installed 302, and in the CG – 318 dental implants (DI). The average period from osteoplasty to implantation was 176±28 and 215±35 days in TG and CG, respectively (p=0.385). The observation continued until the completion of all stages of prosthetics, and included the long-term evaluation of the reconstructed alveolar ridge parameters and the DI state. Clinical, radiological and morphological research methods were used. Statistical analysis was performed using the IBM SPSS Statistics 23 software. Results and discussion. The total complication rate with complete or partial loss of the graft was 0.9 and 13.7% in TG and CG, respectively (p<0.001). As a result of the operation, a sufficient volume of bone was obtained for dental implantation in both groups. The height of the accessible bone in the TG was 20.3% higher than the CG level (p<0.001). and width in TG was 7.6% more than in CG (p<0.001). n a histomorphometric study, it was found that SVF-AT, when added to the granules of osteoplastic material based on deproteinized bovine bone, significantly increases bone remodeling in vivo: the area of vital mineralized tissue was 40.14±3.36% and 24.23±2.63%; osteoconductor residual granules 13.31±1.59 and 24.98±1.97% in TG and CG, respectively (p≤0.001). SVF-AT in the composition of osteoplastic material creates the conditions for its more active neovascularization after implantation in the defect zone: the density of microvessels on sections of the subantral osteoregenerate was 63.1±8.1 and 36.7±7.8 units per 1 mm2 in TG and CG, respectively (p=0.033). The low level of peri-implant marginal bone loss during the functioning of completed orthopedic constructions indicates the functional advantages of the supporting bone restored using SVF-AT: in all control periods, bone loss was significantly less in TG compared with CG (p<0.001). The five-year survival of DI in TG was 99.7%, in the CG – 96.5% (p=0.006).
Conclusion. The use of autologous SVF-AT as a source of regenerative cells and stimuli in combination with osteoconductive biomaterials improves the clinical, radiological, and histomorphological results of osteosubstitution during reconstruction of the atrophied alveolar ridge. The implementation of the presented regenerative approach can significantly increase the effectiveness of treatment and the quality of rehabilitation of the most complex category of patients with secondary adentia and severe deficiency of the supporting bone.
Key words: stromal-vascular fraction of adipose tissue, regeneration of jaw bone tissue, reconstruction of the alveolar ridge, dental implantation in atrophy.
The authors declare no conflict of interest.
Source of financing: not specified.
For citation: Karpyuk V.B., Perova M.D., Porkhanov V.A., Reshetov I.V., Gilevich I.V., Sevostyanov I.A. The use of the stromal-vascular fraction of adipose tissue in regenerative surgery of the alveolar ridge. Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2019;7(4):18–26 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of pub-lishing illustrative material – tables, figures, photographs of patients.
Введение
Современные научные достижения в области клеточной биологии и регенеративной медицины открывают новые горизонты в стоматологии, в т.ч. и в лечении пациентов с костными дефектами челюстей. Активно рассматриваются различные подходы с применением как минимально манипулированных клеток, так и стромальных/стволовых клеточных линий. Использование стромально-васкулярной фракции жировой ткани (СВФ-ЖТ) в качестве клеточного компонента при замещении костных дефектов имеет ряд преимуществ по сравнению с другими видами клеточной терапии [1]. В состав СВФ-ЖТ входят мультипотентные мезенхимальные стромальные клетки (ММСК-ЖТ) (от 1,5 до 25% от общего числа ядросодержащих клеток), гладкомышечные и эндотелиальные васкулярные клетки, макрофаги и лимфоциты [2, 3]. Описан широкий спектр ангиогенных, противовоспалительных, иммуномодулирующих цитокинов и факторов роста, секретируемых клетками СФВ-ЖТ [4]. Проводятся попытки замещения костных дефектов черепно-челюстно-лицевой области тканеинженерными конструкциями, включающими культуру ММСК-ЖТ и/или свежевыделенную СВФ-ЖТ. Между тем представленные в литературе единичные наблюдения не позволяют оценить эффективность и безопасность применения СВФ-ЖТ в челюстно-лицевой хирургии и стоматологии [5–8].
Цель работы: оценить возможности применения СВФ-ЖТ для совершенствования методов реконструктивной хирургии челюстного альвеолярного гребня.
Материал и методы
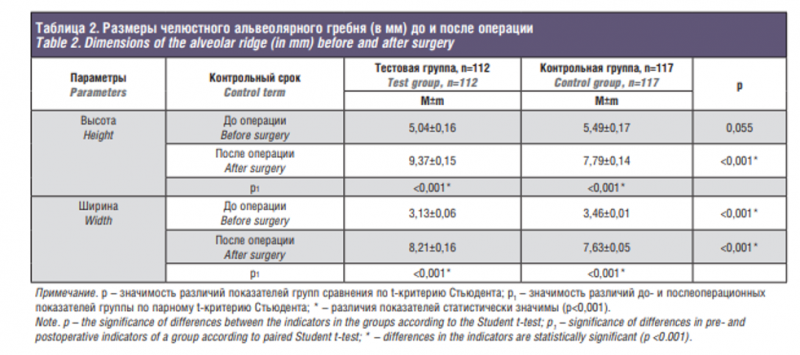
В исследование вошел 141 пациент с вторичной адентией и сопутствующей регрессионной трансформацией альвеолярного гребня челюстей, в т.ч. 61 (43,3%) мужчина, 80 (56,7%) женщин. Всем пациентам требовалось увеличение объема костной ткани перед дентальной имплантацией. Возраст исследуемых колебался от 45 до 78 лет, составляя в среднем 57 (52–63) лет. Лечение и последующее клиническое наблюдение проводились с 2008 по 2019 г. Пациенты подписали добровольное информированное согласие на участие в исследовании, на которое было получено положительное заключение этического комитета Ставропольской государственной медицинской академии. В тестовой группе (ТГ, 68 пациентов, 112 операций) реконструкция альвеолярного гребня выполнялась с использованием костных аутотрансплантатов и остеозамещающих материалов в комбинации с аутологичной СВФ-ЖТ. В контрольной группе (КГ, 73 пациента, 117 операций) использовали такие же материалы, но без клеточного компонента. Распределение клинического материала по видам реконструктивных операций и числу установленных дентальных имплантатов (ДИ) отражено в табл. 1. Анализ состава исследуемых групп выявил сопоставимое распределение по полу (p=0,690 по критерию хи-квадрат) и возрасту (р>0,05 по критерию Манна–Уитни). Исходные параметры подлежащего восстановлению участка альвеолярного гребня не имели различий по высоте (5,04±0,16 и 5,49±0,17 мм в ТГ и КГ соответственно; р=0,055), но по ширине степень атрофии кости в ТГ была более значимой, чем в КГ (3,13±0,06 и 3,46±0,01 мм соответственно; р<0,001 по t-критерию Стьюдента).
Оперативному вмешательству предшествовала консервативно-гигиеническая фаза, включающая санацию ротовой полости, удаление несостоятельных ортопедических конструкций, изготовление не опирающихся на участок реконструкции эстетических капп на период лечения.
В отделении пластической хирургии под местной инфильтрационной тумесцентной анестезией выполняли шприцевую аспирацию 40–120 мл подкожной жировой ткани из гипогастральной области передней брюшной стенки и фланков. Липоаспират в шприцах промывали стерильным физиологическим раствором с добавленным антибиотиком широкого спектра действия и передавали вместе с 10–20 мл сыворотки крови пациента в лабораторию. До 2018 г. СВФ-ЖТ выделяли в условиях операционной, а с 2018 г. – в лаборатории НИИ-ККБ №1 (Краснодар), отвечающей всем требованиям стандарта GMP.
Методика выделения СВФ-ЖТ. Порцию липоаспирата объемом 40–50 мл доводили до 60 мл физиологическим раствором, содержащим лиофилизат фермента коллагеназы 50 мг (активность 180–290 ед/мг) и переносили в стерильный пластиковый мешок. После экспозиции в жидкостном термостате 20 минут при 37 о С суспензию распределяли по пробиркам и центрифугировали в течение 20 минут на скорости 2750–3000 об/мин. Аспирировали верхний слой жидких липидов и флоттирующих адипоцитов, сливали надосадочную жидкость. СВФ-ЖТ собирали со дна пробирок, промывали и окончательно ресуспендировали аутологичной сывороткой крови. Для оценки качественного и количественного состава полученной СВФ-ЖТ проводили цитологическое исследование, по результатам которого оформляли спецификацию с указанием числа клеток и их жизнеспособности. Материал вместе со спецификацией передавали из лаборатории в клинику для дальнейшего использован
Методика подготовки содержащего СВФ-ЖТ костнопластического материала. Для лучшей абсорбции клеток на поверхности и в ячейках матрикса, минимизации повреждения клеток, гранулированный и/или моноблочный биорезорбируемый остеозамещающий материал вносили в пробирку со СВФ-ЖТ, ресуспендированной в аутологичной сыворотке крови. Соблюдали пропорции: 1 объемная часть концентрированной фракции (объем осадка на дне пробирки после центрифугирования) на 2–4 части остеозамещающего материала. За время экспозиции 15–30 минут при периодическом встряхивании пробирки СВФ-ЖТ адсорбировалась на поверхности и внутри каналов губчатого костного заменителя, сыворотка становилась прозрачной. Гранулированный материал извлекали кюреткой со дна пробирки после центрифугирования со скоростью 1000 об/мин в течение 3–4 минут и слива надосадочной жидкости. Синуслифтинг. Под проводниковой инфраорбитальной анестезией общепринятым способом выполняли открытый латеральный доступ к дну верхнечелюстного синуса. После поднятия мембраны и проверки ее целостности на дно синуса помещали ординарные (в КГ) или содержащие СВФ-ЖТ (в ТГ) гранулы остеокондуктивного материала (Bio-Oss, Швейцария; Calcitos, Италия). Латеральное костное окно перекрывали барьерной коллагеновой мембраной, рану ушивали. Операция горизонтальной, вертикальной и трехмерной аугментации альвеолярного гребня. Под местной анестезией с предварительной медикаментозной седацией проводили разрез слизистой оболочки десны по вершине атрофированного альвеолярного гребня с продолжением по десневой борозде соседних зубов, делали послабляющий вертикальный разрез, значительно выходящий за пределы переходной складки. Распатором отслаивали полнослойный лоскут с мобилизацией, достаточной для первичного закрытия раны без натяжения. Кортикальную кость воспринимающего ложа перфорировали тонким шаровидным бором для стимуляции капиллярного кровотечения из микрососудов костного мозга и лучшей интеграции с костнопластическим материалом. В качестве каркасов использовали аутологичные кортикальные блоки толщиной до 1,5 мм, взятые из области наружной косой линии нижней челюсти и фиксированные к реципиентному кортексу винтами, или гетерологичные кортикальные блоки и костные пластины толщиной 200, 400 и 600 микронов (Lamina, OsteoBiol, Италия; Osteoplant Flex Cortical, BioTech, Италия). Подготовленную таким способом зону регенерации кости заполняли гранулированным остеозамещающим материалом ксеногенного происхождения (BioGen, Италия; Bio-Oss, Швейцария) и измельченной аутологичной костью, полученной трепаном из внутриротовых донорских участков. В контрольной группе использовали ординарные костнопластические материалы, в тестовой группе те же материалы комбинировали с аутологичной СВФ-ЖТ. Адаптация и фиксация реконструкта проводилась с помощью резорбируемых коллагеновых мембран (Heart, BioTech, Италия; OsteoBiol, Италия; Bio-Gide, Швейцария), помещаемых под расщепленный лоскут. Рану тщательно ушивали без натяжения. Швы снимали через 2 недели после операции.
Через 6–8 месяцев после операции было установлено 620 внутрикостных ДИ с последующим изготовлением несъемных ортопедических конструкций. В работе применялись титановые остеоинтегрируемые ДИ с разным вариантом погружения в ткани – в уровень десны (359 имплантатов) и субкрестально (261 имплантат). В тестовой группе установлено 302, а в контрольной 318 ДИ. Средний срок от остеопластики до имплантации составил 176±28 и 215±35 дней в ТГ и КГ соответственно (различия статистически незначимы; р=0,385 по критерию Манна–Уитни).
При оценке исходного состояния пациентов, планировании лечения и анализе его результатов использовали комплекс диагностических методов, включая клинические, рентгенологические и морфологические исследования. Материалы исследования были подвергнуты статистической обработке с использованием методов параметрического и непараметрического анализа в соответствии с результатами проверки сравниваемых совокупностей на нормальность распределения. Статистический анализ проводился с использованием программы IBM SPSS Statistics 23.
Результаты
Пациенты легко переносили липоаспирацию, осложнений со стороны донорской зоны не было. По данным цитологических исследований, число жизнеспособных ядросодержащих клеток в порции СВФ-ЖТ, используемой для одной операции, колебалось от 25 до 120 млн, при этом процент жизнеспособности был в пределах 80–95%.
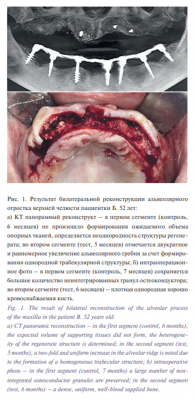
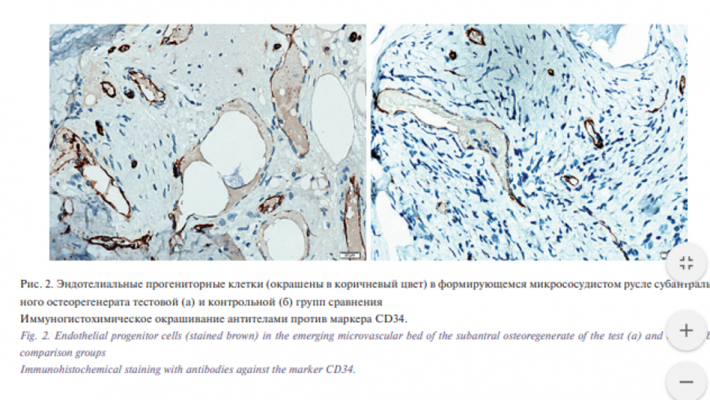
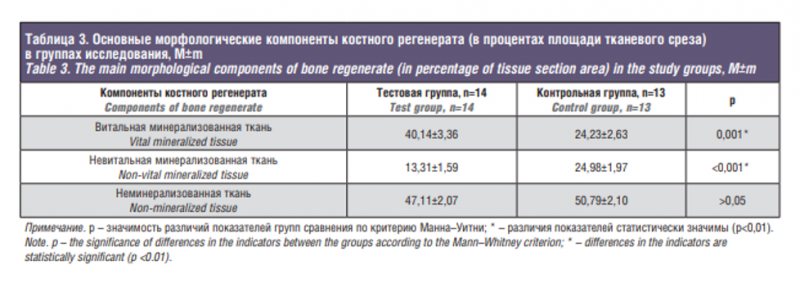
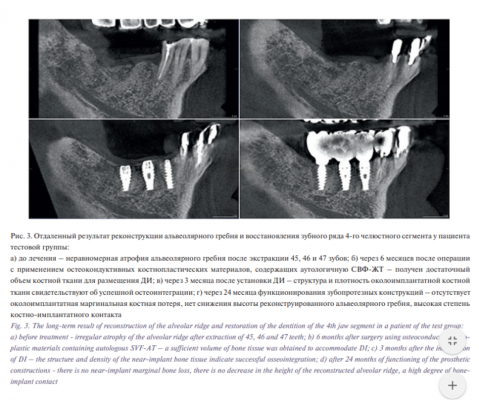
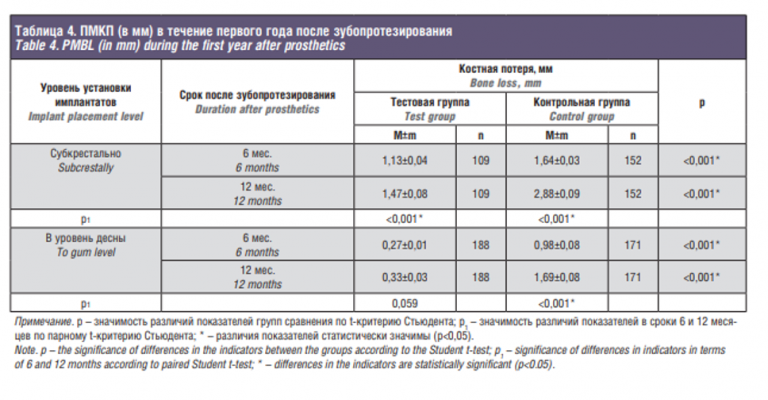
После аугментации челюстного альвеолярного гребня ранняя несостоятельность швов, обусловленная избыточным натяжением покровных мягких тканей, особенно при тонком десневом фенотипе, наблюдалась в 15,8% случаев ТГ и в 27,7% случаев КГ (различия статистически незначимы; р=0,131 по критерию хи-квадрат). При этом благоприятный исход с заживлением вторичным натяжением отмечался у большинства пациентов ТГ и лишь у четверти пациентов КГ: 89 и 22% соответственно. Общая частота осложнений, развившихся в разные сроки после остеопластики и приведших в итоге к полной или частичной утрате трансплантата, составила 0,9 и 13,7% в ТГ и КГ соответственно р<0,001 по точному критерию Фишера). Через 6–8 месяцев после операции в обеих группах зарегистрирован статистически значимый прирост высоты и ширины реконструируемого участка челюсти, получен достаточный объем опорной кости для проведения дентальной имплантации (табл. 2). При сравнении между группами средняя высота доступной кости, включая реконструированный участок, в ТГ на 20,3% превысила показатель КГ (р<0,001), ширина – на 7,6%. Рентгенологические и визуальные различия восстановленной разными способами кости проиллюстрированы случаем билатеральной реконструкции альвеолярного отростка верхней челюсти (рис. 1). По результатам гистоморфометрии относительная площадь витальной минерализованной, т.е. новообразованной костной ткани, была в 1,7 раза больше на срезах трепанбиоптатов ТГ по сравнению с КГ. Относительная площадь невитальной минерализованной ткани, отражающая уровень остаточного нерезорбированного остеозамещающего материала, напротив, в 1,9 раза меньше в ТГ, чем в КГ. Наблюдалась тенденция к снижению количества неминерализованных тканей, включая костномозговую и фиброзную, в образцах ТГ по сравнению с КГ, однако разница в 7,3% статистически незначима (табл. 3). По данным сравнительного иммуногистохимического исследования с маркером эндотелиальных прогениторных клеток CD34 плотность микрососудов на срезах субантрального остеорегенерата составила 63,1±8,1 и 36,7±7,8 единиц на 1 мм2 в ТГ и КГ соответственно (р=0,033 по критерию Манна–Уитни) (рис. 2). Уровень периимплантатной маргинальной костной потери (ПМКП) в процессе функционирования завершенных ортопедических конструкций во все контрольные сроки был значимо меньше в ТГ по сравнению с КГ (табл. 4). В течение второго полугодия функционирования ортопедических конструкций в ТГ показатель ПМКП увеличился в среднем на 30,1% при субкрестальной установке и на 22,2% при установке в уровень десны относительно цифр, зарегистрированных в контрольный срок 6 месяцев. В контрольной группе костная ткань оказалась не столь устойчивой к нагрузке и показатели ПМКП за тот же период (с 6-го по 12-й месяц) при аналогичных способах установки имплантатов возросли в среднем на 75,6 и 72,5% соответственно (табл. 4). Пример реконструкции альвеолярного гребня и последующего зубопротезирования на внутрикостных ДИ у пациента ТГ представлен на рис. 3. В сроки до 5 лет в КГ из 318 первично остеоинтегрованных ДИ поздний периимплантит развился в области 21 искусственной опоры с потерей 11 из них, где разрушение опорной кости составило более 50%. В ТГ в эти сроки признаки нарушения остеоинтеграции были выявлены в области 5 из 297 имплантатов с потерей 1 искусственной опоры как безнадежной. Таким образом, 5-летняя выживаемость имплантатов в ТГ составила 99,7%, в КГ – 96,5% (р=0,006 по точному критерию Фишера).
Обсуждение
В ТГ мы не наблюдали каких-либо специфических осложнений в течение всего периода исследования, что свидетельствует об отсутствии дополнительных клинических рисков, связанных с трансплантацией минимально манипулированного клеточного продукта СВФ-ЖТ. Статистический анализ послеоперационных осложнений с использованием показателя относительного риска (ОР) свидетельствует о большей безопасности лечения с применением костнопластических материалов, содержащих СВФ-ЖТ. Установлено, что в случае расхождение швов с экспозицией костнопластического материала вероятность дальнейшего инфицирования и потери трансплантата в 7 раз ниже в ТГ по сравнению с КГ (ОР=0,143,95% доверительный интервал – ДИ 0,022–0,922; р<0,05). Механизмы такого эффекта могут включать антибактериальные свойства входящих в состав СВФ-ЖТ мезенхимальных стромальных клеток [9], иммуномодулирование с увеличением доли фагоцитирующих М2-макрофагов [10], ускоренную реперфузию трансплантата [11].
В гистоморфометрическом исследовании установлено, что СВФ-ЖТ, добавленная к гранулам остеозамещающего материала на основе депротеинизированной бычьей кости (ДБК), значительно увеличивает регенерацию костной ткани по сравнению с эффектом такого же биоматериала, но без клеточного компонента. По данным ряда авторов, площадь костной ткани в препаратах трепанбиопсии через 6–10 месяцев после синуслифтинга с имплантацией «чистых» гранул ДБК составляет от 26 до 35% [12–15]. Результаты, полученные нами в КГ (24,23±2,63%), укладываются в указанные пределы. При комбинировании гранул ДБК с измельченной аутологичной костью или концентрированным аспиратом костного мозга улучшается остеогенное ремоделирование остеокондуктора in vivo и содержание костной ткани в регенерате может достигать 40,6–55% [16, 17]. Таким образом, показатели гистоморфометрии образцов ТГ (40,14±3,36%) близки данным литературы о результатах применения усовершенствованных методов костной пластики альвеолярного гребня, однако использование СВФ-ЖТ в качестве источника остеогенных регенеративных клеток и стимулов имеет преимущества, т.к. материал доступен в значительном количестве при меньшей морбидности и инвазивности вмешательства.
Выявленные в сравнительном иммуногистохимическом исследовании с маркером эндотелиальных прогениторных клеток CD34 различия плотности микрососудов в образцах субантрального остеорегенерата подтверждают ангиогенные свойства СВФ-ЖТ и указывают на потенциал использования изучаемого нами регенеративного ресурса для создания васкуляризованной тканеинженерной остеозамещающей конструкции.
В начальном нагрузочном периоде показатель ПМКП опосредованно отражает реакцию опорных структур в области проксимального костно-имплантатного контакта на жевательную нагрузку. Выявленные межгрупповые различия по этому показателю свидетельствуют о функциональных преимуществах опорной кости, восстановленной с применением СВФ-ЖТ.
Согласно данным ряда исследований, совокупная выживаемость ДИ, установленных первично без какой-либо хирургической подготовки реципиентного участка, через 5 лет составляет 95–100% [18, 19]. Следовательно, зарегистрированная в работе долгосрочная выживаемость имплантатов, установленных в альвеолярный гребень, реконструированный с использованием СВФ-ЖТ-содержащего костнопластического материала (99,7% – 5 лет), сопоставима с показателями имплантатов, установленных в нативную костную ткань. Это свидетельствует о значительном соответствии восстановленной кости природному образцу.
Заключение Применение аутологичной СВФ-ЖТ в комбинации с остеокондуктивными биоматериалами улучшает клинические, рентгенологические и гистоморфологические результаты остеозамещения при реконструкции атрофированного челюстного альвеолярного гребня. Реализация представленного регенеративного подхода позволяет значительно повысить эффективность лечения и качество реабилитации наиболее сложной категории пациентов с вторичной адентией и выраженным дефицитом опорной кости.
ЛИТЕРАТУРА/REFERENCES
- Simonacci F., Bertozzi N., Raposio E. Off-label use of adipose-derived stem cells. Ann. Med. Surg. (Lond). 2017;25(24): 44–51.
- Alexander R.W. Understanding Mechanical Emulsification (Nanofat) Versus Enzymatic Isolation of Tissue Stromal Vascular Fraction (tSVF) Cells from Adipose Tissue: Potential Uses in Biocellular Regenerative Medicine. J. Prolother. 2016;8:947–60.
- Bora P., Majumdar A.S. Adipose tissue-derived stromal vascular fraction in regenerative medicine: a brief review on biology and translation. Stem. Cell Res. Ther. 2017;https://doi.org/10.1186/s13287-017-0598-y.
- Hirose Y., Funahashi Y., Matsukawa Y., et al. Comparison of trophic factors secreted from human adipose-derived stromal vascular fraction with those from adipose-derived stromal/stem cells in the same individuals. Cytother. 2018;20:589–91.
- Sandor G.K., Numminen J., Wolff J., et al. Adipose stem cells used to reconstruct 13 cases with cranio-maxillofacial hard-tissue defects. Stem. Cells Transl. Med. 2014;3(4):530–40.
- Manimaran K., Rohini S., Sankaranarayanan S., PerumalS.M. Regeneration of mandibular ameloblastoma defect with the help of autologous dental pulp stem cells and buccal pad of fat stromal vascular fraction. Ann. Maxillofac. Surg. 2016;6(1):97–100.
- Pellacchia V., Renzi G., Becelli R., Socciarelli F. Bone Regeneration of the Maxillofacial Region Through the Use of Mesenchymal Cells Obtained by a Filtration Process of the Adipose Tissue. J. Craniofac. Surg. 2016;27(3):558–60.
- Prins H.J., Schulten E.A., ten Bruggenkate C.M., et al. Bone regeneration using the freshly isolated autologous stromal vascular fraction of adipose tissue in combination with calcium phosphate ceramics. Stem. Cells Transl. Med. 2016;5:1362–74.
- Sung D.K., Chang Y.S., Sung S.I., et al. Antibacterial effect of mesenchymal stem cells against Escherichia coli is mediated by secretion of beta-defensin-2 via toll-like receptor 4 signalling. Cell. Microbiol. 2016;18(3):424–36
- Bowles A.C., Wise R.M., Gerstein B.Y., et al. Immunomodulatory Effects of Adipose Stromal Vascular Fraction Cells Promote Alternative Activation Macrophages to Repair Tissue Damage. Stem. Cells. 2017;35(10):2198–207.
- Zakhari J.S., Zabonick J., Gettler B., Williams S.K. Vasculogenic and angiogenic potential of adipose stromal vascular fraction cell populations in vitro. In Vitro Cell. Dev. Biol. Anim. 2018;54(1);32–40.
- Esfahanizadeh N., Rokn A.R., Paknejad M., et al. Comparison of lateral window and osteotome techniques in sinus augmentation: histological and histomorphometric evaluation. J. Dent. (Tehran). 2012;9(3):237–46.
- Galindo-Moreno P., de Buitrago J.G., Padial-Molina M., et al. Histopathological comparison of healing after maxillary sinus augmentation using xenograft mixed with autogenous bone versus allograft mixed with autogenous bone. Clin. Oral. Implants Res. 2018;29(2):192–201.
- Moon J.W., Sohn D.S., Heo J.U., Kim J.S. Comparison of two kinds of bovine bone in maxillary sinus augmentation: a histomorphometric study. Implant Dent. 2015;24(1):19–24.
- Schmitt C.M., Moest T., Lutz R., et al. Anorganic bovine bone (ABB) vs. autologous bone (AB) plus ABB in maxillary sinus grafting. A prospective nonrandomized clinical and histomorphometrical trial. Clin. Oral Implants Res. 2015;26(9):1043–50.
- Jensen S.S., Bosshardt D.D., Gruber R., Buser D. Long-term stability of contour augmentation in the esthetic zone: histologic and histomorphometric evaluation of 12 human biopsies 14 to 80 months after augmentation. J. Periodontol. 2014;85 (11):1549–56.
- Pasquali P.J., Teixeira M.L., de Oliveira T.A., et al. Maxillary Sinus Augmentation Combining Bio-Oss with the Bone Marrow Aspirate Concentrate: A Histomorphometric Study in Humans. Int. J. Biomater. 2015;2015:http:// dx.doi.org/10.1155/2015/121286.
- Mameno T., Wada M., Onodera Y., et al. Longitudinal study on risk indicators for peri-implantitis using survival-time analysis. J. Prosthodont. Res. 2018;18: https://doi: 10.1016/j.jpor.2018.12.002.
- Raes M., D’hondt R., Teughels W., et al. A 5-year randomized clinical trial comparing minimally with moderately rough implants in patients with severe periodontitis. J. Clin. Periodontol. 2018;45(6):711–20.
Поступила 28.08.19 Принята в печать 29.11.19 Received 28.08.19 Accepted 29.11.19
Информация об авторах:
В.Б. Карпюк – ГБУЗ Научно-исследовательский институт – Краевая клиническая больница №1 им. проф. С.В. Очаповского Минздрава Краснодарского края, Краснодар, Россия; e-mail: vkarpyuk@mail.ru
Перова М.Д. – ФГБОУ ВО Кубанский государственный медицинский университет Минздрава РФ, Краснодар, Россия В.А. Порханов – ФГБОУ ВО Кубанский государственный медицинский университет Минздрава РФ, ГБУЗ Научно-исследовательский институт – Краевая клиническая больница №1 им. проф. С.В. Очаповского Минздрава Краснодарского края, Краснодар, Россия
И.В. Решетов – ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава РФ, Москва, Россия; Академия постдипломного образования ФГБУ ФНКЦ ФМБА России, Москва, Россия
И.В. Гилевич – ГБУЗ Научно-исследовательский институт – Краевая клиническая больница №1 им. проф. С.В. Очаповского Минздрава Краснодарского края, Краснодар, Россия
И.А. Севостьянов – ФГБОУ ВО Кубанский государственный медицинский университет Минздрава РФ, Краснодар, Россия
Information about the authors:
V.B. Karpyuk – SBHI Research Institute — Regional Clinical Hospital №1 n.a. prof. S.V. Ochapovsky of Ministry of Health of the Krasnodar Region, Krasnodar, Russia; e-mail: vkarpyuk@mail.ru
M.D. Perova – FSBEI HE Kuban State Medical University of the Ministry of Health of the Russian Federation, Krasnodar, Russia V.A. Porkhanov – FSBEI HE Kuban State Medical University of the Ministry of Health of the Russian Federation, SBHI Research Institute — Regional Clinical Hospital №. 1 n.a. prof. S.V. Ochapovsky of Ministry of Health of the Krasnodar Region, Krasnodar, Russia
I.V. Reshetov – FSBEI HE First Moscow State Medical University n.a. Sechenov I.M. of the Ministry of Health of the Russian Federation, Moscow, Russia; Academy of Postgraduate Education FSBI FSCC FMBA of Russia, Moscow, Russia
I.V. Gilevich – SBHI Research Institute — Regional Clinical Hospital №1 n.a. prof. S.V. Ochapovsky of Ministry of Health of the Krasnodar Region, Krasnodar, Russia
I.A. Sevostyanov – FSBEI HE Kuban State Medical University of the Ministry of Health of the Russian Federation, Krasnodar, Russia
Рецензия на статью
Статья представляет собой описание законченного сравнительного исследования, направленного на доказательство положительного влияния стромально-васкулярной фракции жировой ткани на приживление костного трансплантата при формировании челюстного альвеолярного гребня. Тема чрезвычайно актуально с позиции челюстно-лицевой хирургии и стоматологии и соответствует современным научным тенденциям.
Исследование выполнено на высоком методологическом уровне, полученные данные статистически обработаны.
Клинический материал представлен 141 пациентом, что достаточно для проведения сравнительного исследования
Review on the article
The article presents a description of a completed comparative study aimed at proving the positive effect of the stromal-vascular fraction of adipose tissue on bone engraftment during the formation of the jaw alveolar ridge.
The topic is extremely relevant from the position of maxillofacial surgery and dentistry and is consistent with modern scientific tendencies.
The study has a high-quality methodological performance, the data obtained are statistically processed.
Clinical material was presented by 141 patients, which is sufficient for a comparative study.