Для цитирования: Медведев Ю.А., Испирян Д.Х. Оптимизация хирургического лечения пациентов с препарат-ассоциированным некрозом средней зоны лица. Голова и шея. Российский журнал Head and neck Russian Journal. 2019;7(3):28–35.
For citation: Medvedev Yu.A., Ispiryan D.Kh. Optimization of surgical treatment of patients with drug-associated middle face zone necrosis. Golova i sheya. Rossijskij zhurnal Head and neck. Russian Journal. 2019;7(3):1: 28–35 (in Russian).
Особенностью последних лет является распространение синтетических наркотических препаратов с использованием средств кустарного производства из кодеинсодержащих лекарственных препаратов.
Целью исследования являлось повышение эффективности хирургического лечения пациентов с верифицированным диагнозом «Препарат-ассоциированный остеонекроз средней зоны лица».
Материал и методы. Было проведено обследование и хирургическое лечение 50 пациентов с остеонекрозом (ОН) костей лицевого черепа в области средней зоны лица, обратившихся в клинику челюстно-лицевой хирургии Первого МГМУ им. И.М. Сеченова в период с 2013 по 2017 г., из них 41 мужчина и 9 женщин. Возраст больных составил от 22 до 40 лет. ОН костей лицевого скелета подтверждали при наличии обнажения костной ткани челюстей и/или костей лицевого черепа более 2 месяцев после воздействия триггерного механизма – например, удаления зубов. Все больные были распределены на группы: 1-я группа – пациенты с наличием ограниченного остеонекротического процесса (30%); 2-я группа – пациенты с наличием диффузного остеонекротического процесса в области верхней челюсти (28%); 3-я группа – пациенты с локализацией остеонекротического процесса в области верхней челюсти, тела скуловой кости (22%); 4-я группа – пациенты с препарат-ассоциированным ОН верхней челюсти, скуловой кости, нижней стенки глазницы (20%). Всем пациентам, поступившим или находившимся на обследовании в клинике, проводились клинические, инструментальные и лабораторные исследования. Для оценки боли применяли цифровую рейтинговую шкалу до и после операции. Микробиологическое исследование отделяемого в полости рта и наружных свищей проводили до и после проведенного хирургического лечения на стадии реабилитации. Тридцати пациентам была проведена мультиспиральная компьютерная томография лицевого черепа.
Результаты. В 1-й группе выполняли частичную резекцию верхней челюсти, одностороннюю из внутриротового доступа. Во 2-й группе выполняли резекцию верхней челюсти и скуловой кости из внеротового доступа по Кохеру-Веберу с переходом на подресничный доступ с одномоментной реконструкцией лоскутами _ на питающей ножке со щеки, носогубной области и др. В 3-й и 4-й группах проводили резекцию верхней челюсти, скуловой кости и нижней стенки глазницы из доступа по Кохеру-Веберу с переходом на поди надресничный доступ с одномоментной пластикой лоскутами со щеки, носогубной и височной областей. На основании полученных данных мы провели анализ течения раннего и позднего послеоперационного периодов у пациентов с диагнозом препарат-ассоциированного ОН средней зоны лицевого черепа. _ У всех пациентов, следовавших рекомендациям и не начавших вновь принимать дезоморфин, мы отмечали стойкую ремиссию заболевания – не отмечали по данным осмотра и лучевых методов исследования распространения областей ОН, состояние полости рта было относительно удовлетворительным.
Ключевые слова: препарат-ассоциированный остеонекроз, средняя зона лица, резекция верхней челюсти, резекция скуловой кости, экономная резекция, фосфорный, токсический остеонекроз, височный лоскут, дезоморфин, лицевой череп
Авторы заявляют об отсутствии конфликта интересов. Источник финансирования. Не указан.
Для цитирования: Медведев Ю.А., Испирян Д.Х. Оптимизация хирургического лечения пациентов с препарат-ассоциированным некрозом средней зоны лица. Голова и шея. Российский журнал Head and neck Russian Journal. 2019;7(3):28–35.
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
The main feature of recent years is the spread of synthetic narcotic drugs using handicraft products from codeinecontaining drugs.
Purpose: to increase the effectiveness of surgical treatment of patients with drug-associated facial middle zone osteonecrosis.
Material and methods. An examination and surgical treatment of 50 patients (41 men and 9 women) with facial middle zone osteonecrosis (ON) was performed in the clinic of maxillofacial surgery of the I.M. Sechenov First Moscow State Medical University from 2013 to 2017. The age of patients ranged from 22 to 40 years. ON of the facial bones was confirmed by the presence of exposure of the bone tissue in the jaw and / or bones of the facial skull for more than 2 months after any trigger mechanism action, for example, tooth extraction. All patients were divided into 4 groups: group 1 – patients with a limited osteonecrotic lesion (30%); 2nd group – patients with a diffuse osteonecrosis in the maxilla (28%); 3rd group – patients with osteonecrosis localized in the maxilla and the zygomatic bone body (22%); 4th group — patients with drug-associated ON of the maxilla, zygomatic bone, and lower orbital wall (20%). All patients underwent clinical, instrumental and laboratory studies. To assess pain, a digital rating scale was used before and after surgery. A microbiological examination of the discharge in the oral cavity and external fistulas was performed before and after the surgical treatment at the rehabilitation stage. Thirty patients underwent multispiral computed tomography of the facial skull.
Results. Partial unilateral maxillary resection from the intraoral access was performed in the 1st group. In the 2nd group, resection of maxilla and zygomatic bone was performed from extraoral access according to KocherWeber with a transition to the sub-ciliary access with simultaneous reconstruction with pedicle flaps from the cheek, nasolabial region, etc. In the 3rd and 4th groups, maxilla, zygomatic bone and lower orbital wall were resected from the Kocher-Weber access with a transition to the sub- and supra-ciliary access with simultaneous plastic grafts from the cheek, nasolabial and temporal region. Based on the obtained data, we analyzed the course of the early and late postoperative periods in patients with drug-associated ON of the middle facial zone. In all patients who followed the recommendations and did not start taking desomorphine again, we noted a persistent remission of the disease: no ON spread to the other regions detected, and the condition of the oral cavity was relatively good.
Key words: drug-associated osteonecrosis, midface, maxillary resection, zygomatic bone resection, economical resection, phosphoric, toxic osteonecrosis, temporal flap, desomorphine, facial skull
The authors declare no conflict of interest. Source of financing: not specified.
For citation: Medvedev Yu.A., Ispiryan D.Kh. Optimization of surgical treatment of patients with drug-associated middle face zone necrosis. Golova i sheya. Rossijskij zhurnal Head and neck. Russian Journal. 2019;7(3):1: 28–35 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of pub-lishing illustrative material – tables, figures, photographs of patients.
摘要:
近年来的主要是使用含可待因药物的生产合成麻醉药品。
目的:提高与药物相关的面部中部骨坏死患者的手术治疗效果。
材料与方法: 2013年至2017年,在莫斯科第一莫斯科国立医科大学的颌面外科部门对50例面部中部骨坏死 (ON)患者(41名男性和9名女性)进行了检查和外科手术治疗。患者年龄从22岁到40岁。在任何触发机制作用 (例如拔牙)后两个多月内,面部颌骨或面部颅骨的骨组织暴露,从而确认了面部骨骼的ON状态。所有患者分为 4组:第1组–骨坏死病灶有限(30%);第二组–上颌骨弥漫性骨坏死的患者(28%);第三组–上颌骨和骨体 内骨坏死的患者(22%);第四组-上颌骨,骨和下眶壁药物相关性ON的患者(20%)。所有患者均接受了临 床,仪器和实验室研究。为了评估疼痛程度,在手术前后均使用了数字评分表。进行了手术治疗之前和之后的康 复,对口腔和外瘘的排出物进行了微生物学检查。 30名患者接受了面部颅骨的多螺旋计算机断层扫描。 结果:第一组进行了从口内入路的单侧上颌部分切除术。在第二组中,根据Kocher-Weber的方法从口外入路切 除上颌骨和骨,然后过渡到睫状下入路,同时用颊、鼻唇沟等处的椎弓根皮瓣进行重建。从Kocher-Weber入路 切除上颌骨,骨和下眶壁,同时从脸颊,鼻唇沟和颞部同时移植材料至睫状下和睫状上入路。根据获得的数据, 我们分析了中面部面部药物相关性ON患者的术后早期和晚期过程。在所有遵循建议且未再次开始服用地索吗啡的 患者中,我们注意到该病持续缓解:未发现ON扩散到其他区域,并且口腔状况相对良好。 关键词:药物相关性骨坏死,中脸,上颌骨切除,骨切除,经济切除,含磷,毒性骨坏死,颞皮瓣,去甲吗啡, 面部颅骨。
作者宣称没有利益冲突
资金来源:未说明
引用:Medvedev Yu.A., Ispiryan D.Kh. Optimization of surgical treatment of patients with drug-associated middle face zone necrosis. Golova i sheya. Rossijskij zhurnal = Head and neck. Russian Journal. 2019;7(3):1: 28–35 (in Russian).
作者对所提供数据的独创性以及发布说明性材料(表格,图表,患者照片)的可能性负责
Введение
В последние годы увеличились число и частота обращений лиц с наркологической зависимостью в клиники общего профиля, в т.ч. и в хирургические стационары. Врачам различных специальностей приходится все чаще встречаться с осложнениями наркомании.
В Москве на Коллегии Федеральной службы Российской Федерации по контролю оборота наркотиков, на которой рассматривался вопрос «Об организации работы по противодействию распространения наркотического средства дезоморфин», 22 апреля 2010 г. были приведены следующие цифры: в стране отмечаются ежегодное удвоение числа дезоморфиновых наркоманов. В 2007 г. дезоморфин потребляли в 19 субъектах Российской Федерации, в 2009 г. его потребление стало регулярным в 60 российских регионах. Дезоморфиновыми наркоманами являются преимущественно молодые люди в возрасте от 15 до 30 лет. При этом если в предыдущие годы потребителями дезоморфина становились, как правило, героиновые наркоманы, то в последнее время участились случаи появления наркоманов, которые начинают с дезоморфина (Т.А. Улезко, 2011) [1–4].
Несмотря на то что лечение наркомании является прерогативой клинической наркологии, эта проблема затрагивает и другие клинически дисциплины: неврологию, психиатрию, токсикологию, инфекционные болезни, терапию, педиатрию, травматологию, гинекологию и акушерство, дерматологию, реаниматологию, хирурги и др. [5].
Летальные случаи вследствие наркотизации от передозировки, инфекционных и гнойно-септических заболеваний, соматических осложнений также увеличиваются [6] и в среднем составляют 18–48% за последние 10 лет. Наиболее высокая летальность зарегистрирована среди опийных наркоманов, большей частью у пациентов мужского пола [7] .
Особенностью наркологической ситуации последних лет является распространение синтетических наркотических препаратов с использованием средств кустарного производства из кодеинсодержащих лекарственных препаратов (Коделак, Терпинкод, Тетралгин, Пенталгин, Седал-М), кристаллического йода, красного фосфора, бензина, ацетона и др. [8–9].
Этот вид наркомании особенно стремительно стал распространяться после 2005 г., приняв характер скрытой пандемии. По уровню потребления в России доля кустарного дезоморфина в общем объеме быстро поднялась до 25–28%, заняв второе место после героина (55–58%). Данное вещество в 9 раз активнее морфина и в 5 раз токсичнее, что оказывает выраженный токсический эффект на различные органы и ткани организма. Соединения красного фосфора, содержащиеся в данном препарате, вызывают изменения во всех костях скелета. Поражение челюстей препарат-ассоциированным остеонекрозом (ОН) также связано с их большей подверженностью вторичному инфицированию в связи с высоким уровнем бактериальной обсемененности полости рта даже в нормальных условиях [8].
Тесная взаимосвязь костей средней зоны лицевого черепа, обусловливает стремительное распространение остеонекротических процессов на соседние анатомические области. На верхней челюсти ОН встречается чаще, чем на нижней, характеризуясь секвестрацией небольших участков костной ткани – это связывают с особенностями ее строения. Поэтому в ряде случаев процесс на верхней челюсти протекает легче, но здесь возможно распространение гнойного процесса на примыкающие костные структуры, на основание черепа.
Доказана эффективность проведения радикальных операций по типу резекций челюстей у пациентов с ОН лицевого черепа [10–11]. Однако немаловажную роль играют методы устранения дефектов после радикальных хирургических вмешательств [12]. Остается открытым вопрос индивидуального подхода при выборе тактики лечения пациентов с ОН средней зоны лицевого черепа.
Цель исследования: улучшить качество диагностики и повысить эффективность хирургического лечения пациентов с ОН средней зоны лица на фоне приема наркотических фосфорсодержащих препаратов на основании комплексного подхода и обоснования новых методов.
Материал и методы
Было проведено обследование и хирургическое лечение 50 пациентов (41 мужчина и 9 женщин) с ОН костей лицевого черепа в области средней зоны лица, обратившихся в клинику челюстно-лицевой хирургии Первого МГМУ им. И.М. Сеченова в период с 2013 по 2017 г. Возраст больных составил от 22 до 40 лет.
Критерии включения в исследование: возраст от 18 до 70 лет, употребление синтетических наркотических препаратов (дезоморфин, первитин) в течение длительного времени (от 1 года), прекращение приема наркотических препаратов (более 3 месяцев до госпитализации), наличие очагов оголения костной ткани, со слов пациентов в течение 2 месяцев и более. Критериями исключениями служили: отсутствие контакта с пациентом, постоянное употребление наркотических средств и невозможность/нежелание отказа от них, тяжелая соматическая сопутствующая патология, нарушения лечебного режима, возвращение к приему наркотических препаратов, добровольный отказ от лечения.
ОН костей лицевого скелета верифицировали при наличии обнажения костной ткани челюстей и/или костей лицевого черепа более 2 месяцев после воздействия триггерного механизма, например удаления зубов (данный временно`й интервал выбран с учетом стандартных сроков секвестрации кости при одонтогенном остеомиелите), гнойного отделяемого с ихорозным запахом, изменении мягких тканей в данной области по типу плотного отека или инфильтрата без зон флуктуации. Лицам с наркотической зависимостью при наличии верифицированного ОН костей лицевого скелета в клинике выставлялся следующий диагноз: «Препарат-ассоциированный остеонекроз» соответствующих костей лицевого скелета.
Все больные с учетом локализации остеонекротического процесса в костях лицевого черепа были распределены в следующие группы:
1-я группа – пациенты с наличием ограниченного остеонекротического процесса (в пределах 1–2 зубов или их предполагаемой области) в области верхней челюсти – 15 (30%) больных (рис. 1А);
2-я группа – пациенты с наличием диффузного остеонекротического процесса в области верхней челюсти (в проекции более, чем 3 зубов) – 14 (28%) больных (рис. 1Б);
3-я группа – пациенты с локализацией остеонекротического процесса в области верхней челюсти, тела скуловой кости – 11 (22%) больных (рис. 1В);
4-я группа – пациенты с препарат-ассоциированным ОН верхней челюсти, скуловой кости, нижней стенки глазницы – 10 (20%) больных (рис. 1Г).
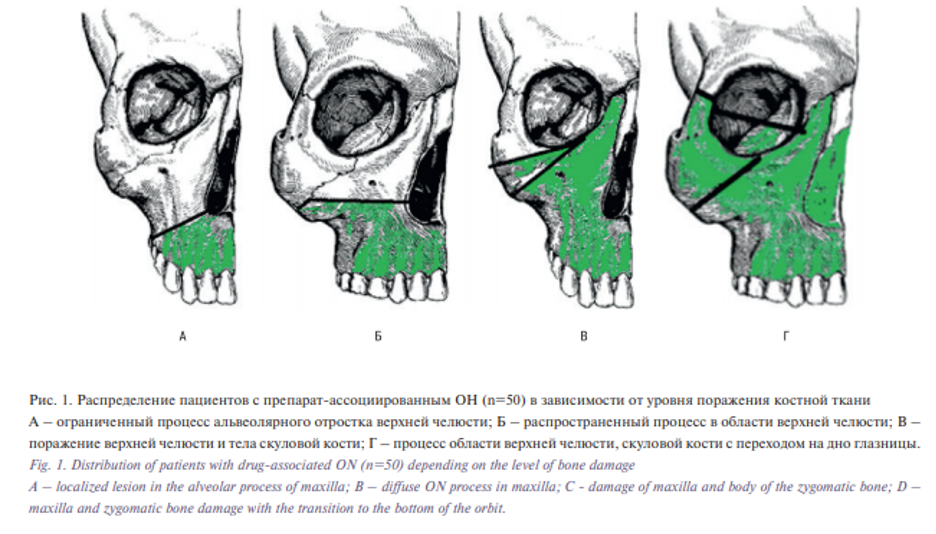
Данное деление на группы отражало также и общее состояние пациентов, клиническую картину и степень тяжести самого заболевания: в 4-й группе находились самые тяжелые пациенты, требовавшие оперативного вмешательства в больших объемах, и, как следствие, с длительным периодом реабилитации и высокой степенью риска развития осложнений, в то время как в 1-й группе находились наиболее «легкие» пациенты, у которых процент хороших результатов в послеоперационном периоде был высок.
Все больные с наличием ОН костей лицевого скелета до поступления в нашу клинику находились на лечении или наблюдении в стоматологических поликлиниках, или стационарах РФ общего профиля, или челюстно-лицевой хирургии. Наиболее часто пациенты поступали из Центрального региона РФ. Всем больным проводили стандартный объем клинико-лабораторных и инструментальных исследований на догоспитальном этапе и во время госпитализации, что позволило более полно изучить общее состояние больных в дооперационном периоде и в процессе их реабилитации, а также местные проявления заболевания в динамике. Анализ крови и мочи исследовали на 1-е сутки после поступления и перед выпиской из стационара, или каждые 10 дней, проведенные в условиях стационара. Проводили анализ результатов исследования с опорой на заключение нарколога – пациенты не поступали на плановое лечение при выявлении фактов продолжения приема наркотических препаратов или алкоголя. Микробиологическое исследование проводили непосредственно при поступлении в стационар и в послеоперационном периоде. Иммунологические исследования проводились на догоспитальном этапе обследования больных, повторно – в процессе лечения.
Всем пациентам, поступившим или находившимся на обследовании в клинике, проводились клинические, инструментальные и лабораторные исследования для оценки динамики состояния.
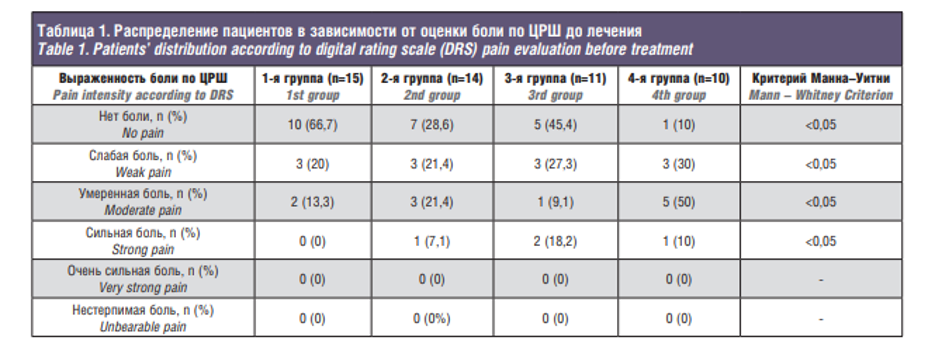
Для оценки такого важного симптома, как боль, мы применяли широко используемую цифровую рейтинговую шкалу (ЦРШ), которая также предназначена для определения интенсивности боли и состоит из 11 пунктов от 0 «боль отсутствует» до 10 «боль, которую невозможно терпеть», как в дооперационном периоде (табл. 1), так и на послеоперационном этапе. Отмечалось прогрессивное снижение жалоб во всех группах пациентов, особенно хорошо это было видно у «тяжелых» больных в 4-й группе в позднем послеоперационном периоде.
Микробиологическое исследование отделяемого в полости рта и наружных свищей проводили у всех больных при поступлении в стационар и после проведенного хирургического лечения на стадии реабилитации. Объем микробиологических исследований включал определение качественного и количественного состава микрофлоры, а также чувствительность микроорганизмов к антибактериальным препаратам.
Лучевые методы исследования (ортопантомография («ORTHOPANTOGRAPH OP 100»), рентгенография черепа в прямой и полуаксиальной проекциях («Silhouette HF» фирмы GeneralElectricMedicalSystems) проводили всем 50 пациентам с целью определения характера и объема изменений костной ткани средней зоны лица для выбора оптимальной тактики хирургического лечения как по месту жительства, так и на базах Университетских клинических больниц Первого МГМУ им. И.М. Сеченова. Кроме рутинных рентгенологических методов 30 пациентам была проведена мультиспиральная компьютерная томография лицевого черепа для верификации диагноза.
Статистическую обработку данных проводили с использованием стандартного пакета статистических программ Statistica в. 9.0. Уровень статистической значимости исследования составлял <0,05.
Изучаемые показатели были представлены в виде долей (%) и абсолютного числа. Сравнительный анализ качественных переменных проводился с помощью χ2 -критерия и двустороннего критерия Фишера.
Результаты
В 1-й группе пациентов с препарат-ассоциированными ОН средней зоны лица при распространении процесса в пределах альвеолярного отростка нижней челюсти 15 (30%) больным выполнили резекцию верхней челюсти, как правило, одностороннюю из внутриротового доступа. Во 2-й группе 14 (28%) пациентам с поражением верхней челюсти до границы со скуловой костью в проекции нижней трети верхнечелюстного синуса выполнили резекцию верхней челюсти и скуловой кости из внеротового доступа Кохера-Вебера с переходом на подресничный доступ с одномоментной реконструкцией лоскутами на питающей ножке со щеки, носогубной области и др. В 3-й группе 11 (22%) пациентам с поражением верхней челюсти, части скуловой кости и в 4-й группе 10 (20%) больным, у которых диагностировали поражение токсическим ОН верхней челюсти, скуловой кости и нижней стенки глазницы, провели резекцию верхней челюсти, скуловой кости и нижней стенки глазницы из доступа Кохера-Вебера с переходом на поди надресничный доступ с одномоментной пластикой лоскутами со щеки, носогубной и височной области.
На основании полученных данных мы провели анализ течения раннего и позднего послеоперационного периодов у пациентов с диагнозом препарат-ассоциированного ОН средней зоны лицевого черепа. В настоящем исследовании ранним послеоперационным периодом считались первые 14 суток после операции, поздним послеоперационным периодом – не ранее, чем через 30 суток после операции резекции костей лицевого черепа.
Все пациенты в раннем послеоперационном периоде проводили около 2 суток в отделение реанимации и интенсивной терапии с целью динамического наблюдения и стабилизации общего состояния после проведенного обширного оперативного вмешательства.
В послеоперационном периоде отмечали нарастание послеоперационного отека мягких тканей у пациентов всех групп с его максимумом на 2–3-и сутки после операции, который регрессировал в течение еще 5–7 суток, однако наибольший отек мягких тканей был отмечен у пациентов 3-й и 4-й групп в связи с большим объемом резекции, дополнительным проведением пластики местными мягкими тканями и височным лоскутом. Наименьший объем отека был у пациентов при ограниченном поражении костей средней зоны лица и частичной резекции верхней челюсти, которую выполняли через внутриротовой доступ. При осуществлении доступа Кохера-Вебера отмечали дополнительный отек век за счет нарушения оттока лимфы.
Для борьбы с послеоперационными отеками кроме основной противовоспалительной, антибактериальной и обезболивающей терапии проводили дополнительное местное лечение через несколько суток после операции в виде полуспиртовых компрессов и повязок с димексидом (в разведении с водой 1:5) на область отеков с экспозицией в течение 1 часа. Отмеченный отек оставшейся слизистой оболочки и лоскутов расценивали как нормальное течение послеоперационного периода с учетом объема оперативного вмешательства с потерей опорных тканей и довольно большой мобилизацией мягких тканей.
В течение первых 7 суток послеоперационный отек мягких тканей прогрессивно уменьшался на фоне проводимого лечения и местных мероприятий, включавших ежедневные перевязки и тщательную гигиену полости рта, проводимую самими пациентами. Послеоперационные раны в основном заживали первичным натяжением. Швы со стороны кожи снимали на 7–9-е сутки после операции, а со стороны полости рта в зависимости от местного статуса и состояния окружающих мягких тканей и лоскутов – на 10–14-е сутки, вне зависимости от групп.
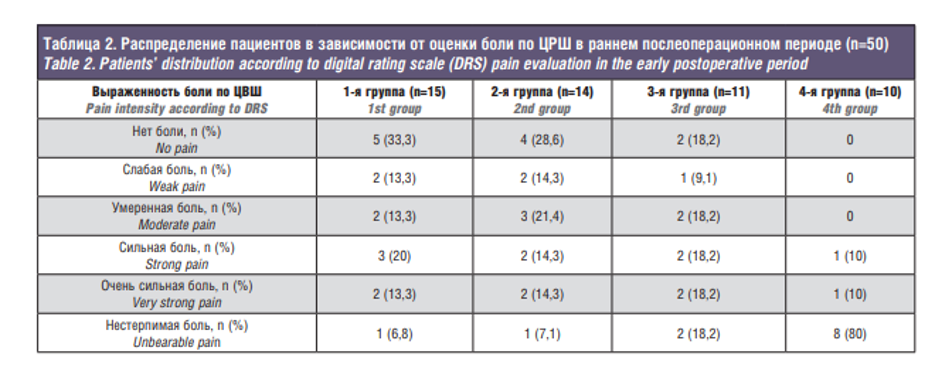
В послеоперационном периоде проводили также оценку болевого синдрома по ЦВШ, но в отдаленном периоде, т.к. результаты могли быть связаны в раннем периоде с наличием послеоперационных болей и отека. Распределение пациентов в группах в зависимости от выраженности болевого синдрома представлено в табл. 2.
Несмотря на интенсивное лечение и проводимые мероприятия у 6 (12%) пациентов отмечалось расхождение послеоперационных швов, что мы связывали с большим объемом оперативного вмешательства, недостаточным питанием перемещенных лоскутов, и, самое главное, с несоблюдением пациентами элементарных правил гигиены, плохой приверженностью лечению вне зависимости от применяемых ранее наркотиков.
Большинство пациентов с расхождением швов были в 3-й группе пациентов (3/27,3%), что может быть связано с выше указанными причинами, а также недостаточным объемом тканей для пластики дефекта, чего не отмечалось в 4-й группе пациентов, у которых дополнительно к местным тканям подшивали височный фасциальный лоскут.
У пациентов с выявленным расхождением швов проводили более интенсивные ежедневные перевязки с антисептиками, применяли кератопластики и мази с антисептическим действием (Солкосерил адгезив дентальная паста, Метрогил Дента, Холисал и др.). У данных пациентов послеоперационные раны заживали более длительно (дополнительно 7–10 суток в отличие от обычного течения) и вторичным натяжением.
Оценку позднего послеоперационного периода проводили через 30 дней после операции. Хочется отметить, что в связи с особенностью данной группы пациентов (сопутствующие хронические инфекционные заболевания, низкая приверженность лечению, частые рецидивы наркомании) было весьма затруднительно добиться регулярного посещения ими клиники для проведения контрольных осмотров.
Контрольные осмотры назначали через 1, 6 месяцев после операции и затем 1 раз в год при непременном контроле местного статуса хирургом-стоматологом или челюстно-лицевым хирургом в медицинских учреждениях по месту жительства.
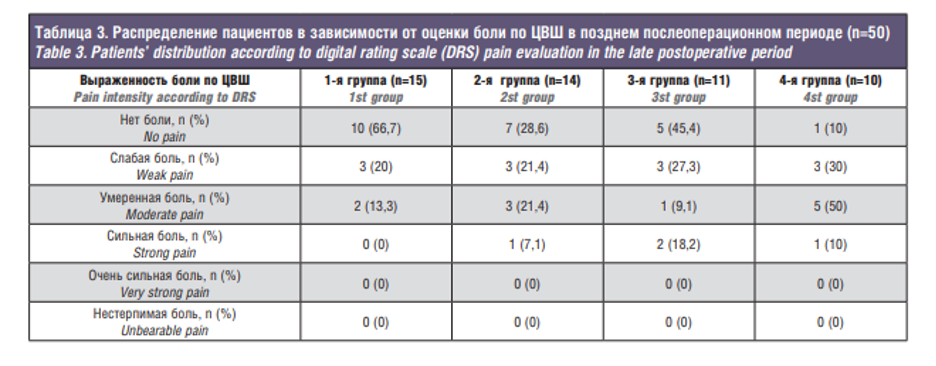
У всех пациентов, следовавших рекомендациям и не начавших вновь принимать дезоморфин, мы отмечали стойкую ремиссию заболевания: не отмечали при осмотре и по данным лучевых методов исследования распространения областей ОН, состояние полости рта было относительно удовлетворительным. Распределение пациентов в зависимости от выраженности болевого синдрома в позднем послеоперационном периоде представлено в табл. 3. В случае нарушения режима, назначений, несоблюдения гигиены полости рта, употребления наркотических препаратов при повторном попадании таких пациентов на госпитализацию мы отмечали распространение препарат-ассоциированного ОН на зону других костей лицевого черепа и даже его основание. Также было отмечено несколько случаев летальных исходов при передозировке наркотических препаратов (3/6%).
Обсуждение
Проблема лечения пациентов с препарат-ассоциированными ОН костей лицевого черепа в последние годы стала не только медицинской и узко специализированной, но и социальной, что связано с возникновением патологического процесса у пациентов группы риска, уже иммуноскомпроментированных, что утяжеляет течение как основных заболеваний, так и самих ОН.
При анализе литературных источников по данному вопросу мы столкнулись с отсутствием такой проблемы в развитых странах, в которых описывают другие некрозы костей лицевого черепа, возникающие на фоне применения бисфосфонатов у пациентов с остеопорозом и отдаленными метастазами при злокачественных образованиях. Пациентов данных категорий различаются между собой как по возрасту, так и социальному статусу, наличию сопутствующих заболеваний, однако есть общая черта: у всех пациентов развивается патологический процесс в области костей лицевого черепа на фоне поступления в организм веществ, содержащих фосфор.
Таким образом, мы обнаружили доклады по диагностике и лечению пациентов с препарат-ассоциироваными ОН на фоне введения наркотического препарата дезоморфин только на территории РФ и стран СНГ, что свидетельствует о довольно высоком уровне наркомании.
Диагностика и лечение пациентов данной категории усложняется из-за их низкой приверженности лечению, наличию сопутствующих тяжелых инфекционных заболеваний, низкого уровня гигиены и «злокачественной» наркомании. Как правило, такие пациенты не приходят на лечение сами, их приводят родственники уже при развитии тяжелой стадии заболеваний с обширными некрозами и даже на пике обострения процесса. У больных при поступлении отмечают ухудшение общего состояния, в местном статусе наблюдается обширное оголение костей лицевого черепа со стороны полости рта, а со стороны кожи – большое количество свищевых ходов с обильным гнойным отделяемым, изменением конфигурации лица за счет дефектов и деформаций.
Мы провели обследование и комплексное лечение 50 пациентов с препарат-ассоциированными некрозами средней зоны лицевого черепа на базе клиники челюстно-лицевой хирургии УКБ №2 Первого МГМУ им. И.М. Сеченова, провели анализ результатов в раннем и позднем послеоперационном периодах.
Хочется отметить, что мы избрали радикальный метод лечения пациентов с препарат-ассоциированными ОН средней зоны лицевого черепа, что совпадает с мнением ряда авторов [13–14]. Радикализм позволяет достичь стойкой ремиссии, предотвратить развитие гнойно-воспалительных осложнений, стабилизировать микробиоциноз полости рта, конечно, при условии хорошего контакта с пациентом, соблюдением им врачебных рекомендаций и гигиены полости рта, регулярного прохождения контрольных осмотров и непременном прекращении приема дезоморфина.
Резекцию костей лицевого черепа проводили в пределах здоровых тканей, отступя от линии, отграничивающей зону поражения, около 0,5 см (до 1 см) с учетом наличия черты диффузности патологического процесса и несоответствия картины при лучевой диагностике и при проведении операции по сравнению с истинными изменениями в костной ткани.
Пациентам после резекции костей лицевого черепа выполняли реконструктивный этап в объеме пластики щечным лоскутом на ножке (25 больных – 50%); пластики височно-фасциальным лоскутом (10 больных – 20%). У 15 (30%) пациентов пластику проводили только местными тканями.
По результатам микробиологического исследования мы обнаружили, что микрофлора полости рта и раневого отделяемого у пациентов с токсическим ОН средней зоны лица на фоне приема наркотического препарата дезоморфин была весьма разнообразна, однако состояла в основном,из условно патогенных микроорганизмов и представителей нормальной микрофлоры. У большинства пациентов (46 больных – 92%) были выделены ассоциации микроорганизмов, тогда как монокультуру обнаружили только у 4% пациентов. Наши данные созвучны с результатами микробиологических исследований пациентов с препаратассоциированными ОН костей лицевого черепа [13, 15], у которых обнаруживали нормальную и условно патогенную микрофлору, но в высоких концентрациях. Подобная картина свидетельствует о гипоэргическом типе воспалительной реакции, что может быть связано с наличием хронических инфекционных заболеваний у данных пациентов (ВИЧ, гепатит В и С) и обусловливает особенности клинической картины – вялотекущий процесс с периодическими обострениями в виде развития абсцессов и флегмон.
Интенсивность послеоперационного отека, сроки его регресса, число осложнений в раннем послеоперационном периоде не отличается от такового, по данным исследований других авторов [13–15].
Заключение
Таким образом, проблема лечения пациентов с препаратассоциированными ОН средней зоны лицевого черепа является комплексной и требует всестороннего лечения: радикальной санации измененной костной ткани, реконструктивно-восстановительных приемов с целью сокращения сроков реабилитации больных, работы в команде с наркологами, инфекционистами с целью нивелирования проявлений сопутствующих заболеваний – инфекционных процессов и наркомании, психологической помощи для борьбы с наркотической зависимостью и повышения приверженности лечению.
ЛИТЕРАТУРА
- Лешнер А.И. Научные взгляды на наркотическую зависимость и ее лечение. Врач. вестник. 2002;ХLVII(1):26–31.
- Adornato M.C., Morcos I., Rozanski J.The treatment of bisphosphonateassociated osteonecrosis of the jaws with bone resection and autologous plateletderived growth factors. J. Am. Dent. Assoc. 2007;138:971–7.
- Almazrooa S.A., Woo S.B. Bisphosphonate and Non bisphosphonate-Associated Osteonecrosis of the Jaw: A Review. J. Am. Dent. Assoc. 2009;140:864–75.
- Badros A., Weikel D., Salama A. Osteonecrosis of the jaw in multiple myeloma patients: Clinical features and risk factors. J. Clin. Oncol. 2006; 24:945–52.
- Гехт А.Б., Полунина А.Г., Брюн Э.А. Неврологические нарушения у больных героиновой наркоманией при острой абстиненции и в раннем постабстинентном периоде. Журн. неврологии и психиатрии. 2003;103(2):9–15.
- Duran E., Lopez L., Martinez A. Primary brain abscess with Nocardia otitidiscaviarum in an intravenous drug abuser. J. Med. Microbiol. 2001;50(1):101–3.
- Герич И.Д. Гнойная хирургическая инфекция, обусловленная парентеральным употреблением наркотиков: клиника, диагностика и лечение. Дисс. докт. мед. наук. Львов, 1998.
- Улезко Т.А. Дезоморфиновая наркомания. Наркология. 2011;10:54–7.
- Чупанова М.Ю., Мандель А.И., Агеева Т.С. Клинико-рентгенологическая характеристика пневмоний при дезоморфиновой наркомании. Бюл. сибирской медицины. 2012;11(5):80–4.
- Broumand V. Bisphosphonateinduced exposed bone (osteonecrosis/osteopetrosis) of the jaws: risk factors, recognition, prevention, and treatment. J. Oral. Maxillofac. Surg. 2005;63: 1567–75.
- Coleman R.E. Risks and benefits of bisphosphonates. Br. J. of Cancer. 2008;98:1736–40.
- Eisele D.W., Smith R.V. Complications in head and neck surgery. 2nd ed. Phil., PA: Mosby, Elseiver, 2009.
- Медведев Ю.А., Басин Е.М. Токсические фосфорные остеонекрозы лицевого черепа у лиц с наркотической зависимостью от дезоморфина и первитина. Часть I. Стоматология. 2015;2:53–7.
- Погосян Ю.М., Акопян К.А.Лечение остеонекроза челюстей у больных, употребляющих самодельно изготовленные наркотические средства. Вопр. теоретической и клинической медицины. 2013;16(1/77):48–51.
- Маланчук В.А., Бродецкий И.С. Комплексное лечение больных остеомиелитом челюстей на фоне наркотической зависимости. Вестник ВГМУ. 2014;13(2):115–23.
Поступила 04.06.19 Принята в печать 01.08.19
REFERENCES
- Leshner A.I. Scientific views on drug addiction and its treatment. Doctor’s bulletin. 2002; XLVII (1): 26–31. (In Russ.).
- Adornato M.C., Morcos I., Rozanski J. The treatment of bisphosphonateassociated osteonecrosis of the jaws with bone resection and autologous plateletderived growth factors. J. Am. Dent. Assoc. 2007;138: 971–7.
- Almazrooa S.A., Woo S.B. Bisphosphonate and Non bisphosphonate-Associated Osteonecrosis of the Jaw: A Review. J. Am. Dent. Assoc. 2009;140:864–75.
- Badros A., Weikel D., Salama A. Osteonecrosis of the jaw in multiple myeloma patients: Clinical features and risk factors. J. Clin. Oncol. 2006;24:945–52.
- Geht A.B., Polunina A.G., Bryun E.A. Neurological disorders in patients with heroin addiction in acute withdrawal symptoms and in the early post-withdrawal period. Neurology and psychiatry journal. 2003;103 (2):9–15. (In Russ.).
- Duran E., Lopez L., Martinez A. Primary brain abscess with Nocardia otitidiscaviarum in an intravenous drug abuser. J. Med. Microbiol. 2001;50(1):101–3.
- Gerich I.D. Purulent surgical infection due to parenteral drug use: clinic, diagnosis and treatment. Diss. Doct. med. sciences. Lviv, 1998. (In Russ.).
- Ulezko T.A. Desomorphine addiction. Narcology. 2011; 10: 54–7 .(In Russ.).
- Chupanova M.Yu., Mandel A.I., Ageeva T.S. Clinical and radiological characteristics of pneumonia in desomorphine addiction. Bull. Siberian medicine. 2012;11 (5):80–4. (In Russ.).
- Broumand V. Bisphosphonateinduced exposed bone (osteonecrosis/osteopetrosis) of the jaws: risk factors, recognition, prevention, and treatment. J. Oral. Maxillofac. Surg. 2005;63:1567–75.
- Coleman R.E. Risks and benefits of bisphosphonates. Br. J. of Cancer. 2008;98:1736–40.
- Eisele D.W., Smith R.V. Complications in head and neck surgery. 2nd ed. Phil., PA: Mosby, Elseiver, 2009.
- Medvedev Yu.A., Bassin E.M. Toxic phosphoric osteonecrosis of the facial skull in individuals with drug dependence on desomorphine and pervitin. Part I. Dentistry. 2015;2:53–7. (In Russ.).
- Poghosyan Yu.M., Akopyan K.A. Treatment of jaw osteonecrosis in patients using home-made narcotic drugs. Quqstions of theoretical and clinical medicine. 2013; 16(1/77):48–51. (In Russ.).
- Malanchuk V.A., Brodetsky I.S. Comprehensive treatment of patients with jaw osteomyelitis against the background of drug dependence. Bulletin of VSMU. 2014;13 (2):115–23. (In Russ.).
Received 04.06.19 Accepted 01.08.19
Информация об авторах:
Ю.А. Медведев – д.м.н., профессор, заведующий кафедрой челюстно-лицевой хирургии ФПДО МГМСУ им. А.И. Евдокимова, Москва, Россия
Д.Х. Испирян – аспирант кафедры челюстно-лицевой хирургии Института стоматологии ФГАОУ ВО Первого МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва; e-mai.: dispiryan@gmail.com
About the authors:
Yu.A. Medvedev – MD, professor, head of the Department of Maxillofacial Surgery A.I. Evdokimov FPDE MSMDU, Moscow, Russia
D.Kh. Ispiryan – Postgraduate Student, Department of Maxillofacial Surgery, Institute of Dentistry, FSAEI HE, I.M.Sechenov First Moscow State Medical University (Sechenov University), Moscow; e-mail: dispiryan@gmail.com
