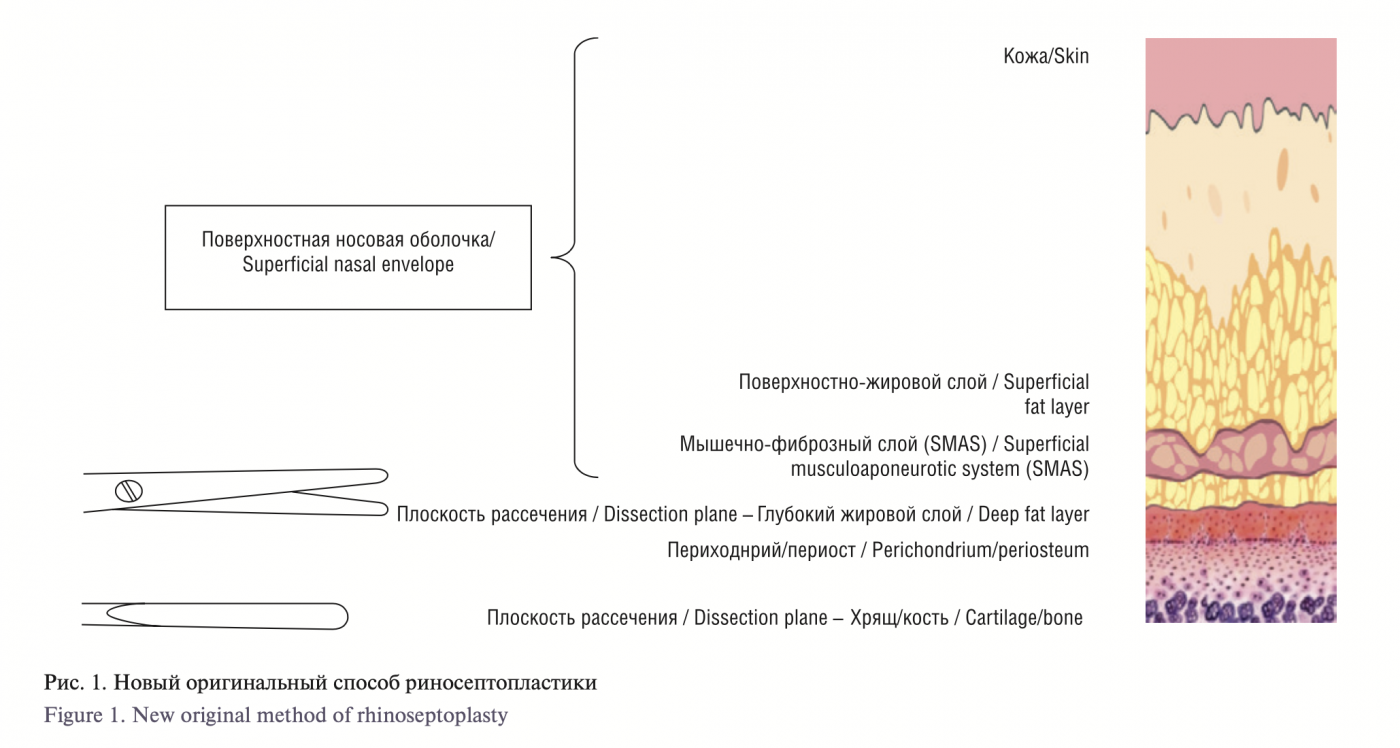
Для цитирования:
Крюков А.И., Кунельская Н.Л., Туровский А.Б., Царапкин Г.Ю., Колбанова И.Г., Алексанян Т.А. Одномоментная функциональная эстетическая хирургия носа. Head and neck. Голова и шея. Российский журнал=Head and neck. Russian Journal. 2021;9(3):34–42
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
DOI: 10.25792/HN.2021.9.3.34–42
Цель: повышение эстетических и функциональных результатов хирургического лечения пациентов с врожденными и приобретенными деформациями наружного носа с помощью методики использования двуплоскостной диссекции мягкотканного покрова наружного носа.
Материал и методы. Обследованы 418 пациентов, которым была проведена первичная эстетическая хирургия носа (ЭХН). Пациенты были разделены на основную и контрольную группы. Пациентам основной группы выполнили эстетическое хирургическое лечение с предлагаемым нами методом двуплоскостной диссекции мягких тканей наружного носа в сочетании с функциональной хирургией носа (ФХН). Объем ФХН зависел от выявленных нарушений архитектоники внутриносовых структур. Пациентам контроль- ной группы выполняли операцию по общепринятым для ЭХН принципам. В эту группу вошли пациенты, которым по разным причинам не проводили ФХН.
Результаты. При анализе эффективности хирургического лечения оценивали функциональные ре- зультаты посредством оценки дыхательной функции носа у прооперированных пациентов по анкете NOSE и по данным передней активной риноманометрии (ПАРМ) перед операцией и в отдаленном послеоперационном периоде (через 1, 6, 12 месяцев). Результаты ЭХН оценивали после операции в раннем периоде – 1 месяц, позднем – 3 месяца и отдаленном – 12 месяцев с использованием 3-балль- ной системы, базирующейся на трех объективных составляющих: эстетической оценке (соответствие результата предоперационной модели), функциональной оценке (сравнении до- и послеоперационных результатов ПАРМ) и наличию осложнений.
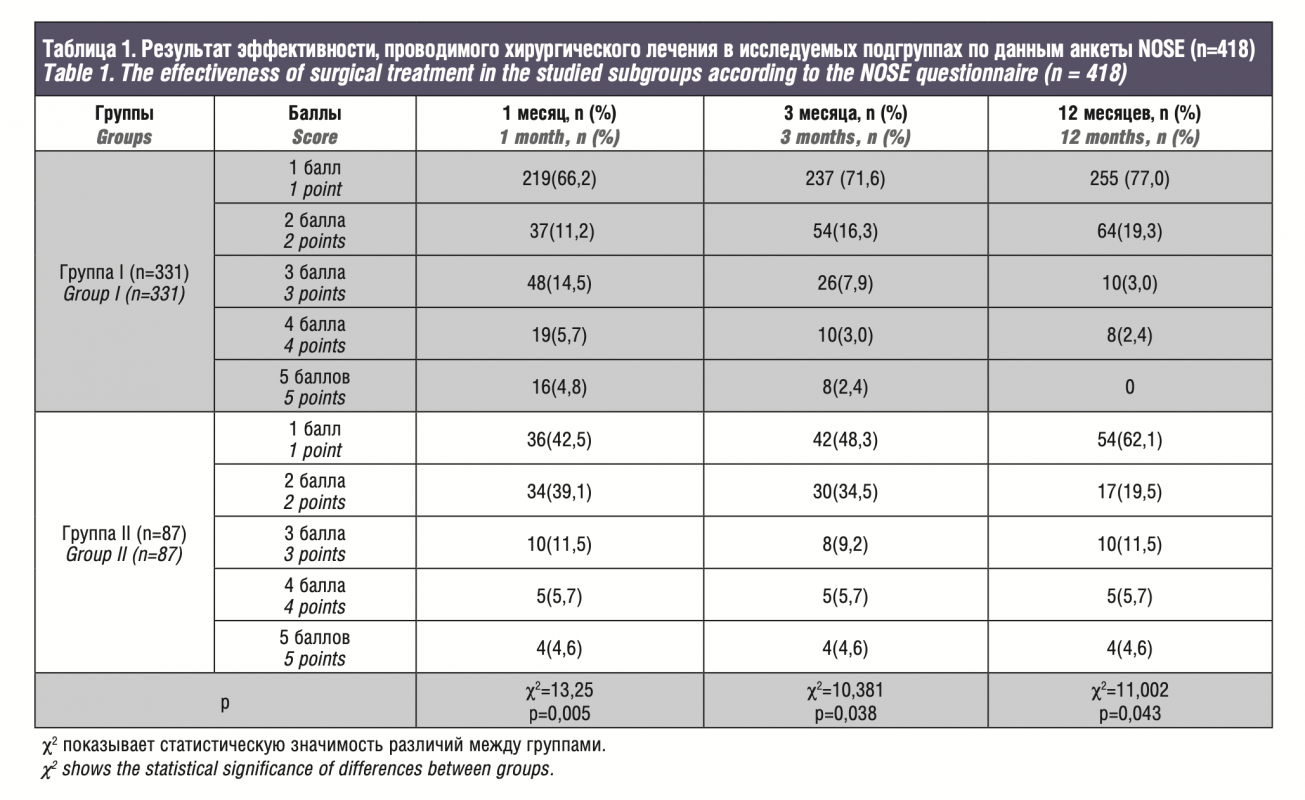
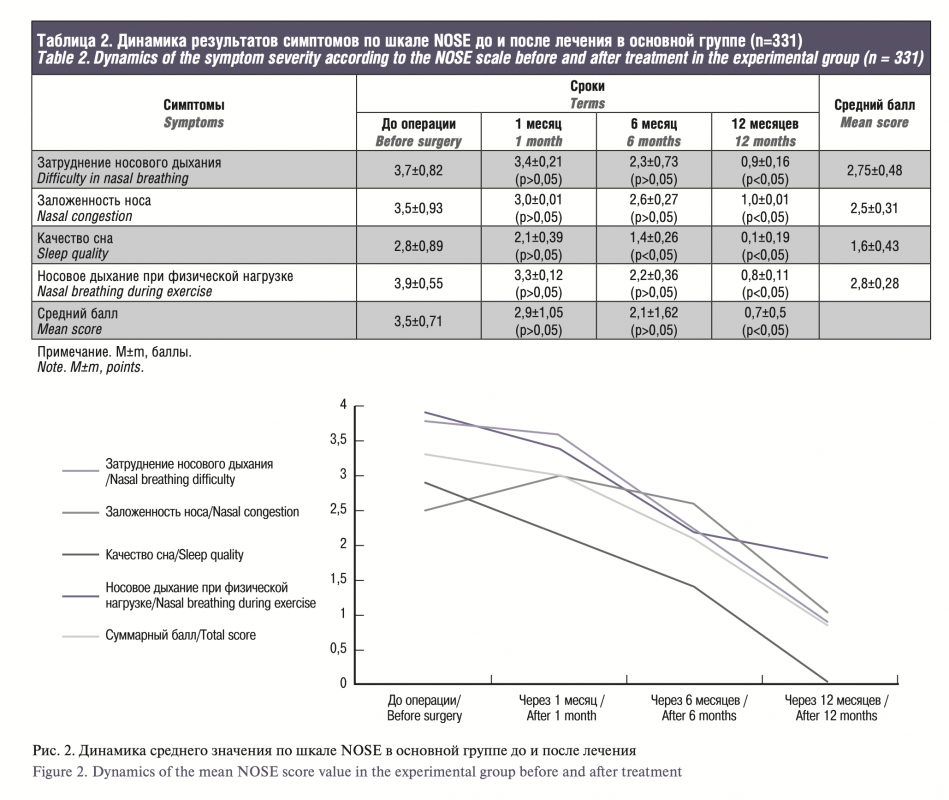
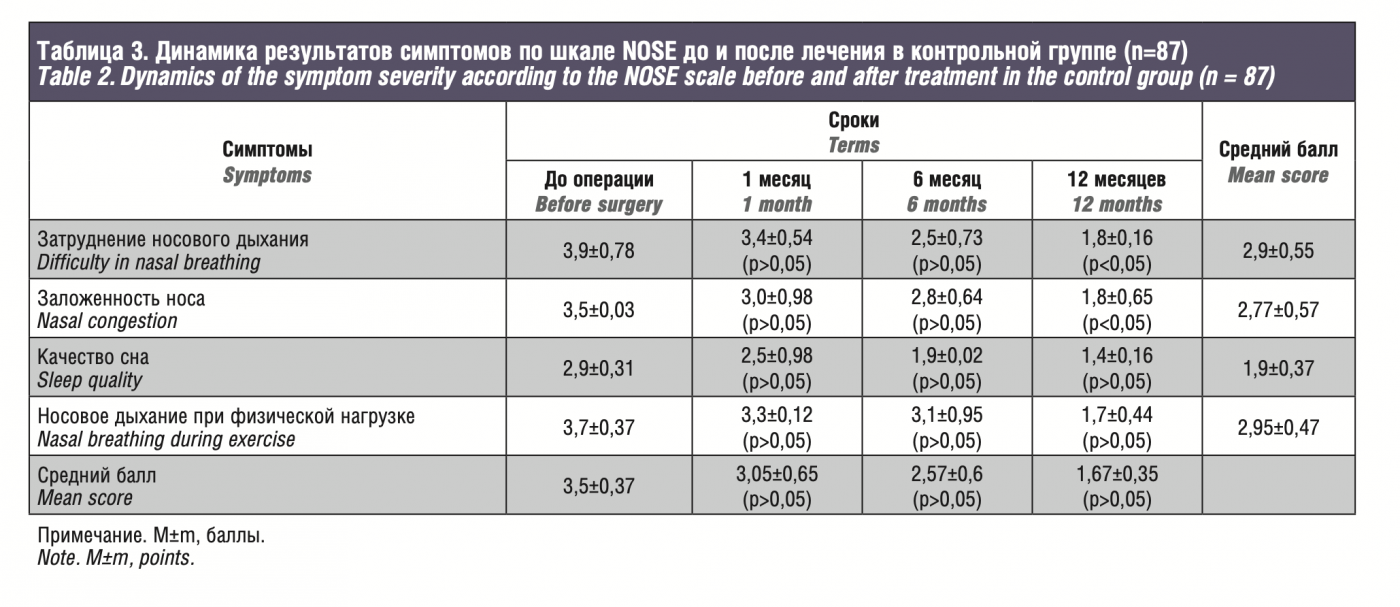
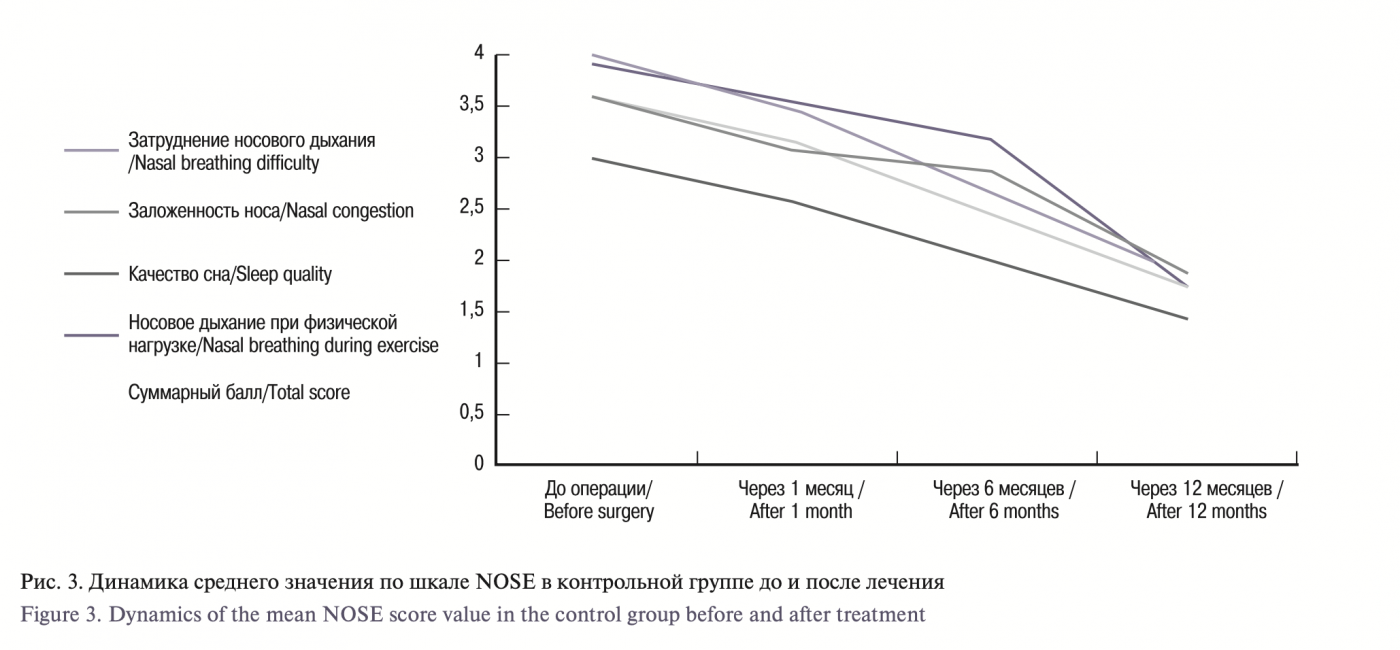
По результатам исследований в обеих группах исходные данные были сопоставимы, средний балл по шкале NOSE на дооперационном этапе в основной группе составил 3,5±0,71, через месяц 2,9±1,05, через 6 месяцев 2,1±1,62, через 12 месяцев 0,7±0,5. По симптомам: затруднение носового дыхания – 2,75±0,48, заложенность носа – 2,5±0,31, качество сна – 1,6±0,43, носовое дыхание при физической нагрузке – 2,8±0,28. В сравниваемой контрольной группе получены следующие значения: общий балл до операции – 3,5±0,37, через 1, 6 и 12 месяцев – 3,05±0,65, 2,57±0,6, 1,67±0,35 соответственно, а по симптомам: 2,9±0,55, 2,77±0,57, 1,9±0,37 и 2,95±0,47.
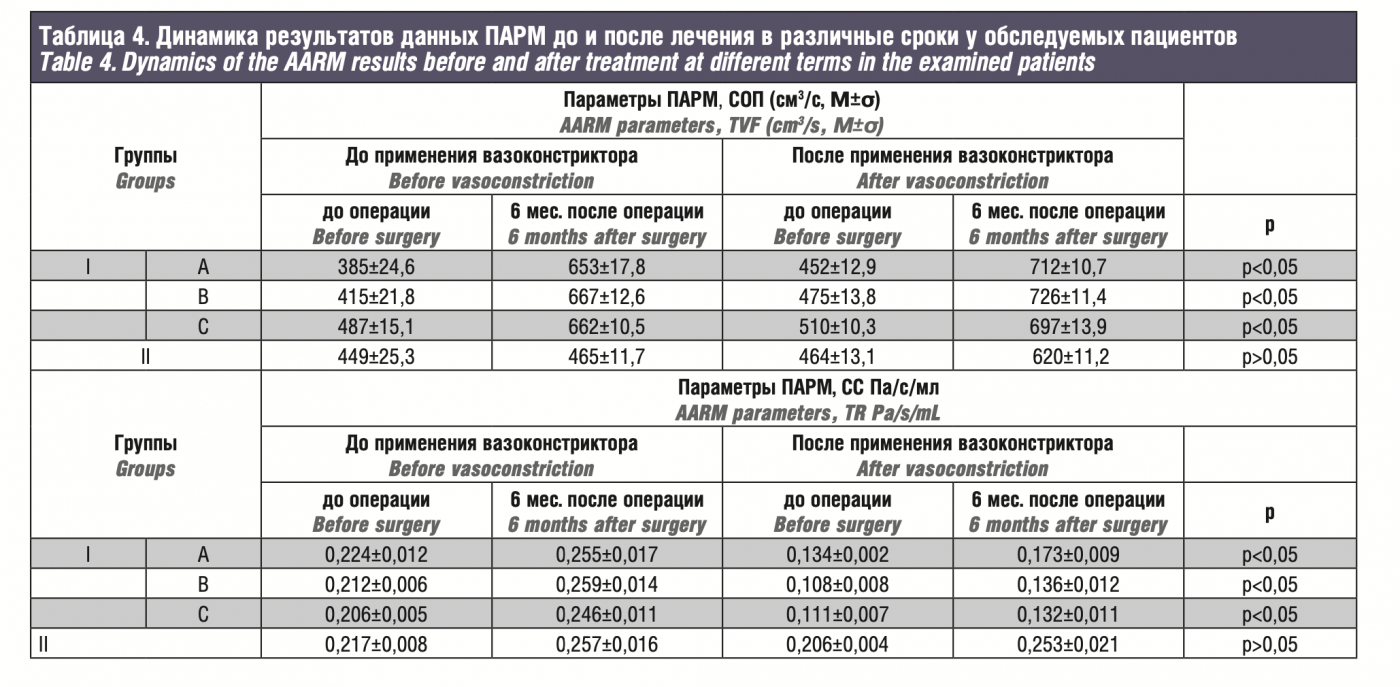
По данным ПАРМ (суммарный объемный поток, суммарное сопротивление) до операции и через 6 месяцев после, показали статистически достоверное увеличение показателей у пациентов, которым выполнялась одномоментная коррекция внутренних и внешних структур носа.
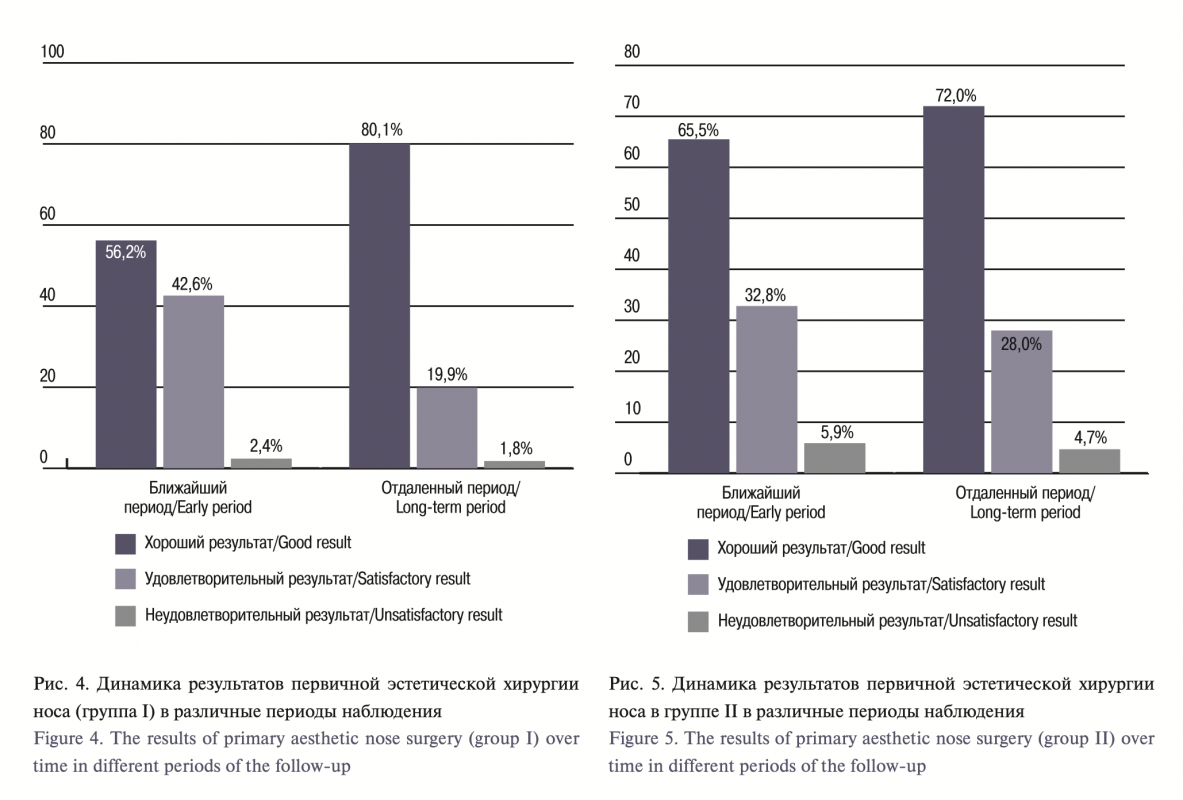
При оценке ЭХН у пациентов контрольной группы с течением времени отсутствовали достоверные различия по количеству хороших, удовлетворительных и неудовлетворительных результатов на протя- жении всего периода наблюдения. Динамика результатов в контрольной группе отличалась от основной бóльшим числом неудовлетворительных результатов в ближайшем (2,4% против 5,9% соответственно) и отдаленном 1,8% против 4,7% соответственно) периодах наблюдения; с течением времени отмече- но снижающееся количество удовлетворительных результатов и их конверсия в хорошие, что было статистически достоверно в контрольной группе. Кроме того, в этой же контрольной группе динамика результатов в отдаленном периоде характеризовалась уменьшением прироста хороших результатов, который был менее значимым по сравнению с основной группой.
Выводы. Применение оригинального метода эстетической и функциональной хирургии носа с приме- нением двухплоскостной диссекции мягких тканей наружного носа и проведением различной коррек- ции внутриносовых структур показало высокую эффективность, что позволило добиться полноценной функциональной и эстетической реабилитации пациентов в большинстве случаев. Разработанный оригинальный метод эстетической и функциональной хирургии носа демонстрирует достоверное прео- бладание хороших результатов в отдаленном периоде по сравнению с ближайшим (80,1% против 56,2%). Ключевые слова: септопластика, ринопластика, искривление перегородки носа, наружный нос, эсте- тическая хирургия наружного носа
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена без спонсорской поддержки.
Purpose: to improve the aesthetic and functional results of surgical treatment of patients with congenital and acquired deformities of the external nose using the two-plane soft tissue dissection technique of the external nose. Material and methods: The study included 418 patients who underwent primary aesthetic nasal surgery (ANS). Patients were divided into the experimental and control groups. The patients of the experimental group underwent aesthetic surgery using the proposed method of the two-plane soft tissue dissection of the external nose in combination with functional nasal surgery (FNS). The FNS volume depended on the violations of the intranasal architectonics revealed. The control group patients underwent surgery according to the principles generally accepted for ANS. This group included patients who, for various reasons, did not undergo FNS.
Results: When analyzing the effectiveness of surgical treatment, functional results were assessed by the respiratory function testing of the nose in the operated patients according to the NOSE questionnaire and according to the data of anterior active rhinomanometry (AARM) before surgery and in the long-term postoperative period (after 1, 6, 12 months). The ANS results were assessed in the early post-operative period – 1 month, in the late post- operative period – 3 months, and in the long-term period – 12 months, using a 3-point system based on three objective components: aesthetic assessment (compliance with the preoperative model), functional assessment (comparison of pre- and postoperative results of AARM) and the presence of complications.
According to the results, in both groups, the initial data were comparable, the mean NOSE score in the experimental group was 3.5±0.71 at the preoperative stage, 2.9±1.05 after a month, 2.1±1.62 after 6 months, and 0.7±0.5 after 12 months. Concerning the symptoms: difficulty in nasal breathing – 2.75±0.48, nasal congestion – 2.5±0.31, sleep quality – 1.6±0.43, nasal breathing during exercise – 2.8±0.28. In the control group, the following values were obtained: total score before surgery – 3.5±0.37, after 1, 6 and 12 months – 3.05±0.65, 2.57±0.6, 1.67±0.35, respectively, and 2.9±0.55, 2.77±0.57, 1.9±0.37 and 2.95±0.47 for the symptoms.
According to the AARM data (total volume flow, total resistance) before surgery and 6 months after, the values were statistically significantly increased in patients who underwent simultaneous correction of the internal and external structures of the nose.When assessing ANS in the control group, over time, there were no significant differences in the number of the good, satisfactory and unsatisfactory results throughout the follow-up period. The changes of the results over time differed between the control and the experimental group, with the greater number of early (2.4% versus 5.9%, respectively) and long-term (1.8% versus 4.7%, respectively) unsatisfactory results in the control within the follow-up; over time, there was a decreasing number of satisfactory results and their conversion to good ones, which was statistically significant in the control group. In addition, in the same control group, the dynamics of results in the long-term period was characterized by declined increase in good results, which was less significant compared to the experimental group.
Conclusions: The use of an original method of aesthetic and functional nasal surgery with the two-plane soft tissue dissection of the external nose and various correction of intranasal structures has shown high efficiency, which made it possible to achieve full functional and aesthetic rehabilitation of the patients in most cases. The developed original method of aesthetic and functional nose surgery demonstrates a significant predominance of good results in the long-term period compared to the early one (80.1% versus 56.2%).
Key words: septoplasty, rhinoplasty, deviation of the nasal septum, external nose, external nose aesthetic surgery
Conflicts of interest. The authors have no conflicts of interest to declare.
Funding. There was no funding for this study.
Введение
К основным причинам возникновения дефектов верхней и нижней челюстей относятся: доброкачественные и злокачествен- ные опухоли, огнестрельные и неогнестрельные травмы, лучевой и медикаментозный остеонекроз. Отсутствие сегмента верхней и/или нижней челюсти с потерей ее непрерывности неизбежно приводит к нарушению функции жевания, глотания и речи, к изменению внешнего вида. При этом потеря фронтального участка нижней челюсти, являющегося местом прикрепления языка и мышц, формирующих дно полости рта, вызывает их смещение кзади и развитию асфиксии. Дефект окружающих мягких тканей еще в большей степени отягощает описанные нарушения. Современный подход к устранению дефектов верх- ней и нижней челюстей заключается в использовании ревас- куляризированных трансплантатов сразу или в ранние сроки после их возникновения [1]. Выбор трансплантата при этом индивидуален и основан на оценке общего состояния больно- го, наличия сопутствующих заболеваний, этиологии дефекта челюсти и состояния окружающих тканей, перспектив орто- педической реабилитации. Наличие собственного источника кровоснабжения позволяет таким трансплантатам срастаться с реципиентной костью как обыкновенный перелом [2] и не зависеть от состояния окружающих тканей. Они претерпевают минимальную резорбцию, а по данным научных публикаций и нашим собственным наблюдениям увеличиваются в разме- рах. Реваскуляризированными трансплантатами, чаще всего используемыми для устранения костных дефектов, являются: малоберцовый, из гребня подвздошной кости, латерального края и угла лопатки, а также трансплантат с включением фраг- мента лучевой кости. По сравнению с другими трансплантат из наружного края лопатки (ТНКЛ) обладает рядом существенных преимуществ для устранения обширных как изолированных костных, так и комбинированных дефектов.
Исследования по изучению анатомических предпосылок при- менения трансплантатов из бассейна подлопаточной артерии были начаты M. Saijo в 1978 г. [3]. A. Gilbert (1979) первым использовал кожно-фасциальный трансплантат, кровоснаб- жаемый горизонтальной кожной ветвью артерии огибающей лопатку [4, 5]. В 1981 г. L. Teot указал на существование анато- мических возможностей использования костного трансплантата из латерального края лопатки, но только спустя 6 лет этот трансплантат был использован в клинике [6–8]. Перед этим T.M. Nassif (1982) предложил использовать нисходящую кож- ную ветвь артерии огибающей лопатку, для забора еще одного кожно-фасциального траснплантата из бассейна подлопаточной артерии [9]. Более трех десятилетий этот трансплантат нахо- дится в арсенале реконструктивных хирургов. В нашей стране данный трансплантат популяризирован благодаря работам Н.В. Калакутского [10, 11]. Наружный край лопатки кровоснабжается ветвями артерии, огибающей лопатку из бассейна подлопаточ- ной артерии. К конечным ветвям артерии, огибающей лопат- ку, относятся горизонтальная и нисходящая кожные артерии, каждая из которых может кровоснабжать отдельный кожно- фасциальный трансплантат, взятый самостоятельно или вместе с наружным краем лопатки. При этом каждый из компонентов такого сложного трансплантата обладает большой подвижно- стью и независимостью друг от друга. Еще одной значимой для реконструктивной микрохирургии ветвью подлопаточной артерии является торакодорсальная артерия, ветви которой кровоснабжают широчайшую мышцу спины и кожу над ней, угол лопатки, а также зубчатую мышцу. Все эти составляющие могут быть включены в единый химерный трансплантат на подлопаточной артерии [12, 13]. В таком исполнении транс- плантат не имеет конкурентов при устранении распространенных и сложных дефектов, включающих как костные, так и мягкие ткани [14, 15].
К недостаткам трансплантата относятся: необходимость пере- ворачивать больного на бок, что осложняет одновременную работу двух бригад; относительно короткая сосудистая ножка. До сих пор еще одним нерешенным вопросом, связанным с использованием ТНКЛ, является возможность его сегментиро- вать. Считается, что возможно выполнить лишь одну остеото- мию наружного края лопатки в составе реваскуляризированного трансплантата, а качество и количество его костной ткани зна- чительно уступает малоберцовой кости и гребню подвздошной кости, что затрудняет или делает невозможным установку в нее дентальных имплантатов [16, 17].
Успехи последних десяти лет в развитии информационных технологий, трехмерной печати позволили выполнять вирту- альное хирургическое планирование, создавать хирургические модели и шаблоны, индивидуальные фиксирующие конструк- ции. Применение этих технологий повысило точность и сокра- тило время реконструктивных операций на верхней и нижней челюстях [18, 19].
В данной статье представлен наш клинический опыт исполь- зования трансплантата из наружного края лопатки для устра- нения дефектов в области лица. В статье описано применение виртуального хирургического планирования (ВХП) с изготов- лением хирургических шаблонов и индивидуальной рекон- структивной титановой пластины для повышения точности этих операций и сокращения операционного времени. Мы также показали возможность выполнения двух остеотомий ТНКЛ при устранении дефектов фронтальных участков верхней и нижней челюстей.
Материал и методы
В период с 2016 по 2020 г. мы применили ТЛКЛ в 7 случа- ях. Все 7 пациентов были мужчинами. Их возраст колебался от 28 до 64 лет (в среднем 47 лет). В 2 случаях трансплантат использовали для устранения дефектов верхней челюсти, в 5 – нижней челюсти. Все дефекты были комбинированными, т.е. требовалось восполнить как костные, так и мягкие ткани. Во всех случаях трансплантат применяли для устранения вторич- ных дефектов, в т.ч. в 5 случаях после предыдущей неудачной попытки их устранения малоберцовыми трансплантатами с обеих голеней. В 2 случаях у пациентов имелась патология сосудов нижних конечностей (выраженный атеросклероз), что также не позволяло использовать малоберцовые трансплантаты. У 1 пациента использовали только ТНКЛ, у 2 пациентов в состав трансплантата были включены лопаточный или окололопаточ- ный кожно-фасциальные лоскуты; в 4 случаях дополнительно к последним – торакодорсальный кожно-мышечный лоскут. Все трансплантаты прижились без осложнений. Средняя продол- жительность операции составила 709 минут (таблица) (Table 1).
Придание трансплантату анатомической формы верхней (рис. 1) или нижней челюсти (рис. 2) в большинстве случаев требо- вало выполнения двух остеотомий. Для повышения точности и сокращения продолжительности данного этапа операции в 5 случаях было применено ВХП с последующей печатью на 3Д принтерах хирургических шаблонов для забора и остеотомии костной части трансплантата. Шаблон фиксировали к лопатке тремя винтами, по одному на каждый сегмент транспланта- та. Наружный край шаблона спроектирован таким образом, чтобы перемычка, соединяющая его сегменты, прикрывала проходящие вдоль наружного края лопатки сосуды, питающие его. Такая конструкция позволяет контролировать и ограничи- вать продвижение пилы в «опасную» зону. Еще одним важным элементом шаблона является его продолжение в дистальной части, повторяя контур угла лопатки (рис. 3). Такая конструкция предназначена для точного позиционирования хирургического шаблона. В одном случае путём трехмерной печати была изготовлена индивидуальная титановая пластина (рис. 4), точно повторяющая контур новой верхней челюсти. Для фиксации фрагментов трансплантата между собой и в реципи- ентной ране использованы титановые винты диаметром 2,4 мм. Толщина напечатанной пластины составила 1,6–2,0 мм. Для точного позиционирования индивидуальной титановой пластины в ране и на фрагментах трансплантата в хирургическом шаблоне предусмотрены направляющие для сверления отверстий под позиционирующие винты. Позиционирующие винты имеют диаметр 2,0 мм, что позволяет им беспрепятственного прохо- дить через отверстия в реконструктивной пластине под винты 2,4 мм. Позиционирующие винты хорошо видны в мышечной манжете, которая крайне важна для сохранения кровоснабжения каждого из фрагментов трансплантата (рис. 5). После того как пластина одета на позиционирующие винты, они могут быть последовательно заменены на постоянные фиксирующие винты.
В послеоперационном периоде всем пациентам выполняли компьютерную томографию для контроля положения фраг- ментов трансплантата относительно друг друга и всего транс- плантата в дефекте челюсти. Данные этих исследований были использованы нами для определения минимальных размеров фрагментов ТНКЛ и максимальной длины ТНКЛ, использо- ванных для устранения дефектов верхней и нижней челюстей.
Наружная и внутренняя (язычная/небная) поверхности фрагмен-
тов ТНКЛ имеют разную длину, что связано с необходимостью
придания трансплантату дугообразной формы челюсти. При
этом внутренняя поверхность всегда меньше наружной. Длину
этой поверхности фрагментов трансплантанта мы и учитывали для определения минимального размера фрагмента транс- плантата (рис. 6 а). Суммирование длин фрагментов ТНКЛ по наружной, наиболее длинной, поверхности дает представление о максимальной длине ТНКЛ (рис. 6 б). Эти данные приведены в табл. 2.
Результаты
Виртуальное хирургическое планирование устранения дефек- тов верхней и нижней челюстей с использованием реваскуляри- зированного трансплантата из наружного края и угла лопатки и изготовлением хирургических шаблонов для забора и остео- томии трансплантата позволило нам получить предсказуемый результат, практически полностью совпадающий с планом операции. Плоскости фрагментов трансплантата после остео- томии совпадали друг с другом, что исключало дополнительные коррегирующие манипуляции с ними. В большинстве случаев требовалось выполнение двух остеотомий трансплантата. Ни один трансплантат не был потерян. Более того, не был потерян в ближайшем послеоперационном периоде и не резорбировался в последующем ни один остеотомированный фрагмент трансплан- тата. Длина минимального фрагмента ТНКЛ использованного нами составила 7,6 мм. При этом средняя длина минимальных фрагментов ТНКЛ была 14,4 мм. Максимальная длина ТНКЛ составила 143,2 мм (в среднем – 110,2 мм).
Объема костной ткани трансплантата из латерального края лопатки достаточно для установки дентальных имплантатов. Дентальные имплантаты были установлены 2 больным, дефекты нижней челюсти которых были устранены при помощи ТНКЛ (рис. 7). Минимальный диаметр использованных дентальных имплантатов составил 3,4 мм, максимальный – 4,5 мм. Длина имплантатов колебалась от 9,5 до 11,5чмм. Спустя 3–4 меся- ца после установки дентальные имплантаты были нагружены постоянным зубным протезом.
Для удлинения сосудистой ножки в двух случаях устранения дефекта верхней челюсти были использованы артериовенозные графты. Базируясь на подлопаточных сосудах, данный транс- плантат не имеет конкурентов в тех случаях, когда требуется устранение обширных комбинированных дефектов. В его состав могут быть включены кожно-фасциальные лоскуты: лопаточ- ный и окололопаточный; кожно-мышечный торакодорсальный, реиннервированная зубчатая мышца, а также дополнительный костный фрагмент – угол лопатки, питаемый угловой артерией. При этом каждый из перечисленных компонентов питает отдель- ный сосуд, что придает им бóльшую подвижность относительно друг друга и позволяет ориентировать их в ране в зависимости от конкретной клинической ситуации (рис. 8). Еще одним бес- спорным преимуществом ТНКЛ является постоянство сосудов и незначительная подверженность их атеросклерозу в отличие от сосудов нижних конечностей. Применение ВХП с изготовлением хирургических шаблонов и индивидуальных титановых кон- струкций сокращает операционное время и повышает точность хирургической операции, уменьшает число послеоперационных осложнений, снижая тем самым стоимость лечения. Это в свою очередь оправдывает расходы на виртуальное хирургическое планирование и изготовление хирургических шаблонов и инди- видуальных реконструктивных титановых пластин.
Заключение
ТНКЛ обладает рядом незначительными недостатков, которые могут быть преодолены. Наш опыт показал высокую эффек- тивность виртуального хирургического планирования рекон- структивных операций с применением ТНКЛ с изготовлением хирургических шаблонов и индивидуальных реконструктивных пластин. Сегментирование данного трансплантата не приводит к ухудшению его кровоснабжения, даже при формировании фрагментов небольших размеров. Объема костной ткани ТНКЛ достаточно для установки дентальных имплантатов с целью последующей ортопедической реабилитации пациентов. Данный трансплантат является трансплантатом выбора для устранения дефектов верхней и нижней челюсти. При этом мощный потен- циал этого трансплантата со всей очевидностью раскрывается в самых сложных случаях комбинированных дефектов лица.
ЛИТЕРАТУРА/REFERENCES
1. Ragbir M., Brown J.S., Mehanna H. Reconstructive considerations in head and neck surgical oncology: United Kingdom National Multidisciplinary Guidelines. J. Laryngol. Otol. 2016;130(S2):S191–7. Doi: 10.1017/S0022215116000621.
2. Lieberman J.R., Daluiski A., Einhorn T.A. The role of growth factors in the repair of bone. Biology and clinical applications. J. Bone Joint Surg. Am. 2002;84(6):1032–44. Doi: 10.2106/00004623-200206000-00022.
3. Saijo M. The vascular territories of the dorsal trunk: a reappraisal for potential flap donor sites. Br. J. Plast. Surg. 1978;31(3):200–4. Doi: 10.1016/s0007- 1226(78)90082-6.
4. Gilbert A., Teot L. The free scapular flap. Plast. Reconstr. Surg. 1982;69(4):601– 4. Doi: 10.1097/00006534-198204000-00002.
5. Stock W., Fernandez-Palacios J.A., Hierner R., Lukas B. Der Skapulalappen- -Ubersichtsarbeit und eigene Erfahrungen [The scapu-la flap—overview and personal experiences]. Handchir. Mikrochir. Plast. Chir. 1993;25(6):283–92.
6. Swartz W.M., Banis J.C., Newton E.D, et al. The osteocutaneous scapular flap for mandibular and maxillary reconstruction. Plast. Reconstr. Surg. 1986;77:530. 7. Granick M.S., Ramasastry S.S., Newton E.D., et al. Reconstruction of complex
maxillary defects with the scapular-free flap. Head Neck. 1990;12:377–85.
8. Funk G.F. Scapular and parascapular free flaps. Facial Plast. Surg. 1996;12:57–
63.
9. Nassif T.M., Vidal L., Bovet J.L., Baudet J. The parascapular flap: a new
cutaneous microsurgical free flap. Plast. Reconstr. Surg. 1982;69(4):591–600.
Doi: 10.1097/00006534-198204000-00001.
10. Булгакова М.В., Калакуцкий Н.В., Чеботарев С.Я. и др. Устранение
огнестрельного дефекта верхней челюсти с исполь-зованием реваскуляризованного мягкотканно-костного лопаточного трансплантата (клинический случай). Рос. оторинола-рингология. 2017;3:119–23. // Bulgakova M.V., Kalakutskiy N.V., Chebotarev S.Ya, et al. Elimination of a gunshot defect in the upper jaw using a revascularized soft tissue- bone scapular graft (clinical case). Ros. Otorinolaringologiya. 2017;3:119–23. [In Russ.]11. Калакуцкий Н.В. Костная пластика нижней челюсти васкуляризированными аутотрансплантатами. Дисс. докт. мед. наук. СПб., 2004. // Kalakutskiy N.V. Bone grafting of the lower jaw with vascularized autografts. Ph.D. Thesis. SPb., 2004. [In Russ.]12. Aviv J.E., Urken M.L., Vickery C., et al. The combined latissimus dorsi-scapular free flap in head and neck reconstruction of the head and neck. Arch. Otolaryngol. Head Neck Surg. 1991;117:1241–50. 13. Rowsell A.R., Davies D.M., Eisenberg N., Taylor G.I. The anatomy of the subscapular-thoracodorsal arterial system: study of 100 cadaver dissections. Br. J. Plast. Surg. 1984;37:574–6.
14. Valentini V., Gennaro P., Torroni A., et al. Scapula free flap for complex maxillofacial reconstruction. J. Craniofac. Surg. 2009;20(4):1125–31. Doi: 10.1097/SCS.0b013e3181abb482.
15. Dowthwaite S.A., Theurer J., Belzile M., et al. Comparison of fibular and scapular osseous free flaps for oromandibular recon-struction: a patient-centered approach to flap selection. JAMA. Otolaryngol. Head Neck Surg. 2013;139(3):285–92. Doi: 10.1001/jamaoto.2013.1802.
16. Frodel J.L., Funk G.F., Capper D.T., et al. Osseointegrated implants: a comparative study of bone thickness in four vascularized bone flaps. Plast. Reconstr. Surg 1993;92:449–55; discussion 456–8.
17. Chim H., Salgado C.J., Mardini S., Chen H.C. Reconstruction of mandibular defects. Semin. Plast. Surg. 2010;24(2):188–97. Doi: 10.1055/s-0030-1255336. 18. Yu H., Shen S.G., Wang X., et al. The indication and application of computer assisted navigation in oral and maxillofacial sur-gery-Shanghai’s experience based on 104 cases. J. Cranio Maxillo Fac. Surg Off Publ Eur. Assoc. Cranio
Maxillo Fac. Surg. 2013;41:770–4.
19. Huang J.-W., Shan X.-F., Lu X.-G., et al. Preliminary clinic study on computer
assisted mandibular reconstruction: the positive role of surgical navigation technique. Maxillofac. Plast. Reconstr. Surg. 2015;37:20.
Вклад авторов: С.В. Терещук, С.Ю. Иванов – концепция и дизайн исследования. В.А. Сухарев, Е.А. Васильев – сбор и об-работка клинического материала. С.В. Терещук, В.А. Сухарев – написание текста. С.В. Терещук, С.Ю. Иванов – редактиро-вание.
Данные СОП и СС, представленные в табл. Д 4о операции и через 6 месяцев после, показали статистически достоверное увеличение этих показателей у пациентов, которым выполняли одномоментную коррекцию внутренних и внешних структур носа (p<0,05). Средний поток воздуха при вдохе у пациентов I группы до и после ЭХН и проведения коррекции внутриносовых струк- тур составил 547,32±68,7 и 632,62±71,4 мл/с соответственно. Средний объем выдыхаемого воздуха до и после операции составил551,32±7,04и624,06±71,8мл/ссоответственно.По результатам ПАРМ, инспираторный и экспираторный потоки воздуха значительно изменились в течение 6 месяцев после ЭХН с ФХН (p<0,05). Средний поток воздуха при вдохе у пациентов II группы до и после традиционного хирургического лечения составил 559,32±68,7 и 589,62±71,4 мл/с соответственно. Средний объем выдыхаемого воздуха до и после операции составил 560,32±7,04 и 600,06±71,8мл/ссоответственно.
Читать статью целиков в формате PDF>