Для цитирования:
Решетов И.В., Самойлова С.И., Сукорцева Н.С., Габоян А.Г., Святославов Д.С., Путь В.А., Кудрин К.Г. Моделирование префабрицированного хрящевого аутотрансплантата in vivo с целью реконструкции ушной раковины в эксперименте. Голова и шея. Российский журнал Head and neck. Russian Journal. 2020;8(1):8–14
For citation:
Reshetov I.V., Samoilova S.I., Sukortseva N.S., Gaboyan A.G., Svyatoslavov D.S., Put V.A., Kudrin K.G. In vivo modeling of a prefabricated cartilaginous autograft for reconstruction of the auricle in an experiment. Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2020;8(1):8–14 (in Russian).
Doi: 10.25792/HN.2020.8.1.8–14
Отопластика постоянно востребованная операция как при врожденных состояниях, так и при повреждениях, ятрогенных деформациях, опухолях. Вторичная отопластика наиболее сложная операция, требующая применения опорного пластического материала. Поиск оптимального пластического материала для реконструкции хряща привел к пониманию наилучшей приживляемости аутотрансплантата, однако имеющей эффективность ниже 70%, кроме того, сложность восстановления точной формы ушного хряща требуют поиска улучшения методики вторичной отопластики.
Цель. Предложен эксперимент по поиску эффективной методики реконструкции ушного хряща на основе аутотрансплантата хряща в виде микрографтов, заключенных в пластичный скафолд из политетрафторэтилена.
Материал и методы. Трубчатые скаффолды изготовлены в виде сплошной трубки и трубки с перфорациями. Исследована приживаемость 60 скаффолодов, по 30 в каждой группе.
Результаты. Полученные результаты показали эффективное прорастание сосудов и активную живую ткань хряща (индекс пролиферации был более 30% клеток) в группе с перфорированным скаффолдом более чем 90%, в то время как в группе со сплошным скаффолдом приживление хряща достигнуто только в ограниченной части аутотрансплантатов, в центре происходил асептический лизис аутографтов. Обсуждение результатов говорит о возможности успешной реконструкции опорного хряща с использованием микрографтов, заключенных в пластичную форму скаффолда, которая вначале сохраняет объем и форму, без надлежащей твердости, а по мере прорастания сосудами и восстановления питания хондроцитов с их перестройкой происходит восстановление необходимой опорной прочности.
Заключение. Исследования применения перфорированного скаффолда из биосовместимого пластичного материала, в который помещены микрографты аутотранслантата хряща, продемонстрировали восстановление опорной способности при вторичной отопластике.
Ключевые слова: отопластика,. хрящ , аутотрансплантат , скаффолд , микрографт
Конфликт интересов.
Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена в рамках гранта РФФИ 15-29-04819
Для цитирования: Решетов И.В., Самойлова С.И., Сукорцева Н.С., Габоян А.Г., Святославов Д.С., Путь В.А., Кудрин К.Г. Моделирование префабрицированного хрящевого аутотрансплантата in vivo с целью реконструкции ушной раковины в эксперименте. Голова и шея. Российский журнал Head and neck. Russian Journal. 2020;8(1):8–14
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Otoplasty is a highly eligible operation for congenital conditions, injuries, iatrogenic deformities, and tumors. Secondary otoplasty is the most complex operation type requiring the use of supportive plastic material. The search for the optimal plastic material for cartilage reconstruction led to conclusion that autografts have the best engraftability, however, demonstrating an efficiency of less than 70%, and in addition, the difficulty of restoring the exact shape of the ear cartilage necessitates a search for improved secondary otoplasty technique. The aim of the study. An experiment is proposed to find an effective method for reconstruction of the ear cartilage based on cartilage autograft in the form of micrografts enclosed in a plastic scaffold made of polytetrafluoroethylene.
Material and methods. Tubular scaffolds are made in the forms of a continuous tube and a tube with perforations. The engraftment rate of 60 scaffolds was studied, 30 in each group.
Results. The results showed effective vascular invasion and active living cartilage tissue (proliferation index was more than 30% of cells) in more than 90% cases in the group with a perforated scaffold, while in the group with a continuous scaffold, cartilage engraftment was achieved only in a limited part of autografts, in the center aseptic lysis of autografts occurred. A discussion of the results suggests the possibility of successful reconstruction of the supporting cartilage using micrografts enclosed in a plastic scaffold shape, which initially retains its volume and shape, without proper hardness, and as the vessels grow and the chondrocytes nutrition is restored, the needed supportive strength is achieved.
Conclusion. Studies of the use of a perforated scaffold made of a biocompatible plastic material, in which micrografts of cartilage autotransplant are placed, have demonstrated the restoration of supportive ability in secondary otoplasty.
Key words: otoplasty, cartilage, autograft, scaffold, micrograft
Conflicts of interest.
The authors have no conflicts of interest to declare. Funding. The work was supported by the grant of RFBR 15-29-04819.
For citation: Reshetov I.V., Samoilova S.I., Sukortseva N.S., Gaboyan A.G., Svyatoslavov D.S., Put V.A., Kudrin K.G. In vivo modeling of a prefabricated cartilaginous autograft for reconstruction of the auricle in an experiment. Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2020;8(1):8–14 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients.
Введение
Реконструкция ушной раковины является активно развивающимся разделом пластической хирургии ввиду высокой потребности в ортотопическом восстановлении ее опорных структур [1]. Реконструкция хрящевых структур дает возможность достичь полноценной реабилитации пациента. Хирургическая реконструкция хрящевой ткани технически сложная операция, успех которой во многом зависит от качественного планирования и подготовки к хирургической интервенции. Стабилизация хрящевых структур в реципиентном ложе необходима для успешной реконструктивной пластики [2]. Правильное периоперационное ведение в комплексе с качественной подготовкой и стабилизацией хрящевого аутотрансплантата определяет успешность реконструкции костно-хрящевых структур.
Вопрос трехмерного моделирования костно-хрящевых структур на сегодняшний день очень актуален. В течение последних 20 лет операция реконструктивной пластики хрящевых и костных структур активно развивалась в направлении трехмерного моделирования, достижения наилучшего эстетического результата и минимизации послеоперационных осложнений [3]. В последнее время к процедуре моделирования опорных структур активно подключены аддитивные технологии, которые с высокой точностью позволяют прототипировать дефект и модель трансплантата.
Хрящ является тканью сложного композитного строения, чем обусловлены неудачи его прямой пересадки. Наиболее частым исходом операции по пересадке хряща оказывалась резорбция трансплантата, что говорило в первую очередь о неадекватном питании трансплантата. С целью повышения жизнеспособности хрящевых аутотрансплантатов была разработана методика графтинга [11], которая позволила многократно увеличить площадь контакта капилляров реципиентного ложа и хрящевой ткани. Однако микрографты хряща не имеют трехмерной структуры.
С целью разработки технологии пространственной фиксации хрящевого аутотрансплантата предложены различные методы и конструкции скафолдов, однако ни один из методов не решает всех задач, возникающих в клинике. В связи с этим метод in vivo моделирования хрящевого аутотрансплантата является актуальной задачей.
Материал и методы
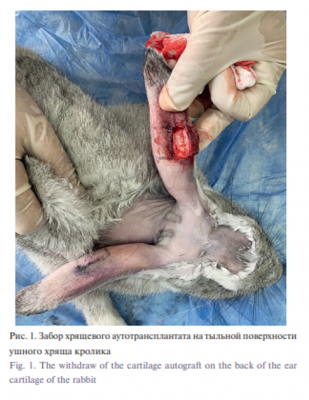
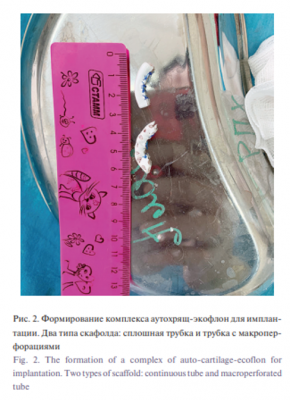
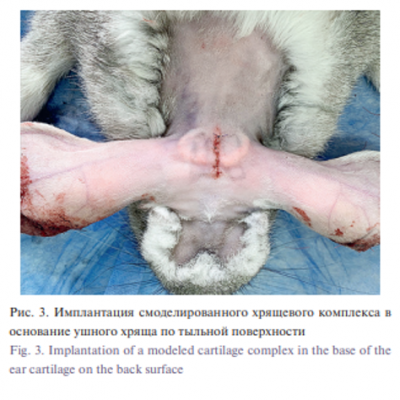
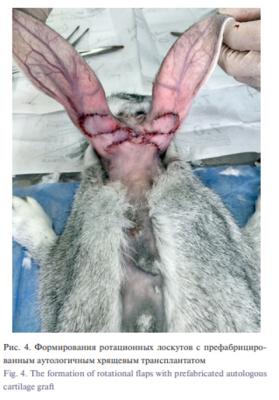
Проведено экспериментальное открытое контролируемое исследование. Эксперимент проведен на 30 живых биологических моделях с выполнением требований по биоэтике и одобренные локальным этическим комитетом. Биологической моделью послужили кролики женского пола породы Шиншила со схожими антропометрическими показателями. В эксперименте смоделирована клиническая методика реконструкции сложной конфигурации противозавитка ушного хряща человека путем префабрикации у основания ушной раковины аутохрящевого трансплантата с последующей его ротацией в составе кожно-фасциального лоскута на питающей ножке в область дефекта ушного хряща. Донорский хрящ получали путем окончатой резекции ушного хряща в средней трети по тыльной поверхности. Затем по известной методике [11] под оптическим увеличением ×3,5 с помощью микрохирургического инструмента производили изготовление микрографтов хряща размерами 1–2 мм. Использовано два варианта префабрикации хрящевой ткани. Первый вариант – пересадка микрографтов в скафолд в виде полнослойной изогнутой трубки, повторяющей конфигурацию противозавитка, и второй – в перфорированную трубку (рис. 1) , Материал скафолда – политетрафоторэтилен, который известен своей биоинертностью и биосовместимостью производства компании «Экофлон» Из пластины материала толщиной 0,75 мм выкраивали площадку, которую далее сшивали виде изогнутой трубки. Были созданы два варианта скафолда. Единая трубка и трубка с нанесенными стабильными перфорациями 1,5 мм в диаметре через каждые 3 мм протяженности трубки (рис. 2, 3). Для корректной биостатистики эксперимента у одного животного справа имплантировали перфорированный скафолд, слева – без перфораций. Таким образом, мы получили две экспериментальные группы по 30 наблюдений в каждой. Имплантация смоделированного хрящевого комплекса с экофлоном выполнялась в области задней ушной складки справа и слева. Далее кроликам проводилась ротация комплекса подготовленного, смоделированного хрящевого трансплантата на 30-е сутки после имплантации с целью оценки качества префабрикации (рис. 4). Затем кролики последовательно выводились из эксперимента, а препараты были отправлены на патогистологическое исследование. Эксплантацию с целью гистологической верификации, а также вывод животного из эксперимента проводили на сроках 2, 3 месяца с соблюдением правил биоэтики.
Результаты
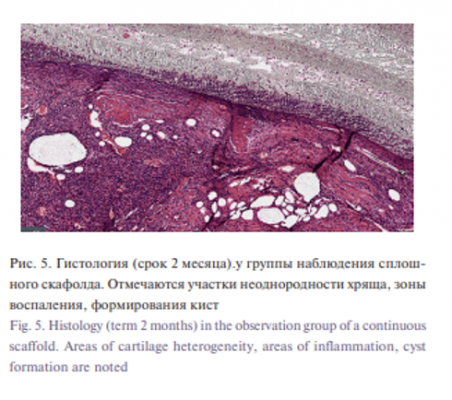
Все животные в нашей работе завершили эксперимент, потери материала не отмечено. Успешное приживление скафолда из экофлона отмечено во всех случаях, тем самым подтверждены высокие биологические свойства этого материала. Во всех наблюдениях не выявлено никаких воспалительных процессов, что также соответствует заявленным свойствам скафолда, а также чистым условиям проведения эксперимента. После удаления экофлона, стабильность хрящевого трансплантата оценивали по прочностным характеристикам, ретенции формы, а также степени прорастания тканей по данным гистологического исследования (рис. 5). В случае использовании сплошной матрицы, аутологичный хрящ демонстрировал худшую биоинтеграцию по сравнению с использованием перфорированного экофлона.
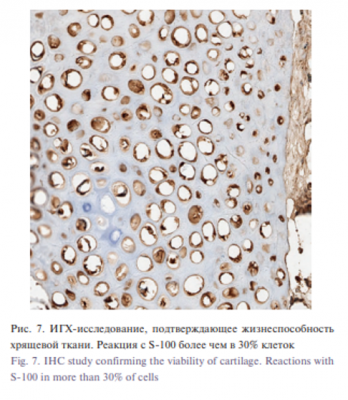
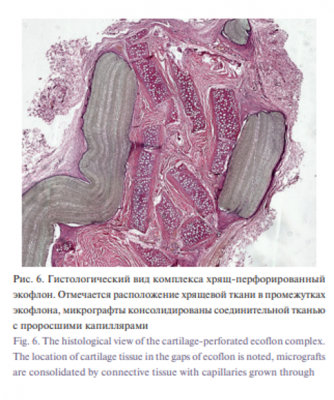
Формирование капиллярной сети, питающей колонию микрографтов, происходило со стороны срезов трубки, поэтому в средней части трубки полной консолидации микрографтов не произошло. При микроскопическом исследовании между полосками вещества (экофлона) линейной формы, не воспринимающего гистологический краситель, находится ткань пористого вида, между пор расположены тонкие фибриллы. Среди грубоволокнистой соединительной ткани с ангиоматозом и полнокровными капиллярами имеются фрагменты гиалинового хряща с краевой резорбцией. В периферической зоне возле экофлона имеется очаговый, слабо выраженный лимфоидный инфильтрат без признаков гранулематозной реакции (рис. 5). В отличие от этого в перфорированной трубке формирование капиллярной сети происходило дополнительно через перфорации, что позволило консолидироваться микрографтам на всем протяжении конструкции скафолда. В результате гистологическая картина показала монолитную консолидированную хрящевую ткань с высокой жизнеспособностью, что подтверждено иммуногистохимическими реакциями, в т.ч. на наличие пролиферирующих клеток более 30 % рис. 6, 7).
При удалении трансплантата на сроке 60 дней отмечается лучшая механическая стабильность аутологичного хрящав в группе с перфорациями, при удалении экофлоновой матрицы на сроке 90 дней отмечается еще более значимая стабильность аутологичного трансплантата хряща. Ротация лоскутов позадиушного пространства (затылочных) с хрящевым аутотрансплантатом для закрытия смоделированного дефекта ушной раковины прошла успешно во всех случаях. Жизнеспособность лоскута не была нарушена ни в одном из случаев. В целом, префабрикация с ротацией хрящевого аутотрансплантата проведена успешно, и осложнений данной процедуры не выявлено.
Биостатистика эксперимента (см. таблицу) (see table). Всего было имплантировано 60 скафолдов, 30 в виде сплошной изогнутой трубки, 30 в виде перфорированной изогнутой трубки. В одно животное интегрировалось 2 скафолда, справа – сплошная трубка, слева – перфорированная. Все кролики перенесли операцию. Послеоперационных осложнений не было. Биоинтеграция скафолда наступила у всех животных независимо от варианта конструкции. Консолидации хряща в стабильную ткань не было ни в одном из наблюдений с полнослойной трубкой, а в группе перфорированного скафолда – в 27 (90,0%) наблюдениях, что достоверно подтверждает преимущества перфорированной конструкции по сравнению со сплошной в плане обеспечения условий регенерации микрографтов.
Обсуждение
Эволюция методов реконструктивной и пластической хирургии костно-хрящевых дефектов увеличивает потребность в стабильности хрящевых аутотрансплантатов в реципиентном ложе с целью надежного и качественного формы ткани. Выбор метода префабрикации хрящевых трансплантатов зависит от многих факторов, в т.ч. объема дефекта, локализации реципиентного ложа и соматического состояния пациента. Для сохранения формы хрящевого аутотрансплантата требуется длительная фиксация хрящевой ткани в реципиентном ложе с помощью материалов фиксации (матриц фиксации). В качестве материалов для фиксации наиболее часто используются материалы неорганического происхождения, имеющие аналлергогенные, инертные и биоинтегрируемые свойства.
Трехмерное моделирование хрящей без использования матриц для стабилизации аутотрансплантата не увенчалось успехом. Такие устаревшие методики, как фиксация с помощью фибринового клея [4], многоэтапного моделирования и других методик, утратили свою популярность ввиду низкой эффективности [5–7]. На смену резобируемым скаффолдам пришли материалы для длительной фиксации, превосходство которых связано с более надежной стабилизацией хрящевого трансплантата, однако данные методики требуют повторного хирургического вмешательства [8, 9].
В данной работе выбранный материал обладает доказанной инертностью, прочностью и пластичностью, в связи с чем его активно применяют для коррекции грыжевой патологии [10]. Отсутствие воспалительных и инфильтративных изменений в зоне импланта свидетельствуют о пригодности данного материала для реконструкции хрящевой ткани. Перфорированный скафолд из экофлона значительно лучше стимулирует биоинтеграцию хрящевой ткани, в отличие от непефорированного экофлона. Поэтому рекомендуется выполнять стабилизацию хрящевых аутотрансплантата с помощью перфорированных матриц, обеспечивающих реваскуляризацию и качественную биоинтеграцию трансплантата.
Заключение
Для реконструкции костно-хрящевых дефектов часто требуется трансплантация хрящевой ткани заданной формы и конфигурации. С целью стабилизации хрящевого аутотрансплантата рекомендуется применение нерезорбируемых скаффолдов с аналлергенными, инертными и хорошими прочностными характеристиками. Более длительная стабилизация хряща с использованием перфорированных пластичных матриц, обеспечивающих более качественную биоинтеграцию аутотрансплантата позволяют достичь лучших результатов стабилизации формы и структурной целостности хряща в реципиентном ложе. Использование аутологичных микрографтов хряща позволяет добиться их хорошего приживления с перестройкой в единую биоконструкцию. Моделирование многоэтапной реконструкции дефекта ушного хряща с префабрикацией хрящевого трансплантата и последующей ротацией в реципиентной ложе показало целесообразность клинического применения данной методики.
ЛИТЕРАТУРА/REFERENCES
- Nayyer L., Patel K.H., Esmaeili A., Rippel R.A., Birchall M., O’Toole G., Seifalian A.M. Tissue engineering: revolution and challenge in auricular cartilage reconstruction. Plast. Reconstr. Surg. 2012;129(5):1123–37.
- Brent B. Technical advances in ear reconstruction with autogenous rib cartilage grafts: personal experience with 1200 cases. Plast. Reconstr. Surg. 1999;104(2):319–34.
- Berens A.M., Newman S., Bhrany A.D., Murakami C., Sie K.C., Zopf D.A. Computer-aided design and 3D printing to produce a costal cartilage model for simulation of auricular reconstruction. Otolaryngol. Head and Neck Surg. 2016;155(2):356–9.
- Ting V., Sims C.D., Brecht L.E., McCarthy J.G., Kasabian A.K., Connelly P.R., Longaker M.T. In vitro prefabrication of human cartilage shapes using fibrin glue and human chondrocytes. Ann. Plast. Surg. 1998;40(4):413–20.
- Vacanti C.A., Vacanti J.P. Bone and cartilage reconstruction with tissue engineering approaches. Otolaryngol. Clin. North Am.. 1994;27(1):263–76.
- Meinhart J., Fussenegger M., Höbling W. Stabilization of fibrin-chondrocyte constructs for cartilage reconstruction. Ann. Plast. Surg. 1999;42(6):673–8.
- Rotter N., Aigner J., Naumann A., Planck H., Hammer C., Burmester G., Sittinger M. Cartilage reconstruction in head and neck surgery: comparison of resorbable polymer scaffolds for tissue engineering of human septal cartilage. Journal of Biomedical Materials Research: Official Journal of The Society for Biomaterials, The Japanese Society for Biomaterials, and the Australian Society for Biomaterials. 1998;42(3):347–56.
- Shin H.J., Lee C.H., Cho I.H., Kim Y.J., Lee Y.J., Kim I.A., Shin J.W. Electrospun PLGA nanofiber scaffolds for articular cartilage reconstruction: mechanical stability, degradation and cellular responses under mechanical stimulation in vitro. J. Biomat. Sci. Polymer Ed. 2006;17(1–2):103–19.
- Subramanian A., Vu D., Larsen G.F., Lin H.Y. Preparation and evaluation of the electrospun chitosan/PEO fibers for potential applications in cartilage tissue engineering. J. Biomat. Sci. Polymer Ed. 2005;16(7):861–73.
- Ivanov S.V., Lazarenko V.A., Ivanov I.S., Katunina T.P., Tsukanov A.V. Features of the cytokine profile in patients with postoperative ventral hernias with the Ecoflon and Uniflex endoprostheses. Vestn. eksperimentalnoi i klinicheskoi hirurgii. 2011; 4 (3): 440–45. Иванов С.В., Лазаренко В.А., Иванов И.С., Катунина Т.П., Цуканов А.В. Особенности цитокинового профиля у больных с послеоперационными вентральными грыжами прииспользовании эндопротезов «Экофлон» и «Унифлекс». Вестн. экспериментальной и клинической хирургии. 2011;4(3):440–45 (In Russ.).
- Reshetov I.V. The method of reconstruction of tissues and organs. Application 2016137499/10 positive decision from 07/18/2018. Bulletin of Rospatent. Решетов И.В. Способ реконструкции тканей и органов. Заявка 2016137499/10 положительное решение от 18.07.2018 . Бюллетень Роспатента (In Russ.).
Поступила 15.01.20 Принята в печать 25.01.20
Received 15.01.20 Accepted 25.01.20
Вклад авторов:
Решетов И.В., Самойлова С.И., Сукорцева Н.С., Габоян А.Г., Святославов Д.С., Путь В.А., Кудрин К.Г.: концепция и дизайн исследования, обзор публикаций по теме статьи, сбор данных, анализ полученных данных, написание текста рукописи, редактирование.
Authors’ contributions:
Reshetov I.V., Samoilova S.I., Sukortseva N.S., Gaboyan A.G., Svyatoslavov D.S., Put V.A., Kudrin K.G conception and design of the study, data collection and analysis, manuscript preparation, and editing.
Благодарности. Работа выполнена в рамках гранта РФФИ 15-29-04819 Acknowledgments. This work was supported by the RFBR grant 15-29-04819
Информация об авторах:
И.В. Решетов – д.м.н., профессор, академик РАН, директор НОКЦ пластической хирургии, заведующий кафедрой онкологии, радиотерапии и пластической хирургии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава РФ (Сеченовский университет), Академия постдипломного образования ФГБУ ФНКЦ ФМБА России, Москва; e-mail: reshetoviv@mail. ru. https://orcid.org/0000-0002-0909-6278
С.И. Самойлова – к.м.н., врач-патологанатом, доцент кафедры онкологии, радиотерапии и пластической хирургии ФГОАУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский университет), Москва, Россия; e-mail: sv_ samoilova75@mail.ru
Н.С. Сукорцева – заведующая отделением онкологии Университетской клинической больницы №1 ФГОАУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский университет), Москва, Россия; e-mail: sukorceva.nataly@mail. ru. https://orcid.org/0000-0002-7704-1658
А.Н. Габоян – главный внештатный специалист по пластической хирургии Министерства Здравоохранения РФ по Астраханской области, Россия; e-mail: dr_gaboyan@mail.ru
Д.С. Святославов – к.м.н., врач-онколог онкологического хирургического отделения комбинированных методов лечения УКБ № 1, доцент кафедры онкологии, радиотерапии и пластической хирургии ФГОАУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский университет), научный сотрудник лаборатории биоинжиниринга и прототипирования органов и тканей института регенеративной медицины Сеченовского университета, Москва, Россия; e-mail: dssvyatoslavov78@mail.ru. https://orcid.org/0000-0003-0898-8693
В.А. Путь – д.м.н., челюстно-лицевой хирург, стоматолог, профессор кафедры онкологии, радиотерапии и пластической хирургии ФГОАУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский университет), Москва, Россия; https://orcid.org/0000-0003-4150-9885
К.Г. Кудрин – старший лаборант кафедры онкологии и пластической хирургии института повышения квалификации ФМБА России (Академия постдипломного образования ФГБУ ФНКЦ ФМБА России), Москва, Россия; e-mail: kudrin_k@rambler.ru
Information about the authors:
I.V. Reshetov – Doctor of Medicine, Professor, Academician of the Russian Academy of Sciences, Director of the Scientific and Educational Clinical Center for Plastic Surgery, Head of the Department of Oncology, Radiotherapy and Plastic Surgery, First Moscow State Medical University n.a. I.M. Sechenov of the Ministry of Health of the Russian Federation (Sechenov University), Academy of Postgraduate Education FSBI FSCC FMBA of Russia, Moscow; e-mail: reshetoviv@mail.ru. https://orcid.org/0000-0002-0909-6278
S.I. Samoilova – PhD, pathologist, associate professor of the Department of Oncology, Radiotherapy and Plastic Surgery FSEAI HE First MSMU n.a.
I.M. Sechenov (Sechenov University), Moscow, Russia; e-mail: sv_samoilova75@mail.ru N.S. Sukortseva – Head of the Department of Oncology, University Clinical Hospital No. 1, FSEAI HE First MSMU n.a. I.M. Sechenov (Sechenov University), Moscow, Russia; e-mail: sukorceva.nataly@mail.ru. https://orcid.org/0000-0002- 7704-1658
A.N. Gaboyan – chief external expert in plastic surgery of the Ministry of Health of the Russian Federation in the Astrakhan region, Russia; e-mail: dr_gaboyan@mail.ru
D.S. Svyatoslavov – PhD, oncologist of the Oncological Surgical Department of Combined Methods of Treatment at the University Clinical Hospital No. 1, associate professor of the Department of Oncology, Radiotherapy and Plastic Surgery, First Moscow State Medical University n.a. I.M. Sechenov of the Ministry of Health of the Russian Federation (Sechenov University), Researcher, Laboratory for Bioengineering and Prototyping of Organ and Tissue, Institute of Regenerative Medicine, Sechenov University, Moscow, Russia; e-mail: dssvyatoslavov78@mail.ru. https://orcid.org/0000-0003-0898-8693
V.A. Put – Doctor of Medicine, maxillofacial surgeon, dentist, professor of the Department of Oncology, Radiotherapy and Plastic Surgery First Moscow State Medical University n.a. I.M. Sechenov of the Ministry of Health of the Russian Federation (Sechenov University), Moscow, Russia; https://orcid.org/ 0000-0003-4150-9885
K.G. Kudrin – Senior Laboratory Assistant, Department of Oncology and Plastic Surgery, Institute for Advanced Training of the Federal Medical and Biological Agency of Russia (Postgraduate Education Academy of FSBI FSCC FMBA of Russia), Moscow, Russia; e-mail: kudrin_k@rambler.ru
Рецензия на статью
Представленная на рецензию работа посвящена актуальной проблеме – поиску наиболее адекватного пластического материала для моделирования хряща наружного уха. Самые разнообразные материалы используются для восстановления хрящевой основы уха – ауто, алло-, материалы небиологического происхождения. У каждой группы используемых материалов есть свои преимущества и недостатки. Авторы остановили свой выбор на использовании аутотрансплантата хряща в виде микрографтов, заключенных в пластичный скафолд из политетрафторэтилена (ПТФ). Авторами выбран оригинальный способ получения аутологичных графтов и интересная методика размещения их в пористом полимере (ПТФЭ), доказана наибольшая эффективность создания в стенках полимерных трубочек перфораций определенного размера в плане обеспечения условий регенерации микрографтов. Для этого были применены методики гистологической и иммуногистохимической оценки. Для подобных утверждений есть все необходимые основания – достаточно большой объем экспериментальных исследований, оформленный в соответствии с современными требованиями к проведению подобного рода научным работам.
Review on the article
The work presented for review is devoted to an urgent problem – the search for the most adequate plastic material for modeling the cartilage of the outer ear. Various materials are used to restore the cartilage base of the ear – auto, allo, non-biological origin materials. Each group of materials used has its advantages and limitations. The authors chose to use a cartilage autograft in the form of micrografts enclosed in a plastic scaffold made of polytetrafluoroethylene (PTF). The authors used an original method for producing autologous grafts and an interesting technique for placing them in a porous polymer (PTFE), and proved the greatest effectiveness in creating perforations of a certain size in the walls of polymer tubes in providing micrografts regeneration conditions. For this, the methods of histological and immunohistochemical evaluation were applied. The basis for such statements is evident – a sufficiently large amount of experimental research, designed in accordance with modern requirements for conducting such kind of scientific work.