Для цитирования: Дустов Ш.Х., Решетов И.В. Экспериментальное обоснование соединения сосудов малого диаметра с помощью саморасправляющегося стента. Голова и шея. Российский журнал Head and neck Russian Journal. 2020;(1):40–46
For citation: Dustov S.H., Reshetov I.V. Experimental substantiation of the fast method of microvascular anastomosis seamless connection using a self-expanding stent technology. Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2020;8(1):40–46 (in Russian).
Doi: 10.25792/HN.2020.8.1.40–46
Цель. Изучение возможностей формирования быстрого бесшовного метода микрососудистого анастомоза с помощью стента.
Материал и методы. Эксперименты проводились на 30 белых беспородных крысах, весом 400 г и более. Для формирования микрососудистого анастомоза использовали саморасправляющийся стент. Методика эксперимента заключается в следующем: под оптическим увеличением производится срединная лапаротомия, осуществляется выделение, мобилизация и подготовка к анастомозу брюшной аорты. После этого брюшная аорта клипируется и пересекается между клипсами. Производится стентирование просвета сосуда. По разработанной нами методике были прооперированы 30 животных.
Результаты. Шесть животных погибли при стентировании просвета сосуда: две крысы от тромбоза зоны анастомоза, три крысы из-за кровотечения в результате несоответствия размера стента с сосудом и одна крыса из-за передозировки препаратов для наркоза. У остальных животных в послеоперационном периоде осложнений не выявлено. На 10–30-е сутки животных выводили из эксперимента.
Выводы. Полученные данные свидетельствуют о возможности быстрого и надежного соединения сосудов малого диаметра конец в конец за счет использования саморасправляющегося стента.
Ключевые слова: стентирование, микроанастомоз, микрохирургия, экспериментальная хирургия, сосуды Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена без спонсорской поддержки
Для цитирования: Дустов Ш.Х., Решетов И.В. Экспериментальное обоснование соединения сосудов малого диаметра с помощью саморасправляющегося стента. Голова и шея. Российский журнал = Head and neck. Russian Journal. 2020;(1):40–46
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Purpose. Studying the possibilities of forming a fast seamless method of microvascular anastomosis using a stent. Material and methods. The experiments were carried out on 30 white outbred rats weighing 400 g or more. A self-expanding stent was used to form a microvascular anastomosis. The experimental technique is as follows: under optical magnification, a midline laparotomy is performed, then, isolation, mobilization and preparation for of abdominal aorta for anastomosis are performed. After this, the abdominal aorta is clipped and intersected between the clips. A stenting of the lumen of the vessel is performed.
Results.
According to our technique, 30 animals were operated on. Six animals died during stenting of the lumen of the vessel, two from thrombosis, three from bleeding due to the discrepancy between the size of the stent and the vessel, and one due to an overdose of anesthetic drugs. In the remaining animals in the postoperative period, complications were not detected. On the 10–30th day after surgery the animals were removed from the experiment using anesthesia.
Conclusions. The data obtained in the experiment indicates the possibility of connecting vessels through the use of a self-expanding stent for quick and reliable connection between small-diameter vessels end to end.
Key words: stent, microanastomosis, microsurgery, experimental surgery, vessels
Conflicts of interest.
The authors have no conflicts of interest to declare. Funding. There was no funding for this study.
For citation: Dustov S.H., Reshetov I.V. Experimental substantiation of the fast method of microvascular anastomosis seamless connection using a self-expanding stent technology. Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2020;8(1):40–46 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients.
Введение
В результате внедрения в онкохирургию метода микрохирургической пересадки кровоснабжаемых аутотрансплантатов существенно расширились возможности помощи онкологическим больным. Одним из важнейших аспектов в микрохирургической аутотрансплантации тканей, который определяющим образом влияет на результат операции, является проходимость сосудистых анастомозов [1]. История этой техники на удивление долгая, начинается с 1902 г., когда Алексис Кэррел впервые сообщила о практическом способе, позволяющем приблизить концы сосудов, минимизируя разрыв между их просветами [6]. В 1960-х гг. одновременно с разработкой хирургических микроскопов был осуществлен анастомоз сосудов диаметром менее 2–3 мм [7]. Для хирурга, чтобы овладеть быстрой и точной техникой анастомоза, требуется определенный объем специальной подготовки. Однако даже у опытных хирургов анастомотический тромбоз встречается примерно в 0,5–10% случаев. Разработка автоматических инструментов для сосудистого анастомоза началась около 1900 г. Были использованы такие методы и материалы, как сшивание и срезание сосудов [8–10], кольцевые штифты [11, 12], трубки и стенты [13, 14], клеи [15], сварка [16] и растворимые полимерные стенты [17]. Тем не менее по сравнению со сшитым вручную анастомозом существуют некоторые ограничения, такие как сложность обработки стенок атеросклеротических сосудов, сложность соединения сосудов с несовпадающими диаметрами, высокая стоимость, низкий коэффициент проходимости и плохая анастомотическая прочность. По этим причинам такие инструменты редко используются [18]. В сердечно-сосудистой области широко используются металлические стенты для сердечных сосудов в виде голых металлических стентов и стентов с лекарственным покрытием для чрескожного коронарного вмешательства. Известно, что при использовании стентов для чрескожного коронарного вмешательства достигаются успешные результаты определенного уровня в отношении их биологической безопасности и степени их проходимости [19]. Кроме того, благодаря недавнему усовершенствованию сложной технологии обработки металлов, в которой используются технологии лазерной и электролитической полировки, стало возможным создание нового, тонкого, но прочного стента из никилида титана, сплава с памятью формы, с конструкцией и размером, которые не влияют на кровоток, так что такой стент может быть помещен в микрососудистый просвет. Бесшовное соединение сосудов малого диаметра с помощью стента является надежным, малотравматичным, быстрым методом формирования микрососудистого анастомоза, снижает процент послеоперационных осложнений, которые в микрохирургии имеют особое значение [20]. Существующие различные способы формирования микрососудистого анастомоза до сих пор нельзя считать совершенными, т.к. они не могут удовлетворить всем предъявляемым к ним требованиям: низкому проценту тромбоза зоны анастомоза, простоте оперативной техники, минимальному числу «повторных» реконструктивных и пластических операций. Цель исследования: изучение возможностей формирования быстрого бесшовного метода микрососудистого анастомоза с помощью стента.
Материал и методы
Исследование выполнено по протоколу в соответствии с «Правилами работ с использованием экспериментальных животных» (приказ Министерства здравоохранения СССР от 12.08.1977 №755 и приложения к приказу МЗ СССР №565 от 04.10.1977), с соблюдением принципов Хельсинской декларации BMA (2000).
Лабораторные животные. Работа была выполнена на 50 белых беспородных лабораторных крысах со средней массой тела 400±50 г. Операция выполнена на инфраренальном отделе брюшной аорты диаметром 2,5–3,0 мм (aorta abdominalis). По завершению хирургического вмешательства и после пробуждения животного от наркоза его помещали на 2 дня в отдельную клетку с соответствующим послеоперационным уходом. В первые 3 дня после хирургического вмешательства для профилактики тромбоза стента животным выполняли подкожную инъекцию раствора эноксапарина натрия (1 мг/кг 1 раз в сутки). В последующее время наблюдения животные не получали какихлибо лекарственных препаратов. В группе 1 (n=30) для создания микрососудистого анастамоза использовался саморасширяющийся микростент, в группе 2 (группа контроля, n=20) микро анастамоз создавался шовным ручным методом. Стент. В качестве материала для микростента использовался никелид титана (NiTi). В эксперименте был использован саморасширяющийся стент (микростент) из никелида титана с системой доставки для имплантации сосудов малого диаметра компании «ООО Минимально инвазивные технологии» (рис. 1). В раскрытом состоянии каркас поддерживает сосудистую стенку, препятствуя ее спадению и обеспечивая полноценный кровоток. Конструкция стентов такова, что края стентов не имеют острых кромок и в случае дислокации стента или неправильном выборе диаметра возможно извлечение стента из сосуда или трубчатого органа, не прибегая к открытой операции, что невозможно при применении стентов других фирм.
Стент составлен из проволок, толщина проволоки не превышает 0,125 мм, длина – до 15–20 мм, а диаметр в расправленном состоянии – 2,0–3,0 мм. Стент перед использованием в анастомозе заправляется внутрь катетера-проводника в нерасправленном виде (рис. 2).
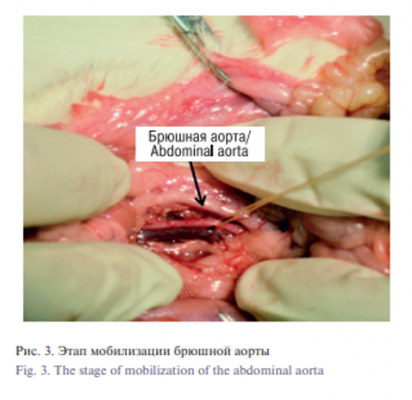
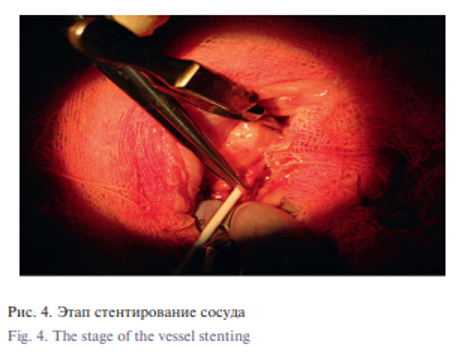
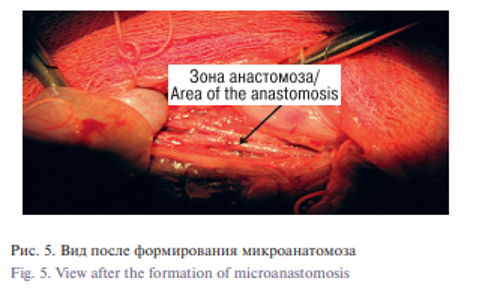
Хирургическая часть. Для формирования микрососудистого анастомоза была использована инфраренальная часть аорты крыс. Методика микростентного анастомоза была следующей. В качестве премедикации (для уменьшения секреции слюнных и бронхиальных желез) использовали 0,1 мг/кг 0,1% атропина внутримышечно. Введение в наркоз осуществляли путем внутрибрюшинной инъекции смеси растворов КсилаВет (PharmamagistLtd, Венгрия), Золетил (VirbacSanteAnimale, Франция) и 0,9% раствор NaCl (Красфарма, Россия) из расчета: 0,3 мг КсилаВет, 15 мг Золетила на 1 кг массы тела и 0,5 мл 0,9% раствора NaCl. После анестезии брюшная полость крысы обрабатывалась бриллиантовым зеленым. Производилась средняя лапаротомия, затем выделение, мобилизация и подготовка сосуда (брюшная аорта) к анастомозированию (рис. 3). Брюшная аорта была выделена под оптическим увеличением с использованием хирургического микроскопа Zeiss (Германия). Крысам вводили гепарин натрий 100 МЕ/кг и ацетилсалициловую кислоту 5 мг/кг перед зажимом аорты, чтобы снизить риск тромбоза сосуда. Для профилактики спазма сосудов вводили 2 мг папаверина гидрохлорида над операционным полем. После зажима аорты микрососудистыми клипсами («Медтехника», Казань, Россия) аорту разделяли, создавая зону для анастомоза. Просвет промывали гепаринизированным физиологическим раствором. После оценки состояния интимы сосуда накладывали 2 фиксирующих шва по боковым стенкам каждого сосуда в качестве держалки. Затем на стенке сосуда производили поперечный разрез (артериотомия) размером 2 мм на 1,0 см ниже зоны анастомоза; через этот разрез в просвет сосуда вводили катетер-проводник, снабженный стентом (рис. 4). Медленно нажимая на стержень катетера-проводника, направляли стент в просвет сосуда, обеспечивая расправление стента с раскрытием под его влиянием просвета сосуда. После оценки взаиморасположения сосудов с использованием оптического увеличения клипсы были удалены, проверена проходимость и при необходимости накладывали 1–2 шва (в зависимости от дефекта) в области анастомоза 8/0 полипропиленовыми нитками, один узловой шов в область артериотомии (рис. 5). Для сравнения времени, затрачиваемого при наложении шовного и бесшовного микроанастомозов, и возможных осложнений у 20 крыс из группы контроля микроанастамоз создавался шовным ручным методом. Во группе 2 оба конца инфраренальной аорты были анастомозированы 10/0 нейлоновой нитью Ethicon (Johnson&Johnson), после зажимы освобождались и оценивалась проходимость крови через шов анастамоза. Разрез на животе животных был зашит по срединной линии 5/0 нейлоновой нитью Ethicon (Johnson&Johnson).
В первые 6 суток у всех крыс после оперативного вмешательства контроль работы анастомоза производился клинически. На 7-й день после операции в обеих группах проводилась оценка проходимости брюшного отдела аорты и наличие тромбоза с помощью ультразвуковой допплерографии (Sono Scope S-22, Mindray, Китай).
Cтатистическая обработка данных была выполнена с использованием программного обеспечения Microsoft Excel. Время операции (ишемическое время), частоту тромбозов и неопределенную причину гибели крыс с микростентными (группа 1, n=30) и сшитыми вручную (группа 2, n=20) анастомозами сравнивали с помощью критерия Фишера.
Результаты исследования
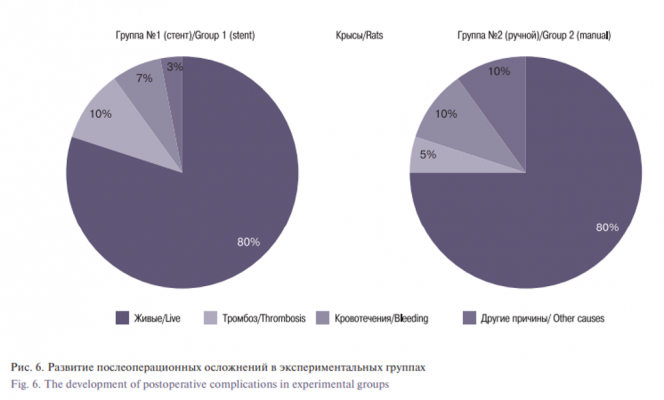
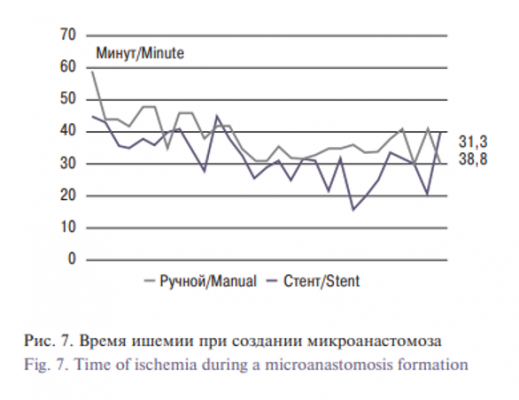
По результатам исследования, в группе 2 умерли пять крыс. Одна крыса умерла от передозировки анестетиками во время операции, одна подопытная погибла по неизвестным причинам на 5-е сутки после операции. Две прооперированные крысы умерли от тромбоза на вторые и третьи сутки и еще одна – от повреждения брюшной вены интраоперационно во время мобилизации. В группе 1 погибли 6 животных. Одна крыса умерла от передозировки анестетиками, 3 крысы умерли от кровотечения из зоны анастомоза, две из них – во время операции из-за несоответствия размера стента и сосуда, а третья крыса погибла через 5 часов. Две крысы погибли от тромбоза зоны анастомоза в 1-е сутки после операции (рис. 6). Среднее время ишемии (время от зажатия аорты до декомпрессии) для выполнения микростентного анастомоза составило 31,3±0,7 минуты (рис. 7). Это было значительно меньше, чем ишемическое время, необходимое для сшивания анастомоза вручную (38,8±0,6 минуты; р<0,001). Причиной, по которой иногда требовалось больше времени для установки микростента, было несоответствие размера стента при первой попытке его установить, и, как следствие, повторное введение стента. В группе 1 из-за интраоперационного кровотечения и летального исхода в результате передозировки препаратов наркоза в трех случаях операция не была завершена. Ультразвуковая допплерография для выявления кровотока через зоны микронастомоза и тромбоза была проведена через неделю после операции. Данный срок допплерографического контроля работы анастомоза выбран из-за того, что через неделю после операции изменения тканей организма со стентом достигали пика своего развития [5].
Ультразвуковая допплерография не показала признаков тромбоза у живых крыс, что подтверждалось клиническими наблюдениями: после тромбоза анастамоза наступала смерть подопытного животного. При анализе случаев смерти животных от тромбоза было выявлено, что частота послеоперационного тромбоза микроанастомоза в группе 2 составила 10%, в группе 1 – 6,66%.
Обсуждение
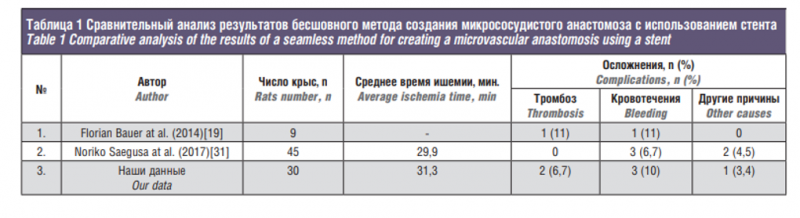
Главная задача стентирования сосудов малого диаметра для микроанастомоза заключается в обеспечении соприкосновения краев сосудов по линии анастомоза, предотвращении перегибов, восстановлении исходного просвета артерии, а также в сдерживании процесса нарастания тромботических наслоений [21]. Металл, помещаемый в кровеносный сосуд, должен обладать высокой биосовместимостью [22]. Одним из важнейших свойств никелида титана, обеспечивших его широкое применение в медицине и хирургии, является свойство восстанавливать свою первоначальную форму после введения в организм человека и нагревания до температуры тела предварительно охлажденного нитинолового устройства с изменением формы [4]. Именно такой эффект памяти формы материала, который уже использовался в стентированиях коронарной артерии и других типах сосудистых стентов, позволил создать уникальные стенты для сердечно-сосудистой хирургии, урологии, гепатологии, хирургической гастроэнтерологии и торакальной хирургии [2, 3, 27, 28]. В настоящее время разработано несколько новых методов восстановления микрососудов с целью сокращения времени процедуры, таких как лазер, клей, внутрисосудистый стент и микрососудистая анастомотическая система [23–26]. В литературе описаны попытки бесшовного соединения сосудов при создании микрохирургических анастомозов с использованием стента [24, 25]. Основными причинами разработки данного метода являются сокращение хирургического времени, нанесенная травма, вероятность тромбоза и сохранение проходимости (см. таблицу).
Технический результат, достигаемый при осуществлении предложенного нами способа, заключается в обеспечении соприкосновения сосудов однородными слоями по линии анастомоза – интима с интимой, отсутствие в просвете анастомозированных сосудов мышечной оболочки или адвентициального покрова, обеспечение гладкой поверхности сосуда в зоне анастомоза (отсутствие перегибов) [29, 30].
В настоящем исследовании было достигнуто создание микрососудистого анастомоза с использованием стента. Мы смогли выполнить сосудистый анастомоз за более короткое время, чем при ручном шитье, с помощью саморасширяюшего стента (NiTi). В группе, в которой для создания анастомоза использовался стент, среднее ишемическое время составило 31,3±0,7 минуты, что меньше, чем время вмешательства у подопытных во 2-й группе (рис. 7). Данные значения коррелируют с протяженностью операций у других авторов. Бо`льшую часть ишемического времени занимала процедура максимального сближения стенок сосудов, этап установки стента (таким образом, чтобы стент фиксировал стенки сосуда равномерно) и подбор размера стента. Кроме того, методика достигала аналогичных или лучших результатов в отношении тромбообразования, степени проходимости просвета и прочности кровеносных сосудов по сравнению с методом ручного сшивания. При анализе осложнений в обеих группах (рис. 6) обращает на себя внимание низкий уровень тромбоза в группе 1 по сравнению с группой, где использовали ручной метод. Другие авторы при использовании стентирования получили идентичные значения смертности от кровотечения (см. таблицу). Основным фактором профилактики кровотечения при использовании нашей методики является подбор размера стента, соответствующего калибру анастомозируемого сосуда.
Заключение
С помощью разработанной нами методики мы смогли выполнить микрососудистый анастомоз с использованием саморасправляющегося стента из никелида титана за более короткое время по сравнению с ручным методом шва. Полученные в эксперименте данные свидетельствуют о возможности быстрого и надежного соединения сосудов малого диаметра конец в конец с помощью саморасправляющегося стента. Микрососудистый анастомоз с использованием стента является методом, который может внести существенный вклад в хирургию, где используются микрохирургические анастомозы.
ЛИТЕРАТУРА/REFERENCES
- Решетов И.В., Чиссов В.И. Пластическая и реконструктивная хирургия в онкологии. М., 2001. [Reshetov I.V., Chissov V.I. Plastic and reconstructive surgery in oncology. M., 2001 (In Russ.)].
- Savchenko A.P., Cherkavskaya O.V., Rudenko B.A. Interventional Cardiology. Coronary angiography and stenting: a guide. Ed. E.D. Bogdanov. M., 2010. 448 р. (In Russ.). Савченко А.П., Черкавская О.В., Руденко Б.А. Интервенционная кардиология. Коронарная ангиография и стентирование: руководство. Ред. Е.Д. Богданова. М., 2010. 448 с.
- Karpov Y.A., Samko A.N., Buza V.V. Coronary angioplasty and stenting. M., 2010.316 s. (In Russ.). Карпов Ю.А., Самко А.Н., Буза В.В. Коронарная ангиопластика и стентирование. М., 2010. 316 с.
- Papirov I.I., Shkuropatenko V.A., Shokurov B.C., Pikapov A.I. Medical Stent Materials: Overview. Kharkov, 2010.40 s. (In Russ.). Папиров И.И., Шкуропатенко В.А., Шокуров B.C., Пикапов А.И. Материалы медицинских стентов: Обзор. Харьков, 2010. 40 с.
- . Protopopov A.V. Development and clinical implementation of the vascular endoprosthetics method with a self-expanding nitinol stent (experimental clinical study). Thesis for Doctor of Medicine grade. M., 2002. (In Russ.). Протопопов А.В. Разработка и клиническое внедрение метода эндопротезирования сосудов саморасширяющимся нитиноловым стентом (экспериментальноклиническое исследование). Дисс. докт. мед. наук. М., 2002.
- Carrel A. La Technique opératoire des anastomoses vasculaires et la transplantation des viscères. Lyon Med. 1902;98:859–64.
- Harii K., Ohmori S. Use of the gastroepiploic vessels as recipient or donor vessels in the free transfer of composite flaps by microvascular anastomoses. Plast. Reconstr. Surg.1973;52:541–8. pmid:4583289.
- Androsov P.I. New method of surgical treatment of blood vessel lesions. AMA Arch. Surg. 1956;73(6):902–10. pmid:13372010.
- Kirsch W.M., Zhu Y.H., Hardesty R.A., Chapolini R. A new method for microvascular anastomosis: report of experimental and clinical research. Am. Surg. 1992;58(12):722–7. pmid:1456593.
- Klöppel M., Tudor C., Kovacs L., Papadopulos N.A., Höhnke C., Himsl I., et al. Comparison of experimental microvascular end-to-end anastomosis via VCS-Clips versus conventional suture technique in an animal model. J. Reconstr. Microsurg. 2007;23:45–9. pmid:17230321.
- Holt G.P., Lewis F.J. A new technique for end-to-end anastomosis of small arteries. Surg. Forum. 1960;11:242–3. pmid:13715532.
- Östrup L.T., Berggren A., The UNILINK Instrument System for Fast and Safe Microvascular Anastomosis. Ann. Plast. Surg. 1986;17: 521–5. pmid:3827122.
- Blakemore A.H., Lord J.W. Jr. A nonsuture method of blood vessel anastomosis: experimental and clinical Study. JAMA. 1945;127:685–91.
- Solem J.O., Boumzebra D., Al-Buraiki A., Nakeeb S., Rafeh W., Al-Halees Z. Evaluation of a new device for quick sutureless coronary artery anastomosis in surviving sheep. Eur. J. Cardiothorac. Surg. 2000;3:312–8.
- Gottlob R., Blümel G. Anastomoses of small arteries and veins by means of bushings and adhesive. J. Cardiovasc. Surg. 1968;9:337–41.
- Stewart R.B., Benbrahim A., LaMuraglia G.M., Rosenberg M., L’Italien G.J., Abbott W.M., et al. Laser assisted vascular welding with real time temperature control. Lasers Surg. Med. 1996;19:9–16. pmid: 8836991.
- Chang E.I., Galvez M.G., Glotzbach J.P., Hamou C.D., El-ftes S., Rappleye C.T., et al. Vascular anastomosis using controlled phase transitions in poloxamer gels. Nat. Med. 2011;17:1147–52. pmid:21873986.
- Zeebregts C.J., Heijmen R.H., van den Dungen J.J., van Schilfgaarde R. Non-suture methods of vascular anastomosis. Br. J. Surg. 2003;90:261–71. pmid:12594661.
- Fischman D.L, Leon M.B., Baim D.S., Schatz R.A., Savage M.P., Penn I., et al. A randomized comparison of coronary-stent placement and balloon angioplasty in the treatment of coronary artery disease. Stentrestenosisstudyinvestigators. N. Engl. J. Med. 1994;331: 496–501. pmid:8041414.
- Bauer F., Fichter A.M., Loeffelbein D.J., Wolff K.D., Schütz K., Mücke T. Microvascular anastomosis using modified micro-stents: a pilot in vivo study. J. Craniomaxillofac. Surg. 2015;43(2):204–07. doi: 10.1016/j.jcms.2014.11.005. [Epub 2014 Nov 15.].
- Aygun H., Yildirim O.S. Vertical mattress suture technique: an alternative vascular anastomosis. J. Reconstr. Microsurg. 2008;24(6):97–404. doi: 10.1055/ s-0028-1082027.
- Verheye S., Salame M.Y., Robinson K.A., et al. Short- and long-term histopathologic evaluation of stenting using a self-expanding nitinol stent in pig carotid and iliac arteries. Cathet. Cardiovasc. Intervent. 1999;48:316–23.
- Leclère F.M., Vogt P., Schoofs M., Delattre M., Mordon S. Current laser applications in reconstructive microsurgery: a review of the literature. J. Cosmet. Laser Ther. 2016;18(3):130–3.
- Langer S., Schildhauer T.A., Dudda M., Sauber J., Spindler N. Fibrin glue as a protective tool for microanastomoses in limb reconstructive surgery. GMS. Interdiscip. Plast. Reconstr. Surg. DGPW. 2015.
- Assersen K., Sørensen J. Intravascular stenting in microvascular anastomoses. J. Reconstr. Microsurg. 2015;31(2):113–8.
- Oguchi H., van der Lei B. The 3M precise microvascular anastomotic system for implanting PTFE microvenous prostheses into the rat femoral vein. Plast. Reconstr. Surg. 1996;97(3):662–5.
- Chen M., et al. Bioactive NiTi shape memory alloy. Materials Science and Engineering. 2004;24:497–502.
- Ayers R.A., et al. Shape memory implants. L’Hocine Yahia (ed.). Berlin, Heidelberg, New York: Springer–Verlag, 2000. 356 p.
- Alghoul M.S., Gordon C.R., Yetman R., Buncke G.M., Siemionow M., Afifi A.M., et al. From simple interrupted to complex spiral: A systematic review of various suture techniques for microvascular anastomoses. Microsurg. 2011);31(1):72–80.
- Shurey S., Green C. Basic microsurgical techniques: A laboratory manual. Middlesex, UK: Surgical Research Department, NPIMR, Northwick Park Hospital. 2011.
- Noriko Saegusa, Shunji Sarukawa,Kunihiro Ohta,Kensuke Takamatsu,Mitsuhiro Watanabe,Takashi Sugino,Masahiro Nakagawa,Yasuto Akiyama,Masatoshi Kusuhara,Kazuo ishi, Keita Inoue. Sutureless microvascular anastomosis assisted by an expandable shape-memory alloy stent. 2017. https://doi.org/10.1371/ journal.pone.0181520.
Поступила 01.04.19 Принята в печать 01.12.19
Received 01.04.19 Accepted 01.12.19
Авторы имеют патент РФ:
«Способ формирования микрососудистого анастомоза» Заявка: 2010148842/14, 30.11.2010.
Авторы: Решетов Игорь Владимирович (RU), Дустов Шерали Хаятович(UZ).
The authors have a patent RusFed: “Method for the formation of microvascular anastomosis” Application: 2010148842/14, 11/30/2010 Authors: Reshetov Igor Vladimirovich (RU), Dustov Sherali Hayatovich (UZ).
Вклад авторов: Дустов Ш.Х., Решетов И.В.: концепция и дизайн исследования, обзор публикаций по теме статьи, сбор данных, анализ полученных данных, написание текста рукописи, редактирование.
Authors’ contributions. Dustov Sh.H., Reshetov I.V.: conception and design of the study, data collection and analysis, manuscript preparation, and editing.
Информация об авторах:
Ш.Х. Дустов – заместитель директора по лечебным вопросам Бухарского филиала Республиканского специализированного научно практического медицинского центра онкологии и радиологии, Бухара, Узбекистан; e-mail: sherali_doc@mail.ru. https://orcid.org/0000-0002-5526-4260
И.В. Решетов – д.м.н., профессор, академик РАН, директор НОКЦ пластической хирургии, ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава РФ (Сеченовский университет), Академия постдипломногообразования ФГБУ ФНКЦ ФМБА России, Москва; e-mail: reshetoviv@mail. ru. https://orcid.org/0000-0002-3888-8004
Information about authors:
Sh.H. Dustov – Deputy Director for Medical Issues, Bukhara Branch of the Republican Specialized Scientific Practical Medical Center of Oncology and Radiology, Bukhara, Uzbekistan; e-mail: sherali_doc@mail.ru. https://orcid. org/0000-0002-5526-4260
I.V. Reshetov – MD, professor, academician of the Russian Academy of Sciences, director of the Scientific and Practical Center for Plastic Surgery, Federal State Autonomous Educational Institution of Higher Education First Moscow State Medical University named after I.M. Sechenov, Ministry of Health of the Russian Federation (Sechenovskiy University), Moscow, Academy of Postgraduate Education FSBI FSCC FMBA of Russia, Moscow. https://orcid.org/0000-0002- 3888-8004
Рецензия на статью
В статье описывается экспериментальная методика установки стента в сосуды малого диаметра. Разработка подобных новых методик имеет большое значение в хирургии, транспланталогии, онкологии.
Полученные данные свидетельствуют о возможности соединения сосудов за счет использования саморасправляющегося стента для быстрого и надежного соединения между собой сосудов малого диаметра, конец в конец.
Review on the article
The article describes an experimental technique for installing a stent in small diameter vessels.
The development of such new techniques is of great importance in surgery, transplantology, oncology. The data obtained indicate the possibility of connecting vessels through the use of a self-expanding stent for quick and reliable connection between small-diameter vessels, end to end.