Для цитирования: Решетов И.В., Сукорцева Н.С., Шевалгин А.А., Агакина Ю.С., Багдасаров П.С., Габаидзе Д.И., Насилевский П.А. Роботизированная хирургия щитовидной железы. Голова и шея. Российский журнал Head and neck Russian Journal. 2020;8(2):8–15
For citation: Reshetov I.V., Sukortseva N.S., Shevalgin A.A., Agakina Y.S., Bagdasarov P.S., Gabaidze D.I., Nasilevsky P.A. Robotic surgery of the thyroid gland. Head and neck Russian Journal. 2020;8(2):8–15 (in Russian).
Цель работы: внедрение в клиническую практику лечения больных злокачественными и доброкачественными новообразованиями щитовидной железы (ЩЖ) робот-ассистированных хирургических вмешательств. По мере увеличения заболеваемости раком ЩЖ, частично из-за более раннего обнаружения и более чувствительных диагностических методов, число лобэктомий ЩЖ и тотальных тиреоидэктомий (ТЭ) также увеличивается. Увеличение числа пациентов этой группы требует разработки новых хирургических подходов. На протяжении многих лет было разработано и внедрено несколько методов с целью минимизации или устранения разреза на шее, классически связанного с хирургией ЩЖ. Доказать эффективность и рациональность применения роботической хирургии ЩЖ из удаленного доступа является одной из задач современной хирургии. Перспективность этого направления доказана и основывается на меньшей травматичности робот-ассистированных операций, небольшом числе осложнений, а также социальной и косметической значимости [1].
Материал и методы. В онкологическом центре Сеченовского университета разработана методика роботассистированной геми-ТЭ у больных доброкачественными новообразованиями ЩЖ небольших размеров (до 30 мм в диаметре) и у больных злокачественными новообразованиями ЩЖ, находящихся на ранних стадиях заболевания (Т1–Т2). Успешно проведено 6 операций: 2 операции у пациенток с узловым зобом и аутоиммунным тиреоидитом и 4 у пациенток с папиллярным раком ЩЖ. Объем операции определялся исходя из клинических данных каждой конкретной больной на онкологическом консилиуме. Было проведено 2 геми-ТЭ с центральной лимфодиссекцией у пациенток с папиллярным раком ЩЖ (Т1), 1 геми-ТЭ у пациентки с коллоидным зобом, 2 ТЭ с центральной лимфодиссекцией у пациенток с папиллярным раком ЩЖ (Т2), 1 ТЭ у больной аутоиммунным тиреоидитом.
Результаты. При проведении операций необходимости в конверсии не потребовалась. Средняя длительность операции составила 120 минут. Миниинвазивность метода робот-ассистированной операции позволяет сократить продолжительность стационарного лечения, сроки нетрудоспособности, а, главное, обеспечивает видимый косметический эффект.
Заключение. Робот-ассистированные хирургические вмешательства на ЩЖ технически осуществимы. Операция из удаленного подмышечного доступа обеспечивает отличное оперативное поле зрения, позволяет легко идентифицировать жизненно важные анатомические структуры, а также существенно улучшает косметический результат, т.к. позволяет избежать рубцов на коже в области шеи.
Ключевые слова: рак щитовидной железы, онкология головы и шеи, роботическая хирургия, подмышечный доступ
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена без спонсорской поддержки.
Для цитирования: Решетов И.В., Сукорцева Н.С., Шевалгин А.А., Агакина Ю.С., Багдасаров П.С., Габаидзе Д.И., Насилевский П.А. Роботизированная хирургия щитовидной железы. Голова и шея. Российский журнал Head and neck Russian Journal. 2020;8(2):8–15
Авторы несут ответственность за оригинальность представленных данных и возможность публикации иллюстративного материала – таблиц, рисунков, фотографий пациентов.
Objective: to introduce the robot-assisted surgical treatment of patients with malignant and benign tumors of the thyroid gland (TG) into clinical practice. As the incidence of thyroid cancer increases, partly due to earlier detection and more sensitive diagnostic methods, the number of thyroid lobectomy and total thyroidectomy (TE) also increases. An increase in the number of patients in this group requires the development of new surgical approaches. Over the years, several methods have been developed and implemented to minimize or eliminate the incision in the neck that is classically associated with thyroid surgery. To prove the effectiveness and rationality of the use of robotic thyroid surgery from remote access is one of the tasks of modern surgery. The prospects of this area are proved based on the lesser trauma, a small number of complications, as well as social and cosmetic significance associated with robot-assisted operations [1].
Material and methods. In the Oncology Center of Sechenov University, a technique has been developed for conducting robot-assisted hemi-TE in patients with small thyroid benign neoplasms (up to 30 mm in diameter) and in patients with early-stage thyroid malignant neoplasms (T1 – T2). 6 operations were successfully performed: 2 in patients with nodular goiter and autoimmune thyroiditis and 4 in patients with papillary thyroid cancer. The volume of the operation was determined based on the clinical data of each specific patient at an oncological consultation. 2 hemi-ТЕ were performed with central lymphatic dissection in patients with papillary thyroid cancer (T1), 1 hemi-ТЕ in patient with colloid goiter, 2 TE with central lymphodissection in patients with papillary thyroid cancer (T2), 1 TE in autoimmune thyroiditis.
Results. During operations, the conversion was not required. The average duration of the operation was 120 minutes. Minimal invasiveness of the robot-assisted operation reduces the duration of inpatient treatment, the period of disability, and, most importantly, provides a visible cosmetic effect.
Conclusion. Carrying out robot-assisted surgical interventions on the thyroid gland is technically feasible. The operation from the remote axillary access provides an excellent operational field of view, makes it easy to identify vital anatomical structures, and also significantly improves the cosmetic result and avoids scarring on the neck skin.
Key words: thyroid cancer, oncology of the head and neck, robotic surgery, axillary access.
Conflicts of interest. The authors have no conflicts of interest to declare.
Funding. There was no funding for this study.
For citation: Reshetov I.V., Sukortseva N.S., Shevalgin A.A., Agakina Y.S., Bagdasarov P.S., Gabaidze D.I., Nasilevsky P.A. Robotic surgery of the thyroid gland. Head and neck Russian Journal. 2020;8(2):8–15 (in Russian).
The authors are responsible for the originality of the data presented and the possibility of publishing illustrative material – tables, figures, photographs of patients.
Введение
Хирургия щитовидной железы (ЩЖ) остается практически неизменной в течение почти 100 лет после того, как Кохер усовершенствовал традиционную технику тиреоидэктомии (ТЭ) с использованием его одноименного разреза. В конце 1990-х гг. значительные достижения в эндоскопической хирургии и благоприятный опыт минимально инвазивной паратиреоидной хирургии побудили исследовать способы снижения косметического воздействия разреза Кохера. В то время как некоторые авторы применяли минимально инвазивные передние шейные доступы к ЩЖ, другие группы разрабатывали удаленные доступы, которые полностью исключают разрез на передней поверхности шеи. Первоначально при удаленном доступе использовали эндоскопические методы и оборудование, которые ограничивали их популярность и применимость на Западе. Впоследствии для удаленного доступа к ЩЖ был введен хирургический робот, что значительно увеличило применение и привлекательность этого метода.
Преимущества удаленного доступа роботизированной ТЭ
Несмотря на то что в последние годы минимально инвазивные передние шейные доступы к ЩЖ привели к уменьшению косметических дефектов, эти процедуры все еще оставляют видимый шрам на шее. В то время как многие пациенты находят этот небольшой шрам приемлемым побочным эффектом после проведенной операции, есть и другие пациенты, которые по личным или профессиональным причинам стремятся избежать любого общественного клейма хирургии. Для этих людей операции из удаленного доступа имеют явное преимущество, т.к. позволяют полностью избежать шрама после ТЭ на видимой части шеи.
Самые ранние методы удаленного доступа обычно включали эндоскопические подходы из передней грудной клетки или подмышечной впадины для доступа к области ЩЖ [2–7]. При таких операциях использовали инсуфляцию СО2 для поддержания оперативного кармана, была ограничена двумерная визуализация, применяли длинные жесткие инструменты, используемые при эндоскопических процедурах [8], что препятствовало их широкому распространению. Чтобы преодолеть эти ограничения в 2005 г. в хирургию на ЩЖ был введен хирургический робот с дистанционным доступом [9], при этом первые отчетные результаты исследований появились в 2009 г. [8, 10]. Роботизированная хирургия ЩЖ с дистанционным доступом имеет несколько преимуществ по сравнению с эндоскопическими подходами, включая трехмерный вид хирургического поля, улучшенную маневренность инструментов и пропорцио нальное масштабирование движения для тонкой диссекции [11]. Разработка надежных систем фиксированной ретракции позволила использовать безгазовые подходы к ЩЖ, устраняя необходимость инсуфляции СО2 в область шеи [10]. Эти достижения в сочетании с косметическими преимуществами подходов удаленного доступа способствовали популяризации роботизированной хирургии ЩЖ в глобальном масштабе.
Роботизированная ТЭ из удаленного доступа
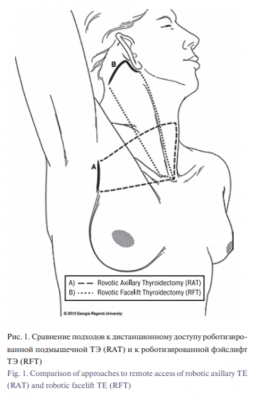
В настоящее время в западных практиках существует два основных типа роботизированной хирургии ЩЖ удаленного доступа (рис. 1).
Роботизированная подмышечная ТЭ (RAT – Robotic Axillary Thyroidectomy) появилась в Южной Корее в 2009 г. [8]. В этом безгазовом подходе используется разрез, скрытый в подмышечной области. Он был разработан для непосредственного преодоления недостатков, присущих эндоскопической хирургии из удаленного доступа к ЩЖ. В то время как RAT была успешной и популярной на некоторых азиатских рынках, некоторые серьезные ограничения стали очевидными после ее внедрения на западе, что побудило многих хирургов отказаться от этой техники [12–14]. Чтобы преодолеть эти ограничения в 2010 г. была разработана безгазовая роботизированная фэйслифт ТЭ (RFT – Robotic Facelift Thyroidectomy), при проведении которой применяется заушный разрез [15, 16].
Роботизированная подмышечная ТЭ
RAT Преимущества и недостатки. Как и во всех методах удаленного доступа, роботизированный подмышечный доступ не оставляет следов после операции на ЩЖ на передней поверхности шеи. Разрез хорошо спрятан в подмышечной впадине, и в отличие от других эндоскопических процедур удаленного доступа он не приводит к формированию рубцов на передней поверхности грудной клетки. Эти косметические атрибуты сделали RAT популярным методом лечения хирургических болезней ЩЖ на некоторых азиатских рынках, где гипертрофические рубцы могут быть заметны, а шея считается очень чувственной областью [17–19]. RAT ассоциируется с повышенной косметической удовлетворенностью пациента по сравнению с открытыми процедурами [20, 21]. Некоторые авторы также сообщили о снижении болевого синдрома после проведения RAT [20], в то время как другие отметили, что снижение послеоперационной боли в шее сопровождалось увеличением боли в грудной клетке [21].
Существует несколько недостатков техники. Длина хирургического кармана затрудняет стимуляцию возвратного гортанного нерва с помощью доступных в настоящее время коммерческих стимуляторов. Вектор подхода предполагает рассечение тканей через подмышечную впадину и переднюю грудную клетку, области, которые могут быть незнакомы для большинства хирургов головы и шеи. Кроме того, поскольку операция была импортирована из Азии в западную практику, было отмечено, что она более сложна для получения адекватной экспозиции у пациентов с высоким ростом или ожирением [22, 23], что способствует увеличению рабочего времени операции [24]. Операция чаще всего выполняется с использованием дренажей и требует стационарного наблюдения, что является шагом назад от многих достижений, достигнутых с помощью минимально инвазивных передних шейных подходов к ТЭ, доступных в настоящее время. Наконец, сообщалось о ряде серьезных осложнений при использовании этого метода в западных практиках [22, 24, 25]. Эти факторы наряду со стоимостью и несколькими другими соображениями заставили многих хирургов в Северной Америке подвергнуть сомнению или вообще отказаться от этой процедуры [12–14, 26, 27].
Отбор пациентов для проведения RAT. Для RAT не существует единого критерия отбора [23, 25]. Эта процедура впервые была описана у пациентов с доброкачественными и злокачественными новообразованиями ЩЖ, при этом RAT показана для пациентов с узлами )5 см и злокачественными поражениями )2 см [8, 9]. Пациенты не допускались до операции, если у них ранее была выполнена операция на шее, «тяжелая» болезнь Грейвса, злокачественные опухоли с экстратироидным распространением, множественные метастазы в лимфоузлы шеи, узловое экстракапсулярное распространение или поражения в дорзальной части [10]. Пациенты с загрудинным или заглоточным расположением также были исключены [24].
В то время как подмышечный доступ в основном используется для односторонней операции на ЩЖ, сообщено о проведении двусторонних операций [8, 10, 22, 23], центральной и боковой диссекции шеи [8, 10, 28].
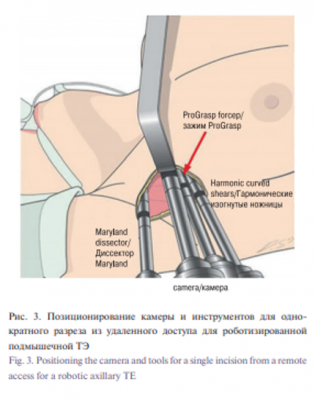
Детали операции RAT. Операция роботизированной подмышечной ТЭ удаленного доступа была подробно описана [8, 10, 22]. Данный вид хирургического вмешательства перенес некоторые изменения и уточнения для хирурга с момента его первоначального описания. После соответствующего позиционирования рука пациента вытягивается в плече, в передней подмышечной впадине делают вертикальный разрез 5–6 см. Руку возвращают в ее естественное положение, чтобы гарантировать, что запланированная линия разреза будет скрыта в подмышечной области. Руку затем снова выдвигают и закрепляют на подлокотнике. Некоторые авторы выступают за сгибание локтя, чтобы свести к минимуму риск травмы нерва [22]. При желании разрез в 1 см отмечается на груди пациента на 2 см выше соска и на 2 см латеральнее среднеключичной линии, хотя многие хирурги в настоящее время опускают этот дополнительный рабочий порт и вводят все инструменты через подмышечный разрез. Подмышечный разрез и далее делается тупым и острым путем, что обеспечивает доступ к фасции, покрывающей большую грудную мышцу. Открывается плоскость между подкожной клетчаткой и большой грудной мышцей, далее рассечение продолжается медиально по средней линии и выше над ключицей. Идентифицируется кивательная мышца, а покрытые ею мягкие ткани поднимаются от ключицы и яремной вырезки грудины. Открывается пространство между грудинной и ключичной головками кивательной мышцы, грудинная головка отодвигается вентрально, чтобы обнажить ременные мышцы и не повредить внутреннюю яремную вену или ее притоки. Затем ременные мышцы поднимаются от ЩЖ, начиная от яремной вырезки грудины по средней линии и до верхнего полюса ЩЖ. Лопаточно-подъязычная мышца, если необходимо, может быть разделена для улучшения экспозиции. Для поддержания оперативного кармана используется фиксированная система ретракции (рис. 2).
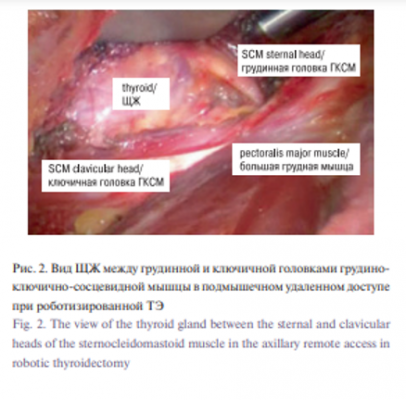
Консоль робота затем закрепляется на противоположной стороне операционного стола. Используется камера, обращенная вниз на 30°. Гармонические ножницы (Ethicon Endosurgery Inc., Cincinnati, OH) помещаются в доминирующее плечо, а зажим ProGrasp (Intuitive Surgical, Sunnyvale, CA) и биполярный диссектор Maryland помещаются в недоминирующие руки. Камера помещается через подмышечный доступ, так, что наконечник ориентирован преимущественно выше, в то время как инструменты занимают нижележащее положение (рис. 3). Первично уделяется внимание верхнему полюсу ЩЖ. Железа отводится книзу, а верхняя сосудистая ножка разделяется гармоническим скальпелем. Фиксированные мягкие ткани и сосуды вдоль нижнего полюса железы разделяются и железа ротируется медиально. Возвратный гортанный нерв и паращитовидные железы идентифицируются и сохраняются. Как только эти структуры сохранены, перешеек и любые оставшиеся вставки мягких тканей разделяются, а доля удаляется. Если показана полная ТЭ, то верхняя ножка контралатеральной доли делится и выполняется субкапсулярная диссекция между ЩЖ и трахеей для выявления контралатеральной ветви возвратного гортанного нерва и выделения железы. Устанавливают дренаж и рану ушивают послойно. Пациентов, как правило, сразу переводят в палату для наблюдения после операции.
Результаты RAT
RAT успешно выполняется у тысяч пациентов, в основном в Азии. Средняя продолжительность операции варьируется от 115 до 168 минут [8, 10, 29, 30]. Независимо от используемого подхода или степени хирургического вмешательства роботизированная операция на ЩЖ с дистанционным доступом, как правило, продолжительнее обычной открытой операции на ЩЖ. Обзор роботизированных подмышечных и двусторонних подмышечных ТЭ показал среднее общее увеличение на 42 минуты для этих подходов по сравнению с открытой хирургией [21]. Однако общая продолжительность пребывания в стационаре короче у пациентов, перенесших роботизированную ТЭ с дистанционным доступом, чем при обычной открытой хирургии [21].
Как центральная, так и латеральная диссекция шеи выполняются из подмышечного доступа с использованием комбинированных подмышечных и передних разрезов грудной клетки [10, 28, 31], в среднем 6,1 лимфатических узла были удалены из центральной клетчатки шеи и 27,7 узла удалены на боковой поверхности шеи [28].
Полнота хирургической резекции может быть отражена в послеоперационном уровне тиреоглобулина (Tg) и I131. S.W. Kang и соавт. [10] сообщили о достижении послеоперационных уровней Tg менее 1 нг/мл у 92% пациентов, при этом средний уровень Tg составил 4,9 нг/мл у остальных 8% пациентов. Недавний систематический обзор, в котором сравнивали 1053 пациента с RAT с 794 пациентами с открытой ТЭ, не выявил различий в послеоперационных уровнях Tg между этими двумя группами [21]. S.W. Kang и соавт. [31] не сообщают об аномальных уровнях поглощения I131 у 209 пациентов, подвергшихся тотальной ТЭ с помощью RAT, после которой проводилась послеоперационная терапия радиоактивным йодом, хотя у пациентов, получавших RAT, был выше уровень послеоперационного Tg, чем у пациентов, имеющих обычную хирургию до радиоактивной абсорбции йода [30].
RAT подвергает пациентов всем стандартным рискам операции на ЩЖ и вводит несколько новых. Сообщалось о таких осложнениях, как кровотечение, невропатия плечевого сплетения, повреждение грудного протока, формирование синдрома Горнера, переход к открытой операции, травма пищевода и трахеи [10, 22, 24, 29]. Сообщалось о временной травме возвратного гортанного нерва в 0,7–8% случаев [29, 30], постоянная травма возвратного гортанного нерва встречалась в 0,4% случаев [29]. Гематома встречалась в 2,6% случаев [30]. Временная гипокальциемия наблюдалась в 41% случаев [21, 30]. Недавний систематический обзор показал, что риск транзиторной гипокальциемии был выше при роботизированных процедурах удаленного доступа, чем при обычной ТЭ, но в остальном не было различий в осложнениях между двумя типами подходов [21].
Материал и методы
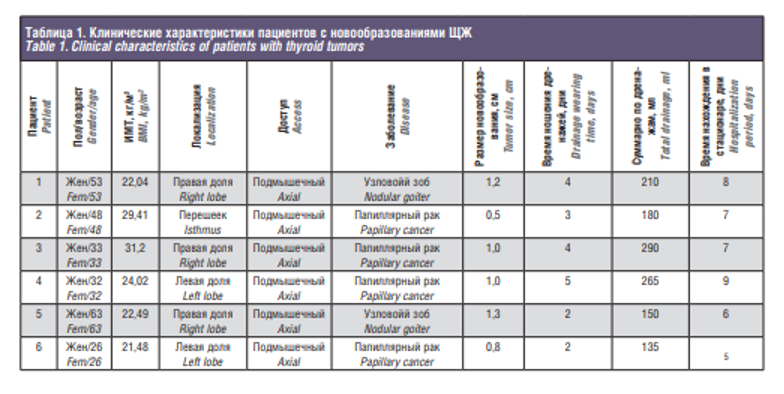
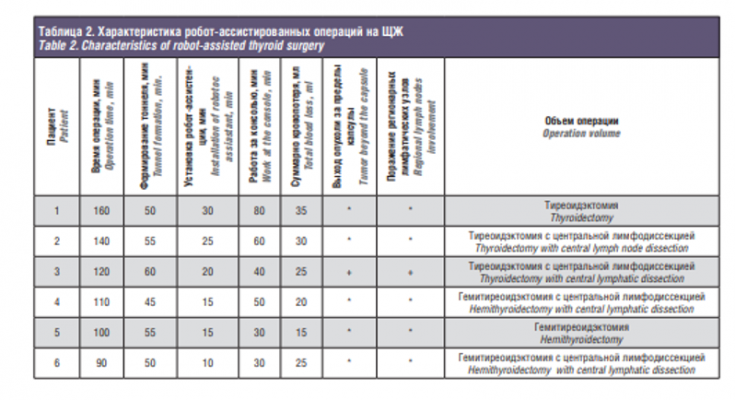
Робот-ассистированные операции на ЩЖ были выполнены у 6 пациенток, находившихся на лечении в онкологическом центре Сеченовского университета с мая 2016 по ноябрь 2018 г. Средний возраст пациенток составил 42 года (табл. 1). Все операции были выполнены из подмышечного доступа. Было выполнено 2 геми-ТЭ с центральной лимфодиссекцией у пациенток с папиллярным раком ЩЖ (Т1), 1 геми-ТЭ у пациентки с коллоидным зобом, 2 ТЭ с центральной лимфодиссекцией у пациенток с папиллярным раком ЩЖ (Т2), 1 ТЭ у больной аутоиммунным тиреоидитом. Показанием к хирургическому лечению считали установленный при тонкоигольной аспирационной биопсии цитологический диагноз: папиллярный рак (4/66%), узловой коллоидный зоб (1/16,6%) и аутоиммунный тиреоидит (1/16,6%). Тактику лечения пациенток и способ лечения определяли на онкологическом консилиуме, исходя из входных клинических данных каждой конкретной пациентки, при этом учитывали размер опухоли, объем ЩЖ, наличие метастазов в центральную группу лимфоузлов шеи (табл. 2). В предоперационном периоде всем пациенткам выполняли исследование тиреоидного статуса, уровней ионизированного кальция и паратгормона крови. Также всем пациенткам была проведена мультиспиральная компьютерная томография. Исследование уровня кальция выполняли через сутки после операции. Операции проводили под эндотрахеальным наркозом. Техника проведения операции изложена выше. Средняя длительность операции составила 120 минут, кровопотеря не превысила 30 мл. Конверсии не потребовалось. Кровотечений в послеоперационном периоде, потребовавших повторной операции, не отмечалось. Всем пациенткам были установлены дренажи, ношение дренажей в среднем составило 3 дня. Среднее время нахождения в стационаре после выполнения робот-ассистированных операций у больных, находящихся под нашим наблюдением, составило 7 дней. Во всех случаях отмечалось гладкое послеоперационное течение без осложнений. После проведения планового патогистологического исследования положительный хирургический край не встретился ни в одном из случаев. В одном случае встретился выход опухоли за пределы капсулы узла без прорастания опухоли за пределы капсулы ЩЖ.
Обсуждение
Накопленный нами опыт лечения больных доброкачественными и злокачественными новообразованиями ЩЖ в онкологическом центре Сеченовского университета свидетельствует об эффективности применения роботической хирургии. Вмешательства данного вида могут быть альтернативой традиционным доступам в группе больных новообразованиями небольшого размера (до 2 см при злокачественных опухолях и до 5 см при доброкачественных новообразованиях). Значимыми преимуществами данного вида вмешательств являются меньшая травматизация тканей, удаленность доступа, что обусловливает лучший косметический результат после вмешательства. Следует обратить внимание на большую длительность роботассистированной операции, это связано как с меньшим опытом этих вмешательств, так и с дополнительным временем, необходимым на установку стойки пациента и калибровку инструментов. Тем не менее время при робот-ассистированной операции, нивелируется высоким качеством визуализации операционного поля за счет 3D изображения, маневренности инструментария и легкости манипуляций, что снижает физические и эмоциональные затраты хирурга. Одним из ключевых факторов, сдерживающих прогресс роботической хирургии, является не только сложность технологии, но и более высокая стоимость по сравнению с традиционной. При этом следует подчеркнуть, что все оперативные вмешательства с использованием хирургического робота включены в перечень высокотехнологичных вмешательств, выполняемых для пациента бесплатно.
Заключение
Операции из удаленного доступа представляют собой новый взгляд на хирургию ЩЖ. Эти процедуры предоставляют пациентам возможность лечения их заболевания без видимого разреза, связанного с более традиционными подходами к ТЭ. Операция на ЩЖ с роботизированной поддержкой продолжает совершенствоваться, и потребительский спрос на этот дистанционный доступ остается высоким среди тех пациентов, которые делают ставку на косметические результаты хирургии ЩЖ.
ЛИТЕРАТУРА/REFERENCES
- Reshetov I.V. Opukholi organov golovy i shei; Tver’, 2016. Р. 151–68. РешетовИ.В. Опухоли органов головы и шеи; Тверь, 2016. С. 151–68. (In Russ.).
- Ohgami M., Ishii S., Arisawa Y., et al. Scarless endoscopic thyroidectomy: breast approach for better cosmetics. Surg. Laparosc. Percutan. Tech. 2000;10:1–4.
- Ikeda Y., Takami H., Niimi M., et al. Endoscopic thyroidectomy by the axillary approach. Surg. Endosc. 2001;15:1362–4.
- Park Y.L., Han W.K., Bae W.G. 100 cases of endoscopic thyroidectomy: breast approach. Surg. Laparosc. Percutan. Tech. 2003;1:20–5.
- Ikeda Y., Takami H., Sasaki Y., et al. Clinical benefits in endoscopic thyroidectomy by the axillary approach. J. Am. Coll. Surg. 2003; 196:189–95.
- Shimazu K., Shiba E., Tamaki Y., et al. Endoscopic thyroid surgery through the axillo-bilateral breast approach. Surg. Laparosc. Percutan. Tech. 2003; 13:196–201.
- Choe J.H., Kim S.W., Chung K.W., et al. Endoscopic thyroidectomy using a new bilateral axillo-breast approach. World J. Surg. 2007;31:601–6.
- Kang S.W., Jeong J.J., Yun J.S., et al. Robot-assisted endoscopic surgery for thyroid cancer: experience with the first 100 patients. Surg. Endosc. 2009;23:2399–406.
- Lobe T.E., Wright S.K., Irish M.S. Novel uses of surgical robotics in head and neck surgery. J. Laparoendosc. Adv. Surg. Tech. 2005;15(6):647–52.
- Kang S.W., Lee S.C., Lee S.H., et al. Robotic thyroid surgery using a gasless, transaxillary approach and the da Vinci S system: the operative outcomes of 338 consecutive patients. Surg. 2009;146:1048–55.
- Cadière G.B., Himpens J., Germay O., et al. Feasibility of robotic laparoscopic surgery: 146 cases. World J. Surg. 2001;25:1467–77.
- Cabot J.C., Lee C.R., Brunaud L., et al. Robotic and endoscopic transaxillary thyroidectomies may be cost prohibitive when compared to standard cervical thyroidectomy: a cost analysis. Surg. 2012;152:1016–24.
- Inabnet W.B. Robotic thyroidectomy: Must we drive a luxury sedan to arrive at our destination safely? Thyroid. 2012;22:988–90.
- Perrier N.D. Why I, have abandoned robot-assisted transaxillary thyroid surgery. Surg. 2012;152:1025–6.
- Singer M.C., Seybt M.W., Terris D.J. Robotic facelift thyroidectomy: I. Preclinical simulation and morphometric assessment. Laryngoscop. 2011;121:1631–5.
- Terris D.J., Singer M.C., Seybt M.W. Robot facelift thyroidectomy: II. Clinical feasibility and safety. Laryngoscop. 2011;121:1636–41.
- Li-Tsang C.W.P., Lau J.C.M., Chan C.C.H. Prevalence of hypertrophic scan formation and its characteristics among the Chinese population. Burns. 2005;31:610–6.
- McCurdy J.A. Considerations in Asian cosmetic surgery. Facial. Plast. Surg. Clin. N. Am. 2007;15:387–97.
- Duh Q.Y. Robot-assisted endoscopic thyroidectomy. Has the time come to abandon neck ncisions? Ann. Surg. 2011;253(6):1067–8.
- Chung W.Y. Pros of robotic transaxillary thyroid surgery: its impact on cancer control and surgical quality. Thyroid. 2012;22(10):986–7.
- Jackson N.R., Yao L., Tufano R.P., Kandil E.H. Safety of robotic thyroidectomy approaches: meta-analysis and systematic review. Head Neck. 2014; 36(1):137–43.
- Kuppersmith R.B., Holsinger F.C. Robotic thyroid surgery: an initial experience with North American patients. Laryngoscop. 2011;121:521–6.
- Berber E., Siperstein A. Robotic transaxillary total thyroidectomy using a unilateral approach. Surg. Laparosc. Endosc. Percutan. Tech. 2011;21:207– 10.
- Kandil E.H., Noureldine S.I., Yao L., Slakey D.P. Robotic transaxillary thyroidectomy: an examination of the first one hundred cases. J. Am. Coll. Surg. 2012;214:558–66.
- Lin H.S., Folbe A.J., Carron M.A., et al. Single-incision transaxillary robotic thyroidectomy: challenges and limitations in a North American population. Otolaryngol. Head Neck Surg. 2012;147(6):1041–6.
- Gross N.D. Is robotic thyroid surgery worth the learning curve? Otolaryngol. Head Neck Surg. 2012;147(6):1047–8.
- Dionigi G. Robotic thyroidectomy: Seoul is not Varese. Otolaryngol. Head Neck Surg. 2013;148:178.
- Kang S.W., Lee S.H., Ryu H.R., et al. Initial experience with robot-assisted modified radical neck dissection for the management of thyroid carcinoma with lateral neck node metastasis. Surgery. 2010;148:1214–21.
- Ryu H.R., Kang S.W., Lee S.H., et al. Feasibility and safety of a new robotic thyroidectomy through a gasless, transaxillary single-incision approach. J. Am. Coll. Surg. 2010;211(3):e13–9.
- Tae K., Ji Y.B., Cho S.H., et al. Early surgical outcomes of robotic thyroidectomy by a gasless unilateral axillo-breast or axillary approach for papillary thyroid carcinoma: 2 years’ experience. Head Neck. 2012; 34:617–25.
- Kang S.W., Park J.H., Jeong J.S., et al. Prospects of robotic thyroidectomy using a gasless transaxillary approach for the management of thyroid carcinoma. Surg. Laparosc. Endosc. Percutan. Tech. 2011;21:223–9.
- Terris D.J., Singer M.C. Qualitative and quantitative differences between 2 robotic thyroidectomy techniques. Otolaryngol. Head Neck Surg. 2012; 147(1):20–5.
Поступила 25.03.20 Принята в печать 25.04.20 Received 25.03.20 Accepted 25.04.20
Вклад авторов: Решетов И.В., Сукорцева Н.С., Шевалгин А.А., Агакина Ю.С., Багдасаров П.С., Габаидзе Д.И., Насилевский П.А. – концепция и дизайн исследования, обзор публикаций по теме статьи, сбор данных, анализ полученных данных, написание текста рукописи, редактирование.
Authors’ contributions: Reshetov I.V., Sukortseva N.S., Shevalgin A.A., Agakina Y.S., Bagdasarov P.S., Gabaidze D.I., Nasilevsky P.A. – conception and design of the study, data collection and analysis, manuscript preparation, and editing.
Информация об авторах:
И.В. Решетов – д.м.н., профессор, академик РАН, заведующий кафедрой пластической хирургии, Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет), Институт повышения квалификации Федерального медико-биологического агентства, Москва, Россия; e-mail: reshetoviv@mail.ru; ORCID.org/0000-0002- 0580-7052
Н.С. Сукорцева – врач-онколог; Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет), Москва, Россия; e-mail: sukorceva.nataly@mail.ru; ORCID.org/0000-0002- 7704-1658
Ю.С. Агакина – врач-химиотерапевт; Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет), Москва, Россия; e-mail: y.agakina@gmail.com; ORCID.org/0000-0002- 3556-2703
П.С. Багдасаров – врач-анестезиолог; Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет), Москва, Россия; e-mail: pbagdasarov@inbox.ru; ORCID.org/0000-0002- 1917-7493
А.А. Шевалгин – врач-онколог, Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет), Москва, Россия; e-mail: doktor_kz@bk.ru; ORCID.org/0000-0002-7045-5540
Д.И. Габаидзе – врач-хирург, Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет), Москва, Россия; e-mail: giagabaidze@mail.ru
П.А. Насилевский – врач-онколог, ассистент кафедры онкологии. Институт повышения квалификации Федерального медико-биологического агентства, Москва, Россия; e-mail: nassilevsky@mail.ru; ORCID.org/0000- 0001-6747-0056
Information about the authors:
I.V. Reshetov – Doctor of Medical Sciences, Professor, Academician of the Russian Academy of Sciences, Head of the Department of Plastic Surgery, First Moscow State Medical University n.a. I.M. Sechenov (Sechenov University), Institute for Advanced Studies of the Federal Medical and Biological Agency, Moscow, Russia; e-mail: reshetoviv@mail.ru; ORCID.org/0000-0002-0580-7052
N.S. Sukortseva – MD, oncologist; First Moscow State Medical University n.a. I.M. Sechenov (Sechenov University), Moscow, Russia; e-mail: sukorceva. nataly@mail.ru; ORCID.org/0000-0002-7704-1658
Y.S. Agakina – MD, chemotherapist; First Moscow State Medical University n.a. I.M. Sechenov (Sechenov University), Moscow, Russia; e-mail: y.agakina@ gmail.com; ORCID.org/0000-0002-3556-2703
P.S. Bagdasarov – MD, anesthetisiologist; First Moscow State Medical University n.a. I.M. Sechenov (Sechenov University), Moscow, Russia; e-mail: pbagdasarov@ inbox.ru; ORCID.org/0000-0002-1917-7493
A.A. Shevalgin – MD, oncologist, First Moscow State Medical University n.a. I.M. Sechenov (Sechenov University), Moscow, Russia; e-mail: doktor_kz@ bk.ru; ORCID.org/0000-0002-7045-5540
D.I. Gabaidze – MD, surgeon, First Moscow State Medical University n.a. I.M. Sechenov (Sechenov University), Moscow, Russia; e-mail: giagabaidze@mail.ru
P.A. Nasilevsky – MD, oncologist, assistant of the Department of Oncology, Institute for Advanced Studies of the Federal Medical and Biological Agency, Moscow, Russia; e-mail: nassilevsky@mail.ru; ORCID.org/0000-0001- 6747-0056